Тромбофилия – это наследственно обусловленная или приобретенная предрасположенность к формированию тромбов (кровяных сгустков) в просвете кровеносных сосудов. Тромбофилия не является заболеванием как таковым, а представляет собой состояние, которое в сочетании с факторами риска увеличивает вероятность возникновения тромбов в несколько раз.
Проявления тромбофилии связаны с образованием тромбов в венах и/или артериях, которые нарушают работу внутренних органов и представляют серьезную опасность для здоровья и жизни пациента. Однако многие люди с тромбофилией не испытывают в течение жизни никаких негативных последствий этого состояния.
Специфическое лечение тромбофилии отсутствует. Вопрос необходимости использования профилактической терапии, направленной на предотвращение формирования тромбов, решается индивидуально для каждого пациента. При высоком риске тромбоза профилактическое лечение позволяет предотвратить ряд тяжелых осложнений.
Прогноз тромбофилии зависит от ее типа, наличия и тяжести предшествующих случаев тромбоза, сопутствующих заболеваний.
Синонимы русские
Первичная тромбофилия, наследственная тромбофилия, врождённая тромбофилия, вторичная тромбофилия, приобретенная тромбофилия.
Синонимы английские
Hypercoagulability, coagulability, hypercoagulable state, hereditary thrombophilia, familial thrombophilia, primary thrombophilia, acquired thrombophilia, secondary thrombophilia.
Тромбофилия – это наследственно обусловленная или приобретенная предрасположенность к формированию тромбов (кровяных сгустков) в просвете кровеносных сосудов. Тромбофилия не является заболеванием как таковым, а представляет собой состояние, которое в сочетании с факторами риска увеличивает вероятность возникновения тромбов в несколько раз.
Проявления тромбофилии связаны с образованием тромбов в венах и/или артериях, которые нарушают работу внутренних органов и представляют серьезную опасность для здоровья и жизни пациента. Однако многие люди с тромбофилией не испытывают в течение жизни никаких негативных последствий этого состояния.
Специфическое лечение тромбофилии отсутствует. Вопрос необходимости использования профилактической терапии, направленной на предотвращение формирования тромбов, решается индивидуально для каждого пациента. При высоком риске тромбоза профилактическое лечение позволяет предотвратить ряд тяжелых осложнений.
Прогноз тромбофилии зависит от ее типа, наличия и тяжести предшествующих случаев тромбоза, сопутствующих заболеваний.
Симптомы
Большинство пациентов не знают о наличии у них тромбофилии до тех пор, пока не возникнет тромбоз или другие нарушения свертывания крови. Чаще всего при появлении тромба появляются следующие симптомы:
- Отек, покраснение, болезненность, онемение голеней и стоп
- Одышка
- Затруднение дыхания
- Кашель с кровью
- Боль в груди при глубоком вдохе
- Учащенное сердцебиение
- Повторяющиеся выкидыши и другие нарушения течения беременности
Общая информация о заболевании
Тромбофилия представляет собой состояние, при котором сгустки в крови образуются легче, чем в норме. Это происходит за счет изменения соотношения свертывающих и противосвертывающих факторов.
Нормальный процесс свертывания крови необходим для предотвращения кровотечений и заключается в формировании сгустков, которые закупоривают поврежденный сосуд. Процесс формирования сгустка происходит за счет взаимодействия ряда активных веществ – так называемых факторов свертывания. Существуют и противосвертывающие факторы, необходимые для предотвращения избыточного свертывания крови. При тромбофилии баланс этих веществ нарушен – либо повышается количество факторов свертывания, либо снижается количество противосвертывающих веществ. Это может привести к формированию тромбов – сгустков в просвете сосудов (вен или артерий), которые могут закупоривать просвет сосуда, нарушая таким образом кровоснабжение органов и тканей.
Тромбофилии делят на:
1. Врождённые (наследственные, первичные). Это тромбофилии, которые обусловлены наличием аномалий в генах, содержащих информацию о белках, участвующих в свертывании крови. Чаще всего встречается дефицит антитротромбина III, протеинов C и S, аномалия фактора V (мутация Лейден), аномалия протромбина G 202110А:
- Дефицит антитромбина III. При этом заболевании нарушен синтез антитромбина III. Является одним из самых распространенных заболеваний среди всех наследственных нарушений свертывания крови. Имеет аутосомно-доминантный тип наследования. Это значит, что передача дефектного гена от родителей к детям происходит независимо от пола, и при наличии хотя бы одного дефектного гена из двух у человека возникнет тромбофилия. Однако ген имеет частичную пенетрантность (проявление), то есть даже при наличии у человека дефектного гена вероятность возникновения тромбоза может быть разной. Антитромбин III – важнейший компонент противосвертывающей системы. Он образует соединения с тромбином, что приводит к их взаимной инактивации. Тромбин – это белок, который участвует в образовании тромба, стимулирует тромбоциты и клетки сосудистой стенки.
- Дефицит протеинов С и S. Протеин С – это белок, который синтезируется в печени. Он активируется тромбином и при взаимодействии с другим важным компонентом крови – протеином S – ограничивает процесс тромбообразования за счет разрушения факторов свертывания V и VIII и прекращения образования фибрина. Таким образом, протеины С и S регулируют интенсивность свертывающей системы крови. Их дефицит приводит к избыточному тромбообразованию.
- Аномалия фактора V (мутация Лейден). При этом заболевании появляется дефект в гене, несущем информацию о пятом факторе свертывания крови. В результате фактор V становится устойчивым к разрушающему действию протеина C. Фактор V является фактором свертывания и участвует в образовании тромбина. При увеличении его количества риск возникновения тромбов повышается.
- Аномалия протромбина. При этом заболевании увеличивается синтез протромбина – предшественника тромбина. В результате активность свертывающей системы крови увеличивается. При подобном нарушении синтеза протромбина часто встречаются не только венозные тромбозы, но и тромбы в артериях сердца и головного мозга, что может привести к инфарктам и инсультам у людей моложе 50 лет.
2. Приобретенные. К ним относятся тромбофилии, которые возникли в результате других заболеваний или приема лекарственных препаратов:
- Антифосфолипидный синдром, который сопровождается избыточным количеством белков (антител), уничтожающих фосфолипиды – важные компоненты мембраны нервных клеток, тромбоцитов и стенки сосудов. В результате разрушения этих клеток выделяются активные вещества, которые нарушают нормальное взаимодействие свертывающей и противосвертывающей систем крови. Свертываемость крови повышается, увеличивается склонность к образованию тромбов. Большое количество антител к фосфолипидам образуется при злокачественных опухолях, системной красной волчанке, ревматоидном артрите и других заболеваниях, при приеме оральных контрацептивов.
- Миелопролиферативные заболевания – заболевания, при которых костный мозг продуцирует избыточное количество клеток крови. Например, при полицитемии увеличивается количество эритроцитов, при тромбоцитемии – тромбоцитов. В результате меняется вязкость крови и нарушается ее ток по сосудам. Это может привести к повышенному тромбообразованию.
- Приобретенный дефицит антитромбина III. Возникает при нарушении синтеза этого фактора или при его избыточном разрушении. Например, при заболеваниях печени, дефиците витамина К нарушается образование антитромбина III, а при нефротическом синдроме страдают почки и происходит потеря белков, в том числе антитромбина, с мочой.
Тромбофилия может встречаться при заболеваниях, сопровождающихся повреждением сосудов, в частности при сахарном диабете, при котором, как известно, уровень инсулина снижен и, как следствие, повышена концентрация глюкозы в крови. Механизм повреждения сосудов при сахарном диабете до конца не выяснен, однако известно, что глюкоза токсически действует на клетки сосудов. Это приводит к выделению факторов свертывания, нарушению тока крови и избыточному тромбообразованию.
Чаще всего тромбофилия проявляется следующим образом.
- При тромбозе глубоких вен, как правило, поражаются нижние конечности и таз. Тромб нарушает отток крови, что проявляется отеком, болезненностью, онемением.
- При тромбоэмболии легочной артерии оторвавшиеся тромбы (эмболы) закупоривают просвет легочной артерии, что нарушает работу легких. Возникает одышка, учащается сердцебиение. Вероятен инфаркт (некроз, омертвение) участка легкого, что проявляется болью в груди, кашлем с кровью.
- Образование тромбов в артериях может сопровождаться инсультом (нарушением мозгового кровообращения), инфарктом миокарда (нарушением кровоснабжения и гибелью клеток сердечной мышцы), нарушением плацентарного кровообращения во время беременности с развитием ряда тяжелых осложнений, вплоть до гибели плода.
Кто в группе риска?
- Люди старше 60 лет.
- Люди, у родственников которых была тромбофилия.
- Беременные.
- Женщины, принимающие оральные контрацептивы.
- Пациенты с онкологическими, аутоиммунными, обменными заболеваниями.
- Недавно перенесшие тяжелые инфекции, травмы, операции.
Диагностика
Основой диагностики тромбофилий являются лабораторные исследования. Они должны проводиться через несколько недель после перенесенного эпизода тромбоза и вне приема препаратов, влияющих на свертывание крови.
Лабораторная диагностика
- Общий анализ крови. Тромбофилия может сопровождаться полицитемией, то есть повышенным количеством эритроцитов, а также тромбоцитозом – повышенным количеством тромбоцитов.Гематокрит (отношение объема эритроцитов к общему объему крови) также бывает повышен. Эти изменения могут происходить при полицитемии, тромбоцитемии.
- D-димер – вещество, которое образуется при разрушении тромба. Он является показателем активности образования и разрушения тромбов в крови. При тромбофилии может быть повышен.
- Активированное частичное тромбопластиновое время (АЧТВ) – анализ, имитирующий естественный процесс свертывания и позволяющий оценить активность факторов свертывания. При тромбофилии АЧТВ иногда снижено, что указывает на повышенную свертываемость крови. Это происходит при заболеваниях печени, аутоиммунных заболеваниях, антифосфолипидном синдроме, дефиците витамина К (он участвует в синтезе белков свертывающей системы крови).
- Антитромбин III. Это антикоагулянт, то есть вещество, которое активирует противосвертывающую систему. При тромбофилии активность антитромбина III может быть снижена. Так происходит при хронических заболеваниях печени, дефиците витамина К, ДВС – диссеминированном внутрисосудистом свертывании (состоянии после инфекций, ожогов, травм).
- Тромбиновое время. Исследуют время образования сгустка в плазме крови. При тромбофилии оно бывает снижено. Это может наблюдаться при антифосфолипидном синдроме.
- Фибриноген. Один из основных элементов свертывающей системы крови. Фибриноген может быть повышен при инфекциях, травмах, сахарном диабете, атеросклерозе (хроническом заболевании с образованием бляшек на внутренней поверхности сосудов, развивающемся в результате нарушения жирового обмена).
- Протромбиновый индекс. Используется для оценки скорости свертываемости крови. Его уровень может повышаться из-за врождённой аномалии синтеза протромбина, при приеме оральных контрацептивов, на последних месяцах беременности.
- Волчаночный антикоагулянт. Это специфический белок, разрушающий элементы мембраны клеток сосудов. Его наличие в крови является индикатором повышенной вероятности тромбозов. Может быть увеличен при аутоиммунных заболеваниях (системной красной волчанке, ревматоидном артрите, васкулите).
- Гомоцистеин – аминокислота, которая образуется из метионина – другой аминокислоты, поступающей в организм с продуктами животного происхождения: мясом, творогом, яйцами. Повышение уровня гомоцистеина может быть показателем усиленного тромбообразования.
- Антифосфолипидные антитела – белки, разрушающие элементы клеточных мембран. Их избыток свидетельствует об антифосфолипидном синдроме – состоянии, которое сопровождается повышенным риском тромбозов.
- Генетические исследования. Выявление аномалий в генах факторов свертываемости крови V и протромбина.
Лечение
Лечение тромбофилии зависит от степени риска тромбоза. Если он велик и превышает риск развития осложнений от терапии тромбофилии, то врач может назначить:
- антикоагулянты – препараты, уменьшающие свертывающую активность крови, чаще всего используют варфарин в виде таблеток (он подавляет синтез факторов свертывания) и гепарин в виде инъекций (замедляет образование фибрина, входящего в состав тромба);
- низкие дозы аспирина, который уменьшает слипание тромбоцитов; часто применяется женщинами с тромбофилией во время беременности.
Профилактика
Специфической профилактики самой тромбофилии нет, однако большое значение имеет предупреждение тромбоза у пациентов с уже диагностированной тромбофилией: контроль за массой тела, рациональное питание, достаточное употребление жидкости (без кофеина, т. к. он сужает сосуды), умеренность в употреблении алкоголя, подвижный образ жизни, отказ от курения, ношение компрессионного белья при варикозе.
Рекомендуемые анализы
- Общий анализ крови
- Коагулограмма № 3 (протромбин (по Квику), МНО, фибриноген, АТIII, АЧТВ, D-димер)
- Волчаночный антикоагулянт, скрининговый тест (LA1)
- Гомоцистеин
- Антифосфолипидные антитела IgG
- Предрасположенность к повышенной свертываемости крови
© 2020 Медицинский центр «ЛМД». Лицензия на медицинскую деятельность ЛО-78-01-006578 от 20.02.2016
- Тромбофилии
- Система свертывания крови
- Генетические заболевания
Описание
Синонимы (rus): Первичная тромбофилия, наследственная тромбофилия, врождённая тромбофилия
Синонимы (eng): Hypercoagulability, coagulability, hypercoagulable state, hereditary thrombophilia, familial thrombophilia, primary thrombophilia
Биоматериал: Венозная кровь
Показатель(и): Мутации в генах FGB, FII (протромбин), FV (мутация Лейдена), FVII, FXIII, ITGA2, ITGB3 и PAI-1
Метод(и): Полимеразная цепная реакция (ПЦР)
Тип контейнера и особенности преаналитики: Пробирка для гематологических исследований с EDTA, 2 мл (фиолетовая крышечка)
Тромбофилия – это патологическое состояние, при котором происходит нарушение системы свертывания крови и повышается риск тромбозов. Таким образом, у больных развивается повышенный риск осложнений беременности, хирургических операций, чаще наблюдается формирование тромбоэмболий и ишемических поражений органов. Заболевание может быть наследственным или же развиться вторично, например, при онкологических заболеваниях, приеме оральных контрацептивов, длительном ограничении подвижности. В 30-50% случаев причиной является генетическая предрасположенность, обусловленная мутациями в генах F2, F5, F7, F13, FGB (плазменное звено системы гемостаза) и ITGA2, ITGB3, PAI-1 (сосудисто-тромбоцитарное звено). Проведение скрининга на мутации в этих генах необходимо для оценки риска развития тромботических осложнений и своевременной коррекции проводимой терапии.
Ген FGB (фибриноген). Исследуется полиморфизм 455 G>A, мутация заключается в замене гуанина на аденин. Данная мутация приводит к умеренно повышенному уровню фибриногена в плазме.
Ген FII (протромбин). Исследуется полиморфизм 20210 G>A, при мутации отмечается замена гуанина на аденин. Данная мутация увеличивает уровень протромбина на 30%, что способствует повышению свертываемости крови.
Ген FV (проакцелерин). Мутация Лейдена заключается в замене гуанина на аденин в 1691 позиции (1691 G>A), что приводит к синтезу мутантного фактора V. Данная мутация приводит к резистентности к протеину C, поскольку замещает аминокислоту аргинин на гуанин в месте, где протеин C взаимодействует с фактором V. Мутация Лейдена существенно увеличивает риск тромбоза: при генотипе G/A и А/А риск тромбозов возрастает в 7 раз.
Ген FVII (проконвертин). Проконвертин активирует X фактор свертываемости крови. Исследуется полиморфизм 10976 G>A, мутация заключается в замене гуанина аденином. Наличие аллели А является защитным фактором в развитии тромбозов. Генотип A/A и A/G обладает протективной функцией, снижая активность белка.
Ген FXIII (фибриназа). Фактор XIII образует внутримолекулярные сшивки между молекулами фибрина и гамма-глутамил-эпсилон-лизина, стабилизируя кровяные сгустки. Исследуется полиморфизм 103 G>T. При замене гуанина тимином и формировании генотипа G/T и T/T образуется аномальная структура сгустка фибрина, что снижает риск развития инфаркта миокарда и тромбоза глубоких вен..
Ген ITGA2 (интегрин). Данный ген ко кодирует белок интегрин α2β1, который является структурным элементом тромбоцитарного рецептора GPIa/GPIIa. Данный рецептор связывается с субэндотелиальным коллагеном и регулирует адгезию и активацию тромбоцитов. Исследуется полиморфизм 807 C>T. Генотипы С/Т и Т/Т приводят к умеренному увеличению скорости адгезии тромбоцитов, что является фактором повышенного риска развития тромбоза.
Ген ITGB3 (интегрин). Данный ген кодирует белок интегрин бета-3 – мембранный гликопротеин IIIа (GP IIIа). Гликопротеин GPIIIa, связываясь с GPIIb, образует тромбоцитарный рецептор фибриногена. Исследуется полиморфизм 1565 T>C. Тромбоциты носителей генотипов T/C и C/C имеют значимо повышенную склонность к агрегации, что приводит к повышенному риску тромбоза.
Ген PAI-I (серпин). Серпин, или активатор плазминогена – 1, относится к ингибиторам сериновой протеиназы и ухудшает растворение сгустков. Исследуется полиморфизм 675 5G>4G . Носители генотипа 4G/5G и 4G/4G имеют повышенный уровень серпина, что приводит к умеренному снижению фибринолитической активности крови и повышенному риску тромбоза.
Когда назначается
Дифференциальный диагноз ранних тромбозов глубоких вен и артерий, превычного невынашивания беременности, ишемического поражения головного мозга.
Подготовка к анализу
Специальной подготовки не требуется. Исследование проводится натощак (не принимать пищу 3 часа до исследования, можно пить воду).
Интерпретация
Исследуется наличие полиморфизмов в указанных генах, на основании чего делается заключение о наличии протромбогенного и протективного генотипа.
При мутациях в гене FII генотипы G/A и A/A предрасполагают к повышенной свертываемости крови.
При мутациях в гене FGB генотипы G/A и A/A предрасполагают к повышенной концентрации фибриногена и свертываемости крови.
При мутациях в гене FV генотипы G/A и A/A предрасполагают к повышенной свертываемости крови.
При мутациях в гене FVII генотипы G/A и A/A предрасполагают к пониженной активности проконвертина (протективный генотип).
При мутациях в гене FXIII генотипы G/T и T/T предрасполагают к пониженной активности фибриназы (протективный генотип).
При мутациях в гене ITGA2 генотипы С/T и T/T предрасполагают к повышенной скорости адгезии тромбоцитов.
При мутациях в гене ITGB3 генотипы T/C и C/C предрасполагают к повышенной агрегационной способности тромбоцитов.
При мутациях в гене PAI-I генотипы 4G/5G и 4G/4G предрасполагают к повышенному уровню серпина в плазме и риску тромбоза.
Список литературы
- А.Л. Комаров, О.О. Шахматова, Д.В. Ребриков, Д.Ю. Трофимов, Т.И. Коткина, Т.А. Илющенко, А.Д. Деев, Е.П. Панченко. Влияние генетических факторов, ассоциированных с тромбозами, на долгосрочный прогноз больных хронической ишемической болезнью сердца Рациональная Фармакотерапия в Кардиологии 2011;7(4)
- Murin S, Marelich GP, Arroliga AC, Matthay RA. Hereditary thrombophilia and venous thromboembolism. Am J Respir Crit Care Med. 1998;158(5 I):1369-1373.
- Stevens SM, Woller SC, Bauer KA, et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis. 2016;41(1):154-164. doi:10.1007/s11239-015-1316-1.
- Michiels JJ, Hamulyák K. Laboratory diagnosis of hereditary thrombophilia. Semin Thromb Hemost. 1998;24(4):309-320. doi:10.1055/s-2007-996019.
- Stevens SM, Woller SC, Bauer KA, et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis. 2016;41(1):154-164. doi:10.1007/s11239-015-1316-1.
- Eldor A. Thrombophilia, thrombosis and pregnancy. In: Thrombosis and Haemostasis. Vol 86. ; 2001:104-111.
Тромбофилия: причины появления, симптомы, диагностика и способы лечения.
Определение
Тромбофилия – наследственные или приобретенные состояния, которые характеризуются чрезмерной склонностью организма к образованию тромбов в кровеносных сосудах. Под тромбообразованием понимают формирование сгустков крови в местах повреждения сосудистой стенки. Это физиологический процесс, который препятствует истечению крови в местах повреждений сосуда.
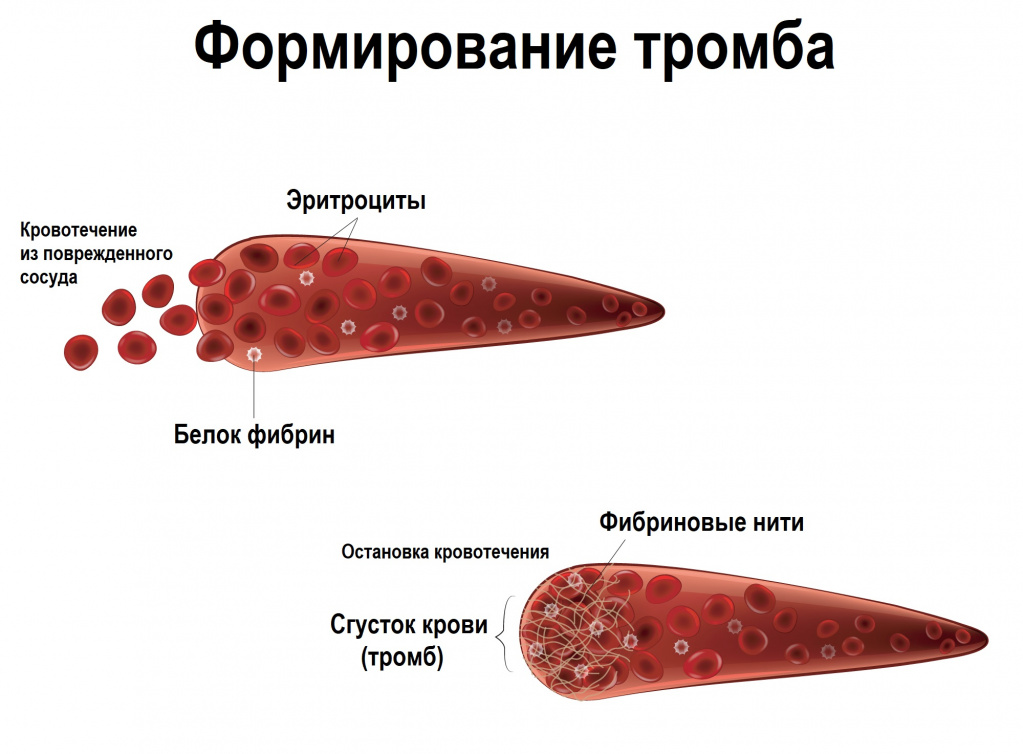
Причины появления тромбофилии
Поддержание крови в жидком состоянии и остановка кровотечения при повреждении сосуда реализуется посредством взаимодействия свертывающей, противосвертывающей и фибринолитической систем, имеющих множество составляющих.
В норме наблюдается равновесие, обеспечивающее жидкое состояние крови при неповрежденной сосудистой стенке, образование тромба при ее повреждении и последующее его растворение (фибринолиз).
В организме существует большое количество факторов свертывания, последовательно активирующихся при необходимости.
Таким образом, основной причиной тромбофилии становится дисбаланс свертывающих и противосвертывающих факторов крови, когда образование тромбов в сосудах происходит независимо от повреждения сосудистой стенки, а организм не может самостоятельно растворить их.
Классификация тромбофилии
В зависимости от этиологии (причины) тромбофилии подразделяются на две большие группы: врожденные (первичные) и приобретенные (вторичные).
К врожденным относят различные генетические дефекты, которые обуславливают предрасположенность организма к тромбозам. В этом случае риск патологического образования тромбов увеличивается при появлении дополнительных факторов тромбообразования (например, во время беременности и родов, у пациентов с выраженным ожирением, а также после травм, ожогов, длительной иммобилизации – неподвижности и др.).
Существуют подтвержденные данные о связи врожденной тромбофилии с дефицитом антитромбина III, протеина С и S, АПС-резистентностью, гомоцистинурией.
Приобретенная тромбофилия может быть связана с различными инфекционными, онкологическими заболеваниями.
Самой частой приобретенной тромбофилией иммунного генеза является антифосфолипидный синдром, возникающий при различных аутоиммунных и инфекционных заболеваниях и связанный с выработкой в организме определенных белков, т. н. антифосфолипидных антител.
Синдром проявляется тромбозами вен и/или артерий, снижением числа тромбоцитов (тромбоцитопенией) и акушерско-гинекологической патологией – чаще всего привычным невынашиванием беременности.
Тромбофилия может быть одним из проявлений так называемого нефротического синдрома. При этом заболевании, наряду со снижением уровня альбумина в крови, выраженными отеками и повышением холестерина, имеется склонность к избыточному тромбообразованию.
Ряд заболеваний крови – истинная полицитемия, пароксизмальная ночная гемоглобинурия также могут проявляться образованием тромбов.
Ситуационная тромбофилия регистрируется при травмах, хирургических вмешательствах, особенно ортопедических, химиотерапии, приеме оральных контрацептивов, гормонально-заместительной терапии.
В зависимости от локализации различают тромбозы артериальные (в артериях), микроциркуляторные (в капиллярном русле), венозные (в венах), смешанные (с поражением различных типов сосудов).
Симптомы тромбофилии
Клинические проявления тромбофилии различаются в зависимости от локализации тромбов.
Для венозных тромбозов, когда закупоривается сосуд, возвращающий кровь к сердцу, характерно нарушение оттока крови от органа, отеки, повышение кожной температуры в области тромбоза, чувство распирания, умеренной интенсивности давящая боль. Часто поражаются поверхностные или глубокие вены нижних конечностей. Поражение может быть односторонним.

Клинические проявления тромбоза артерий головного мозга во многом зависят от локализации и диаметра пораженного сосуда, обратимости изменений, то есть от времени начала активной терапии. При инсульте наблюдается интенсивная головная боль, головокружение, нарушение сознания, речи, чувствительные и двигательные расстройства – онемение, слабость в руке или ноге с одной стороны.
Если предприняты незамедлительные меры по растворению тромба (тромболизис), человек может полностью восстановиться.
Классической картиной при инфаркте миокарда являются интенсивные давящие боли за грудиной, иногда с иррадиацией в левую лопатку, левую руку; возможны резкая слабость, тошнота, рвота, страх смерти. При проведении тромболизиса возможен регресс симптоматики. Если же своевременное лечение не было проведено – участок сердечной мышцы замещается соединительной тканью (образуется рубец), он выключается из эффективного сокращения, из-за чего человек может хуже переносить физические нагрузки, могут появляться одышка, отеки нижних конечностей, как проявление сердечной недостаточности.
Диагностика тромбофилии
Диагноз подтверждается лабораторными и инструментальными методами. Основа диагностики – различные анализы крови.
Исследуют клинический анализ крови, отдельные параметры биохимического анализа крови – общий белок, альбумин, общий холестерин, креатинин и др.
Общий белок (в крови) (Protein total)
Синонимы: Общий белок сыворотки крови; Общий сывороточный белок.
Total Protein; Serum Тotal Protein; Total Serum Protein; TProt; ТР.
Краткая характеристика определяемого вещества Общий бе�…
Альбумин (в крови) (Albumin)
Синонимы: Человеческий сывороточный альбумин; ЧСА; Альбумин плазмы;
Human Serum Albumin; ALB.
Краткая характеристика исследуемого вещества Альбумин
Альбумин – эт…
Креатинин (в крови) (Creatinine)
Синонимы: Анализ крови на креатинин; Сывороточный креатинин; Креатинин сыворотки, оценка СКФ. Сreat; Сre; Blood Creatinine; Serum Creatinine; Serum Creat.
Краткая характеристика определя�…
Исследуется гемостазиограмма (коагулограмма), включающая определение протромбина (протромбиновое время, протромбин, МНО), фибриногена, АЧТВ, тромбинового времени. Может быть назначена и гемостазиограмма (коагулограмма) расширенная, которая дополнительно включает антитромбин III, Д-димер, плазминоген.
Гемостазиограмма (коагулограмма), скрининг
Синонимы: Гемостазиограмма, коагулограмма.
Coagulation studies (coagulation profile, coag panel, coagulogram).
Состав профиля:
№ 2 Протромбин (протромбиновое время, протромбин (по Квику), МНО…
Гемостазиограмма (коагулограмма) расширенная
Синонимы: Гемостазиограмма.
Coagulation studies (coagulation profile, coag panel, coagulogram).
Краткая характеристика исследования «Гемостазиограмма (коагулограмма) расширенная»
…
Генетический анализ: сокращенная панель или расширенная панель. Может быть назначено расширенное исследование генов системы гемостаза. Есть комплекс анализов «Привычное невынашивание беременности (в т.ч. склонность к тромбозу при беременности: расширенная панель).
Тромбозы: расширенная панель
Генетические факторы риска тромбоза и повышения уровня гомоцистеина. Анализ наличия полиморфизмов в генах протромбина, фактора Лейдена и ферментов реакций фолат�…
Расширенное исследование генов системы гемостаза (с описанием результатов врачом- генетиком)
Расширенное исследование генов системы гемостаза: F2, F5, MTHFR, MTR, MTRR, F13, FGB, ITGA2, ITGВ3, F7, PAI-1
Комплексное исследование генетических факторов риска развития нарушений в…
Для подтверждения антифосфолипидного синдрома используют определение в крови уровня антител к фосфолипидам — антител к кардиолипину IgG, IgM; антител к β-2-гликопротеину 1; повторная оценка содержания волчаночного антикоагулянта.
Волчаночный антикоагулянт (ВА, Lupus anticoagulants, LA)
Синонимы: Аутоантитела (IgG) против фосфолипидов;
Lupus anticoagulant panel; Lupus inhibitor; LA sensitive PTT; PTT-LA; Dilute Russell viper venom test; DRVVT; Modified Russell viper venom tes; MRVVT.
Краткая характеристик�…
В отдельных случаях может понадобиться определение онкомаркеров и некоторых инфекционных агентов.
Инструментальная диагностика.
С помощью УЗИ сосудов определяют локализацию тромбоза, размер и характер тромба – окклюзирующий (полностью перекрывающий просвет сосуда) или неокклюзирующий, флотирующий (плавающий) и создающий угрозу тромбоэмболии при отрыве, или нефлотирующий.
Широко применяется ангиография – рентгеновское исследование (рентгенография, КТ) или МРТ с контрастированием сосудов, в частности при ТЭЛА, ишемических инсультах.
Эти методики необходимы не только в диагностике, но и при хирургическом лечении тромбозов.
Реже используются радиоизотопные методы; так, например, сцинтиграфия легких помогает верифицировать различные варианты ТЭЛА (тромбоэмболии легочной артерии).
К каким врачам обращаться
Заподозрить тромбоз может врач любой специальности. Обследованием и лечением занимаются врачи-
терапевты
, гематологи, хирурги.
Лечение тромбофилии
Тактика лечения во многом зависит от причины тромбофилического состояния.
Так, ведение пациентов с врожденной тромбофилией может отличаться от схемы терапии пациентов с ситуационным гиперкоагуляционным состоянием.
Чаще всего пациенты с тромбозами нуждаются в госпитализации в специализированный стационар. Проводится лечение антикоагулянтами – препаратами, угнетающими процесс свертывания крови и тем самым препятствующими образованию тромбов. В лечении тромбозов могут использоваться также антиагреганты – препараты, препятствующие склеиванию тромбоцитов и эритроцитов и уменьшающие их прилипание к стенке сосуда, улучшающие текучесть крови. В ряде случаев в терапии тромбозов применяют малообъемные плазмаферезы (удаляется 300–350 мл плазмы с возмещением плазмопотери физраствором).
Целью терапии тромбозов является максимально возможное лизирование (растворение) тромбов. Длительность терапии тромбоза составляет, как правило, не менее 2–3 недель, а при необходимости – до 6–12 месяцев.
В ряде случаев при тромбозах может быть использовано хирургическое лечение. Так, например, при тромбозах глубоких вен нижних конечностей проводится тромбэктомия – удаление тромба: открытая или эндоваскулярная операция. Принцип эндоваскулярного вмешательства заключается в следующем: после диагностической ангиографии через небольшой разрез или прокол стенки сосуда в его просвет вводятся катетеры и проводники и выполняется манипуляция в проблемной зоне. Вмешательство проводится под местной анестезией, под рентгенологическим контролем. Для профилактики ТЭЛА при помощи эндоваскулярной методики может быть установлен кава-фильтр – т.н. ловушка для тромбов.
Осложнения
При тромбозе глубоких вен грозным осложнением является тромбоэмболия легочной артерии, когда оторвавшийся кусочек тромба с кровотоком перемещается из вен нижней конечности в артерии легких и закупоривает их просвет. В результате появляется резкая боль в груди, внезапная одышка, синюшность (цианоз) лица и верхней части туловища, кашель, кровохарканье, возможна потеря сознания.
Локальные тромбозы в артериях головного мозга могут приводить к развитию ишемических инсультов головного мозга (острому нарушению мозгового кровообращения), в артериях сердца — к инфаркту миокарда.
Профилактика тромбозов
Пациентам со склонностью к тромбозам рекомендуется избегать физического перенапряжения, травм. Рекомендуется соблюдать питьевой режим, предполагающие ежедневное потребление достаточного количества жидкости; ношение компрессионного трикотажа; из рациона питания следует исключить орехи, зеленый чай, шпинат, листовой салат, печень.
Профилактика тромбозов осуществляется препаратами из группы антикоагулянтов. При тяжелых тромбофилиях профилактика тромбозов проводится в течение всей жизни.
Во время хирургических операций у данной группы пациентов особое внимание уделяется профилактике тромботических осложнений: антикоагулянты используют до и после операции. Ранняя активизация больных в послеоперационном периоде и ношение компрессионного трикотажа обязательны.
Источники:
- Васильев С.А., Виноградов В.Л., Смирнов А.Н., Погорельская Е.П., Маркова М.Л. Тромбозы и тромбофилии: классификация, диагностика, лечение, профилактика. РМЖ (Русский медицинский журнал). № 17 от 22.07.2013. С. 896.
- Момот А.П. Проблема тромбофилии в клинической практике. Российский журнал детской гематологии и онкологии. № 1, 2015. С. 36-48.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Поделитесь этой статьей сейчас
Рекомендации
-
2956
02 Мая
-
5923
26 Апреля
-
5959
26 Апреля
Похожие статьи
Аллергии
Аллергии: причины появления, симптомы, диагностика и способы лечения.
Гепатит С
Гепатит С: причины появления, классификация, симптомы, диагностика и способы лечения.
Ушиб
Ушиб: причины появления, симптомы, диагностика и способы лечения.
Герпес
Герпес: причины появления, симптомы, диагностика и способы лечения.
Тромбофилия – это патологическое состояние, при котором нарушается процесс свертывания крови и значительно возрастает риск образования тромбов. Она развивается постепенно, и долгое время человек не замечает никаких тревожных симптомов. Однако внезапно состояние ухудшается, образуется тромб, который фиксируется на стенке вены, вызывает воспаление и затрудняет нормальный кровоток. Данное состояние требует врачебного контроля, так как является коварным: в одних случаях люди долгое время живут с тромбофилией и прекрасно себя чувствуют, а в других случаях – развивается опасное для жизни осложнение в виде тромбоза.
- Причины тромбофилии
- Виды тромбофилии
- Симптомы
- Диагностика
- Методы лечения
Причины тромбофилии
В последние годы данное заболевание диагностируется все чаще. Среди главных причин первичной тромбофилии врачи выделяют следующие:
- ухудшение экологии;
- стремительное старение населения во всем мире;
- врожденный дефицит протеинов C и S;
- лейденская мутация (из-за изменений в отдельных участках генов нарушается активность V факторов свертываемости);
- гипергомоцистеинемия (повышение концентрации гомоцистеина в крови);
- недостаток антитромбина, который приводит к угнетению функции свертываемости крови.
Если ближайшие родственники страдали тромбофилией или тромбофлебитом, необходимо уделять своему здоровью максимум внимания. Необходимо разумно подходить к физическим нагрузкам, исключить длительное стояние на ногах, не поднимать тяжести, правильно питаться и носить компрессионный трикотаж.
Виды тромбофилии
Врожденные
Это первичные и наследственные формы патологии. Они развиваются вследствие аномальных изменений в генах, которые содержат информацию о белках, которые участвуют в процессе свертываемости крови. Чаще всего развитие патологии связано с дефицитом антитромбина III. Дефектный ген передается от родителей детям обоих полов. Однако даже при наличии такого гена в организме развитие тромбофилии не обязательно. Меньше случаев заболевания связано с недостатком протеинов C и S, мутацией Лейдена, а также аномалиями протромбина.
Приобретенные
В этом случае проблемы со свертываемостью крови никак не связаны с генетическими факторами. Тромбофилия может развиться из-за длительного использования капельниц или лечения инъекциями, различных пороков сердца, аутоиммунных заболеваний, сильного обезвоживания организма, при котором увеличивается объем эритроцитов, использования химиотерапии для лечения онкологии. Также тромбофилия может появиться во время беременности.
Симптомы
В течение многих лет тромбофилия протекает совершенно бессимптомно. Человек ведет привычный образ жизни и даже не догадывается о развитии у него проблем со свертываемостью крови. В стадии обострения клиническая картина становится достаточно яркой и сопровождается развитием тромбофлебита и других проблем с сосудами. Тромб может располагаться в капиллярном русле, артериях, венах, а также поражать сразу разные типы сосудов.
Человек сталкивается с такими симптомами:
- отек в месте появления тромба (при тромбозе глубоких вен);
- уплотнение и покраснение кожных покровов возле тромбов (характерно для тромбоза поверхностных вен).
Без своевременной медицинской помощи развиваются серьезные осложнения:
- онемение верхних и нижних конечностей;
- боль в грудной клетке;
- учащенное сердцебиение;
- высокий риск инфарктов;
- угроза выкидыша, тяжелая беременность.
Образование тромбов нельзя оставлять без внимания. Это состояние рано или поздно приводит к тромбоэмболии. Образовавшийся тромб отделяется от стенок вены или артерии и вместе с потоком крови может попасть в правый желудочек сердца, а далее в легочную артерию. В результате развивается сердечная недостаточность и наступает летальный исход.
Диагностика
Специалисты используют различные методы лабораторной диагностики:
- Общий анализ крови. Он может показывать повышенное количество эритроцитов либо тромбоцитов.
- D-димер. Это вещество высвобождается при распаде тромба и его значение может значительно превышать норму.
- Активированное частичное тромбопластиновое время. Врач специально создает условия, при которых имитируется естественный процесс свертываемости крови. При тромбофилии показатель АЧТВ низкий, что указывает на высокую скорость свертываемости крови. Данный результат также свидетельствует о развитии патологий печени, антифосфолипидного синдрома, аутоиммунных заболеваний, недостатке в организме витамина K.
- Тромбозы (сокращенная и расширенная панель), которые позволяют выявить изменения в генах системы гемостаза.
После образования тромба проводят аппаратную диагностику, которая включает в себя такие процедуры:
- Ультразвуковая допплерография для определения скорости кровотока на отдельных участках сосуда.
- Ангиография. Проводится на нижних конечностях и позволяет получить трехмерное изображение вен, благодаря введению контрастного вещества.
- Флебография. Рентгенологическое исследование с параллельным введением контраста с йодом.
- Спиральная КТ. Очень точный метод диагностики, благодаря которому врач получает объемную модель венозной системы, на которой хорошо видно расположение вен и их состояние.
Важно провести тщательное обследование пациента, чтобы поставить точный диагноз и определить наличие уже образовавшихся тромбов. По полученным результатам врач назначает индивидуальный курс терапии.
Методы лечения
Консервативное лечение
Пациентов с тромбофилией госпитализируют в стационар, где проводится медикаментозная терапия. Врачи назначают антиагреганты, которые не дают тромбоцитам склеиваться между собой и не позволяют им прикрепляться к стенкам сосудов. Для этих же целей проводят малообъемный плазмаферез. Врач удаляет от 300 до 350 мл плазмы, замещая ее физраствором.
При высоком риске тромбоза используют антикоагулянты. Эти лекарственные средства угнетающе действуют на процесс свертывания крови. В результате заметно снижается риск образования тромбов. Длительность лечения зависит от тяжести конкретного случая. Положительного результата можно добиться за 2–3 недели или же потратить на лечение от 6 месяцев до 1 года.
Хирургическое лечение
При тяжелых формах тромбоза проводят тромбэктомию, прибегая к открытой операции или эндоваскулярной методике. Она является малотравматичной: врач прокалывает стенку сосуда и вводит в его просвет катетеры и проводники, а далее приступает к удалению тромба. Процедура проводится под местной анестезией с рентгенологическим контролем, не сопряжена с кровотечениями и не имеет осложнений.
При лечении тромбофилии пациенту также показана диета (запрещено употреблять пищу с высоким содержанием холестерина, а также жирные и жареные блюда), необходимо следить за физическими нагрузками, пить достаточное количество жидкости и носить компрессионные носки или гольфы. Эти меры также являются профилактическими: при их постоянном применении удается избежать появления тромбов и других осложнений, сохранив двигательную активность.
| Thrombophilia | |
|---|---|
 |
|
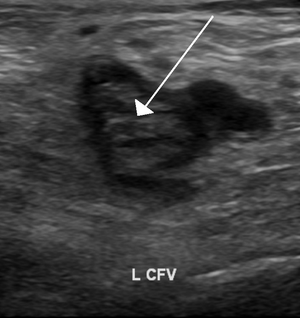
| An ultrasound image demonstrating a blood clot in the left common femoral vein. | |
| Specialty | Hematology |
Thrombophilia (sometimes called hypercoagulability or a prothrombotic state) is an abnormality of blood coagulation that increases the risk of thrombosis (blood clots in blood vessels).[1][2] Such abnormalities can be identified in 50% of people who have an episode of thrombosis (such as deep vein thrombosis in the leg) that was not provoked by other causes.[3] A significant proportion of the population has a detectable thrombophilic abnormality, but most of these develop thrombosis only in the presence of an additional risk factor.[2]
There is no specific treatment for most thrombophilias, but recurrent episodes of thrombosis may be an indication for long-term preventive anticoagulation.[2] The first major form of thrombophilia to be identified by medical science, antithrombin deficiency, was identified in 1965, while the most common abnormalities (including factor V Leiden) were described in the 1990s.[4][5]
Signs and symptoms[edit]
A right-sided acute deep vein thrombosis (to the left in the image). The leg is swollen and red due to venous outflow obstruction.
The most common conditions associated with thrombophilia are deep vein thrombosis (DVT) and pulmonary embolism (PE), which are referred to collectively as venous thromboembolism (VTE). DVT usually occurs in the legs, and is characterized by pain, swelling and redness of the limb. It may lead to long-term swelling and heaviness due to damage to valves in the veins.[6] The clot may also break off and migrate (embolize) to arteries in the lungs. Depending on the size and the location of the clot, this may lead to sudden-onset shortness of breath, chest pain, palpitations and may be complicated by collapse, shock and cardiac arrest.[2][7]
Venous thrombosis may also occur in more unusual places: in the veins of the brain, liver (portal vein thrombosis and hepatic vein thrombosis), mesenteric vein, kidney (renal vein thrombosis) and the veins of the arms.[2] Whether thrombophilia also increases the risk of arterial thrombosis (which is the underlying cause of heart attacks and strokes) is less well established.[2][8][9]
Thrombophilia has been linked to recurrent miscarriage,[10] and possibly various complications of pregnancy such as intrauterine growth restriction, stillbirth, severe pre-eclampsia and abruptio placentae.[2]
Protein C deficiency may cause purpura fulminans, a severe clotting disorder in the newborn that leads to both tissue death and bleeding into the skin and other organs. The condition has also been described in adults. Protein C and protein S deficiency have also been associated with an increased risk of skin necrosis on commencing anticoagulant treatment with warfarin or related drugs.[2][11]
Causes[edit]
Thrombophilia can be congenital or acquired. Congenital thrombophilia refers to inborn conditions (and usually hereditary, in which case «hereditary thrombophilia» may be used) that increase the tendency to develop thrombosis, while, on the other hand, acquired thrombophilia refers to conditions that arise later in life.
Congenital[edit]
The most common types of congenital thrombophilia are those that arise as a result of overactivity of coagulation factors. They are relatively mild, and are therefore classified as «type II» defects.[12][13] The most common ones are factor V Leiden (a mutation in the F5 gene at position 1691) and prothrombin G20210A, a mutation in prothrombin (at position 20210 in the 3′ untranslated region of the gene).[1][14]
The rare forms of congenital thrombophilia are typically caused by a deficiency of natural anticoagulants. They are classified as «type I» and are more severe in their propensity to cause thrombosis.[12] The main ones are antithrombin III deficiency, protein C deficiency and protein S deficiency.[1][14] Milder rare congenital thrombophilias are factor XIII mutation[14] and familial dysfibrinogenemia (an abnormal fibrinogen).[14] It is unclear whether congenital disorders of fibrinolysis (the system that destroys clots) are major contributors to thrombosis risk.[12] Congenital deficiency of plasminogen, for instance, mainly causes eye symptoms and sometimes problems in other organs, but the link with thrombosis has been more uncertain.[15]
Blood group determines thrombosis risk to a significant extent. Those with blood groups other than type O are at a 2- to 4-fold relative risk. O blood group is associated with reduced levels of von Willebrand factor – because of increased clearance – and factor VIII, which is related to thrombotic risk .[5]
Acquired[edit]
A number of acquired conditions augment the risk of thrombosis. A prominent example is antiphospholipid syndrome,[1][14] which is caused by antibodies against constituents of the cell membrane, particularly lupus anticoagulant (first found in people with the disease systemic lupus erythematosus but often detected in people without the disease), anti-cardiolipin antibodies, and anti-β2-glycoprotein 1 antibodies; it is therefore regarded as an autoimmune disease. In some cases, antiphospholipid syndrome can cause arterial as well as venous thrombosis. It is also more strongly associated with miscarriage, and can cause a number of other symptoms (such as livedo reticularis of the skin and migraine).[16]
Heparin-induced thrombocytopenia (HIT) is due to an immune system reaction against the anticoagulant drug heparin (or its derivatives).[1] Though it is named for associated low platelet counts, HIT is strongly associated with risk of venous and arterial thrombosis.[17] Paroxysmal nocturnal hemoglobinuria (PNH) is a rare condition resulting from acquired alterations in the PIGA gene, which plays a role in the protection of blood cells from the complement system. PNH increases the risk of venous thrombosis but is also associated with hemolytic anemia (anemia resulting from destruction of red blood cells).[18] Both HIT and PNH require particular treatment.[17][18]
Hematologic conditions associated with sluggish blood flow can increase risk for thrombosis. For example, sickle-cell disease (caused by mutations of hemoglobin) is regarded as a mild prothrombotic state induced by impaired flow.[1] Similarly, myeloproliferative disorders, in which the bone marrow produces too many blood cells, predispose to thrombosis, particularly in polycythemia vera (excess red blood cells) and essential thrombocytosis (excess platelets). Again, these conditions usually warrant specific treatment when identified.[19]
Cancer, particularly when metastatic (spread to other places in the body), is a recognised risk factor for thrombosis.[2][14] A number of mechanisms have been proposed, such as activation of the coagulation system by cancer cells or secretion of procoagulant substances. Furthermore, particular cancer treatments (such as the use of central venous catheters for chemotherapy) may increase the risk of thrombosis further.[20]
Nephrotic syndrome, in which protein from the bloodstream is released into the urine due to kidney diseases, can predispose to thrombosis;[1] this is particularly the case in more severe cases (as indicated by blood levels of albumin below 25 g/L) and if the syndrome is caused by the condition membranous nephropathy.[21] Inflammatory bowel disease (ulcerative colitis and Crohn’s disease) predispose to thrombosis, particularly when the disease is active. Various mechanisms have been proposed.[2][22]
Pregnancy is associated with an increased risk of thrombosis of 2- to 7-fold.[23] This probably results from a physiological hypercoagulability in pregnancy that protects against postpartum hemorrhage.[24] This hypercoagulability in turn is likely related to the high levels of estradiol and progesterone that occur during pregnancy.[25]
Estrogens, when used in combined hormonal birth control and in menopausal hormone therapy (in combination with progestogens), have been associated with a 2- to 6-fold increased risk of venous thrombosis. The risk depends on the types of hormones used, the dose of estrogen, and the presence of other thrombophilic risk factors.[26] Various mechanisms, such as deficiency of protein S and tissue factor pathway inhibitor, are said to be responsible.[27]
Obesity has long been regarded as a risk factor for venous thrombosis. It more than doubles the risk in numerous studies, particularly in combination with the use of oral contraceptives or in the period after surgery. Various coagulation abnormalities have been described in the obese. Plasminogen activator inhibitor-1, an inhibitor of fibrinolysis, is present in higher levels in people with obesity. Obese people also have larger numbers of circulating microvesicles (fragments of damaged cells) that bear tissue factor. Platelet aggregation may be increased, and there are higher levels of coagulation proteins such as von Willebrand factor, fibrinogen, factor VII and factor VIII. Obesity also increases the risk of recurrence after an initial episode of thrombosis.[28]
Unclear[edit]
A number of conditions that have been linked with venous thrombosis are possibly genetic and possibly acquired.[14] These include: elevated levels of factor VIII, factor IX, factor XI, fibrinogen and
thrombin-activatable fibrinolysis inhibitor, and decreased levels of tissue factor pathway inhibitor. Activated protein C resistance that is not attributable to factor V mutations is probably caused by other factors and remains a risk factor for thrombosis.[14]
There is an association between the blood levels of homocysteine and thrombosis,[14] although this has not been reported consistently in all studies.[5] Homocysteine levels are determined by mutations in the MTHFR and CBS genes, but also by levels of folic acid, vitamin B6 and vitamin B12, which depend on diet.[12]
Mechanism[edit]
The coagulation system, often described as a «cascade», consists of a group of proteins that interact in the formation of a fibrin-rich clot.
Thrombosis is a multifactorial problem because there are often multiple reasons why a person might develop thrombosis. These risk factors may include any combination of abnormalities in the blood vessel wall, abnormalities in the blood flow (as in immobilization), and abnormalities in the consistency of the blood. Thrombophilia is caused by abnormalities in blood consistency, which is determined by the levels of coagulation factors and other circulating blood proteins that participate in the «coagulation cascade».[14]
Normal coagulation is initiated by the release of tissue factor from damaged tissue. Tissue factor binds to circulating factor VIIa. The combination activates factor X to factor Xa and factor IX to factor IXa. Factor Xa (in the presence of factor V) activates prothrombin into thrombin. Thrombin is a central enzyme in the coagulation process: it generates fibrin from fibrinogen, and activates a number of other enzymes and cofactors (factor XIII, factor XI, factor V and factor VIII, TAFI) that enhance the fibrin clot.[12] The process is inhibited by TFPI (which inactivates the first step catalyzed by factor VIIa/tissue factor), antithrombin (which inactivates thrombin, factor IXa, Xa and XIa), protein C (which inhibits factors Va and VIIIa in the presence of protein S), and protein Z (which inhibits factor Xa).[12]
In thrombophilia, the balance between «procoagulant» and «anticoagulant» activity is disturbed. The severity of the imbalance determines the likelihood that someone develops thrombosis. Even small perturbances of proteins, such as the reduction of antithrombin to only 70–80% of the normal level, can increase the thrombosis risk; this is in contrast with hemophilia, which only arises if levels of coagulation factors are markedly decreased.[12]
In addition to its effects on thrombosis, hypercoagulable states may accelerate the development of atherosclerosis, the arterial disease that underlies myocardial infarction and other forms of cardiovascular disease.[29][30]
Diagnosis[edit]
A mutation of coagulation factor V (schematic representation drawn here) is much more common in people with thrombosis than in those without, but is only regarded as a weak risk factor.
Tests for thrombophilia include complete blood count (with examination of the blood film), prothrombin time, partial thromboplastin time, thrombodynamics test, thrombin time and reptilase time, lupus anticoagulant, anti-cardiolipin antibody, anti-β2 glycoprotein 1 antibody, activated protein C resistance, fibrinogen tests, factor V Leiden and prothrombin mutation, and basal homocysteine levels.[2] Testing may be more or less extensive depending on clinical judgement and abnormalities detected on initial evaluation.[2]
For hereditary cases, the patient must have at least two abnormal tests plus family history.
Screening[edit]
There are divergent views as to whether everyone with an unprovoked episode of thrombosis should be investigated for thrombophilia. Even those with a form of thrombophilia may not necessarily be at risk of further thrombosis, while recurrent thrombosis is more likely in those who have had previous thrombosis even in those who have no detectable thrombophilic abnormalities.[8][11][31] Recurrent thromboembolism, or thrombosis in unusual sites (e.g. the hepatic vein in Budd-Chiari syndrome), is a generally accepted indication for screening. It is more likely to be cost-effective in people with a strong personal or family history of thrombosis.[32] In contrast, the combination of thrombophilia with other risk factors may provide an indication for preventive treatment, which is why thrombophilia testing may be performed even in those who would not meet the strict criteria for these tests.[31] Searching for a coagulation abnormality is not normally undertaken in patients in whom thrombosis has an obvious trigger. For example, if the thrombosis is due to immobilization after recent orthopedic surgery, it is regarded as «provoked» by the immobilization and the surgery and it is less likely that investigations will yield clinically important results.[11][31]
When venous thromboembolism occurs when a patient is experiencing transient major risk factors such as prolonged immobility, surgery, or trauma, testing for thrombophilia is not appropriate because the outcome of the test would not change a patient’s indicated treatment.[33][34] In 2013, the American Society of Hematology, as part of recommendations in the Choosing Wisely campaign, cautioned against overuse of thrombophilia screening; false positive results of testing would lead to people inappropriately being labeled as having thrombophilia, and being treated with anticoagulants without clinical need[33]
In the United Kingdom, professional guidelines give specific indications for thrombophilia testing. It is recommended that testing be done only after appropriate counseling, and hence the investigations are usually not performed at the time when thrombosis is diagnosed but at a later time.[11] In particular situations, such as retinal vein thrombosis, testing is discouraged altogether because thrombophilia is not regarded as a major risk factor. In other rare conditions generally linked with hypercoagulability, such as cerebral venous thrombosis and portal vein thrombosis, there is insufficient data to state for certain whether thrombophilia screening is helpful, and decisions on thrombophilia screening in these conditions are therefore not regarded as evidence-based.[11] If cost-effectiveness (quality-adjusted life years in return for expenditure) is taken as a guide, it is generally unclear whether thrombophilia investigations justify the often high cost,[35] unless the testing is restricted to selected situations.[36]
Recurrent miscarriage is an indication for thrombophilia screening, particularly antiphospholipid antibodies (anti-cardiolipin IgG and IgM, as well as lupus anticoagulant), factor V Leiden and prothrombin mutation, activated protein C resistance and a general assessment of coagulation through an investigation known as thromboelastography.[10]
Women who are planning to use oral contraceptives do not benefit from routine screening for thrombophilias, as the absolute risk of thrombotic events is low. If either the woman or a first-degree relative has had thrombosis, the risk of developing thrombosis is increased. Screening this selected group may be beneficial,[27] but even when negative may still indicate residual risk.[11] Professional guidelines therefore suggest that alternative forms of contraception be used rather than relying on screening.[11]
Thrombophilia screening in people with arterial thrombosis is generally regarded as unrewarding and is generally discouraged,[11] except possibly for unusually young patients (especially when precipitated by smoking or use of estrogen-containing hormonal contraceptives) and those in whom revascularization, such as coronary arterial bypass, fails because of rapid occlusion of the graft.[9]
Treatment[edit]
People considered to be at a high risk of repeated thrombosis due to thrombophilia are often advised to take warfarin for prolonged periods of time or even indefinitely.
There is no specific treatment for thrombophilia, unless it is caused by an underlying medical illness (such as nephrotic syndrome), where the treatment of the underlying disease is needed. In those with unprovoked and/or recurrent thrombosis, or those with a high-risk form of thrombophilia, the most important decision is whether to use anticoagulation medications, such as warfarin, on a long-term basis to reduce the risk of further episodes.[3] This risk needs to weighed against the risk that the treatment will cause significant bleeding, as the reported risk of major bleeding is over 3% per year, and 11% of those with major bleeding may die as a result.[3]
Apart from the abovementioned forms of thrombophilia, the risk of recurrence after an episode of thrombosis is determined by factors such as the extent and severity of the original thrombosis, whether it was provoked (such as by immobilization or pregnancy), the number of previous thrombotic events, male sex, the presence of an inferior vena cava filter, the presence of cancer, symptoms of post-thrombotic syndrome, and obesity.[3] These factors tend to be more important in the decision than the presence or absence of a detectable thrombophilia.[11][37]
Those with antiphospholipid syndrome may be offered long-term anticoagulation after a first unprovoked episode of thrombosis. The risk is determined by the subtype of antibody detected, by the antibody titer (amount of antibodies), whether multiple antibodies are detected, and whether it is detected repeatedly or only on a single occasion.[16]
Women with a thrombophilia who are contemplating pregnancy or are pregnant usually require alternatives to warfarin during pregnancy, especially in the first 13 weeks, when it may produce abnormalities in the unborn child. Low molecular weight heparin (LMWH, such as enoxaparin) is generally used as an alternative.[38] Warfarin and LMWH may safely be used in breastfeeding.[38]
When women experience recurrent pregnancy loss secondary to thrombophilia, some studies have suggested that low molecular weight heparin reduces the risk of miscarriage. When the results of all studies are analysed together, no statistically significant benefit could be demonstrated.[39]
Prognosis[edit]
In people without a detectable thrombophilia, the cumulative risk of developing thrombosis by the age of 60 is about 12%. About 60% of people who are deficient in antithrombin will have experienced thrombosis at least once by age 60, as will about 50% of people with protein C deficiency and about a third of those with protein S deficiency. People with activated protein C resistance (usually resulting from factor V Leiden), in contrast, have a slightly raised absolute risk of thrombosis, with 15% having had at least one thrombotic event by the age of sixty.[12] In general, men are more likely than women to experience repeated episodes of venous thrombosis.[5]
People with factor V Leiden are at a relatively low risk of thrombosis, but may develop thrombosis in the presence of an additional risk factor, such as immobilization. Most people with the prothrombin mutation (G20210A) never develop thrombosis.[12]
Epidemiology[edit]
The major («type 1») thrombophilias are rare. Antithrombin deficiency is present in 0.2% of the general population and 0.5–7.5% of people with venous thrombosis. Protein C deficiency, too, is present in 0.2% of the population, and can be found in 2.5–6% of people with thrombosis. The exact prevalence of protein S deficiency in the population is unknown; it is found 1.3–5% of people with thrombosis.[12]
The minor («type 2») thrombophilias are much more common. Factor V Leiden is present in 5% of the population of Northern European descent, but much rarer in those of Asian or African extraction. In people with thrombosis, 10% have factor V Leiden. In those who are referred for thrombophilia testing, 30–50% have the defect. The prothrombin mutation occurs at rates of 1–4% in the general population, 5–10% of people with thrombosis, and 15% of people referred for thrombophilia testing. Like factor V Leiden, this abnormality is uncommon in Africans and Asians.[12]
The exact prevalence of antiphospholipid syndrome is not well known, as different studies employ different definitions of the condition. Antiphospholipid antibodies are detected in 24% of those referred to thrombophilia testing.[16]
History[edit]
Rudolf Virchow, the German pathologist who distinguished the various causes of thrombosis, and whose work led to the development of thrombophilia as a concept
German physician Rudolf Virchow categorized abnormalities in the consistency of the blood as a factor in the development of thrombosis in 1856. The exact nature of these abnormalities remained elusive until the first form of thrombophilia, antithrombin deficiency, was recognized in 1965 by the Norwegian hematologist Olav Egeberg.[40] Protein C deficiency followed in 1981, when described by researchers from the Scripps Research Institute and the U.S. Centers of Disease Control.[41] Protein S deficiency followed in 1984, described by researchers at the University of Oklahoma.[4][5][42]
Antiphospholipid syndrome was described in full in the 1980s, after various previous reports of specific antibodies in people with systemic lupus erythematosus and thrombosis.[16][43] The syndrome is often attributed to the British rheumatologist Graham R.V. Hughes, and is often referred to as Hughes syndrome for that reason.[44]
The more common genetic thrombophilias were described in the 1990s. Many studies had previously indicated that many people with thrombosis showed resistance activated protein C. In 1994 a group in Leiden, The Netherlands, identified the most common underlying defect—a mutation in factor V that made it resistant to the action of activated protein C. The defect was called factor V Leiden, as genetic abnormalities are typically named after the place where they are discovered.[45] Two years later, the same group described a common mutation in the prothrombin gene that caused elevation of prothrombin levels and a mild increase in thrombosis risk.[4][5][46]
It is suspected that other genetic abnormalities underlying familial thrombosis will in future be discovered through studies of the entire genetic code, looking for small alternations in genes.[4][5]
References[edit]
- ^ a b c d e f g Mitchell RS, Kumar V, Abbas AK, Fausto N (2007). «Chapter 4». Robbins Basic Pathology (Eighth ed.). Philadelphia: Saunders. ISBN 978-1-4160-2973-1.
- ^ a b c d e f g h i j k l Heit JA (2007). «Thrombophilia: common questions on laboratory assessment and management». Hematology Am. Soc. Hematol. Educ. Program. 2007 (1): 127–35. doi:10.1182/asheducation-2007.1.127. PMID 18024620.
- ^ a b c d Kyrle PA, Rosendaal FR, Eichinger S (December 2010). «Risk assessment for recurrent venous thrombosis». Lancet. 376 (9757): 2032–9. doi:10.1016/S0140-6736(10)60962-2. PMID 21131039. S2CID 31610364.
- ^ a b c d Dahlbäck B (July 2008). «Advances in understanding pathogenic mechanisms of thrombophilic disorders». Blood. 112 (1): 19–27. doi:10.1182/blood-2008-01-077909. PMID 18574041.
- ^ a b c d e f g Rosendaal FR, Reitsma PH (July 2009). «Genetics of venous thrombosis». J. Thromb. Haemost. 7 Suppl 1: 301–4. doi:10.1111/j.1538-7836.2009.03394.x. PMID 19630821.
- ^ Scarvelis D, Wells PS (October 2006). «Diagnosis and treatment of deep-vein thrombosis». CMAJ. 175 (9): 1087–92. doi:10.1503/cmaj.060366. PMC 1609160. PMID 17060659.
- ^ Agnelli G, Becattini C (July 2010). «Acute pulmonary embolism». N. Engl. J. Med. 363 (3): 266–74. doi:10.1056/NEJMra0907731. PMID 20592294.
- ^ a b Middeldorp S, van Hylckama Vlieg A (August 2008). «Does thrombophilia testing help in the clinical management of patients?». Br. J. Haematol. 143 (3): 321–35. doi:10.1111/j.1365-2141.2008.07339.x. PMID 18710381.
- ^ a b de Moerloose P, Boehlen F (April 2007). «Inherited thrombophilia in arterial disease: a selective review». Semin. Hematol. 44 (2): 106–13. doi:10.1053/j.seminhematol.2007.01.008. PMID 17433903.
- ^ a b Rai R, Regan L (August 2006). «Recurrent miscarriage». Lancet. 368 (9535): 601–11. doi:10.1016/S0140-6736(06)69204-0. PMID 16905025. S2CID 42968924.
- ^ a b c d e f g h i Baglin T, Gray E, Greaves M, et al. (April 2010). «Clinical guidelines for testing for heritable thrombophilia». Br. J. Haematol. 149 (2): 209–20. doi:10.1111/j.1365-2141.2009.08022.x. PMID 20128794.
- ^ a b c d e f g h i j k Crowther MA, Kelton JG (2003). «Congenital thrombophilic states associated with venous thrombosis: a qualitative overview and proposed classification system». Ann. Intern. Med. 138 (2): 128–34. doi:10.7326/0003-4819-138-2-200301210-00014. PMID 12529095. S2CID 43161448.
- ^ «Congenital Causes of Venous Thrombosis—A Classification System». Annals of Internal Medicine. American College of Physicians. January 21, 2003.
- ^ a b c d e f g h i j Rosendaal FR (2005). «Venous thrombosis: the role of genes, environment, and behavior». Hematology Am. Soc. Hematol. Educ. Program. 2005 (1): 1–12. doi:10.1182/asheducation-2005.1.1. PMID 16304352.
- ^ Mehta R, Shapiro AD (November 2008). «Plasminogen deficiency». Haemophilia. 14 (6): 1261–8. doi:10.1111/j.1365-2516.2008.01825.x. PMID 19141167.
- ^ a b c d Ruiz-Irastorza G, Crowther M, Branch W, Khamashta MA (October 2010). «Antiphospholipid syndrome». Lancet. 376 (9751): 1498–509. doi:10.1016/S0140-6736(10)60709-X. hdl:2318/1609788. PMID 20822807. S2CID 25554663.
- ^ a b Keeling D, Davidson S, Watson H (May 2006). «The management of heparin-induced thrombocytopenia». Br. J. Haematol. 133 (3): 259–69. doi:10.1111/j.1365-2141.2006.06018.x. PMID 16643427.
- ^ a b Brodsky RA (April 2008). «Narrative review: paroxysmal nocturnal hemoglobinuria: the physiology of complement-related hemolytic anemia». Ann. Intern. Med. 148 (8): 587–95. CiteSeerX 10.1.1.668.4942. doi:10.7326/0003-4819-148-8-200804150-00003. PMID 18413620. S2CID 19715590.
- ^ Papadakis E, Hoffman R, Brenner B (November 2010). «Thrombohemorrhagic complications of myeloproliferative disorders». Blood Rev. 24 (6): 227–32. doi:10.1016/j.blre.2010.08.002. PMID 20817333.
- ^ Prandoni P, Falanga A, Piccioli A (June 2005). «Cancer and venous thromboembolism». Lancet Oncol. 6 (6): 401–10. doi:10.1016/S1470-2045(05)70207-2. PMID 15925818.
- ^ Hull RP, Goldsmith DJ (May 2008). «Nephrotic syndrome in adults». BMJ. 336 (7654): 1185–9. doi:10.1136/bmj.39576.709711.80. PMC 2394708. PMID 18497417.
- ^ Quera R, Shanahan F (October 2004). «Thromboembolism—an important manifestation of inflammatory bowel disease». Am. J. Gastroenterol. 99 (10): 1971–3. doi:10.1111/j.1572-0241.2004.40923.x. PMID 15447758. S2CID 11391129.
- ^ Abdul Sultan A, West J, Stephansson O, Grainge MJ, Tata LJ, Fleming KM, Humes D, Ludvigsson JF (November 2015). «Defining venous thromboembolism and measuring its incidence using Swedish health registries: a nationwide pregnancy cohort study». BMJ Open. 5 (11): e008864. doi:10.1136/bmjopen-2015-008864. PMC 4654387. PMID 26560059.
- ^ Bourjeily G, Paidas M, Khalil H, Rosene-Montella K, Rodger M (February 2010). «Pulmonary embolism in pregnancy». Lancet. 375 (9713): 500–12. doi:10.1016/S0140-6736(09)60996-X. PMID 19889451. S2CID 8633455.
- ^ Daughety, Molly M.; Samuelson Bannow, Bethany T. (2019). «Hemostasis and Thrombosis in Pregnancy». Hemostasis and Thrombosis. pp. 197–206. doi:10.1007/978-3-030-19330-0_30. ISBN 978-3-030-19329-4. S2CID 201995636.
- ^ Gomes MP, Deitcher SR (October 2004). «Risk of venous thromboembolic disease associated with hormonal contraceptives and hormone replacement therapy: a clinical review». Arch. Intern. Med. 164 (18): 1965–76. doi:10.1001/archinte.164.18.1965. PMID 15477430.
- ^ a b Tchaikovski SN, Rosing J (July 2010). «Mechanisms of estrogen-induced venous thromboembolism». Thromb. Res. 126 (1): 5–11. doi:10.1016/j.thromres.2010.01.045. PMID 20163835.
- ^ Stein PD, Goldman J (September 2009). «Obesity and thromboembolic disease». Clin. Chest Med. 30 (3): 489–93, viii. doi:10.1016/j.ccm.2009.05.006. PMID 19700047.
- ^ Borissoff JI, Spronk HM, Heeneman S, ten Cate H (2009). «Is thrombin a key player in the ‘coagulation-atherogenesis’ maze?». Cardiovasc. Res. 82 (3): 392–403. doi:10.1093/cvr/cvp066. PMID 19228706.
- ^ Borissoff JI, Spronk HM, ten Cate H (2011). «The hemostatic system as a modulator of atherosclerosis». N. Engl. J. Med. 364 (18): 1746–1760. doi:10.1056/NEJMra1011670. PMID 21542745.
- ^ a b c Dalen JE (June 2008). «Should patients with venous thromboembolism be screened for thrombophilia?». Am. J. Med. 121 (6): 458–63. doi:10.1016/j.amjmed.2007.10.042. PMID 18501222.
- ^ Wu O, Robertson L, Twaddle S, et al. (October 2005). «Screening for thrombophilia in high-risk situations: a meta-analysis and cost-effectiveness analysis». Br. J. Haematol. 131 (1): 80–90. doi:10.1111/j.1365-2141.2005.05715.x. PMID 16173967.
- ^ a b American Society of Hematology (September 2013), «Five Things Physicians and Patients Should Question», Choosing Wisely: an initiative of the ABIM Foundation, American Society of Hematology, retrieved 10 December 2013, which cites
- Chong, L. -Y.; Fenu, E.; Stansby, G.; Hodgkinson, S.; Guideline Development, G. (2012). «Management of venous thromboembolic diseases and the role of thrombophilia testing: Summary of NICE guidance». BMJ. 344: e3979. doi:10.1136/bmj.e3979. PMID 22740565. S2CID 42342532.
- Baglin, T.; Gray, E.; Greaves, M.; Hunt, B. J.; Keeling, D.; Machin, S.; MacKie, I.; Makris, M.; Nokes, T.; Perry, D.; Tait, R. C.; Walker, I.; Watson, H.; British Committee for Standards in Haematology (2010). «Clinical guidelines for testing for heritable thrombophilia». British Journal of Haematology. 149 (2): 209–220. doi:10.1111/j.1365-2141.2009.08022.x. PMID 20128794.
- ^ Hicks LK, Bering H, Carson KR, et al. (2013). «The ASH Choosing Wisely(R) campaign: five hematologic tests and treatments to question». Blood. 122 (24): 3879–83. doi:10.1182/blood-2013-07-518423. PMID 24307720.
- ^ Simpson EL, Stevenson MD, Rawdin A, Papaioannou D (January 2009). «Thrombophilia testing in people with venous thromboembolism: systematic review and cost-effectiveness analysis». Health Technol. Assess. 13 (2): iii, ix–x, 1–91. doi:10.3310/hta13020. PMID 19080721.
- ^ Wu O, Greer IA (September 2007). «Is screening for thrombophilia cost-effective?». Curr. Opin. Hematol. 14 (5): 500–3. doi:10.1097/MOH.0b013e32825f5318. PMID 17934357. S2CID 22896788.
- ^ Kearon C, Kahn SR, Agnelli G, Goldhaber S, Raskob GE, Comerota AJ (June 2008). «Antithrombotic therapy for venous thromboembolic disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition)». Chest. 133 (6 Suppl): 454S–545S. doi:10.1378/chest.08-0658. PMID 18574272. Archived from the original on 2013-01-12.
- ^ a b Bates SM, Greer IA, Pabinger I, Sofaer S, Hirsh J (June 2008). «Venous thromboembolism, thrombophilia, antithrombotic therapy, and pregnancy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition)». Chest. 133 (6 Suppl): 844S–886S. doi:10.1378/chest.08-0761. PMID 18574280. Archived from the original on 2013-01-12.
- ^ Skeith L, Carrier M, Kaaja R, Martinelli I, Petroff D, Schleußner E, Laskin CA, Rodger MA (2016). «A meta-analysis of low-molecular-weight heparin to prevent pregnancy loss in women with inherited thrombophilia». Blood. 127 (13): 1650–55. doi:10.1182/blood-2015-12-626739. PMID 26837697.
- ^ Egeberg O (June 1965). «Inherited antithrombin deficiency causing thrombophilia». Thromb. Diath. Haemorrh. 13 (2): 516–30. doi:10.1055/s-0038-1656297. PMID 14347873. S2CID 42594050.
- ^ Griffin JH, Evatt B, Zimmerman TS, Kleiss AJ, Wideman C (November 1981). «Deficiency of protein C in congenital thrombotic disease». J. Clin. Invest. 68 (5): 1370–3. doi:10.1172/JCI110385. PMC 370934. PMID 6895379.
- ^ Comp PC, Esmon CT (December 1984). «Recurrent venous thromboembolism in patients with a partial deficiency of protein S». N. Engl. J. Med. 311 (24): 1525–8. doi:10.1056/NEJM198412133112401. PMID 6239102.
- ^ Hughes GR (October 1983). «Thrombosis, abortion, cerebral disease, and the lupus anticoagulant». Br. Med. J. (Clin. Res. Ed.). 287 (6399): 1088–89. doi:10.1136/bmj.287.6399.1088. PMC 1549319. PMID 6414579.
- ^ Sanna G, D’Cruz D, Cuadrado MJ (August 2006). «Cerebral manifestations in the antiphospholipid (Hughes) syndrome». Rheum. Dis. Clin. North Am. 32 (3): 465–90. doi:10.1016/j.rdc.2006.05.010. PMID 16880079.
- ^ Bertina RM, Koeleman BP, Koster T, et al. (May 1994). «Mutation in blood coagulation factor V associated with resistance to activated protein C». Nature. 369 (6475): 64–7. Bibcode:1994Natur.369…64B. doi:10.1038/369064a0. PMID 8164741. S2CID 4314040.
- ^ Poort SR, Rosendaal FR, Reitsma PH, Bertina RM (November 1996). «A common genetic variation in the 3′-untranslated region of the prothrombin gene is associated with elevated plasma prothrombin levels and an increase in venous thrombosis» (PDF). Blood. 88 (10): 3698–703. doi:10.1182/blood.V88.10.3698.bloodjournal88103698. PMID 8916933.
External links[edit]
- «Thrombophilia». Patient UK.