Сукцинилхолин
Succinylcholine
Фармакологическое действие
Сукцинилхолин (суксаметониум, диацетилхолин) — деполяризующий миорелаксант. Действует аналогично ацетилхолину, вызывает деполяризацию моторной замыкательной пластинки в мионевральном соединении, что вызывает стойкий паралич вялых скелетных мышц, вызванный состоянием аккомодации, которое развивается в соседних возбудимых мышечных оболочках.
При внутривенном введении сукцинилхолин связывается с постсинаптическими никотиновыми рецепторами и оказывает ацетилхолин-подобное действие, то есть вызывает деполяризацию мембран. Этот процесс сопровождается мышечными сокращениями, которые клинически проявляются фасцикуляциями (мышечные подёргивания). Этот период характеризуют как Ⅰ фаза нейромышечного блока. Таким образом нарушается проведение нервно-мышечного возбуждения и возникает расслабление скелетных мышц. При высоких или повторных дозах сукцинилхолина наступает Ⅱ фаза (недеполяризующий блок), механизм которого не ясен. Препарат также связывается с H-холинорецепторами других органов и тканей, что объясняет его побочные эффекты.
Фармакокинетика
Обладает быстрым началом действия — 30–60 с и кратковременным эффектом — <10 мин. Поступая в кровоток, сукцинилхолин разрушается путём гидролиза псевдохолинэстеразой и распадается на сукцинилмонохолин и холин, причём настолько быстро, что только около 10 % препарата попадает в нервно-мышечный синапс. Затем концентрация препарата в сыворотке крови снижается и молекулы сукцинилхолина начинают диффундировать из комплекса с холинорецепторами в кровоток и нервно-мышечная проводимость восстанавливается. Период полувыведения (T½) сукцинилхолина составляет около 47 секунд.
Сукцинилхолин действует дольше при увеличении дозы, а также нарушении метаболизма — при гипотермии (замедляет гидролиз), низкой концентрации или наследственном дефекте псевдохолинэстеразы. Концентрация псевдохолинэстеразы в сыворотке крови может снижаться при беременности, заболеваниях печени и при воздействии некоторых лекарственных средств. У 2 % больных одна аллель гена псевдохолинэстеразы нормальная, вторая — патологическая (гетерозиготный дефект гена псевдохолинэстеразы), что удлиняет действие препарата до 20–30 мин. У 1 больного из 3000 обе аллели гена псевдохолинэстеразы патологические (гомозиготный дефект гена псевдохолинэстеразы), в результате чего активность псевдохолинэстеразы значительно снижается, при этом нервно-мышечный блок после введения сукцинилхолина длится около 4–8 ч.
Показания
Кратковременная нервно-мышечная блокада при интубации трахеи, хирургии или механической вентиляции лёгких.
Противопоказания
- Повышенная чувствительность к сукцинилхолину;
- возраст до 18 лет из-за высокого риска рабдомиолиза, гиперкалиемии и остановки сердца у детей с недиагностированной миопатией;
- глаукома (возможно резкое повышение внутриглазного давления);
- гиперкалиемия;
- ожоги.
Беременность и грудное вскармливание
Категория действия на плод по FDA — C.
Применение в детском возрасте
Применение у пациентов в возрасте до 18 лет противопоказано.
Способ применения и дозы
Внутривенно, внутримышечно.
Побочные действия
Сердечно-сосудистая система
Сукцинилхолин, имея схожую структуру с ацетилхолином, взаимодействует также с холинорецепторами и вне нервно-мышечного синапса. Стимуляция H-холинорецепторов парасимпатических и симпатических ганглиев, а также M-холинорецепторов синоатриального узла в сердце приводит к увеличению или уменьшению артериального давления и частоты сердечных сокращений.
Метаболит сукцинилхолина стимулирует м-холинорецепторы синоатриального узла, что вызывает брадикардию. Хотя к этому эффекту особенно чувствительны дети, после второй дозы сукцинилхолина брадикардия развивается и у взрослых. Для профилактики брадикардии вводят атропин: во всех возрастных группах обязательно перед инъекцией второй дозы сукцинилхолина, а у детей часто и перед первой инъекцией. Дозы атропина: у детей — 0,02 мг/кг в/в, у взрослых — 0,4 мг в/в. Иногда сукцинилхолин вызывает узловую брадикардию и желудочковые эктопические ритмы.
Фасцикуляции
При введении сукцинилхолина о начале миорелаксации сигнализируют видимые глазом сокращения моторных единиц, которые называются фасцикуляциями. Фасцикуляции можно предотвратить предварительным введением недеполяризующего миорелаксанта в низкой дозе (прекураризация). Так как это взаимодействие препятствует развитию I фазы деполяризующего блока, требуются высокие дозы сукцинилхолина (1,5 мг/кг).
Гиперкалиемия
При введении сукцинилхолина деполяризация приводит к тому, что из здоровых мышц выделяется калий с увеличением его концентрации в сыворотке крови до 0,5 ммоль/л. При нормальной концентрации калия этот феномен не имеет клинического значения, но при некоторых состояниях (обширные ожоги, травмы, некоторые неврологические заболевания) возникающая гиперкалиемия может привести к нарушению ритма и даже к остановке сердца, которая часто бывает рефрактерна (устойчива) к стандартным реанимационным мероприятиям: для снижения концентрации калия и устранения метаболического ацидоза требуются кальций, инсулин и глюкоза, бикарбонат, катионо-обменная смола, дантролен и даже искусственное кровообращение.
К состоянием высокого риска относят обширные ожоги и травмы, тяжёлую внутрибрюшную инфекцию, травму спинного мозга, энцефалит, инсульт, синдром Гийена-Барре, Тяжёлые формы болезни Паркинсона, столбняк, длительную неподвижность, полинейропатии и миопатии, разрыв артериальной аневризмы головного мозга, закрытые черепно-мозговые травмы, утопление, геморрагический шок с метаболическим ацидозом.
Если травма вызывает денервацию (например, при полном поперечном разрыве спинного мозга денервации подвергаются многие группы мышц), то холинорецепторы формируются на мембранах мышц вне нервно-мышечного синапса, что при введении сукцинилхолина вызывает всеохватывающую деполяризацию мышц и мощный выброс калия в кровоток. Предварительное введение недеполяризующего миорелаксанта не вызывает достоверного предотвращения высвобождения калия и не устраняет угрозы опасных для жизни осложнений. Риск гиперкалиемии достигает максимума на 7–10-й день после травмы, но точные временные параметры периода риска неизвестны.
Боль в мышцах
При введении сукцинилхолина часто возникают миалгии (боли в мышцах) в послеоперационном периоде, что связано с фасцикуляциями и микротравмой мышц вследствие них. На миалгию чаще всего жалуются молодые люди (чаще женщины) после амбулаторных хирургических вмешательств. При беременности, а также в детском и преклонном возрасте риск миалгии уменьшается.
Некоторые исследования говорят о том, что предварительное введение недеполяризующего миорелаксанта или лидокаина (1–1,5 мг/кг) уменьшает вероятность возникновения миалгии. Нестероидные противовоспалительные препараты эффективны при лечении миалгии.
Повышение давления в полости желудка
Фасцикуляции мышц брюшной стенки увеличивают давление в просвете желудка, что в свою очередь приводит к повышению тонуса нижнего пищеводного сфинктера. Следовательно, эти два эффекта взаимопоглощаются, и сукцинилхолин, вероятнее всего, не увеличивает риск возникновения желудочного рефлюкса и лёгочной аспирации. Предварительное введение недеполяризующего миорелаксанта предотвращает как увеличение давления в просвете желудка, так и компенсаторное повышение тонуса нижнего пищеводного сфинктера.
Однако следует соблюдать насторожённость к желудочной регургитации и профилактировать её с помощью возвышенного положения головного конца тела и приёма Селика.
Повышение внутриглазного давления
Сукцинилхолин повышает внутриглазное давление, что связано с сокращением мышц глазного яблока. При этом у пациентов с травмой глаза увеличивается риск повреждения, в частности при проникающим ранением глаза теоретически существует опасность вытекания стекловидного тела. Некоторые авторы оспаривают это утверждение. Предварительное введение недеполяризующего миорелаксанта не всегда предотвращает увеличение внутриглазного давления.
Злокачественная гипертермия
Сукцинилхолин — мощный провоцирующий фактор злокачественной гипертермии. Ранним симптомом злокачественной гипертермии часто служит парадоксальное сокращение челюстных мышц после введения сукцинилхолина.
Генерализованные сокращения
При миотонии введение сукцинилхолина может вызывать миоклонус.
Длительный паралич скелетной мускулатуры
Как уже отмечалось ранее, при низкой концентрации нормальной псевдохолинэстеразы введение сукцинилхолина вызывает умеренное удлинение деполяризующего блока. После введения сукцинилхолина больным с патологической псевдохолинэстеразой возникает длительный паралич скелетных мышц. В отсутствие адекватной респираторной поддержки это осложнение представляет серьёзную опасность.
Повышение внутричерепного давления
Сукцинилхолин может увеличивать мозговой кровоток и внутричерепное давление. Это также можно предотвратить с помощью прекураризации и инъекции лидокаина (1,5–2 мг/кг) за 2–3 мин до интубации, а также предварительной ИВЛ в режиме гипервентиляции. Интубация трахеи с неадекватной анестезией и миорелаксацией увеличивает внутричерепное давление значительно сильнее, чем сукцинилхолин.
Классификация
-
Фармакологическая группа
-
Категория при беременности по FDA
C
(риск не исключается)
Информация о действующем веществе Сукцинилхолин предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Сукцинилхолин, содержатся в инструкции производителя, прилагаемой к упаковке.
 |
||
|
Сукцинилхолин (Succinylcholine) |
||
| Химическое соединение | ||
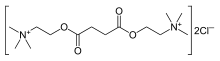
| ИЮПАК | 2,2′-[(1,4-диоксибутан-1,4-диил)бис(окси)]бис (N,N,N-триметилэтанаминий) |
|
| Брутто- формула |
C14H30N2O4 | |
| Мол. масса |
290.399 г/моль | |
| CAS | 306-40-1 | |
| PubChem | 22475 | |
| DrugBank | DB00202 | |
| Классификация | ||
| Фарм. группа |
н-Холинолитики (миорелаксанты) | |
| АТХ | M03AB01 | |
| МКБ-10 | Z100.100. | |
| Фармакокинетика | ||
| Метаболизм | Псевдохолинэстеразой до сукцинилмонохолина и холина | |
| Экскреция | почками (10 %) | |
| Лекарственные формы | ||
| Раствор для внутривенного и внутримышечного введения | ||
| Способ введения | ||
| внутривенно, внутримышечно | ||
| Торговые названия | ||
| Суксаметония хлорид, Суксаметония йодид, Суксаметония бромид, Дитилин, Листенон | ||
Сукцинилхолин (Суксаметониум, Диацетилхолин) — единственный деполяризующий миорелаксант, применяемый в клинической практике в настоящее время.
Содержание
- 1 История
- 2 Строение и свойства
- 3 Фармакодинамика
- 4 Фармакокинетика
- 5 Показания
- 6 Противопоказания
- 7 Режим дозирования
- 8 Побочные эффекты
- 8.1 Сердечно-сосудистая система
- 8.2 Фасцикуляции
- 8.3 Гиперкалиемия
- 8.4 Боль в мышцах
- 8.5 Повышение давления в полости желудка
- 8.6 Повышение внутриглазного давления
- 8.7 Злокачественная гипертермия
- 8.8 Генерализованные сокращения
- 8.9 Длительный паралич скелетной мускулатуры
- 8.10 Повышение внутричерепного давления
- 9 Хранение
- 10 Примечания
История
Был синтезирован Бове (Bovet) в 1949 году и разрешён к применению в клинической практике в 1951 году.
Строение и свойства
По химическому строению сукцинилхолин — две молекулы ацетилхолина, соединённых между собой метиловой группой (диацетилхолин)[1].
Белый мелкокристаллический порошок. Как и все миорелаксанты, является четвертичным аммониевым соединением. Легко растворим в воде, очень мало — в спирте.
Фармакодинамика
При внутривенном введении сукцинилхолин связывается с постсинаптическими никотиновыми рецепторами и оказывает ацетилхолин-подобное действие, то есть вызывает деполяризацию мембран[2]. Этот процесс сопровождается мышечными сокращениями, которые клинически проявляются фасцикуляциями (мышечные подёргивания). Этот период характеризуют как I (первая) фаза нейромышечного блока. Таким образом нарушается проведение нервно-мышечного возбуждения и возникает расслабление скелетных мышц[3]. При высоких или повторных дозах сукцинилхолина наступает II фаза (недеполяризующий блок), механизм которого не ясен[2]. Препарат также связывается с Н-холинорецепторами других органов и тканей, что объясняет его побочные эффекты.
Фармакокинетика
Для сукцинилхолина характерно быстрое начало действия (30-60 с) и кратковременный эффект (обычно <10 мин)[4][5]. Поступая в кровоток, сукцинилхолин разрушается путём гидролиза псевдохолинэстеразой и распадается на сукцинилмонохолин и холин, причем настолько быстро, что только примерно 10 % препарата попадает в нервно-мышечный синапс[6]. Затем концентрация препарата в сыворотке крови снижается и молекулы сукцинилхолина начинают диффундировать из комплекса с холинорецепторами в кровоток и нервно-мышечная проводимость восстанавливается. Период полувыведения сукцинилхолина составляет примерно 47 секунд[7].
Сукцинилхолин действует дольше при увеличении дозы, а также нарушении метаболизма — при гипотермии (замедляет гидролиз), низкой концентрации или наследственном дефекте псевдохолинэстеразы[1]. Концентрация псевдохолинэстеразы в сыворотке крови может снижаться при беременности, заболеваниях печени и при воздействии некоторых лекарственных средств[8]. У 2 % больных одна аллель гена псевдохолинэстеразы нормальная, вторая — патологическая (гетерозиготный дефект гена псевдохолинэстеразы), что удлиняет действие препарата до 20-30 мин. У 1 больного из 3000 обе аллели гена псевдохолинэстеразы патологические (гомозиготный дефект гена псевдохолинэстеразы), в результате чего активность псевдохолинэстеразы значительно снижается, при этом нервно-мышечный блок после введения сукцинилхолина длится около 4-8 ч[1].
Дибукаин — местный анестетик, который ингибирует активность нормальной псевдохолинэстеразы на 80 %, активность псевдохолинэстеразы при гетерозиготном дефекте на 60 %, при гомозиготном дефекте — на 20 %. Процент угнетения активности псевдохолинэстеразы называют дибукаиновым числом. Дибукаиновое число прямо пропорционально функциональной активности псевдохолинэстеразы и не зависит от её концентрации. Поэтому для определения активности псевдохолинэстеразы при лабораторном исследовании измеряют концентрацию фермента в ед/л (второстепенный фактор, определяющий активность) и определяют его качественную полноценность — дибукаиновое число (главный фактор, определяющий активность). При длительном параличе скелетных мышц, который возникает после введения сукцинилхолина больным с патологической псевдохолинэстеразой (синоним — атипичная псевдохолинэстераза), осуществляют ИВЛ до тех пор, пока нервно-мышечная проводимость не восстановится. В некоторых странах (но не в США) применяют термически обработанные препараты холинэстеразы человеческой плазмы. Хотя можно использовать свежезамороженную плазму, риск инфекции обычно превышает пользу от трансфузии.
Показания
Сукцинилхолин считают миорелаксантом выбора для стандартной интубации трахеи у взрослых благодаря быстрому началу и короткой продолжительности действия[9]. Хотя рокуроний начинает действовать практически так же быстро, как и сукцинилхолин, он вызывает более длительный блок[10].
Противопоказания
Сукцинилхолин противопоказан детям и подросткам из-за высокого риска рабдомиолиза, гиперкалиемии и остановки сердца у детей с недиагносцированной миопатией; при глаукоме (возможно резкое повышение внутриглазного давления), а также при гиперкалиемии, ожогах.
Режим дозирования
У взрослых доза сукцинилхолина для интубации трахеи составляет 1-1,5 мг/кг внутривенно. Дробное введение сукцинилхолина в низких дозах (10 мг) или длительное капельное введение (1 г на 500—1000 мл раствора), титруемое по эффекту, применяют при некоторых хирургических вмешательствах, требующих кратковременной, но выраженной миорелаксации (например, при эндоскопии ЛОР-органов). К раствору сукцинилхолина часто добавляют метиленовый синий, чтобы не спутать его с другими жидкостями для инфузий. Для предотвращения передозировки препарата и развития II фазы деполяризующего блока следует проводить постоянный мониторинг нервно-мышечной проводимости с помощью стимуляции периферического нерва. Для поддержания миорелаксации более популярен мивакурий — недеполяризующий миорелаксант короткого действия.
Так как сукцинилхолин не растворяется в жирах, его распределение ограничено внеклеточным пространством. Доля внеклеточного пространства на килограмм массы тела у новорожденных и грудных детей больше, чем у взрослых. Следовательно, доза сукцинилхолина у детей выше по сравнению с таковой у взрослых. При в/м введении сукцинилхолина у детей даже доза 4-5 мг/кг не всегда позволяет добиться полной миорелаксации.
Побочные эффекты
Сукцинилхолин имеет многочисленные побочные эффекты. Относительно безопасное его применение возможно только при чётком понимании природы этих явлений.
Сердечно-сосудистая система
Сукцинилхолин, имея схожую структуру с ацетилхолином, взаимодействует также с холинорецепторами и вне нервно-мышечного синапса. Стимуляция H-холинорецепторов парасимпатических и симпатических ганглиев, а также M-холинорецепторов синоатриального узла в сердце приводит к увеличению или уменьшению артериального давления и частоту сердечных сокращений.
Метаболит сукцинилхолина стимулирует м-холинорецепторы синоатриального узла, что вызывает брадикардию. Хотя к этому эффекту особенно чувствительны дети, после второй дозы сукцинилхолина брадикардия развивается и у взрослых. Для профилактики брадикардии вводят атропин: во всех возрастных группах обязательно перед инъекцией второй дозы сукцинилхолина, а у детей часто и перед первой инъекцией. Дозы атропина: у детей — 0,02 мг/кг в/в, у взрослых — 0,4 мг в/в. Иногда сукцинилхолин вызывает узловую брадикардию и желудочковые эктопические ритмы.
Фасцикуляции
При введении сукцинилхолина о начале миорелаксации сигнализируют видимые глазом сокращения моторных единиц, которые называются фасцикуляциями. Фасцикуляции можно предотвратить предварительным введением недеполяризующего миорелаксанта в низкой дозе (прекураризация). Так как это взаимодействие препятствует развитию I фазы деполяризующего блока, требуются высокие дозы сукцинилхолина (1,5 мг/кг).
Гиперкалиемия
При введении сукцинилхолина деполяризация приводит к тому, что из здоровых мышц выделяется калий с увеличением его концентрации в сыворотке крови до 0,5 ммоль/л. При нормальной концентрации калия этот феномен не имеет клинического значения, но при некоторых состояниях (обширные ожоги, травмы, некоторые неврологические заболевания) возникающая гиперкалиемия может привести к нарушению ритма и даже к остановке сердца, которая часто бывает рефрактерна (устойчива) к стандартным реанимационным мероприятиям: для снижения концентрации калия и устранения метаболического ацидоза требуются кальций, инсулин и глюкоза, бикарбонат, катионо-обменная резина, дантролен и даже искусственное кровообращение.
К состоянием высокого риска относят обширные ожоги и травмы, тяжелую внутрибрюшную инфекцию, травму спинного мозга, энцефалит, инсульт, синдром Гийена-Барре, Тяжелые формы болезни Паркинсона, столбняк, длительную неподвижность, полинейропатии и миопатии, разрыв артериальной аневризмы головного мозга, закрытые черепно-мозговые травмы, утопление, геморрагический шик с метаболическим ацидозом..
Если травма вызывает денервацию (например, при полном поперечном разрыве спинного мозга денервации подвергаются многие группы мышц), то холинорецепторы формируются на мембранах мышц вне нервно-мышечного синапса, что при введении сукцинилхолина вызывает всеохватывающую деполяризацию мышц и мощный выброс калия в кровоток[11]. Предварительное введение недеполяризующего миорелаксанта не вызывает достоверного предотвращения высвобождения калия и не устраняет угрозы опасных для жизни осложнений. Риск гиперкалиемии достигает максимума на 7-10-й день после травмы, но точные временные параметры периода риска неизвестны[1].
Боль в мышцах
При введении сукцинилхолина часто возникают миалгии (боли в мышцах) в послеоперационном периоде, что связано с фасцикуляциями и микротравмой мышц вследствие них. На миалгию чаще всего жалуются молодые люди (чаще женщины) после амбулаторных хирургических вмешательств[12]. При беременности, а также в детском и преклонном возрасте риск миалгии уменьшается[13][14][15].
Некоторые исследования говорят о том, что предварительное введение недеполяризующего миорелаксанта или лидокаина (1-1,5 мг/кг) уменьшает вероятность возникновения миалгии[1][12]. Нестероидные противовоспалительные препараты эффективны при лечении миалгии[16].
Повышение давления в полости желудка
Фасцикуляции мышц брюшной стенки увеличивают давление в просвете желудка, что в свою очередь приводит к повышению тонуса нижнего пищеводного сфинктера. Следовательно, эти два эффекта взаимопоглощаются, и сукцинилхолин, вероятнее всего, не увеличивает риск возникновения желудочного рефлюкса и легочной аспирации. Предварительное введение недеполяризующего миорелаксанта предотвращает как увеличение давления в просвете желудка, так и компенсаторное повышение тонуса нижнего пищеводного сфинктера.
Однако следует соблюдать настороженность к желудочной регургитации и профилактировать её с помощью возвышенного положения головного конца тела и приёма Селика.
Повышение внутриглазного давления
Сукцинилхолин повышает внутриглазное давление, что связано с сокращением мышц глазного яблока. При этом у пациентов с травмой глаза увеличивается риск повреждения, в частности при проникающим ранением глаза теоретически существует опасность вытекания стекловидного тела[8]. Некоторые авторы оспаривают это утверждение[17][18]. Предварительное введение недеполяризующего миорелаксанта не всегда предотвращает увеличение внутриглазного давления.
Злокачественная гипертермия
Сукцинилхолин — мощный провоцирующий фактор злокачественной гипертермии. Ранним симптомом злокачественной гипертермии часто служит парадоксальное сокращение челюстных мышц после введения сукцинилхолина.
Генерализованные сокращения
При миотонии введение сукцинилхолина может вызывать миоклонус.
Длительный паралич скелетной мускулатуры
Как уже отмечалось ранее, при низкой концентрации нормальной псевдохолинэстеразы введение сукцинилхолина вызывает умеренное удлинение деполяризующего блока. После введения сукцинилхолина больным с патологической псевдохолинэстеразой возникает длительный паралич скелетных мышц. В отсутствие адекватной респираторной поддержки это осложнение представляет серьёзную опасность.
Повышение внутричерепного давления
Сукцинилхолин может увеличивать мозговой кровоток и внутричерепное давление[19]. Это также можно предотвратить с прекурарезации и инъекции лидокаина (1,5-2 мг/кг) за 2-3 мин до интубации, а также предварительной ИВЛ в режиме гипервентиляции. Интубация трахеи с неадекватной анестезией и миорелаксацией увеличивает внутричерепное давление значительно сильнее, чем сукцинилхолин[20].
Хранение
Хранение: список А. В защищённом от света месте (в холодильнике) при температуре от +2 °C до +8 °C (для предупреждения спонтанного гидролиза).
Примечания
- ↑ 1 2 3 4 5 Морган-мл. Дж.Э., Мэгид С.М., перевод Бунятин А.А., Клиническая анестезиология: книга первая, Изд. Москва, Бином, 2008
- ↑ 1 2 Богданов А. А., врач анестезиолог, Wexham Park and Heatherwood Hospitals, Berkshire, UK Сукцинилхолин – друг или враг? (рус.). Архивировано из первоисточника 3 февраля 2012. Проверено 1 декабря 2011.
- ↑ Cahalan, Michael D.; Barash, Paul G.; Cullen, Bruce F.; Stoelting, Robert K. Handbook of Clinical Anesthesia. — Hagerstwon, MD: Lippincott Williams & Wilkins, 2009. — P. 143-144. — ISBN 0-7817-8948-6
- ↑ Curran MJ, Donati F, Bevan DR (August 1987). «Onset and recovery of atracurium and suxamethonium-induced neuromuscular blockade with simultaneous train-of-four and single twitch stimulation». Br J Anaesth 59 (8): 989–94. PMID 3651281.
- ↑ Viby-Mogensen J (December 1980). «Correlation of succinylcholine duration of action with plasma cholinesterase activity in subjects with the genotypically normal enzyme». Anesthesiology 53 (6): 517–20. PMID 7457973.
- ↑ Gissen AJ, Katz RL, Karis JH, Papper EM (1966). «Neuromuscular block in man during prolonged arterial infusion with succinylcholine». Anesthesiology 27 (3): 242–9. PMID 5937158.
- ↑ Torda TA, Graham GG, Warwick NR, Donohue P (June 1997). «Pharmacokinetics and pharmacodynamics of suxamethonium». Anaesth Intensive Care 25 (3): 272–8. PMID 9209610.
- ↑ 1 2 Бунятян А.А. Рациональная фармакотерапия в анестезиологии. — Литерра, 2006. — С. 181-183. — 800 с. — ISBN 5-98216-040-7
- ↑ Miller R (June 2004). «Will succinylcholine ever disappear?». Anesth. Analg. 98 (6): 1674–5. PMID 15155326.
- ↑ Perry JJ, Lee JS, Sillberg VA, Wells GA (2008). «Rocuronium versus succinylcholine for rapid sequence induction intubation». Cochrane Database Syst Rev (2): CD002788. DOI:10.1002/14651858.CD002788.pub2. PMID 18425883.
- ↑ Martyn JA, Richtsfeld M (January 2006). «Succinylcholine-induced hyperkalemia in acquired pathologic states: etiologic factors and molecular mechanisms». Anesthesiology 104 (1): 158–69. PMID 16394702.
- ↑ 1 2 Wong SF, Chung F (February 2000). «Succinylcholine-associated postoperative myalgia». Anaesthesia 55 (2): 144–52. PMID 10651675.
- ↑ Thind GS, Bryson TH (August 1983). «Single dose suxamethonium and muscle pain in pregnancy». Br J Anaesth 55 (8): 743–5. PMID 6882612.
- ↑ BUSH GH, ROTH F (March 1961). «Muscle pains after suxamethonium chloride in children». Br J Anaesth 33: 151–5. PMID 13689350.
- ↑ FOSTER CA (July 1960). «Muscle pains that follow administration of suxamethonium». Br Med J 2 (5191): 24–5. PMID 13824106.
- ↑ Schreiber JU, Lysakowski C, Fuchs-Buder T, Tramèr MR (October 2005). «Prevention of succinylcholine-induced fasciculation and myalgia: a meta-analysis of randomized trials». Anesthesiology 103 (4): 877–84. PMID 16192781.
- ↑ Vachon CA, Warner DO, Bacon DR (July 2003). «Succinylcholine and the open globe. Tracing the teaching». Anesthesiology 99 (1): 220–3. PMID 12826863.
- ↑ Libonati MM, Leahy JJ, Ellison N (May 1985). «The use of succinylcholine in open eye surgery». Anesthesiology 62 (5): 637–40. PMID 3994030.
- ↑ Minton MD, Grosslight K, Stirt JA, Bedford RF (August 1986). «Increases in intracranial pressure from succinylcholine: prevention by prior nondepolarizing blockade». Anesthesiology 65 (2): 165–9. PMID 2874752.
- ↑ Cahalan, Michael D.; Barash, Paul G.; Cullen, Bruce F.; Stoelting, Robert K. Clinical anesthesia. — Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins, 2009. — P. 427-9. — ISBN 0-7817-8763-7
Суксаметоний-Биолек (Suxamethonium-Biolek) инструкция по применению
📜 Инструкция по применению Суксаметоний-Биолек
💊 Состав препарата Суксаметоний-Биолек
✅ Применение препарата Суксаметоний-Биолек
📅 Условия хранения Суксаметоний-Биолек
⏳ Срок годности Суксаметоний-Биолек
Описание лекарственного препарата
Суксаметоний-Биолек
(Suxamethonium-Biolek)
Основано на официально утвержденной инструкции по применению препарата и подготовлено для электронного издания справочника Видаль 2011 года, дата обновления: 2020.05.07
Владелец регистрационного удостоверения:
Код ATX:
M03AB01
(Суксаметония хлорид)
Лекарственная форма
| Суксаметоний-Биолек |
Р-р д/в/в и в/м введения 20 мг/1 мл: амп. 5 мл 5 или 10 шт. рег. №: ЛСР-002685/07 |
Форма выпуска, упаковка и состав
препарата Суксаметоний-Биолек
Раствор для в/в и в/м введения в виде прозрачной, бесцветной жидкости.
Вспомогательные вещества: натрия хлорид — 7 мг, динатрия эдетат — 0.05 мг, аскорбиновая кислота — 0.05 мг, хлористоводородной кислоты раствор 0.1М — до pH 3.3-3.6, вода д/и — до 1 мл.
5 мл — ампулы (5) — пачки картонные.
5 мл — ампулы (10) — пачки картонные.
Фармакологическое действие
Деполяризующий миорелаксант короткого действия. Вызывает блокаду нервно-мышечной передачи. Взаимодействуя с H-холинорецепторами, вызывает деполяризацию концевой пластинки. Процесс распространяется на прилежащие мембраны, возникает генерализованное дезорганизованное сокращение миофибрилл (т.е. развитию блокады предшествуют мышечные подергивания – результат кратковременного облегчения нервно-мышечной передачи). Мембраны, оставаясь деполяризованными, не реагируют на дополнительные импульсы, поскольку для поддержания мышечного тонуса требуется поступление повторных импульсов, сопряженных с реполяризацией концевой пластинки, возникает спастический паралич. После в/в введения миорелаксация происходит в следующей последовательности: мышцы век, жевательная мускулатура, мышцы пальцев рук, глаз, конечностей, шеи, спины и живота, голосовых связок, затем межреберные мышцы и диафрагма.
Вызывает увеличение мозгового кровотока и повышение внутричерепного давления. После в/в введения, действие начинается через 54-60 сек, через 2-3 мин релаксация мышц достигает максимума и сохраняется в полном объеме 3 мин. Продолжительность действия – 5-10 мин.
Выраженность действия зависит от величины введенной дозы: 0.1 мг/мл – расслабление скелетной мускулатуры без значительного влияния на дыхательную систему; 0.2-1 мг/кг – полное расслабление мускулатуры брюшной стенки и дыхательной мускулатуры (происходит значительное ограничение или полная остановка спонтанного дыхания). Для длительного расслабления мышц необходимо повторное введение. Быстрое наступление эффекта и последующее быстрое восстановление тонуса мышц позволяют создавать контролируемую и управляемую релаксацию мышц.
Фармакокинетика
После в/в введения распределяется в плазме и внеклеточной жидкости. Более 90% гидролизуется холинэстеразой крови до янтарной кислоты и холина. Период полувыведения составляет 90 сек при нормальном уровне псевдохолинэстеразы. Выводится почками. Не проникает через интактный гематоэнцефалический барьер. Не кумулирует.
Показания препарата
Суксаметоний-Биолек
- отключение спонтанного дыхания (интратрахеальная интубация, бронхоскопия);
- полная миорелаксация (эндоскопия, вправление вывихов, репозиция переломов, гинекологические, торакальные, абдоминальные оперативные вмешательства);
- профилактика судорог при электроимпульсной терапии;
- отравление стрихнином;
- столбняк (симптоматическая терапия).
Режим дозирования
Взрослые: в/в медленно, струйно или капельно (для длительной капельной инфузии используют 0.1% раствор). В зависимости от клинической ситуации, при в/в введении разовая доза варьирует от 100 мкг/кг до 1.5-2 мг/кг массы тела.
Для проведения интубации трахеи – 0.2-0.8 мг/кг; для миорелаксации и отключения спонтанного дыхания – 0.2-1 мг/кг; для релаксации скелетной мускулатуры при вправлении вывихов и репозиции костных отломков при переломах – 0.1-0.2 мг/кг; для проведения эндоскопии – 0.2 мг/кг; для профилактики осложнений при проведении электроимпульсной терапии (судороги, отрыв мышц и сухожилий) – 0.1-1 мг/кг в/в, но не более 150 мг.
Для длительного расслабления мускулатуры в течение всей операции можно вводить фракционно, через 5-7 мин по 0.5-1 мг/кг. Повторные дозы действуют более продолжительно.
В/м применяется у детей в дозах до 2.5 мг/кг, но не более 150 мг; в/в – 1-2 мг/кг.
Побочное действие
Аллергические реакции (анафилактический шок, бронхоспазм); гиперкалиемия.
Снижение АД, нарушение проводимости сердца, аритмия, брадикардия (чаще у детей, при повторном введении – у детей и взрослых), кардиогенный шок, повышение внутриглазного давления, гиперсаливация, лихорадка, миалгия (в послеоперационном периоде); длительный паралич дыхательных мышц (связан с генетически обусловленным нарушением образования сывороточной холинэстеразы); редко – рабдомиолиз с развитием миоглобинемии и миоглобинурии. У детей, молодых больных и женщин (преимущественно у ваготоников) может возникнуть кратковременная брадикардия, в некоторых случаях асистолия.
Через 10-12 ч после применения препарата могут возникнуть мышечные боли. При многократном введении препарата иногда может развиться чрезмерно продолжительная релаксация мышц и длительное апноэ.
Противопоказания к применению
- гиперчувствительность;
- злокачественная гипертермия (в т.ч. в анамнезе);
- миастения;
- врожденная и дистрофическая миотония;
- мышечная дистрофия Дюшенна;
- закрытоугольная глаукома;
- острая печеночная недостаточность;
- отек легких;
- проникающие травмы глаз;
- бронхиальная астма;
- гиперкалиемия;
- детский возраст до 1 года;
- беременность;
- период лактации.
С осторожностью: снижение активности сывороточной псевдохолинэстеразы (терминальная стадия печеночной недостаточности, анемия, кахексия, длительное голодание, хронические инфекции, распространенные ожоги, травмы), послеродовой период, столбняк, туберкулез, злокачественные новообразования, хроническая почечная недостаточность, микседема, системные болезни соединительной ткани, состояние после переливания плазмы, плазмаферез, искусственное кровообращение, острая и хроническая интоксикация инсектицидами – ингибиторами холинэстеразы (при попадании внутрь) или антихолинэстеразными средствами (неостигмин, физостигмин, дистигмина бромид), одновременное использование препаратов, конкурирующих с сукцинилхолином за холинэстеразу (прокаин в/в), экстренные хирургические вмешательства у больных с «полным желудком».
Применение при беременности и кормлении грудью
Запрещается принимать данный препарат во время беременности и в период лактации.
Применение при нарушениях функции печени
Противопоказан: острая печеночная недостаточность. С осторожностью при снижении активности сывороточной псевдохолинэстеразы (терминальная стадия печеночной недостаточности).
Применение при нарушениях функции почек
С осторожностью: хроническая почечная недостаточность. Пациентам с почечной недостаточностью (без признаков гиперкалиемии и нейропатии) препарат вводят однократно в средних дозах, но не применяют для многократных введений или в повышенных дозах из-за риска развития гиперкалиемии.
Применение у детей
Запрещено принимать препарат детям в возрасте до 1 года.
Особые указания
Применяют только в условиях специализированного отделения при наличии аппаратуры для искусственной вентиляции легких и на фоне общей анестезии. Предварительное введение за 1 минуту до инфузии суксаметония йодида препарата 3-4 мг тубокурарина хлорида или 10-15 мг диплацина хлорида предотвращает фибриллярные подергивания мышц, и последующее появление мышечных болей. При соответствующей дозе и повторном введении может использоваться и для более длительных операций, однако, для продолжительного расслабления мускулатуры обычно применяют недеполяризующие миорелаксанты, которые вводят после предварительной интубации трахеи на фоне суксаметония йодида.
Медленное введение препарата, а также предварительная в/в инъекция атропина в дозе 1-1.5 мг в значительной степени предотвращает брадикардию и повышение бронхиальной секреции.
Пациентам с почечной недостаточностью (без признаков гиперкалиемии и нейропатии) препарат вводят однократно в средних дозах, но не применяют для многократных введений или в повышенных дозах из-за риска развития гиперкалиемии. Затянувшаяся миорелаксация с возможным апноэ может быть вызвана несколькими причинами: «атипичной» холинэстеразой сыворотки крови, наследственной недостаточностью сывороточной холинэстеразы или временным снижения ее уровня. Если препарат вводят многократно и через 25-30 минут после последней инъекции у больного не восстанавливается мышечный тонус, остается поверхностным дыхание, можно думать о переходе деполяризующего блока в антидеполяризующий (возникновение «двойного блока»). Для снятия этого эффекта следует применять прозерин по обычной методике: в вену вводят предварительно атропин в дозе 0.5-0.7 мг (0.5-0.7 мл 0.1% раствора), дожидаются учащения пульса и через 1-2 минуты в/в вводят прозерин в дозе 1.5 мг (3 мл 0.05% раствора).
Передозировка
Симптомы: усиление выраженности побочных эффектов, остановка дыхания.
Лечение: искусственная вентиляция легких, в случае снижения содержания в сыворотке крови холинэстеразы – переливание свежей крови.
Лекарственное взаимодействие
Фармацевтически несовместим с донорской кровью и препаратами крови (происходит гидролиз), с растворами барбитуратов и щелочными растворами (образуется осадок).
Совместим с изотоническими растворами натрия хлорида, раствором Рингера, 5% раствором фруктозы и 6% раствором декстрана.
Антихолинэстеразные средства, прокаин, прокаинамид, лидокаин, верапамил, бета-адреноблокаторы, аминогликозидные антибиотики, амфотерицин B, клиндамицин, циклопропан, пропанидид, фосфорорганические инсектициды, соли Mg2+и Li+, хинидин, хинин, хлорохин, панкуроний усиливают и удлиняют миорелаксирующее действие.
Совместим с другими миорелаксантами наркотическими анальгетиками.
Усиливает кардиальные эффекты сердечных гликозидов (брадикардия).
Снижает эффективность антимиастенических препаратов.
Галогенсодержащие средства для общей анестезии усиливают, а тиопентал натрия и атропин уменьшают нежелательное действие на сердечно-сосудистую систему.
Препараты, обладающие потенциальной способностью снижать активность холинэстеразы крови (апротинин, дифенгидрамин, прометазин, эстрогены, окситоцин, глюкокортикостероиды в высоких дозах, пероральные контрацептивы), усиливают и удлиняют миорелаксирующее действия суксаметония йодида.
Условия хранения препарата Суксаметоний-Биолек
Список А.
Препарат следует хранить в защищенном от света, недоступном для детей месте, при температуре от +2 до +8°C. Замораживания не допускается.
Срок годности препарата Суксаметоний-Биолек
Срок годности 1 год и 6 месяцев. Не использовать после срока годности, указанного на упаковке.
Условия реализации
Препарат отпускается по рецепту.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Содержание
-
Структурная формула
-
Русское название
-
Английское название
-
Латинское название
-
Химическое название
-
Брутто формула
-
Фармакологическая группа вещества Суксаметония йодид
-
Нозологическая классификация
-
Код CAS
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Суксаметония йодид
-
Противопоказания
-
Ограничения к применению
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Суксаметония йодид
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Меры предосторожности
-
Торговые названия с действующим веществом Суксаметония йодид
Структурная формула
Русское название
Суксаметония йодид
Английское название
Suxamethonium iodide
Латинское название
Suxamethonii iodidum (род. Suxamethonii iodidi)
Химическое название
2,2′-[(1,4-Диоксо-1,4-бутандиил)бис(окси)]бис[N,N,N-триметилэтанаминия йодид
Брутто формула
C14H30I2N2O4
Фармакологическая группа вещества Суксаметония йодид
Нозологическая классификация
Список кодов МКБ-10
-
A35 Другие формы столбняка
-
R56.8 Другие и неуточненные судороги
-
T14.2 Перелом в неуточненной области тела
-
T14.3 Вывих, растяжение и повреждение капсульно-связочного аппарата сустава неуточненной области тела
-
T65.1 Стрихнина и его солей
-
Z100* КЛАСС XXII Хирургическая практика
-
Z40 Профилактическое хирургическое вмешательство
Код CAS
541-19-5
Фармакологическое действие
—
миорелаксирующее.
Характеристика
Миорелаксант периферического действия (деполяризующий). По химическому строению — удвоенная молекула ацетилхолина (диацетилхолин).
Белый или белый со слегка желтоватым оттенком мелкокристаллический порошок без запаха. Легко растворим в воде, практически нерастворим в 95% спирте и хлороформе. Температура плавления — 250–255 °C. рН 1% раствора — 4,5–6,2.
Фармакология
Деполяризующий миорелаксант короткого действия. Нарушает проведение нервно-мышечного возбуждения и вызывает расслабление скелетных мышц. Конкурирует с ацетилхолином за н-холинорецепторы, вызывает стойкую деполяризацию концевой пластинки вследствие высокого аффинитета к холинергическим рецепторам и устойчивости к ацетилхолинэстеразе. Вначале развитие деполяризации проявляется фасцикуляциями (генерализованное дезорганизованное сокращение миофибрилл) вследствие кратковременного облегчения нервно-мышечной передачи, затем деполяризованные мембраны перестают реагировать на дополнительные импульсы и наступает миопаралитический эффект (возникает спастический паралич). После в/в введения миорелаксация развивается в следующей последовательности: мышцы пальцев рук, глаз, ног, шеи, спины; затем межреберные мышцы и диафрагма. Вызывает увеличение мозгового кровотока и внутричерепного давления в условиях слабой общей анестезии. После в/м введения действие развивается через 2–4 мин, после в/в введения — через 54–60 с, максимальный эффект развивается через 2–3 мин и сохраняется в полном объеме 3 мин. Продолжительность действия 5–10 мин.
Выраженность эффекта зависит от дозы: 0,1 мг/кг — расслабление скелетной мускулатуры без значительного влияния на дыхательную систему, 0,2–1 мг/кг — полное расслабление мускулатуры брюшной стенки и дыхательной мускулатуры (значительное ограничение или полная остановка спонтанного дыхания). Оказывает быстрое и кратковременное действие. Не кумулирует. Для длительной миорелаксации необходимо повторное введение. Быстрое наступление эффекта и последующее быстрое восстановление нервно-мышечной проводимости позволяют создавать контролируемую и управляемую миорелаксацию.
После в/в введения распределяется в плазме и внеклеточной жидкости. Более 90% гидролизуется псевдохолинэстеразой крови до янтарной кислоты и холина. Т1/2 — 90 с при нормальном уровне псевдохолинэстеразы. Выводится почками. Не проникает через интактный ГЭБ.
Применение вещества Суксаметония йодид
Вмешательства, требующие миорелаксации (обычно кратковременной): отключение спонтанного дыхания (интратрахеальная интубация, бронхоскопия); полная миорелаксация (эндоскопия, электроэнцефалография, вправление вывихов, репозиция костных отломков при переломах, гинекологические, торакальные, абдоминальные операции); профилактика судорог при электроимпульсной терапии, отравление стрихнином, столбняк (симптоматическая терапия).
Противопоказания
Гиперчувствительность, злокачественная гипертермия (в т.ч. в анамнезе, семейная), врожденная и дистрофическая миотония, мышечная дистрофия Дюшенна, закрытоугольная глаукома, острая печеночная недостаточность, отек легких, проникающие травмы глаза, бронхиальная астма, гиперкалиемия, возраст до 1 года.
Ограничения к применению
Экстренная хирургия у больных с «полным желудком», миастения, терминальная стадия печеночной недостаточности, анемия, кахексия, длительное голодание, хронические инфекции, распространенные ожоги, травмы, послеродовой период, столбняк, туберкулез, злокачественные новообразования, хроническая почечная недостаточность, микседема, коллагеновые болезни, состояния после переливания плазмы, плазмаферез, искусственное кровообращение, острая или хроническая интоксикация инсектицидами — ингибиторами холинэстеразы (при попадании внутрь) или антихолинэстеразными ЛС (неостигмин, физостигмин, дистигмин, фосфолин), одновременный прием ЛС, конкурирующих с суксаметонием за холинэстеразу (например прокаин в/в). У детей старше 1 года не рекомендован при внеплановых операциях.
Применение при беременности и кормлении грудью
С осторожностью при беременности (проходит через плацентарный барьер).
Побочные действия вещества Суксаметония йодид
Со стороны сердечно-сосудистой системы: понижение АД, аритмия, брадикардия (чаще у детей, при повторном введении — у детей и взрослых), нарушение проводимости, кардиогенный шок.
Аллергические реакции: анафилактический шок, бронхоспазм.
Прочие: гиперкалиемия, повышение внутриглазного давления, изменение секреции слюнных желез, лихорадка, миалгия (через 10–12 ч после введения), длительный паралич дыхательных мышц (связан с генетически обусловленным нарушением образования сывороточной холинэстеразы); редко — рабдомиолиз с развитием миоглобинемии и миоглобинурии.
Взаимодействие
Усиливает эффекты сердечных гликозидов. Снижает эффективность антимиастенических ЛС. Несовместим с донорской кровью (происходит гидролиз препарата), консервантами крови, сывороточными консервантами, с препаратами крови, с растворами барбитуратов (образуется осадок) и щелочными растворами. Совместим с 0,9% раствором натрия хлорида, раствором Рингера, 5% раствором фруктозы и 6% раствором декстрана.
Усиливают и пролонгируют миорелаксирующее действие: антихолинэстеразные средства и ЛС, обладающие потенциальной способностью снижать активность холинэстеразы крови (апротинин, дифенгидрамин, прометазин, эстрогены, окситоцин, глюкокортикостероиды в высоких дозах, пероральные контрацептивы), прокаин, прокаинамид, лидокаин, верапамил, бета-адреноблокаторы, аминогликозиды, амфотерицин В, клиндамицин, циклопропан, пропанидид, фосфорорганические инсектициды, соли магния и лития, хинидин, хинин, хлорохин, панкурония бромид. Совместим с другими миорелаксантами, наркотическими анальгетиками. Галогенсодержащие ЛС для общей анестезии усиливают, а тиопентал натрия и атропин уменьшают нежелательное действие на сердечно-сосудистую систему.
Передозировка
Симптомы: длительное угнетение дыхания, остановка дыхания.
Лечение: ИВЛ; при снижении содержания в сыворотке крови холинэстеразы — переливание свежей крови (высокая активность холинэстеразы плазмы), коррекция электролитных нарушений.
Способ применения и дозы
В/в медленно струйно или капельно, в/м. Взрослым: при в/в введении разовая доза варьирует от 100 мкг/кг до 1,5–2 мг/кг в зависимости от клинической ситуации; максимальная доза — 500 мг/ч. В/м — 3–4 мг/кг, но не более 150 мг. Детям от 1 года до 12 лет: в/в — 1–2 мг/кг или в/м — 2–4 мг/кг (не более 150 мг). Интубация трахеи — 0,2–0,8 мг/кг; миорелаксация и отключение спонтанного дыхания — 0,2–1 мг/кг; релаксация скелетной мускулатуры при вправлении вывихов и репозиции костных отломков при переломах — 0,1–0,2 мг/кг; проведение эндоскопии и электроэнцефалографии — 0,2 мг/кг; профилактика осложнений электроимпульсной терапии — 0,1–1 мг/кг в/в и до 2,5 мг/кг в/м, но не более 150 мг. Для длительного расслабления мускулатуры в течение всей операции вводят фракционно по 0,5–1 мг/кг через 5–7 мин, повторные дозы действуют более продолжительно.
Меры предосторожности
С осторожностью применяют при заболеваниях сердечно-сосудистой системы, болезнях органов дыхания, нервно-мышечных заболеваниях, повышенном внутриглазном давлении.
Возможно применение у больных миастенией. Следует помнить, что больные миастенией (у них снижено число функционирующих н-холинорецепторов) относительно устойчивы к действию ЛС, но при развитии двойного блока восстановление нервно-мышечной проводимости замедляется.
Неостигмина метилсульфат (Прозерин) или другие антихолинэстеразные средства не являются антагонистами суксаметония йодида, наоборот, подавляя активность холинэстеразы, они удлиняют и усиливают действие. Предварительное (за 1 мин) введение 3–4 мг d-тубокурарина или 10–15 мг диплацина дихлорида почти полностью предотвращает фасцикуляции и последующие мышечные боли.
Для продолжительных операций обычно применяют недеполяризующие миорелаксанты, которые вводят после предварительной интубации трахеи на фоне суксаметония йодида. Применяют только в условиях специализированного отделения, при наличии аппаратуры для ИВЛ и персонала, владеющего этой техникой.
В больших дозах или при повторном введении может вызывать «двойной блок»: если после последнего введения миорелаксация сохраняется более 25–30 мин и дыхание полностью не восстанавливается, в/в вводят неостигмина метилсульфат (Прозерин) или галантамин — после предварительного введения атропина (0,5–0,7 мл 0,1% раствора).
Торговые названия с действующим веществом Суксаметония йодид
Обновлено: 04.05.2023
Антидеполяризующие миорелаксанты имеют жесткие молекулы с расстоянием между четвертичными атомами азота 1,0±0,1 нм. В состав молекул входят гидрофобные ароматические и гетероциклические радикалы (пахикураре — буквально «толстые кураре», греч. pachys — толстый).
Механизм действия антидеполяризующих миорелаксантов — конкурентный антагонизм с ацетилхолином в отношении Н-холинорецепторов скелетной мускулатуры. Миорелаксанты блокируют анионный центр рецепторов, а также образуют вандерваальсовы связи с участками рецептора, окружающими анионный центр. Блокада Н-холинорецепторов, стабилизируя потенциал покоя в концевой пластинке, вызывает вялый паралич скелетных мышц. В больших концентрациях миорелаксанты прямо нарушают проводимость открытых натриевых каналов скелетных мышц.
Сведения об антидеполяризующих миорелаксантах — четвертичных аминах (ТУБОКУРАРИН-ХЛОРИД, ПИПЕКУРОНИЯ БРОМИД, АТРАКУРИЯ БЕСИЛАТ, МИВАКУРИЯ ХЛОРИДи др.) приведены в табл. 25.
При введении антидеполяризующих миорелаксантов скелетные мышцы парализуются в определенной последовательности. Сначала расслабляются наружные мышцы глаз, среднего уха, пальцев рук и ног, затем — мышцы лица, шеи, конечностей, туловища, межреберные мышцы, в последнюю очередь — диафрагма. Восстановление тонуса скелетных мышц происходит в обратном порядке.
Четвертичные амины не проникают в ЦНС. Известно, что анестезиолог Смит (С. Smith, 1947г.) испытал на себе действие тубокурарина-хлорида в дозе, превышающей в 2,5 раза терапевтическую дозу. После введения тубокурарина в вену у испытуемого не возникали анальгезия, нарушения сознания, памяти, чувствительности, зрения, слуха, не регистрировались отклонения на ЭЭГ.
Миорелаксанты — третичные амины менее эффективны, не вызывают паралич дыхательной мускулатуры, хорошо всасываются при приеме внутрь. Представитель этой группы — производное алкалоида живокости (дельфиниум) МЕЛЛИКТИН.
Синергистами антидеполяризующих миорелаксантов являются средства для наркоза и препараты, объединенные названием «центральные миорелаксанты» (седативные транквилизаторы — сибазон, феназепам; агонист ГАМК-рецепторов типа В — баклофен; центральный
Таблица 25.Миорелаксанты
| Миорелаксанты | Химическое строение | Время появления | Продолжительность | Полная продолжительность действия (мин) | Относительная сила действия | Пути элиминации | Побочные эффекты |
| паралича дыхательных мышц (мин) | |||||||
| Антидеполяризующие миорелаксанты | |||||||
| Длительного действия | |||||||
| ТУБОКУРАРИН-ХЛОРИД (ТУБАРИН) | Природный алкалоид (циклический бензилизохинолин) | 4-6 | 35-40 | 80-120 | Элиминация почками, печеночный клиренс | Блокада ганглиев, М-холинорецепто-ров, освобождение гистамина | |
| ПАНКУРОНИЯ БРОМИД (МИОНИЭМ, МУСКУРОН, ПАВУЛОН) | Аммониостероид | 4-6 | 35-40 | 120-180 | Те же | Блокада М-холино-рецепторов (тахикардия, аритмия) артериальная гипо-тензия, кумуляция | |
| ПИПЕКУРОНИЯ БРОМИД (АПЕРОМИД, АРДУАН) | Аммониостероид | 2-4 | 35-40 | 80-100 | Элиминация почками, печеночные метаболизм и клиренс | Брадикардия | |
| Средней продолжительности действия | |||||||
| АТРАКУРИЯ БЕСИЛАТ (ТРАКРИУМ) | Бензилизохинолин | 2-4 | 20-30 | 30-40 | 1,5 | Неферментативная инактивация, гидролиз холинэстеразой крови | Освобождение гистамина |
| ЦИСАТРАКУРИЯ БЕСИЛАТ (НИМБЕКС) | Бензилизохинолин | 2-4 | 20-30 | 30-40 | 4,5 | Неферментативная инактивация | Освобождение гистамина |
| ВЕКУРОНИЯ БРОМИД (НОРКУРОН) | Аммониостероид | 2-4 | 20-30 | 30-40 | б | Элиминация почками, печеночные метаболизм и клиренс | |
| РОКУРОНИЯ БРОМИД (ЗЕМУРОН) | Аммониостероид | 1-2 | 20-30 | 30-40 | 0,8 | Элиминация почками, метаболизм в печени | |
| ИЗОЦИУРОНИЯ БРОМИД | Бензиламмонио-этиловый эфир изоциуроновой кислоты | 1-2 | 25-35 | 40-45 | Элиминация почками | Блокада М-холинорецепторов (тахикардия) | |
| Короткого действия | |||||||
| МИВАКУРИЯ ХЛОРИД (МИВАКРОН) | Бензилизохинолин | 2-4 | 10-20 | 10-20 | Гидролиз холинэстеразой крови | ||
| Деполяризующие миорелаксанты | |||||||
| ДИТИЛИН (СУКСАМЕТОНИЯ ЙОДИД или ХЛОРИД, ЛИСТЕНОН, МИОРЕЛАКСИН) | Дихолиновый эфир янтарной кислоты | 1 — 1,5 | 6 — 8 | 6 — 8 | Гидролиз холинэстеразой крови | Возбуждение ганглиев, травмы мышц, «двойной» блок, злокачественная гипертермия |
Н-холиноблокатор — мидокалм[7]). Эти лекарственные средства угнетают базальные ганглии, гиппокамп, спинной мозг.
Миопаралитическое действие потенцируют также средства, препятствующие выделению ацетилхолина из нервных окончаний, — антибиотики группы аминогликозидов, тетрациклин, линкомицин, полимиксины, магния сульфат, местные анестетики.
Антагонистами антидеполяризующих миорелаксантов являются обратимые блокаторы холинэстеразы с никотиноподобным действием — прозерин, галантамин, хинотилин. Они вызывают в нервно-мышечных синапсах накопление ацетилхолина, который вытесняет антидеполяризующие миорелаксанты из связи с Н-холинорецепторами. Декураризацию проводят, когда объем вентиляции легких достигает 20 — 30 % нормального объема. Действие большинства деблокирующих средств короче, чем миорелаксантов. Это создает опасность рекураризации с возвратом паралича дыхательной мускулатуры.
2.1.2.1.2.2.2. Курареподобные средства (миорелаксанты периферического действия)
Курареподобные препараты применяются при хирургических операциях для расслабления скелетной мускулатуры.
Кураре, специально обработанный сок южноамериканского растения, с давних пор использовался индейцами как стрельный яд, обездвиживающий животных. В середине прошлого столетия установили, что расслабление скелетной мускулатуры, вызванное кураре, реализуется за счет прекращения передачи возбуждения с двигательных нервов на скелетные мышцы.
Основное действующее вещество кураре — алкалоид d-тубокурарин. В настоящее время известно и много других курареподобных препаратов. Механизм действия этих средств заключается в образовании комплекса с Н-холинорецепторным участком мембраны мышечного волокна (постсинаптическая мембрана). В зависимости от функциональных свойств образовавшегося комплекса миорелаксанты делятся на группы:
1) средства антидеполяризующего (недеполяризующего) действия;
2) средства деполяризующего действия.
Тубокурарина хлорид, пипекурония бромид, панкурония бромид. Эти препараты (бисчетвертичные аммониевые соединения) при внутривенном введении вызывают быстрое расслабление скелетной мускулатуры, продолжающееся 30-60 мин. Сначала расслабляются мышцы головы и шеи, затем конечностей, голосовых связок, туловища и, в последнюю очередь (при больших дозах), дыхательные (межреберные и мышцы диафрагмы), что приводит к остановке дыхания. На центральную нервную систему четвертичные аммониевые соединения не действуют, так как плохо проходят гематоэнцефалический барьер. К антидеполяризующим миорелаксантам относится мелликтин, который является третичным основанием (алкалоид из семейства лютиковых), хорошо всасывается из желудочно-кишечного тракта и может применяться внутрь при повышенном тонусе скелетной мускулатуры. Антидеполяризующие миорелаксанты, связываясь с Н-холинорецептором, прикрывают (экранируют) его от воздействия синаптического ацетилхолина. В результате нервный импульс не вызовет деполяризации мембраны мышечного волокна (поэтому препараты называют антидеполяризующими). Эти соединения конкурируют (конкурентные миорелаксанты) с ацетилхолином за Н-холинорецепторы постсинаптической мембраны: при увеличении количества ацетилхолина в синапсе (например, при введении антихолинэстеразных средств) медиатор вытесняет миорелаксант из связи с мембраной и сам образует комплекс с рецептором, вызывая деполяризацию.
Антидеполяризующие препараты могут вызывать снижение артериального давления, блокируя Н-холинорецепторы ганглиев. Миорелаксантный эффект их усиливается некоторыми наркозными средствами (эфир, фторотан). Антагонистами антидеполяризующих (конкурентных) миорелаксантов являются антихолинэстеразные средства (прозерин и др.), которые, ингибируя синаптическую холинэстеразу (фермент, разрушающий ацетилхолин), способствуют накоплению ацетилхолина.
Антидеполяризующие миорелаксанты применяются при больших оперативных вмешательствах для длительного расслабления мускулатуры.
Кроме того, их используют для купирования судорог у больных тяжелой формой столбняка.
Деполяризующий миорелаксант суксаметония хлорид (дитилин) широко применяется в медицинской практике, является дихолиновым эфиром янтарной кислоты (сукцинилхолин) и в силу большого структурного сходства с ацетилхолином не только связывает Н-холинорецептор скелетной мускулатуры (по аналогии с тубокурарином), но и возбуждает его, вызывая деполяризацию постсинаптической мембраны (подобно ацетилхолину). В отличие от ацетилхолина, мгновенно разрушаемого холинэстеразой, дитилин дает стойкую деполяризацию: после короткого (несколько секунд) сокращения, мышечное волокно расслабляется, а его Н-холинорецепторы теряют чувствительность к медиатору. Заканчивается действие дитилина через 5-10 мин, в течение которых он вымывается из синапса и гидролизуется псевдохолинэстеразой.
Естественно, антихолинэстеразные средства, способствуя накоплению ацетилхолина, удлиняют и усиливают действие деполяризующих миорелаксантов.
Применяется дитилин для кратковременной миорелаксации при интубации трахеи, вправлении вывихов, репозиции костей при переломах, проведении бронхоскопии и др. Осложнения:
1) мышечные послеоперационные боли. В начале деполяризации появляются мышечные фибриллярные сокращения, подергивания, они являются причиной послеоперационных мышечных болей;
2) повышение внутриглазного давления;
3) нарушение ритма сердечной деятельности. При передозировке дитилина переливают свежую (высокая активность псевдохолинэстеразы) кровь и корригируют электролитные нарушения. Применение миорелаксантов допустимо только при наличии условий для интубации трахеи и искусственной вентиляции легких.
Применяется наружно в глазной практике и внутрь в стоматологической практике.
Выпускается в виде 1% и 2% раствора во флаконах по 5 и 10 мл.
Применяется внутрь и подкожно.
Выпускается в таблетках по 0,015 г; в ампулах по 1 мл 0,05% раствора.
Применяется внутрь и инъекционно (подкожно, внутримышечно, внутривенно).
Выпускается в таблетках по 0,0005 г; в ампулах и шприц-тюбиках по 1 мл 0,1% раствора.
42) Антидеполяризующие миорелаксанты: классификация, механизм и
Тубокурарина хлорид, панкурония бромид, пипекурония бромид.
Блокируют н-холинорецепторы и препятствуют деполяризующему влиянию ацетилхолина. М/т быть конкурентными и неконкурентными н-холиноблокаторами.
1) Конкурентные – например м/у тубокурарином и ацетилхолином. Если на фоне нервно-мышечного блока, вызванного тубокурарином, в области н-холинорецепторов концевой пластинки значительно повысить концентрацию ацетилхолина, это приведет к восстановлению нервно-мышечной передачи (конкурентно действующий ацетилхолин вытеснит связанный с холинорецепторами тубокурарин). Если при этом вновь повысить до определенных величин концентрацию тубокурарина, снова наступит блокирующий эффект. Препараты: панкуроний, пиперкуроний, векуроний.
Для антидеполяризующих средств активными антагонистами являются антихолинэстеразные вещества (прозерин, галантамин), они блокируя ацетилхолинэстеразу, значительно повышают концентрацию ацетилхолина в синаптической щели, что приводит к вытеснению курареподобных соединений, связанных с н-холинорецепторами, и восстановлению нервно-мышечной передачи. Кроме того, в качестве антагониста можно воспользоваться пимадином, который способствует высвобождению ацетилхолина из окончаний двигательных нервов.
Тубокурарин и некоторые другие препараты могут стимулировать высвобождение гистамина, что сопровождается снижением артериального давления, повышением тонуса мышц бронхов.
2) Неконкурентные — курареподобный препарат и ацетилхолин, по-видимому, взаимодействуют с разными, но взаимосвязанными рецепторными субстратами концевой пластинки. Препараты: престонал.
Активность и продолжительность действия антидеполяризующих курареподобных средств могут изменяться под влиянием средств для наркоза. Эфир и фторотан усиливают и пролонгируют миопаралитический эффект. Незначительное усиление блокирующего действия антидеполяризующих препаратов возможно при их введении на фоне гексенала или тиопентал-натрия.
43) Деполяризующие миорелаксанты: механизм и особенности действия,
синергисты, применение.
Деполяризующие средства (дитилин) возбуждают н-холинорецепторы и вызывают стойкую деполяризацию постсинаптической мембраны. Вначале развитие деполяризации проявляется мышечными подергиваниями — фас-цикуляциями, через небольшой промежуток времени наступает миопаралитический эффект.
По продолжительности миопаралитического действия курареподобные средства условно можно подразделить на 3 группы: короткого действия (5-10 мин) -дитилин; средней продолжительности (20-30 мин) — атракурий, векуроний; длительного действия (30-40 мин и более) — тубокурарин, пиперкуроний, панкуроний.
При применении деполяризующих средств в посленаркозном периоде иногда возникают мышечные боли, что считается результатом микротравм мышц во время их фасцикуляций.
В больших дозах они стимулируют н-холинорецепторы ганглиев и мозгового слоя надпочечников, повышая артериальное давление.
Курареподобные препараты плохо всасываются в желудочно-кишечном тракте, поэтому вводят их парентерально, обычно внутривенно.
Курареподобные препараты широко применяют в анестезиологии при проведении различных хирургических вмешательств. Вызывая расслабление скелетных мышц, они значительно облегчают проведение многих операций на органах грудной и брюшной полостей, а также на верхних и нижних конечностях. Их применяют при интубации трахеи, бронхоскопии, вправлении вывихов и репозиции костных отломков.
Побочные эффекты: аритмии, бронхоспазм, повышение внутриглазного давления, мышечные боли.
Антидеполяризующие миорелаксанты. Деполяризующие миорелаксанты
Антидеполяризующие миорелаксанты. Деполяризующие миорелаксанты
Нервно-мышечное соединение имеет большой коэффициент безопасности, и деполяризация концевой пластинки должна быть значительно уменьшена антидеполяризующими миорелаксантами до наступления истощения. В клинической практике мониторируют ответ в виде мышечного сокращения при воздействии четырьмя электрическими стимулами с частотой 2 Гц на конкретный нерв. Антидеполяризующие миорелаксанты уменьшают или блокируют эти сокращения. В абдоминальной хирургии при эффективной нервно-мышечной блокаде заметно только первое сокращение: последовательные стимулы вызывают прогрессирующее снижение количества высвобождаемого АХ и, соответственно, коэффициента безопасности.
По истечении эффекта миорелаксантов момент появления двух или более сокращений является индикатором того, что ингибирование ацетилхолинэстеразы противостоит блокаде. Ингибирование фермента позволяет достаточному количеству АХ накапливаться в синаптической щели и неоднократно взаимодействовать с рецепторами. Таким образом, откроется большее число каналов и восстановится нервно-мышечная передача. В случае избыточной антидеполяризующей блокады увеличение потенциала концевой пластинки из-за дезактивации ацетилхолинэстеразы не повлияет на восстановление передачи.
Важно понимать, что летучие анестетики и другие лекарственные средства тоже могут блокировать нервно-мышечную передачу, однако этот эффект не проявляется при введении клинических доз. Тем не менее они будут усиливать эффект антидеполяризующих миорелаксантов.
Молекулярный механизм действия деполяризующих миорелаксантов также включает связывание с нАХР. Когда два нАХР связываются с АХ или молекулами миорелаксанта, канал открывается и концевая пластинка деполяризуется. Это действие АХ быстротечно, поскольку он подвергается расщеплению ацетилхолинэстеразой на неактивные ацетат и холин, последний из которых возвращается в нервное окончание. Когда тубокурарин блокирует -нервно-мышечную передачу, связываясь с нАХР, он не активирует рецептор, а устраняет доступ к АХ. Сукцинилхолин же, представляющий собой две молекулы АХ, связанные через ацетильные группы, активирует нАХР, связываясь с ним.
Действуя как аналог АХ, сукцинилхолин оказывает те же эффекты. Однако он разрушается не под действием ацетилхолинэстеразы, а медленно гидролизуется в плазме холинэстеразами. В результате сукцинилхолин сохраняется в синаптической щели в высоких концентрациях дольше, чем АХ. Вслед за длительной активацией нАХР сукцинилхолином поддерживается деполяризация концевой пластинки и десенситизация потенциал-зависимых натриевых каналов мембраны скелетной мышцы, и, следовательно, нейротрансмиссия отсутствует. Аналогичная нервно-мышечная блокада имеет место в эксперименте, когда блокируют ацетилхолинэстеразу и в концевую пластинку поступает большое количество АХ.
Основные отличия в молекулярном механизме действия двух групп миорелаксантов обусловливают характер их действия. Одним из основных отличий является то, что сукцинилхолин вызывает мышечные фасцикуляции — асинхронные сокращения всей двигательной единицы. Предполагают, что они становятся причиной устойчивой миалгии, длящейся довольно долго после операции. Одним из возможных механизмов считают стимуляцию множественно иннервируемых интрафузальных мышечных волокон, расположенных в рецепторах растяжения скелетных мышц. В результате рефлекторно активируются мотонейроны и соответствующие двигательные единицы. Другой возможный механизм основан на действии пресинаптических никотиновых рецепторов.
Можно отметить и то, что единственными множественно иннервируемыми мышцами в человеческом организме являются интрафузальные волокна и внеглазничные мышцы. Такая мышца отвечает ступенчатым сокращением на нарастание концентрации АХ или сукцинилхолина. Так, сукцинилхолин, вызывая ненужные и нескоординированные сокращения мышц глазного яблока, может усугубить глаукому.
Фасцикуляции по природе своего происхождения могут повредить мышцу и вследствие этого увеличить концентрацию натрия в сыворотке. Обычно это не имеет значения, за исключением больных с недавно полученными ожогами, спинальными травмами или миопатиями. У них значительное увеличение концентрации натрия может быть связано с денервацией поврежденной области и последующим образованием избыточного количества нАХР вне синапса, а рецепторы, активируясь, вызывают потерю натрия мышцами.
У некоторых людей (1 из 2000) имеется недостаток в плазме эстераз, разрушающих сукцинилхолин (недостаточность псевдохолинэстераз). В результате этого возникает продолжительная нервно-мышечная блокада. При полном отсутствии этих ферментов она может длиться несколько часов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Миорелаксанты антидеполяризующего действия
Вещества этой группы блокируют Н-холинорецепторы, локализованные на концевой пластинке скелетных мышц, и препятствуют их взаимодействию с аце-тилхолином, в результате чего ацетилхолин не вызывает деполяризацию мембраны мышечных волокон — мышцы не сокращаются. Такое состояние называется нервно-мышечным блоком. Однако при повышении концентрации ацетилхолина в синаптической щели (например, при применении антихолинэстеразных средств) ацетилхолин конкурентно вытесняет миорелаксант из связи с Н-холинорецептором и вызывает деполяризацию постсинаптической мембраны — происходит восстановление нервно-мышечной передачи. Вещества, действующие подобным образом, называются миорелаксантами антидеполяризующего конкурентного действия.
Первым препаратом этой группы был алкалоид тубокурарин- основное действующее вещество стрельного яда кураре. В состав этого яда входят экстракты южноамериканских растений вида Strychnos и Chondodendron. Индейцы Южной Америки использовали кураре во время охоты на животных, смазывая им наконечники стрел. Кураре, попав в организм животного, вызывало паралич скелетных мышц и животное теряло способность двигаться, но его мясо было пригодно к употреблению в пищу. Впоследствии было установлено, что по химической структуре тубокурарин не всасывается из ЖКТ.
Вещества, близкие тубокурарину по действию, стали называть курареподобны-ми средствами
Антидеполяризующие миорелаксанты (тубокурарин, атракурий, мивакурий);
(пипекуроний, векуроний, рокуроний).
В зависимости от продолжительности вызываемого ими нервномышечного блока выделяют препараты: длительного действия (30 мин и более) — тубокурарин, пипекуроний; средней продолжительности действия (20—30 мин) — атракурий, векуроний, рокуроний; короткого действия (10 мин) — мивакурий.
Курареподобные средства используются для расслабления скелетных мышц при хирургических операциях.
Под действием курареподобных средств мышцы расслабляются в следующей последовательности:
сначала мышцы лица, гортани, шеи,
затем мышцы конечностей, туловища
и в последнюю очередь дыхательные мышцы — наступает остановка дыхания. При выключении дыхания больного переводят на искусственную вентиляцию легких.
Кроме того, курареподобные средства применяют для устранения тонических судорог при столбняке и при отравлении стрихнином. При этом расслабление скелетных мышц способствует устранению судорог.
Побочные эффекты некоторых курареподобных средств (тубокурарин, атракурий, мивакурий) связаны главным образом с их способностью высвобождать гистамин. Это может быть причиной гипотензии, бронхоспазма, покраснения кожи, а также реже — других анафилактоидных реакций. В большей степени высвобождению гистамина способствует тубокурарин.
Антагонистами миорелаксантов антидеполяризующего действия являются антихолинэстеразные средства.
Миорелаксанты деполяризующего действия
Суксаметония йодид (Дитилин, Листенон, Миорелаксин) к нарушению нервно-мышечной передачи и расслаблению скелетных мышц. При этом выделяющийся в синапти-ческую щель ацетилхолин лишь усиливает деполяризацию мембраны и углубляет нервно-мышечный блок.
Антихолинэстеразные средства не устраняют действие суксаметония (не являются его антагонистами). Более того, подавляя активность ацетилхолинэсте-разы и холинэстеразы плазмы крови, они усиливают и удлиняют его действие.
Суксаметоний применяется при интубации трахеи, эндоскопических процедурах (бронхо-, эзофаго-, цистоскопии), кратковременных операциях (наложение швов на брюшную стенку, вправление вывихов, репозиция костных отломков), для устранения тонических судорог при столбняке.
После внутривенного введения суксаметония его миопаралитическое действие начинается через 30 с—1 мин, и продолжается до 10 мин. Миорелаксирующее действие препарата можно прекратить переливанием свежей цитратной крови.
Побочные эффекты:
— послеоперационные мышечные боли (что связывают с микротравмами мышц во время их фасцикуляций),
— угнетение дыхания (апноэ),
— гиперкалиемия и аритмии сердца,
— повышение внутриглазного давления,
Суксаметоний противопоказан при
— нарушении функции печени,
— в грудном возрасте.
Сравнительные характеристики миорелаксантов антидеполяризующего и деполяризующего действия
| Показатели | Антидеполяризующие миорелаксанты | Деполяризующие миорелаксанты |
| Механизм развития нервно-мышечного блока | Блокада Н-холинорецепторов концевой пластинки скелетных мышц, устранение деполяризующего действия ацетилхолина | Стойкая деполяризация постси-наптической мембраны нервно-мышечного синапса |
| Фазы действия | Фаза расслабления | Фаза мышечной фасцикуляций (сокращения одной или нескольких двигательных единиц) Фаза расслабления |
| Влияние антихолин-эстеразных средств | Устранение нервно-мышечного блока | Усиление и удлинение нервно-мышечного блока |
Диоксоний является препаратом смешанного типа действия.
Диоксоний сочетает в себе свойства деполяризующих и недеполяризующих миорелаксантов. Сначала он вызывает кратковременную деполяризацию, которая сменяется недеполяризующим блоком. Вводят диоксоний внутривенно. Мышечное расслабление наступает через 1-3 мин и продолжается 20—40 мин.
Курареподобные препараты применяются только в условиях стационара и самостоятельное введение их больными недопустимо.
Взаимодействие миорелаксантов периферического действия с другими лекарственными средствами
Читайте также:
- Дефекты межпредсердной и межжелудочковой перегородок
- Эффективность леводопы. Побочные эффекты леводопы
- Эпигенетическая регуляция ооцита. Геномный импринтинг
- Эволюция микроорганизмов — молекулярная филогенетика
- Лучевые признаки заращенной девственной плевы