Внутрибольничные инфекции – различные инфекционные заболевания, заражение которыми произошло в условиях лечебного учреждения. В зависимости от степени распространения различают генерализованные (бактериемию, септицемию, септикопиемию, бактериальный шок) и локализованные формы внутрибольничных инфекций (с поражением кожи и подкожной клетчатки, дыхательной, сердечно-сосудистой, урогенитальной системы, костей и суставов, ЦНС и т. д.). Выявление возбудителей внутрибольничных инфекций проводится с помощью методов лабораторной диагностики (микроскопических, микробиологических, серологических, молекулярно-биологических). При лечении внутрибольничных инфекций используются антибиотики, антисептики, иммуностимуляторы, физиотерапия, экстракорпоральная гемокоррекция и т. д.
Общие сведения
Внутрибольничные (госпитальные, нозокомиальные) инфекции — инфекционные заболевания различной этиологии, возникшие у пациента или медицинского сотрудника в связи с пребыванием в лечебно-профилактическом учреждении. Инфекция считается внутрибольничной, если она развилась не ранее 48 часов после поступления больного в стационар. Распространенность внутрибольничных инфекций (ВБИ) в медицинских учреждениях различного профиля составляет 5-12%. Наибольший удельный вес внутрибольничных инфекций приходится на акушерские и хирургические стационары (отделения реанимации, абдоминальной хирургии, травматологии, ожоговой травмы, урологии, гинекологии, отоларингологии, стоматологии, онкологии и др.). Внутрибольничные инфекции представляют собой большую медико-социальную проблему, поскольку утяжеляют течение основного заболевания, увеличивают длительность лечения в 1,5 раза, а количество летальных исходов — в 5 раз.
Внутрибольничные инфекции
Этиология и эпидемиология внутрибольничных инфекций
Основными возбудителями внутрибольничных инфекций (85% от общего числа) выступают условно-патогенные микроорганизмы: грамположительные кокки (эпидермальный и золотистый стафилококк, бета-гемолитический стрептококк, пневмококк, энтерококк) и грамотрицательные палочковидные бактерии (клебсиеллы, эшерихии, энтеробактер, протей, псевдомонады и др.). Кроме этого, в этиологии внутрибольничных инфекций велика удельная роль вирусных возбудителей простого герпеса, аденовирусной инфекции, гриппа, парагриппа, цитомегалии, вирусных гепатитов, респираторно-синцитиальной инфекции, а также риновирусов, ротавирусов, энтеровирусов и пр. Также внутрибольничные инфекции могут быть вызваны условно-патогенными и патогенными грибами (дрожжеподобными, плесневыми, лучистыми). Особенностью внутригоспитальных штаммов условно-патогенных микроорганизмов служит их высокая изменчивость, лекарственная резистентность и устойчивость к воздействию факторов среды (ультрафиолета, дезинфектантов и пр.).
Источниками внутрибольничных инфекций в большинстве случаев выступают пациенты или медицинский персонал, являющиеся бактерионосителями или больными стертыми и манифестными формами патологии. Как показывают исследования, роль третьих лиц (в частности, посетителей стационаров) в распространении ВБИ невелика. Передача различных форм госпитальной инфекции реализуется с помощью воздушно-капельного, фекально-орального, контактного, трансмиссивного механизма. Кроме этого, возможен парентеральный путь передачи внутрибольничной инфекции при проведении различных инвазивных медицинских манипуляций: забора крови, инъекций, вакцинации, инструментальных манипуляций, операций, ИВЛ, гемодиализа и пр. Таким образом в медучреждении возможно заразиться гепатитами В, С и D, гнойно-воспалительными заболеваниями, сифилисом, ВИЧ-инфекцией. Известны случаи внутрибольничных вспышек легионеллеза при приеме больными лечебного душа и вихревых ванн.
Факторами, участвующими в распространении внутрибольничной инфекции, могут выступать контаминированные предметы ухода и обстановки, медицинский инструментарий и аппаратура, растворы для инфузионной терапии, спецодежда и руки медперсонала, изделия медицинского назначения многоразового использования (зонды, катетеры, эндоскопы), питьевая вода, постельные принадлежности, шовный и перевязочный материал и мн. др.
Значимость тех или иных видов внутрибольничной инфекции во многом зависит от профиля лечебного учреждения. Так, в ожоговых отделениях преобладает синегнойная инфекция, которая в основном передается через предметы ухода и руки персонала, а главным источником внутрибольничной инфекции являются сами пациенты. В учреждениях родовспоможения основную проблему представляет стафилококковая инфекция, распространяемая медицинским персоналом-носителем золотистого стафилококка. В урологических отделениях доминирует инфекция, вызываемая грамотрицательной флорой: кишечной, синегнойной палочкой и др. В педиатрических стационарах особую значимость имеет проблема распространения детских инфекций – ветряной оспы, эпидемического паротита, краснухи, кори. Возникновению и распространению внутрибольничной инфекции способствуют нарушение санитарно-эпидемиологического режима ЛПУ (несоблюдение личной гигиены, асептики и антисептики, режима дезинфекции и стерилизации, несвоевременное выявление и изоляция лиц-источников инфекции и т. д.).
К группе риска, в наибольшей степени подверженной развитию внутрибольничной инфекции, относятся новорожденные (особенно недоношенные) и дети раннего возраста; пожилые и ослабленные пациенты; лица, страдающие хроническими заболеваниями (сахарным диабетом, болезнями крови, почечной недостаточностью), иммунодефицитом, онкопатологией. Восприимчивость человека к внутрибольничным инфекциям увеличивается при наличии у него открытых ран, полостных дренажей, внутрисосудистых и мочевых катетеров, трахеостомы и других инвазивных устройств. На частоту возникновения и тяжесть течения внутрибольничной инфекции влияет долгое нахождение пациента в стационаре, длительная антибиотикотерапия, иммуносупрессивная терапия.
Классификация внутрибольничных инфекций
По длительности течения внутрибольничные инфекции делятся на острые, подострые и хронические; по тяжести клинических проявлений – на легкие, среднетяжелые и тяжелые формы. В зависимости от степени распространенности инфекционного процесса различают генерализованные и локализованные формы внутрибольничной инфекции. Генерализованные инфекции представлены бактериемией, септицемией, бактериальным шоком. В свою очередь, среди локализованных форм выделяют:
- инфекции кожи, слизистых и подкожной клетчатки, в т. ч. послеоперационных, ожоговых, травматических ран. В частности, к их числу относятся омфалит, абсцессы и флегмоны, пиодермия, рожа, мастит, парапроктит, грибковые инфекции кожи и др.
- инфекции полости рта (стоматит) и ЛОР-органов (ангина, фарингит, ларингит, эпиглоттит, ринит, синусит, отит, мастоидит)
- инфекции бронхолегочной системы (бронхит, пневмония, плеврит, абсцесс легкого, гангрена легкого, эмпиема плевры, медиастинит)
- инфекции пищеварительной системы (гастрит, энтерит, колит, вирусные гепатиты)
- глазные инфекции (блефарит, конъюнктивит, кератит)
- инфекции урогенитального тракта (бактериурия, уретрит, цистит, пиелонефрит, эндометрит, аднексит)
- инфекции костно-суставной системы (бурсит, артрит, остеомиелит)
- инфекции сердца и сосудов (перикардит, миокардит, эндокардит, тромбофлебиты).
- инфекции ЦНС (абсцесс мозга, менингит, миелит и др.).
В структуре внутрибольничных инфекций на долю гнойно-септических заболеваний приходится 75-80%, кишечных инфекций — 8-12%, гемоконтактных инфекций — 6-7%. На прочие инфекционные заболевания (ротавирусные инфекции, дифтерию, туберкулез, микозы и др.) приходится около 5-6%.
Диагностика внутрибольничных инфекций
Критериями, позволяющими думать о развитии внутрибольничной инфекции, служат: возникновение клинических признаков заболевания не ранее чем через 48 часов после поступления в стационар; связь с проведением инвазивного вмешательства; установление источника инфекции и фактора передачи. Окончательное суждение о характере инфекционного процесса получают после идентификации штамма возбудителя с помощью лабораторных методов диагностики.
Для исключения или подтверждения бактериемии проводится бактериологический посев крови на стерильность, желательно не менее 2-3-х раз. При локализованных формах внутрибольничной инфекции микробиологическое выделение возбудителя может быть произведено из других биологических сред, в связи с чем выполняется посев мочи, кала, мокроты, отделяемого ран, материала из зева, мазка с конъюнктивы, из половых путей на микрофлору. Дополнительно к культуральному методу выявления возбудителей внутрибольничных инфекций используются микроскопия, серологические реакции (РСК, РА, ИФА, РИА), вирусологический, молекулярно-биологический (ПЦР) методы.
Лечение внутрибольничных инфекций
Сложности лечения внутрибольничной инфекции обусловлены ее развитием в ослабленном организме, на фоне основной патологии, а также резистентностью госпитальных штаммов к традиционной фармакотерапии. Больные с диагностированными инфекционными процессами подлежат изоляции; в отделении проводится тщательная текущая и заключительная дезинфекция. Выбор противомикробного препарата основывается на особенностях антибиотикограммы: при внутрибольничной инфекции, вызванной грамположительной флорой наиболее эффективен ванкомицин; грамотрицательными микроорганизмами – карбапенемы, цефалоспорины IV поколения, аминогликозиды. Возможно дополнительное применение специфических бактериофагов, иммуностимуляторов, интерферона, лейкоцитарной массы, витаминотерапии.
При необходимости проводится чрескожное облучение крови (ВЛОК, УФОК), экстракорпоральная гемокоррекция (гемосорбция, лимфосорбция). Симптоматическая терапия осуществляется с учетом клинической формы внутрибольничной инфекции с участием специалистов соответствующего профиля: хирургов, травматологов, пульмонологов, урологов, гинекологов и др.
Профилактика внутрибольничных инфекций
Основные меры профилактики внутрибольничных инфекций сводятся к соблюдению санитарно-гигиенических и противоэпидемических требований. В первую очередь, это касается режима дезинфекции помещений и предметов ухода, применения современных высокоэффективных антисептиков, проведения качественной предстерилизационной обработки и стерилизации инструментария, безукоснительного следования правилам асептики и антисептики.
Медицинский персонал должен соблюдать меры индивидуальной защиты при проведении инвазивных процедур: работать в резиновых перчатках, защитных очках и маске; осторожно обращаться с медицинским инструментарием. Большое значение в профилактике внутрибольничных инфекций имеет вакцинация медработников от гепатита В, краснухи, гриппа, дифтерии, столбняка и других инфекций. Все сотрудники ЛПУ подлежат регулярному плановому диспансерному обследованию, направленному на выявление носительства патогенов. Предупредить возникновение и распространение внутрибольничных инфекций позволит сокращение сроков госпитализации пациентов, рациональная антибиотикотерапия, обоснованность проведения инвазивных диагностических и лечебных процедур, эпидемиологический контроль в ЛПУ.
Широкое распространение инфекций, связанных с оказанием медицинской помощи (ИСМП), в медицинских организациях различного профиля, значительный ущерб здоровью населения, экономике и демографической ситуации в различных странах континента определяют актуальность их профилактики на современном этапе.
Так, ежегодно в России регистрируется 26-30 тыс. случаев внутрибольничных инфекций (ВБИ), из них 15% – это гнойно-септические инфекции (ГСИ) новорожденных, около 16% ГСИ – у оперированных больных. Фактически же их распространение значительно выше. Срок пребывания больных с ИСМП в медицинских учреждениях увеличивается до 10 дней, экономический ущерб – до 10-15 млрд рублей в год. В Европе ежегодный экономический ущерб от ИСМП составляет примерно 7 млрд евро, а в США – 6,5 млрд долларов.
Впервые в нашей стране на государственном уровне основные направления профилактики внутрибольничных инфекций были сформулированы в 1999 г. в программном документе «Концепция профилактики внутрибольничных инфекций», разработанном академиком РАМН В. И. Покровским.
За прошедшие десятилетия были накоплены новые научные данные о механизмах развития внутрибольничных инфекций, появилось значительное количество разнообразной медицинской техники, новых медицинских технологий, средств лечения и методов лабораторной диагностики. Произошло реформирование здравоохранения и государственной санитарно- эпидемиологической службы.
В связи с этим возникла необходимость пересмотра существующей концепции, что и было осуществлено группой авторов, в состав которой вошли и сотрудники кафедры эпидемиологии Пермской государственной медицинской академии им. ак. Е. А. Вагнера. Национальная концепция профилактики инфекций, связанных с оказанием медицинской помощи, была утверждена главным государственным санитарным врачом РФ Г. Г. Онищенко 6 ноября 2011г..
В рамках новой национальной концепции была изменена терминология: вместо «внутрибольничные инфекции» эта группа инфекций получила другое название. В зарубежной литературе для обсуждения данной проблемы используют термин «Healthcare- associated infections – HAIs», что в переводе означает «инфекции, связанные с оказанием медицинской помощи» (ИСМП). Таким образом, понятие ИСМП, рекомендованное в новой концепции, соответствует терминологии ВОЗ и гармонизации отечественных нормативных документов с международными требованиями.
В свете вышеизложенного вашему вниманию представляется обзорная лекция по эпидемиологии и профилактике ИСМП с учетом основных положений новой национальной концепции их профилактики.
Инфекции, связанные с оказанием медицинской помощи (ИСМП) – это случаи инфицирования, связанные с оказанием любых видов медицинской помощи (в медицинских стационарах и амбулаторно-поликлинических, образовательных, санаторно-оздоровительных учреждениях, учреждениях социальной защиты населения, при оказании скорой медицинской помощи на дому и др.), а также случаи инфицирования медицинских работников в результате их профессиональной деятельности.
Характеристика эпидемического процесса инфекций, связанных с оказанием медицинской помощи
Как известно, эпидемический процесс при любой инфекции возникает и реализуется при взаимодействии трех факторов – биологического, природного и социального.
Биологический фактор эпидемического процесса ИСМП характеризуется, с одной стороны, многообразием микроорганизмов, обусловливающих их развитие, с другой – низкой резистентностью пациентов, находящихся в медицинских организациях различного профиля.
Возбудители ИСМП представлены тремя группами микроорганизмов.
- Первая группа – патогенные возбудители традиционных инфекций: шигеллезов, кори, краснухи, гриппа, туберкулеза и др.
- Вторая группа – облигатные паразиты, патогенность которых проявляется в условиях стационара при широком применении лечебных и диагностических манипуляций. К этой группе относятся вирусные гепатиты В, С, D, ВИЧ-инфекция.
- Третья группа – условно-патогенные микроорганизмы, облигатные и факультативные паразиты, которые вызывают гнойно-септические инфекции. К ним относятся стафилококки, синегнойная палочка, протей, анаэробные микроорганизмы и др.
Возбудители гнойно-септических инфекций, как правило, определяются профилем стационара. Так, в ожоговых, травматологических и акушерских отделениях преобладают стафилококки, в урологических отделениях – кишечная палочка, синегнойная палочка, протей, клебсиелла, в стоматологических – анаэробы.
При адаптации штаммов возбудителя к условиям стационара формируются так называемые «госпитальные штаммы». Госпитальные штаммы – это штаммы микроорганизмов с измененными биологическими свойствами, выделенные в медицинской организации. При формировании госпитального штамма (клона) коэффициент разнообразия циркулирующих микроорганизмов снижается, штаммы приобретают такие свойства, как устойчивость к антимикробным препаратам, к физическим воздействиям, повышенная вирулентность.
Поступающие в стационар больные, как правило, имеют пониженную сопротивляемость, отсутствие местного иммунитета, иммунодефицитное состояние. Следует учесть, что в стационарах находится большое число лиц пожилого и престарелого возраста, сопротивляемость у которых ниже, чем у лиц активного возраста. К группам риска ИСМП, кроме пожилых лиц, относятся и недоношенные дети в силу несовершенной иммунной системы.
Источники возбудителей ИСМП
Основными категориями источников возбудителей ИСМП являются пациенты, окружающая среда и медицинский персонал. Различают два типа развития ИСМП: при экзогенном и эндогенном заражении.
Эндогенное заражение связано с собственной микрофлорой пациента, когда происходит активизация местной флоры и занос микробного агента из других органов и тканей. Например, в процессе хирургического вмешательства в рану могут попадать микроорганизмы с кожи пациента или из его кишечника.
При экзогенном заражении источником возбудителя инфекции могут быть больные или персонал, а также объекты окружающей среды, в которых накапливаются возбудители. Наибольшее значение как источника ИСМП имеют пациенты с клинически выраженным заболеванием, а также носители.
Окружающая среда как источник возбудителей госпитальных инфекций имеет наибольшую важность при условно- патогенных микроорганизмах, которые сохраняются и размножаются в различных увлажняющих устройствах, растворах для парентерального введения, некоторых антисептиках и дезинфектантах.
Медицинский персонал как источник возбудителя инфекции представляет опасность при наличии инфекционного поражения кожи, а также при формировании у них носительства, когда происходит размножение микроорганизмов в различных биотопах без признаков инфекции (колонизация).
Пути и факторы передачи
При традиционных ИСМП характерны естественные пути передачи, определяемые эволюционно сложившимися механизмами передачи. Возбудители ИСМП передаются воздушно-капельным, воздушно-пылевым, контактным, пищевым, водным путями, а также трансплацентарно или при прохождении плода по родовым путям.
Искусственными путями передачи считают те, которые связаны с лечебно-диагностическим процессом. Так, искусственным является заражение при гемотрансфузиях такими инфекциями, как ВИЧ-инфекция, гепатиты В, С, D, малярия и другими. Кроме того, к искусственным путям передачи относят контактный путь с руками персонала и предметами ухода за пациентами, инструментальный, аппаратный, трансфузионный.
Искусственные пути передачи, как и естественные, определяют по конечному фактору передачи. Руки медицинского персонала являются одним из основных факторов передачи. Медицинские перчатки не всегда обеспечивают непроницаемость микроорганизмов и защиту пациентов от заражения.
Распространению ИСМП в стационарах способствует скученность (госпитализированные люди находятся в круглосуточном общении друг с другом в закрытых помещениях) и перемешиваемость (производится постоянная выписка больных с одновременной госпитализацией новых).
Проявления эпидемического процесса ИСМП
Интенсивность. В работах отечественных и зарубежных ученых показано, что ИСМП возникают у 5-12% больных, поступающих в медицинские учреждения. В США ежегодно регистрируется до 2 млн заболевших в стационаре, в Германии 500 – 700 тыс., что составляет 1% населения этих стран. В РФ ИСМП по расчетным данным ежегодно развиваются у 2-2,5 млн человек.
Отсутствие единого подхода к выявлению больных ГСИ в медицинских учреждениях, некачественная организация микробиологического мониторинга, сокрытие случаев ИСМП привели к тому, что регистрируемый уровень заболеваемости не соответствует фактическому, что не позволяет госпитальному эпидемиологу осуществлять качественную эпидемиологическую диагностику и целенаправленную профилактику.
Для решения этой проблемы приоритетной задачей в современных условиях является разработка отечественных стандартных определений случаев ГСИ, организация в медицинских учреждениях высокого риска инфицирования (учреждения охраны материнства и детства, хирургического профиля) активного поиска ГСИ в рамках ретроспективного и проспективного наблюдения.
Динамика. Для многолетней динамики эпидемического процесса ИСМП характерны цикличность, сезонные подъемы и вспышки, определяемые конкретной нозоформой инфекции. Изменение динамики может быть связано с формированием устойчивости возбудителей к антибактериальным препаратам, а также рядом социальных факторов: изменения в ходе лечебно-диагностического процесса, переуплотненность, нарушение дезинфекционно-стерилизационного режима.
Структура. Основными клиническими формами ИСМП являются инфекции: мочевыводящих путей; в области хирургических вмешательств; дыхательных путей; инфекции кровотока.
Локализация патологического процесса может изменяться в зависимости от факторов риска возникновения ИСМП в конкретных условиях стационара. В структуре ИСМП в многопрофильных медицинских учреждениях ведущее место занимают ГСИ, которые составляют до 75-80% от общего количества заболеваний.
Наиболее часто ГСИ регистрируются в отделениях неотложной и абдоминальной хирургии, травматологии, урологии, учреждениях родовспоможения. В структуре неонатальной смертности ГСИ составляют 30%, летальность родильниц от сепсиса – 12%.
Гемоконтактные вирусные гепатиты В, С, D составляют в общей структуре ИСМП 6- 7%. При этом риску заражения подвержены больные, которым проводятся кровезаместительная терапия, гемодиализ и др. Группами риска инфицирования вирусом гепатита В является и медицинский персонал, выполняющий хирургические манипуляции или работающий с кровью в хирургических, гемодиализных, гематологических и лабораторных отделениях, а также пациенты, подвергшиеся данным манипуляциям. При этом носителями маркеров гемоконтактных гепатитов становятся от 15 до 62% персонала этих отделений.
Доля других традиционных ИСМП (гриппа, респираторных инфекций, дифтерии, туберкулеза и др.) составляет 5- 6% от общей заболеваемости. Группа внутрибольничных кишечных инфекций достигает 7-12%, при этом преобладают сальмонеллезы. Штаммы сальмонелл отличаются высокой антибиотикорезистентностью и устойчивостью к внешним воздействиям.
Возрастными группами риска развития ИСМП являются лица старше 60 лет, новорожденные, особенно с низкой массой тела, а также пациенты, которые получают инвазивные лечебно-диагностические медицинские технологии.
Пространственное распределение. К высокому риску инфицирования относятся отделения реанимации и интенсивной терапии, ожоговые, онкологические, травматологические, урологические, а также учреждения охраны материнства и детства. Внутри отделений помещениями повышенного риска заражения являются операционные, перевязочные, палаты интенсивной терапии и другие.
Эпидемиологический надзор за инфекциями, связанными с оказанием медицинской помощи
Эпидемиологический надзор за ИСМП – это система непрерывного слежения за эпидемическим процессом и его детерминантами для осуществления эпидемиологической диагностики с целью принятия обоснованных управленческих решений по предупреждению возникновения и распространения ИСМП.
Эпидемиологический надзор должен осуществляться в каждой медицинской организации с учетом ее профиля. Эпидемиологический надзор в медицинских организациях организует и контролирует госпитальный эпидемиолог. Практика работы госпитального эпидемиолога показывает, что эпидемиологический надзор и контроль за ИСМП характеризуется высокими показателями эффективности в тех медицинских организациях, где в штатное расписание введена ставка заместителя главного врача по эпидемиологическим вопросам.
Информационная подсистема эпидемиологического надзора должна включать систему учета и регистрацию случаев ИСМП и носительства у пациентов и персонала, а также микробиологический мониторинг больных и объектов внешней среды, направленный на своевременное обнаружение госпитальных штаммов (клонов). При этом должно осуществляться внутривидовое типирование штаммов с использованием молекулярно-биологических методов исследования.
Целесообразно также в рамках информационной подсистемы выделить поток информации, характеризующий условия заражения: переуплотненность, оперативную активность, нарушение протоколов по обеспечению безопасности лечебно-диагностического процесса, дезинфекционно-стерилизационного режима, своевременности и качества противоэпидемических мероприятий.
Диагностическая подсистема эпидемического надзора включает оперативный и ретроспективный эпидемиологический анализ с определением факторов риска. При эндогенной инфекции ретроспективный эпидемиологический анализ должен учитывать длительность нахождения больного в стационаре, характер операции, вид наркоза, очередность операции и другие факторы риска. При экзогенной инфекции, кроме определения факторов риска, эпидемиологическая диагностика должна быть направлена на выявление резервуара и источников возбудителя инфекции, мест и способов заражения.
Совершенствование эпидемиологического надзора в рамках Национальной концепции профилактики ИСМП предусматривает аппаратно-программное его обеспечение с использованием компьютерной техники.
Профилактические и противоэпидемические мероприятия
В основе профилактических и противоэпидемических мероприятий должен находиться санитарно-гигиенический и противоэпидемический режим медицинской организации, предусматривающий предупреждение заноса, распространения и выноса инфекции за её пределы.
Основными профилактическими мерами являются:
- соблюдение асептики при использовании химических средств для создания чистой гигиенической среды, исключающей распространение микробов;
- соблюдение антисептики при использовании химических средств для уничтожения микробов на живых тканях;
- совершенствование системы стерилизации и предстерилизационной очистки, контроля качества стерилизации и дезинфекции;
- раннее и полное выявление больных и носителей среди пациентов и медицинского персонала с гнойно-воспалительными и другими инфекционными заболеваниями;
- разграничение потоков отделения «чистой» и гнойной хирургии;
- сокращение числа инвазивных вмешательств.
Для обеспечения профилактики ИСМП среди персонала должны проводиться следующие мероприятия:
- после контакта с кровью, жидкостями организма пациентов, секретами, экскретами, контаминированными предметами руки моют с мылом;
- после снятия перчаток руки моют с мылом или обрабатывают спиртовым антисептиком;
- персонал должен надеть перчатки при осмотре пациента или проведении манипуляций, если возможен контакт с кровью, жидкостями организма, слизистыми оболочками, кожей и контаминированными предметами;
- персонал надевает маску, очки и щитки, так как при осмотре пациента или проведении манипуляций возможно образование брызг крови, секретов или экскретов;
- дезинфекция и стерилизация медицинского инструментария проводится в соответствии с нормативными документами.
Изоляционно-ограничительные мероприятия – это комплекс мероприятий по предупреждению передачи возбудителей от пациентов с потенциально заразными заболеваниями другим пациентам, медицинским работникам и посетителям стационара. К изоляционно-ограничительным мероприятиям относят:
- требования к размещению пациентов;
- применение средств индивидуальной защиты;
- обработку рук медицинского персонала;
- требования к перемещению и транспортировке пациентов;
- требования к использованию и обработку средств ухода за пациентами;
- проведение текущей и заключительной дезинфекции;
- при необходимости изоляцию пациентов в отдельном помещении (отдельные палаты, боксы, полубоксы).
К числу профилактических и противоэпидемических мероприятий следует отнести стерилизацию, дезинфекцию и очистку.
К объектам, подлежащим стерилизации, относятся хирургические инструменты, сердечные, сосудистые и мочевые катетеры, внутриматочные устройства. Дезинфекции, в частности химической, подлежат эндоскопы, дыхательное оборудование для анестезии, любые предметы, контаминированные патогенными микроорганизмами. Очистке подлежат предметы, не находящиеся в непосредственном контакте с пациентами: тонометры, термометры, предметы мебели. Эффективность стерилизации определяет предстерилизационная очистка изделий медицинского назначения, методы стерилизации, их контроль.
Организацию и контроль за проведением профилактических и противоэпидемических мероприятий обеспечивает госпитальный эпидемиолог. Предупреждение заноса инфекции в стационар обеспечивается правильной организацией приема: сбор эпидемиологического анамнеза, лабораторное обследование пациентов, обоснованное размещение в стационаре.
В функцию госпитального эпидемиолога входит проведение оперативного и ретроспективного анализа, эпидемиологическое обследование возникших очагов. Важное значение имеет полная регистрация всех случаев инфекционных заболеваний, особенно ГСП, контроль за которой должен осуществлять госпитальный эпидемиолог. Систематическое бактериологическое исследование больных, персонала и объектов внешней среды с внутривидовым типированием выделенных штаммов необходимо для установления эпидемиологических связей и формирования госпитальных штаммов.
Оценка эффективности профилактических мероприятий проводится по трем критериям: эпидемиологическому, социальному и экономическому. Эпидемиологическая эффективность мероприятия определяется по темпам снижения среднемноголетней заболеваемости ИСМП. Социальная эффективность мероприятий оценивается по совокупности ущерба, который наносят ИСМП здоровью и качеству жизни населения (показатели смертности, инвалидизации). Экономическая эффективность мероприятий определяется сокращением прямого и косвенного материального ущерба, наносимого региону.
Все дополнительные профилактические и противоэпидемические меры должны проводиться с учетом эпидемиологических особенностей конкретной инфекции, а также факторов риска, выявленных в процессе проведения эпидемиологического надзора.
Основными направлениями совершенствования профилактики ИСМП в современных условиях в соответствии с Национальной концепцией являются:
- формирование гармонизированного с международными правилами перечня обязательных требований, которые обеспечивают эффективную профилактику ИСМП в лечебно-профилактических организациях;
- подготовка стандарта проверки соблюдения обязательных требований, направленных на профилактику ИСМП в лечебно-профилактических организациях в зависимости от их профиля;
- совершенствование административного законодательства в сфере защиты прав потребителей медицинских услуг.
1.Группы риска ВБИ:
– пациенты, особенно хирургических, урологических, реанимационных отделений, а также отделений гемодиализа;
– посетители, особенно лица пожилого возраста и дети;
– родственники, ухаживающие за тяжелобольными;
– медицинский персонал, особенно те, кто использует инструментарий многоразового пользования, требующий проведения всех этапов обработки, предусмотренной санитарно-эпидемиологическими правилами.
2.Резервуары возбудителей ВБИ.
Возбудители инфекции находятся в резервуарах (источниках) инфекции. Резервуаром (источником) внутрибольничной (госпитальной) инфекции являются:
– руки персонала;- кишечник, мочеполовая система, носоглотка, кожа, волосы, полость рта (как пациента, так и персонала);
– окружающая среда: персонал, пыль, вода, продукты питания;
– инструментарий; оборудование;
– лекарственные средства и т. д.
Типичными местами обитания ВБИ являются изделия из резины (катетеры, дренажные трубки), приборы, в которых используются вода и антисептики (дистилляторы, ингаляторы, ионизаторы и т д), аппараты для искусственного дыхания, инструментарий.
Наиболее опасны в качестве источника инфекции больные легкими формами и носители.
С целью профилактики внутрибольничных инфекций в учреждениях здравоохранения соблюдается санитарно-противоэпидемический режим в соответствии с САНПИН 2.1.3.2630-10 «Санитарно-эпидемиологические требования к организациям, осуществляющих медицинскую деятельность».
3.Профилактика ВБИ
Проблема профилактики ВБИ является многоплановой и весьма трудна для решения по целому ряду причин – организационных, эпидемиологических, научно-методических. Эффективность борьбы с ВБИ определяется тем, соответствует ли конструктивное решение здания ЛПУ последним научным достижениям, а также современным оснащением ЛПУ и строгим выполнением требований противоэпидемического режима на всех этапах предоставления медицинской помощи. В ЛПУ независимо от профиля должны выполняться три важнейших требования:
– сведение к минимуму возможности заноса инфекции;
– исключение внутригоспитальных заражений;
– исключение выноса инфекции за пределы лечебного учреждения
4.Санитарно- противоэпидемический режим различных помещений медицинского учреждения.
Общие требования к организации профилактических и противоэпидемических мероприятий
В целях профилактики возникновения и распространения внутрибольничных инфекций (ВБИ) разрабатывается план профилактических и противоэпидемических мероприятий, который утверждается руководителем организации.
Профилактические мероприятия проводятся исходя из положения, что каждый пациент расценивается как потенциальный источник гемоконтактных инфекций (гепатит B, C, ВИЧ и других).
При плановом поступлении на стационарное лечение пациенты на догоспитальном этапе подлежат профилактическому обследованию на:
– туберкулез (флюорография, результаты действительны в течение года);
– маркеры гепатитов B и C, сифилис (в случае оперативного лечения);
– дифтерию и кишечные инфекции (пациенты психиатрических стационаров);
– кишечные инфекции (пациенты детских стационаров до 2 лет и сопровождающие лица, результаты действительны в течение 2 недель до госпитализации).
Дети, поступающие на стационарное лечение, должны иметь сведения об отсутствии контактов с инфекционными больными в течение 21 дня до госпитализации.
Санитарное содержание помещений, оборудования, инвентаря
Все помещения, оборудование, медицинский и другой инвентарь должны содержаться в чистоте. Влажная уборка помещений (обработка полов, мебели, оборудования, подоконников, дверей) должна осуществляться не менее 2 раз в сутки, с использованием моющих и дезинфицирующих средств, разрешенных к использованию в установленном порядке. Администрация ЛПО организует предварительный и периодический (не реже 1 раза в год) инструктаж персонала, осуществляющего уборку помещений по вопросам санитарно-гигиенического режима и технологии уборки.
Хранение моющих и дезинфекционных средств должно осуществляться в таре (упаковке) изготовителя, снабженной этикеткой, на стеллажах, в специально предназначенных местах.
Необходимо иметь отдельные емкости с рабочими растворами дезинфекционных средств, используемых для обработки различных объектов:
– для дезинфекции, для предстерилизационной очистки и для стерилизации изделий медицинского назначения, а также для их предварительной очистки (при использовании средств, обладающих фиксирующими свойствами);
– для дезинфекции поверхностей в помещениях, мебели, аппаратов, приборов и оборудования;
– для обеззараживания уборочного материала, для обеззараживания отходов классов Б и В (в случае отсутствия установок для обеззараживания).
Емкости с рабочими растворами дезинфекционных средств должны быть снабжены плотно прилегающими крышками, иметь четкие надписи или этикетки с указанием средства, его концентрации, назначения, даты приготовления, предельного срока годности раствора.
При работе с дезинфекционными средствами необходимо соблюдать все меры предосторожности, включая применение средств индивидуальной защиты, указанные в инструкциях по применению.
Уборочный инвентарь (тележки, мопы, емкости, ветошь, швабры) должен иметь четкую маркировку или цветовое кодирование с учетом функционального назначения помещений и видов уборочных работ и храниться в выделенном помещении. Схема цветового кодирования размещается в зоне хранения инвентаря. Стиральные машины для стирки мопов и другой ветоши устанавливаются в местах комплектации уборочных тележек.
Мытье оконных стекол должно проводиться по мере необходимости, но не реже 2 раз в год.
Генеральная уборка помещений палатных отделений и других функциональных помещений и кабинетов должна проводиться по графику не реже 1 раза в месяц, с обработкой стен, полов, оборудования, инвентаря, светильников.
Генеральная уборка операционного блока, перевязочных, родильных залов, процедурных, манипуляционных, стерилизационных и других помещенийасептическим режимом проводится один раз в неделю. В день проведения генеральной уборки в оперблоке плановые операции не проводятся.
Вне графика генеральную уборку проводят в случае получения неудовлетворительных результатов микробной обсемененности внешней среды и по эпидемиологическим показаниям.
Для проведения генеральной уборки персонал должен иметь специальную одежду и средства индивидуальной защиты (халат, шапочка, маска, резиновые перчатки, резиновый фартук и др.), промаркированный уборочный инвентарь и чистые тканевые салфетки.
Использованный уборочный инвентарь обеззараживают в растворе дезинфицирующего средства, затем прополаскивают в воде и сушат. Уборочный инвентарь для пола и стен должен быть раздельным, иметь четкую маркировку, применяться раздельно для кабинетов, коридоров, санузлов.
Хранение уборочного инвентаря необходимо осуществлять в специально выделенном помещении или шкафу вне помещений рабочих кабинетов.
Для обеззараживания воздуха в помещениях с асептическим режимом следует применять разрешенные для этой цели оборудование и/или химические средства.
Сбор грязного белья осуществляется в закрытой таре (клеенчатые или полиэтиленовые мешки, специально оборудованные и маркированные бельевые тележки или другие аналогичные приспособления) и передаваться в центральную кладовую для грязного белья.
Стирка белья должна осуществляться в специальных прачечных или прачечной в составе медицинской организации. Режим стирки белья должен соответствовать действующим гигиеническим нормативам.
Транспортировка чистого белья из прачечной и грязного белья в прачечную должна осуществляться в упакованном виде (в контейнерах) специально выделенным автотранспортом.
Перевозка грязного и чистого белья в одной и той же таре не допускается. Стирка тканевой тары (мешков) должна осуществляться одновременно с бельем.
После выписки (смерти) больного, а также по мере загрязнения матрацы, подушки, одеяла должны подвергаться дезинфекционной камерной обработке. В случае использования для покрытия матрацев чехлов из материала, допускающего влажную дезинфекцию, камерная обработка не требуется. Дезинфекционной обработке подлежат кровать и тумбочка пациента. В медицинской организации должен быть обменный фонд постельных принадлежностей, для хранения которого предусматривается специальное помещение.
В ООМД не должно быть синантропных членистоногих, крыс и мышевидных грызунов. Проведение дезинсекции и дератизации должно осуществляться в соответствии с санитарными правилами специализированными организациями.
Сбор, временное хранение и удаление отходов различных классов опасности в ООМД осуществляются в соответствии с санитарными правилами по обращению с медицинскими отходами.
В целях профилактики ВБИ обеззараживанию подлежат руки медицинских работников (гигиеническая обработка рук, обработка рук хирургов) и кожные покровы пациентов (обработка операционного и инъекционного полей, локтевых сгибов доноров, санитарная обработка кожных покровов).При поступлении в стационар пациенты, при необходимости, проходят санитарную обработку в приемном отделении, включающую: принятие душа или ванны, стрижку ногтей и другие процедуры, в зависимости от результатов осмотра. После санитарной обработки больному выдается комплект чистого нательного белья, пижама/халат, тапочки. Личная одежда и обувь оставляется в специальной упаковке с вешалками (полиэтиленовые мешки, чехлы из плотной ткани) в помещении для хранения вещей пациентов или передается его родственникам (знакомым). Допускается нахождение больных в стационарах в домашней одежде. Личная одежда больных инфекционными заболеваниями должна подвергаться камерной дезинфекции в случаях, предусмотренных санитарными правилами.
В отделении больному выдается мыло, полотенце, стакан (чашка, кружка), при необходимости – поильник, плевательница, подкладное судно с подставкой. Разрешается использовать собственные предметы личной гигиены.
Гигиеническая обработка больных (при отсутствии медицинских противопоказаний) должна осуществляться не реже 1 раза в 7 дней с отметкой в истории болезни. Гигиенический уход за тяжелобольными (умывание, протирание кожи лица, частей тела, полоскание полости рта и т.д.) проводится утром, а также после приема пищи и при загрязнении тела. Периодически должны быть организованы стрижка и бритье больных.
Смена белья пациентам должна проводиться по мере загрязнения, регулярно, но не реже 1 раза в 7 дней. Загрязненное белье подлежит немедленной замене. Смену постельного белья родильницам следует проводить 1 раз в 3 дня, нательного белья и полотенец – ежедневно, подкладных пеленок – не менее 4 – 5 раз в сутки и по необходимости. Допускается использование прокладок фабричного изготовления.
Перед возвращением пациента в палату после операции производится обязательная смена белья. Смена белья пациентам после операций должна проводиться систематически до прекращения выделений из ран.
В операционных, акушерских стационарах (родильных блоках и других помещениях с асептическим режимом, а также в палатах для новорожденных) должно применяться стерильное белье. Для новорожденных допускается использование памперсов.
После каждой раздачи пищи производят влажную уборку помещений буфетных. Уборочный материал промывается, обеззараживается, просушивается.
Не допускается оставлять в буфетных остатки пищи после ее раздачи больным, а также смешивать пищевые остатки со свежими блюдами.
Раздачу пищи больным производят буфетчицы и дежурные медицинские сестры отделения. Раздача пищи должна производиться в халатах с маркировкой “Для раздачи пищи”. Не допускается к раздаче пищи младший обслуживающий персонал.
В местах приема передач и в отделениях должны быть вывешены списки разрешенных для передачи продуктов (с указанием их предельного количества).
Ежедневно дежурная медицинская сестра отделения проверяет соблюдение правил и сроков годности (хранения) пищевых продуктов, хранящихся в холодильниках отделения. При обнаружении пищевых продуктов в холодильниках отделения с истекшим сроком годности, хранящихся без упаковок с указанием фамилии больного, а также имеющих признаки порчи, они должны изыматься в пищевые отходы. О правилах хранения личных пищевых продуктов пациент должен быть информирован при поступлении в отделение.
Персонал обеспечивается средствами индивидуальной защиты в необходимом количестве и соответствующих размеров (перчатками, масками, щитками, респираторами, фартуками и пр.) в зависимости от профиля отделения и характера проводимой работы.
Для персонала стационаров предусматривается устройство гардеробных с душем и туалетом.
В каждом структурном подразделении выделяются комнаты для персонала, в которых должны быть предусмотрены условия для приема пищи.
Медицинский персонал должен быть обеспечен комплектами сменной одежды: халатами, шапочками, сменной обувью в соответствии с табелем оснащения, но не менее 3 комплектов спецодежды на одного работающего.
В оперблоке врачи и другие лица, участвующие в операции, должны работать в стерильных халатах, перчатках и масках. Сменная обувь должна быть из нетканого материала.
Стирка одежды персонала должна осуществляться централизованно и раздельно от белья больных.
Смена одежды в подразделениях хирургического и акушерского профиля осуществляется ежедневно и по мере загрязнения. В учреждениях терапевтического профиля – 2 раза в неделю и по мере загрязнения. Сменная обувь персонала, работающего в помещениях с асептическим режимом, должна быть из нетканого материала, доступного для дезинфекции. Сменная одежда и обувь должна быть предусмотрена также и для медицинского персонала других подразделений, оказывающего консультативную и другую помощь, а также для инженерно-технических работников.
В ходе проведения манипуляций пациенту персонал не должен вести записи, прикасаться к телефонной трубке и тому подобное.
Прием пищи персоналом проводится в специально отведенных помещениях, на рабочем месте принимать пищу запрещено.
Нахождение в медицинской одежде и обуви за пределами ЛПО не допускается.
В целях профилактики внутрибольничных инфекций (далее – ВБИ) в лечебно-профилактической организации (далее – ЛПО) осуществляются дезинфекционные и стерилизационные мероприятия, которые включают в себя работы по профилактической и очаговой дезинфекции, дезинсекции, дератизации, обеззараживанию, предстерилизационной очистке и стерилизации изделий медицинского назначения.
- Уборка, использование, дезинфекция уборочного инвентаря, его хранение проводятся согласно приказам МЗ № 288 СанПиН 5 179-90 г.
- Соблюдается порядок хранения рабочей одежды.
- Санитарная обработка пациентов в отделении и смена белья проводится один раз в семь дней и по необходимости.
- Соблюдается порядок хранения грязного белья, личной одежды пациента.
5.Дезинфекция, предстерилизационная очистка и стерилизация предметов медицинского назначения, предметов ухода проводятся согласно приказам МЗ: ОСТ 42-21-02-85 г. и приказу № 408, а также методическим указаниям по дезинфекции, предстерилизационной очистке и стерилизации предметов медицинского назначения, утвержденных МЗ России 30 декабря 1998 г. № МУ – 287-113.
- Проводится активное выявление инфекционных пациентов (подозрение на кишечную инфекцию, брюшной тиф, дифтерию, вирусный гепатит), соблюдаются сроки наблюдения за контактными больными.
- Соблюдается режим питания: оснащение раздаточных, буфетных, время реализации готовой пищи, порядок сбора и удаления пищевых отходов, порядок обработки посуды, ветоши, уборочный инвентарь и его хранение, порядок хранения передач.
- На случай выявления пациентов с карантинными и особо опасными инфекциями в отделениях имеются схемы-памятки поведения медперсонала при выявлении подозрительных пациентов, оказания первой помощи, схемы оповещения, укладки по особо опасным инфекциям.
- Соблюдаются правила сбора, хранения и удаления отходов в лечебно – профилактических учреждениях (СанПиН 2.1.7.728-99).
| Nosocomial infection | |
|---|---|
| Other names | HAI (Healthcare-Associated Infections) |
 |
|
| Contaminated surfaces increase cross-transmission | |
| Specialty | Infectious disease |
A hospital-acquired infection, also known as a nosocomial infection (from the Greek nosokomeion, meaning «hospital»), is an infection that is acquired in a hospital or other health care facility.[1] To emphasize both hospital and nonhospital settings, it is sometimes instead called a healthcare-associated infection.[2] Such an infection can be acquired in hospital, nursing home, rehabilitation facility, outpatient clinic, diagnostic laboratory or other clinical settings. A number dynamic processes bring contamination into operating rooms and other areas within nosocomial settings. [3][4] Infection is spread to the susceptible patient in the clinical setting by various means. Health care staff also spread infection, in addition to contaminated equipment, bed linens, or air droplets. The infection can originate from the outside environment, another infected patient, staff that may be infected, or in some cases, the source of the infection cannot be determined. In some cases the microorganism originates from the patient’s own skin microbiota, becoming opportunistic after surgery or other procedures that compromise the protective skin barrier. Though the patient may have contracted the infection from their own skin, the infection is still considered nosocomial since it develops in the health care setting.[5] Nosocomial infection tends to lack evidence that it was present when the patient entered the healthcare setting, thus meaning it was acquired post-admission.[5][6]
Effects[edit]
In the United States, the Centers for Disease Control and Prevention estimated that roughly 1.7 million healthcare-associated infections, from all types of microorganisms, including bacteria and fungi combined, cause or contribute to 99,000 deaths each year.[7] In Europe, where hospital surveys have been conducted, the category of gram-negative infections are estimated to account for two-thirds of the 25,000 deaths each year.[8] Nosocomial infections can cause severe pneumonia and infections of the urinary tract, bloodstream and other parts of the body.[9][10] Many types display antimicrobial resistance, which can complicate treatment.[citation needed]
In the UK about 300,000 patients were affected in 2017, and this was estimated to cost the NHS about £1 billion a year.[11]
Types[edit]
- Hospital-acquired pneumonia
- Ventilator-associated pneumonia
- Urinary tract infection
- Gastroenteritis
- Puerperal fever
- Central line-associated blood stream infection
Organisms[edit]
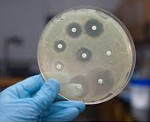
- Staphylococcus aureus
- Methicillin resistant Staphylococcus aureus[12]
- Candida albicans[12]
- Pseudomonas aeruginosa[12]
- Acinetobacter baumannii’[12]
- Stenotrophomonas maltophilia
- Clostridium difficile
- Escherichia coli[12]
- Tuberculosis
- Vancomycin-resistant Enterococcus
- Legionnaires’ disease
Cause[edit]
Transmission[edit]
In-dwelling catheters have recently been identified with hospital acquired infections.[13] To deal with this complication, procedures are used, called intravascular antimicrobial lock therapy, that can reduce infections that are unexposed to blood-borne antibiotics.[14] Introducing antibiotics, including ethanol, into the catheter (without flushing it into the bloodstream) reduces the formation of biofilms.[12]
| Route | Description |
|---|---|
| Contact transmission | The most important and frequent mode of transmission of nosocomial infections is by direct contact. |
| Droplet transmission | Transmission occurs when droplets containing microbes from the infected person are propelled a short distance through the air and deposited on the patient’s body; droplets are generated from the source person mainly by coughing, sneezing, and talking, and during the performance of certain procedures, such as bronchoscopy. |
| Airborne transmission | Dissemination can be either airborne droplet nuclei (small-particle residue {5 µm or smaller in size} of evaporated droplets containing microorganisms that remain suspended in the air for long periods of time) or dust particles containing the infectious agent. Microorganisms carried in this manner can be dispersed widely by air currents and may become inhaled by a susceptible host within the same room or over a longer distance from the source patient, depending on environmental factors; therefore, special air-handling and ventilation are required to prevent airborne transmission. Microorganisms transmitted by airborne transmission include Legionella, Mycobacterium tuberculosis and the rubeola and varicella viruses. |
| Common vehicle transmission | This applies to microorganisms transmitted to the host by contaminated items, such as food, water, medications, devices, and equipment. |
| Vector borne transmission | This occurs when vectors such as mosquitoes, flies, rats, and other vermin transmit microorganisms. |
Contact transmission is divided into two subgroups: direct-contact transmission and indirect-contact transmission.
| Route | Description |
|---|---|
| Direct-contact transmission | This involves a direct body surface-to-body surface contact and physical transfer of microorganisms between a susceptible host and an infected or colonized person, such as when a person turns a patient, gives a patient a bath, or performs other patient-care activities that require direct personal contact. Direct-contact transmission also can occur between two patients, with one serving as the source of the infectious microorganisms and the other as a susceptible host. |
| Indirect-contact transmission | This involves contact of a susceptible host with a contaminated intermediate object, usually inanimate, such as contaminated instruments, needles, or dressings, or contaminated gloves that are not changed between patients. In addition, the improper use of saline flush syringes, vials, and bags has been implicated in disease transmission in the US, even when healthcare workers had access to gloves, disposable needles, intravenous devices, and flushes.[15] |
Patient susceptibility[edit]
Alongside reducing vectors for transmission, patient susceptibility to hospital-acquired infection needs to be considered. Factors which render patients at greater risk of infections include:
- Receipt of immunosuppressive medications such as glucocorticoids[16] or immunosuppressive drugs as part of treatments for cancer, organ transplantation or autoimmune diseases
- Impaired immunity due to diseases such as haematological malignancy, primary immunodeficiency, HIV/AIDS or critical illness,[17] including severe COVID-19[16][18]
- Presence of indwelling devices which breach natural defences, including endotracheal tubes, central venous catheters and urinary catheters.
- The use of antibiotics does not, itself, increase risk of hospital-acquired infections, but does contribute to the prevalence of Antimicrobial resistant organisms amongst patients with hospital-acquired infections[19]
Device-associated infections[edit]
Given the association between invasive devices and hospital-acquired infections, specific terms are used to delineate such infections to allow for monitoring and prevention. Noted device-associated infections include ventilator-associated pneumonia, catheter-associated blood stream infections, catheter-associated urinary tract infections and device-associated ventriculitis. Surveillance for these infections is commonly undertaken and reported by bodies such as the European Centre for Disease Prevention and Control and Centers for Disease Control and Prevention.[citation needed]
Prevention[edit]
Controlling nosocomial infection is to implement QA/QC measures to the health care sectors, and evidence-based management can be a feasible approach. For those with ventilator-associated or hospital-acquired pneumonia, controlling and monitoring hospital indoor air quality needs to be on agenda in management,[20] whereas for nosocomial rotavirus infection, a hand hygiene protocol has to be enforced.[21][22][23]
To reduce the number of hospital-acquired infections, the state of Maryland implemented the Maryland Hospital-Acquired Conditions Program that provides financial rewards and penalties for individual hospitals. An adaptation of the Centers for Medicare & Medicaid Services payment policy causes poor-performing hospitals to lose up to 3% of their inpatient revenues, whereas hospitals that are able to decrease hospital-acquired infections can earn up to 3% in rewards. During the program’s first two years, complication rates fell by 15.26% across all hospital-acquired conditions tracked by the state (including those not covered by the program), from a risk-adjusted complication rate of 2.38 per 1,000 people in 2009 to a rate of 2.02 in 2011. The 15.26% decline translates into more than $100 million in cost savings for the health care system in Maryland, with the largest savings coming from avoidance of urinary tract infections, sepsis and other severe infections, and pneumonia and other lung infections. If similar results could be achieved nationwide, the Medicare program would save an estimated $1.3 billion over two years, while the US health care system as a whole would save $5.3 billion.[24]
Sanitation[edit]
Hospitals have sanitation protocols regarding uniforms, equipment sterilization, washing, and other preventive measures. Thorough hand washing and/or use of alcohol rubs by all medical personnel before and after each patient contact is one of the most effective ways to combat nosocomial infections.[25] More careful use of antimicrobial agents, such as antibiotics, is also considered vital.[26] As many hospital-acquired infections caused by bacteria such as methicillin-resistant Staphylococcus aureus, methicillin-susceptible Staphylococcus aureus, and Clostridium difficile are caused by a breach of these protocols, it is common that affected patients make medical negligence claims against the hospital in question.[27]
Sanitizing surfaces is part of control measures to reduce nosocomial infections in health care environments. Modern sanitizing methods such as Non-flammable Alcohol Vapor in Carbon Dioxide systems have been effective against gastroenteritis, methicillin-resistant Staphylococcus aureus, and influenza agents. Use of hydrogen peroxide vapor has been clinically proven to reduce infection rates and risk of acquisition. Hydrogen peroxide is effective against endospore-forming bacteria, such as Clostridium difficile, where alcohol has been shown to be ineffective.[28][non-primary source needed] Ultraviolet cleaning devices may also be used to disinfect the rooms of patients infected with Clostridium difficile or methicillin-resistant Staphylococcus aureus after discharge.[29][non-primary source needed]
Despite sanitation protocol, patients cannot be entirely isolated from infectious agents. Furthermore, patients are often prescribed antibiotics and other antimicrobial drugs to help treat illness; this may increase the selection pressure for the emergence of resistant strains.[30]
Sterilization[edit]
Sterilization goes further than just sanitizing. It kills all microorganisms on equipment and surfaces through exposure to chemicals, ionizing radiation, dry heat, or steam under pressure.[31]
Isolation[edit]
Isolation is the implementation of isolating precautions designed to prevent transmission of microorganisms by common routes in hospitals. (See Universal precautions and Transmission-based precautions.) Because agent and host factors are more difficult to control, interruption of transfer of microorganisms is directed primarily at transmission for example isolation of infectious cases in special hospitals and isolation of patient with infected wounds in special rooms also isolation of joint transplantation patients on specific rooms.[citation needed]
Handwashing[edit]
Handwashing frequently is called the single most important measure to reduce the risks of transmitting skin microorganisms from one person to another or from one site to another on the same patient. Washing hands as promptly and thoroughly as possible between patient contacts and after contact with blood, body fluids, secretions, excretions, and equipment or articles contaminated by them is an important component of infection control and isolation precautions.
The spread of nosocomial infections, among immunocompromised patients is connected with health care workers’ hand contamination in almost 40% of cases, and is a challenging problem in the modern hospitals. The best way for workers to overcome this problem is conducting correct hand-hygiene procedures; this is why the WHO launched in 2005 the GLOBAL Patient Safety Challenge.[32]
Two categories of micro-organisms can be present on health care workers’ hands: transient flora and resident flora. The first is represented by the micro-organisms taken by workers from the environment, and the bacteria in it are capable of surviving on the human skin and sometimes to grow. The second group is represented by the permanent micro-organisms living on the skin surface (on the stratum corneum or immediately under it). They are capable of surviving on the human skin and to grow freely on it. They have low pathogenicity and infection rate, and they create a kind of protection from the colonization from other more pathogenic bacteria. The skin of workers is colonized by 3.9 × 104 – 4.6 × 106 cfu/cm2. The microbes comprising the resident flora are: Staphylococcus epidermidis, Staphylococcus hominis, and Microccocus, Propionibacterium, Corynebacterium, Dermobacterium, and Pitosporum spp., while transient organisms are Staphylococcus aureus, and Klebsiella pneumoniae, and Acinetobacter, Enterobacter and Candida spp. The goal of hand hygiene is to eliminate the transient flora with a careful and proper performance of hand washing, using different kinds of soap, (normal and antiseptic), and alcohol-based gels. The main problems found in the practice of hand hygiene is connected with the lack of available sinks and time-consuming performance of hand washing. An easy way to resolve this problem could be the use of alcohol-based hand rubs, because of faster application compared to correct hand-washing.[33]
Improving patient hand washing has also been shown to reduce the rate of nosocomial infection. Patients who are bed-bound often do not have as much access to clean their hands at mealtimes or after touching surfaces or handling waste such as tissues. By reinforcing the importance of handwashing and providing sanitizing gel or wipes within reach of the bed, nurses were directly able to reduce infection rates. A study published in 2017 demonstrated this by improving patient education on both proper hand-washing procedure and important times to use sanitizer and successfully reduced the rate of enterococci and Staphylococcus aureus.[34]
All visitors must follow the same procedures as hospital staff to adequately control the spread of infections. Moreover, multidrug-resistant infections can leave the hospital and become part of the community flora if steps are not taken to stop this transmission.[citation needed]
It is unclear whether or not nail polish or rings affected surgical wound infection rates.[35]
Gloves[edit]
In addition to hand washing, gloves play an important role in reducing the risks of transmission of microorganisms. Gloves are worn for three important reasons in hospitals. First, they are worn to provide a protective barrier for personnel, preventing large scale contamination of the hands when touching blood, body fluids, secretions, excretions, mucous membranes, and non-intact skin. In the United States, the Occupational Safety and Health Administration has mandated wearing gloves to reduce the risk of bloodborne pathogen infections.[36] Second, gloves are worn to reduce the likelihood that microorganisms present on the hands of personnel will be transmitted to patients during invasive or other patient-care procedures that involve touching a patient’s mucous membranes and nonintact skin. Third, they are worn to reduce the likelihood that the hands of personnel contaminated with micro-organisms from a patient or a fomite can transmit those micro-organisms to another patient. In this situation, gloves must be changed between patient contacts, and hands should be washed after gloves are removed.[citation needed]
Antimicrobial surfaces[edit]
Micro-organisms are known to survive on inanimate «touch» surfaces for extended periods of time.[37][38] This can be especially troublesome in hospital environments where immunodeficient patients are at enhanced risk for contracting nosocomial infections. Patients with hospital-acquired infections are predominantly hospitalized in different types of intensive care units (ICUs).[39]
Touch surfaces commonly found in hospital rooms, such as bed rails, call buttons, touch plates, chairs, door handles, light switches, grab rails, intravenous poles, dispensers (alcohol gel, paper towel, soap), dressing trolleys, and counter and table tops are known to be contaminated with Staphylococcus, methicillin-resistant Staphylococcus aureus (one of the most virulent strains of antibiotic-resistant bacteria) and vancomycin-resistant Enterococcus.[40] Objects in closest proximity to patients have the highest levels of methicillin-resistant Staphylococcus aureus and vancomycin-resistant Enterococcus. This is why touch surfaces in hospital rooms can serve as sources, or reservoirs, for the spread of bacteria from the hands of healthcare workers and visitors to patients.[citation needed]
A number of compounds can decrease the risk of bacteria growing on surfaces including: copper, silver, and germicides.[41]
There have been a number of studies evaluating the use of no-touch cleaning systems particularly the use of ultraviolet C devices. One review was inconclusive due to lack of, or of poor quality evidence.[42] Other reviews have found some evidence, and growing evidence of their effectiveness.[43][44]
Treatment[edit]
Two of the bacteria species most likely to infect patients are the Gram-positive strains of methicillin-resistant Staphylococcus aureus, and Gram-negative Acinetobacter baumannii. While antibiotic drugs to treat diseases caused by methicillin-resistant Staphylococcus aureus are available, few effective drugs are available for Acinetobacter. Acinetobacter bacteria are evolving and becoming immune to antibiotics, so in many cases, polymyxin-type antibacterials need to be used. «In many respects it’s far worse than MRSA», said a specialist at Case Western Reserve University.[45]
Another growing disease, especially prevalent in New York City hospitals, is the drug-resistant, Gram-negative Klebsiella pneumoniae. An estimated more than 20% of the Klebsiella infections in Brooklyn hospitals «are now resistant to virtually all modern antibiotics, and those supergerms are now spreading worldwide.»[45]
The bacteria, classified as Gram-negative because of their color on the Gram stain, can cause severe pneumonia and infections of the urinary tract, bloodstream, and other parts of the body. Their cell structures make them more difficult to attack with antibiotics than Gram-positive organisms like methicillin-resistant Staphylococcus aureus. In some cases, antibiotic resistance is spreading to Gram-negative bacteria that can infect people outside the hospital. «For gram-positives we need better drugs; for gram-negatives we need any drugs», said Brad Spellberg, an infectious-disease specialist at Harbor–UCLA Medical Center, and the author of Rising Plague, a book about drug-resistant pathogens.[45]
Hospital-acquired pneumonia (HAP) is the second most common nosocomial infection and accounts for approximately one-fourth of all infections in the intensive care unit (ICU).[46] HAP, or nosocomial pneumonia, is a lower respiratory infection that was not incubating at the time of hospital admission and that presents clinically two or more days after hospitalization.[47] Ventilator-associated pneumonia (VAP) is defined as HAP in patients receiving mechanical ventilation. The incidence of VAP is 10–30% among patients who require mechanical ventilation for >48 h.[48] A standard treatment protocol is based on accurate diagnosis definitions, microbiological confirmation of VAP, and the administration of imipenem plus ciprofloxacin as initial empirical antibiotic treatment.[49]
One-third of nosocomial infections are considered preventable. The CDC estimates 2 million people in the United States are infected annually by hospital-acquired infections, resulting in 99,000 deaths.[50] The most common nosocomial infections are of the urinary tract, surgical site and various pneumonias.[7]
An alternative treatment targeting localised infections is the use of irradiation by ultraviolet C.[51]
Epidemiology[edit]
The methods used differ from country to country (definitions used, type of nosocomial infections covered, health units surveyed, inclusion or exclusion of imported infections, etc.), so the international comparisons of nosocomial infection rates should be made with the utmost care.[citation needed]
Belgium[edit]
In Belgium the prevalence of nosocomial infections is about 6.2%. Annually about 125,500 patients become infected by a nosocomial infection, resulting in almost 3000 deaths. The extra costs for the health insurance are estimated to be approximately €400 million/year.[52]
France[edit]
Estimates ranged from 6.7% in 1990 to 7.4% (patients may have several infections).[53] At national level, prevalence among patients in health care facilities was 6.7% in 1996,[54] 5.9% in 2001[55] and 5.0% in 2006.[56] The rates for nosocomial infections were 7.6% in 1996, 6.4% in 2001 and 5.4% in 2006.[citation needed]
In 2006, the most common infection sites were urinary tract infections (30.3%), pneumopathy (14.7%), infections of surgery site (14.2%). Infections of the skin and mucous membrane (10.2%), other respiratory infections (6.8%) and bacterial infections / blood poisoning (6.4%).[57] The rates among adult patients in intensive care were 13.5% in 2004, 14.6% in 2005, 14.1% in 2006 and 14.4% in 2007.[58]
Nosocomial infections are estimated to make patients stay in the hospital four to five additional days. Around 2004–2005, about 9,000 people died each year with a nosocomial infection, of which about 4,200 would have survived without this infection.[59]
Finland[edit]
Rate was estimated at 8.5% of patients in 2005.[60]
Italy[edit]
Since 2000, estimates show about a 6.7% infection rate, i.e. between 450,000 and 700,000 patients, which caused between 4,500 and 7,000 deaths.[61] A survey in Lombardy gave a rate of 4.9% of patients in 2000.[62]
Switzerland[edit]
Estimates range between 2 and 14%.[63] A national survey gave a rate of 7.2% in 2004.[64]
United Kingdom[edit]
In 2012, the Health Protection Agency reported the prevalence rate of hospital-acquired infections in England was 6.4% in 2011, against a rate of 8.2% in 2006,[65] with respiratory tract, urinary tract and surgical site infections the most common types of infections reported.[65] In 2018, it was reported that in-hospital infections had risen from 5,972 in 2008 to 48,815 in 2017.[66]
United States[edit]
The Centers for Disease Control and Prevention (CDC) estimated roughly 1.7 million hospital-associated infections, from all types of bacteria combined, cause or contribute to 99,000 deaths each year.[67] Other estimates indicate 10%, or 2 million, patients a year become infected, with the annual cost ranging from $4.5 billion to $11 billion.[68] In the US, the most frequent type of hospital infection is urinary tract infection (36%), followed by surgical site infection (20%), and bloodstream infection and pneumonia (both 11%).[45][needs update]
History[edit]
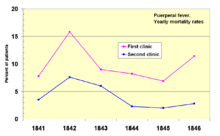
Mortality rates 1841–1846 in two clinics documented by Semmelweis
In 1841, Ignaz Semmelweis, a Hungarian obstetrician was working at a Vienna maternity hospital. He was «shocked» by the death rate of women who developed puerperal fever. He documented that mortality was three times higher in the ward where the medical students were delivering babies than in the next ward that was staffed by midwifery students.[69] The medical students were also routinely working with cadavers. He compared the rates of infection with a similar hospital in Dublin, Ireland, and hypothesized that it was the medical students who somehow were infecting the women after labor. He instituted mandatory hand-washing in May 1847 and infection rates dropped dramatically. Louis Pasteur proposed the germ theory of disease and began his work on cholera in 1865 by identifying that it was microorganisms that were associated with disease.[70][71]
See also[edit]
- Cubicle curtain
- ESKAPE
- Infection control
- Iatrogenesis
- Phototherapy
- Sanitation Standard Operating Procedures
References[edit]
- ^ Rosenthal, Victor D.; Bijie, Hu; Maki, Dennis G.; Mehta, Yatin; Apisarnthanarak, Anucha; Medeiros, Eduardo A.; Leblebicioglu, Hakan; Fisher, Dale; Álvarez-Moreno, Carlos; Khader, Ilham Abu; Martínez, Marisela Del Rocío González; Cuellar, Luis E.; Navoa-Ng, Josephine Anne; Abouqal, Rédouane; Garcell, Humberto Guanche (June 2012). «International Nosocomial Infection Control Consortium (INICC) report, data summary of 36 countries, for 2004-2009» (PDF). American Journal of Infection Control. 40 (5): 396–407. doi:10.1016/j.ajic.2011.05.020. PMID 21908073.
- ^ «HAI Data and Statistics». cdc.gov. 2018-01-10. Retrieved 2018-01-13.
- ^ https://pssjournal.biomedcentral.com/articles/10.1186/s13037-022-00343-8
- ^ https://www.sciencedirect.com/science/article/pii/S2405603022000504
- ^ a b Monegro, Alberto F.; Muppidi, Vijayadershan; Regunath, Hariharan (2020), «Hospital Acquired Infections», StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 28722887, retrieved 2021-02-01
- ^ Sydnor, Emily R. M.; Perl, Trish M. (January 2011). «Hospital epidemiology and infection control in acute-care settings». Clinical Microbiology Reviews. 24 (1): 141–173. doi:10.1128/CMR.00027-10. ISSN 1098-6618. PMC 3021207. PMID 21233510.
- ^ a b Klevens, R. Monina; Edwards, Jonathan R.; Richards, Chesley L.; Horan, Teresa C.; Gaynes, Robert P; Pollock, Daniel A.; Cardo, Denise M. (2007). «Estimating Healthcare-associated Infections and Deaths in U.S. Hospitals, 2002». Public Health Reports. 122 (2): 160–166. doi:10.1177/003335490712200205. PMC 1820440. PMID 17357358.
- ^ Pollack, Andrew (2010-02-26). «Doctors Struggle to Treat Gram-Negative Bacterial Infections». The New York Times. ISSN 0362-4331. Retrieved 2019-11-15.
- ^ Burke A Cunha (July 30, 2018). John L Brusch (ed.). «Hospital-Acquired Pneumonia (Nosocomial Pneumonia) and Ventilator-Associated Pneumonia: Overview, Pathophysiology, Etiology». Webscape.
- ^ Su, Lin-Hui; Ou, Jonathan T.; Leu, Hsieh-Shong; Chiang, Ping-Cherng; Chiu, Yueh-Pi; Chia, Ju-Hsin; Kuo, An-Jing; Chiu, Cheng-Hsun; Chu, Chishih (2003-10-01). «Extended Epidemic of Nosocomial Urinary Tract Infections Caused by Serratia marcescens». Journal of Clinical Microbiology. 41 (10): 4726–4732. doi:10.1128/JCM.41.10.4726-4732.2003. ISSN 0095-1137. PMC 254321. PMID 14532211.
- ^ Hunt, Jeremy (2022). Zero. London: Swift Press. p. 71. ISBN 9781800751224.
- ^ a b c d e f Akbari, Freshta; Kjellerup, Birthe (2015). «Elimination of Bloodstream Infections Associated with Candida albicans Biofilm in Intravascular Catheters». Pathogens. 4 (3): 457–469. doi:10.3390/pathogens4030457. ISSN 2076-0817. PMC 4584267. PMID 26131615.
- ^ «Catheter-associated Urinary Tract Infections (CAUTI)». cdc.gov. 2017-07-19. Retrieved 2018-01-13.
- ^ Justo, JA; Bookstaver, PB (2014). «Antibiotic lock therapy: review of technique and logistical challenges». Infection and Drug Resistance. 7: 343–63. doi:10.2147/IDR.S51388. PMC 4271721. PMID 25548523.
- ^ Jain SK, Persaud D, Perl TM, et al. (July 2005). «Nosocomial malaria and saline flush». Emerging Infect. Dis. 11 (7): 1097–9. doi:10.3201/eid1107.050092. PMC 3371795. PMID 16022788.
- ^ a b Conway Morris, Andrew; Kohler, Katharina; De Corte, Thomas; Ercole, Ari; De Grooth, Harm-Jan; Elbers, Paul W. G.; Povoa, Pedro; Morais, Rui; Koulenti, Despoina; Jog, Sameer; Nielsen, Nathan; Jubb, Alasdair; Cecconi, Maurizio; De Waele, Jan; for the ESICM UNITE COVID investigators (December 2022). «Co-infection and ICU-acquired infection in COIVD-19 ICU patients: a secondary analysis of the UNITE-COVID data set». Critical Care. 26 (1): 236. doi:10.1186/s13054-022-04108-8. ISSN 1364-8535. PMC 9347163. PMID 35922860.
- ^ Conway Morris, Andrew; Datta, Deepankar; Shankar-Hari, Manu; Stephen, Jacqueline; Weir, Christopher J.; Rennie, Jillian; Antonelli, Jean; Bateman, Anthony; Warner, Noel; Judge, Kevin; Keenan, Jim; Wang, Alice; Burpee, Tony; Brown, K. Alun; Lewis, Sion M. (May 2018). «Cell-surface signatures of immune dysfunction risk-stratify critically ill patients: INFECT study». Intensive Care Medicine. 44 (5): 627–635. doi:10.1007/s00134-018-5247-0. ISSN 0342-4642. PMC 6006236. PMID 29915941.
- ^ Maes, Mailis; Higginson, Ellen; Pereira-Dias, Joana; Curran, Martin D.; Parmar, Surendra; Khokhar, Fahad; Cuchet-Lourenço, Delphine; Lux, Janine; Sharma-Hajela, Sapna; Ravenhill, Benjamin; Hamed, Islam; Heales, Laura; Mahroof, Razeen; Soderholm, Amelia; Forrest, Sally (December 2021). «Ventilator-associated pneumonia in critically ill patients with COVID-19». Critical Care. 25 (1): 25. doi:10.1186/s13054-021-03460-5. ISSN 1364-8535. PMC 7797892. PMID 33430915.
- ^ European Centre for Disease Prevention and Control. (October 2019). «Healthcare-associated infections acquired in intensive care units. In: ECDC. Annual epidemiological report for 2017. Stockholm: ECDC; 2019» (PDF). European CDC. Retrieved 15 August 2022.
{{cite web}}: CS1 maint: url-status (link) - ^ Leung M, Chan AH (March 2006). «Control and management of hospital indoor air quality». Med. Sci. Monit. 12 (3): SR17–23. PMID 16501436.
- ^ Chan PC, Huang LM, Lin HC, et al. (April 2007). «Control of an outbreak of pandrug-resistant Acinetobacter baumannii colonization and infection in a neonatal intensive care unit». Infect Control Hosp Epidemiol. 28 (4): 423–9. doi:10.1086/513120. PMID 17385148. S2CID 25876369.
- ^ Traub-Dargatz JL, Weese JS, Rousseau JD, Dunowska M, Morley PS, Dargatz DA (July 2006). «Pilot study to evaluate 3 hygiene protocols on the reduction of bacterial load on the hands of veterinary staff performing routine equine physical examinations». Can. Vet. J. 47 (7): 671–6. PMC 1482439. PMID 16898109.
- ^ Katz JD (September 2004). «Hand washing and hand disinfection: more than your mother taught you». Anesthesiol Clin North America. 22 (3): 457–71, vi. doi:10.1016/j.atc.2004.04.002. PMID 15325713.
- ^ «Statewide, All-Payer Financial Incentives Significantly Reduce Hospital-Acquired Conditions in Maryland Hospitals». Agency for Healthcare Research and Quality. 2013-07-03. Retrieved 2013-07-06.
- ^ McBryde ES, Bradley LC, Whitby M, McElwain DL (October 2004). «An investigation of contact transmission of methicillin-resistant Staphylococcus aureus». Journal of Hospital Infection. 58 (2): 104–8. doi:10.1016/j.jhin.2004.06.010. PMID 15474180.
- ^ Lautenbach E (2001). «Chapter 14. Impact of Changes in Antibiotic Use Practices on Nosocomial Infections and Antimicrobial Resistance—Clostridium difficile and Vancomycin-resistant Enterococcus (VRE)». In Markowitz AJ (ed.). Making Health Care Safer: A Critical Analysis of Patient Safety Practices. Agency for Healthcare Research and Quality.
- ^ «Hospital Negligence Claims». PatientClaimLine.com. Retrieved 2019-08-21.
- ^ Otter JA, French GL (January 2009). «Survival of nosocomial bacteria and spores on surfaces and inactivation by hydrogen peroxide vapor». J. Clin. Microbiol. 47 (1): 205–7. doi:10.1128/JCM.02004-08. PMC 2620839. PMID 18971364.
- ^ «Performance Feedback, Ultraviolet Cleaning Device, and Dedicated Housekeeping Team Significantly Improve Room Cleaning, Reduce Potential for Spread of Common, Dangerous Infection». Agency for Healthcare Research and Quality. 2014-01-15. Retrieved 2014-01-20.
- ^ Kolár, M.; Urbánek, K.; Látal, T. (May 2001). «Antibiotic selective pressure and development of bacterial resistance». International Journal of Antimicrobial Agents. 17 (5): 357–363. doi:10.1016/S0924-8579(01)00317-X. ISSN 0924-8579. PMID 11337221.
- ^ «The Different Methods of Sterilizing Medical Equipment». Gibraltar Laboratories. 2013-05-31. Archived from the original on 2018-12-06. Retrieved 2018-12-06.
- ^ World Alliance for patient safety. WHO Guidelines on Hand Hygiene in Health Care. [1][dead link]. 2009
- ^ Hugonnet, Stéphane; Perneger, Thomas V.; Pittet, Didier (2002-05-13). «Alcohol-Based Handrub Improves Compliance With Hand Hygiene in Intensive Care Units». Archives of Internal Medicine. 162 (9): 1037–1043. doi:10.1001/archinte.162.9.1037. PMID 11996615.
- ^ Haverstick, Stacy; Goodrich, Cara; Freeman, Regi; James, Shandra; Kullar, Rajkiran; Ahrens, Melissa (June 2017). «Patients’ Hand Washing and Reducing Hospital-Acquired Infection». Critical Care Nurse. 37 (3): e1–e8. doi:10.4037/ccn2017694. PMID 28572111.
- ^ Arrowsmith, VA; Taylor, R (Aug 4, 2014). «Removal of nail polish and finger rings to prevent surgical infection». The Cochrane Database of Systematic Reviews. 2014 (8): CD003325. doi:10.1002/14651858.CD003325.pub3. PMC 7163182. PMID 25089848.
- ^ «Occupational Exposure to Bloodborne Pathogens;Needlestick and Other Sharps Injuries; Final Rule. — 66:5317-5325». Osha.gov. Retrieved 2011-07-11.
- ^ Wilks, S.A.; Michels, H.; Keevil, C.W. (2005). «The survival of Escherichia coli O157 on a range of metal surfaces». International Journal of Food Microbiology. 105 (3): 445–454. doi:10.1016/j.ijfoodmicro.2005.04.021. PMID 16253366.
- ^ Michels, H.T. (2006), Anti-Microbial Characteristics of Copper, ASTM Standardization News, October, pp. 28–31
- ^ Wang, Meng; Wei, Hongyan; Zhao, Yaxin; Shang, Linlin; Di, Linlin; Lyu, Chuanfeng; Liu, Jun (2019). «Analysis of multidrug-resistant bacteria in 3223 patients with hospital-acquired infections (HAI) from a tertiary general hospital in China». Bosnian Journal of Basic Medical Sciences. 19 (1): 86–93. doi:10.17305/bjbms.2018.3826. PMC 6387671. PMID 30579325.
- ^ U.S. Department of Defense-funded clinical trials, as presented at the Interscience Conference on Antimicrobial Agents and Chemotherapy in Washington, D.C., October 28, 2008
- ^ Weber, DJ; Rutala, WA (May 2013). «Self-disinfecting surfaces: review of current methodologies and future prospects». American Journal of Infection Control. 41 (5 Suppl): S31-5. doi:10.1016/j.ajic.2012.12.005. PMID 23622745.
- ^ Health Quality, Ontario (2018). «Portable Ultraviolet Light Surface-Disinfecting Devices for Prevention of Hospital-Acquired Infections: A Health Technology Assessment». Ontario Health Technology Assessment Series. 18 (1): 1–73. PMC 5824029. PMID 29487629.
- ^ Weber, DJ; Kanamori, H; Rutala, WA (August 2016). «‘No touch’ technologies for environmental decontamination: focus on ultraviolet devices and hydrogen peroxide systems». Current Opinion in Infectious Diseases. 29 (4): 424–31. doi:10.1097/QCO.0000000000000284. PMID 27257798. S2CID 23252531.
- ^ Weber, DJ; Rutala, WA; Anderson, DJ; Chen, LF; Sickbert-Bennett, EE; Boyce, JM (2 May 2016). «Effectiveness of ultraviolet devices and hydrogen peroxide systems for terminal room decontamination: Focus on clinical trials». American Journal of Infection Control. 44 (5 Suppl): e77–84. doi:10.1016/j.ajic.2015.11.015. PMC 7132689. PMID 27131140.
- ^ a b c d Pollack, Andrew (2010-02-26). «Rising Threat of Infections Unfazed by Antibiotics». The New York Times. Retrieved 2022-10-27.
- ^ Torres, Antoni; Ferrer, Miquel; Badia, Joan Ramón (2010). «Treatment Guidelines and Outcomes of Hospital‐Acquired and Ventilator‐Associated Pneumonia». Clinical Infectious Diseases. 51: S48–S53. doi:10.1086/653049. PMID 20597672.
- ^ «Hospital-Acquired Pneumonia (Nosocomial Pneumonia) and Ventilator-Associated Pneumonia». 17 October 2021.
- ^ Torres, Antoni; Ewig, Santiago; Lode, Harmut; Carlet, Jean; European HAP working group (2009). «Defining, treating and preventing hospital acquired pneumonia: European perspective». Intensive Care Medicine. 35 (1): 9–29. doi:10.1007/s00134-008-1336-9. PMID 18989656.
- ^ Ibrahim, Emad H.; Ward, Suzanne; Sherman, Glenda; Schaiff, Robyn; Fraser, Victoria J.; Kollef, Marin H. (2001). «Experience with a clinical guideline for the treatment of ventilator-associated pneumonia». Critical Care Medicine. 29 (6): 1109–1115. doi:10.1097/00003246-200106000-00003. PMID 11395584. S2CID 19045707.
- ^ «99,000 Americans die of Healthcare-Acquired Infections Every Year». 2013-07-26.
- ^ Dai, T; Vrahas, MS; Murray, CK; Hamblin, MR (February 2012). «Ultraviolet C irradiation: an alternative antimicrobial approach to localized infections?». Expert Review of Anti-infective Therapy. 10 (2): 185–95. doi:10.1586/eri.11.166. PMC 3292282. PMID 22339192.
- ^ Federaal Kenniscentrum voor de Gezondheidszorg (2009) Nosocomiale Infecties in België, deel II: Impact op Mortaliteit en Kosten. KCE-rapport 102A.
- ^ Quenon JL, Gottot S, Duneton P, Lariven S, Carlet J, Régnier B, Brücker G. Enquête nationale de prévalence des infections nosocomiales en France : Hôpital Propre (octobre 1990). BEH n° 39/1993.
- ^ Comité technique des infections nosocomiales (CTIN), Cellule infections nosocomiales, CClin Est, CClin Ouest, CClin Paris-Nord, CClin Sud-Est, CClin Sud-Ouest, avec la participation de 830 établissements de santé. Enquête nationale de prévalence des infections nosocomiales,1996 Archived 2009-08-11 at the Wayback Machine, BEH n° 36/1997, 2 sept. 1997, 4 pp.. Résumé Archived 2009-09-25 at the Wayback Machine.
- ^ Lepoutre A, Branger B, Garreau N, Boulétreau A, Ayzac L, Carbonne A, Maugat S, Gayet S, Hommel C, Parneix P, Tran B pour le Réseau d’alerte, d’investigation et de surveillance des infections nosocomiales (Raisin). Deuxième enquête nationale de prévalence des infections nosocomiales, France, 2001 Archived 2009-11-26 at the Wayback Machine, Surveillance nationale des maladies infectieuses, 2001–2003. Institut de veille sanitaire, sept. 2005, 11 pp. Résumé Archived 2009-08-08 at the Wayback Machine.
- ^ Institut de veille sanitaire Enquête nationale de prévalence des infections nosocomiales, France, juin 2006, Volume 1 – Méthodes, résultats, perspectives Archived 2009-10-07 at the Wayback Machine, mars 2009, ii + 81 pp. Volume 2 – Annexes Archived 2009-10-07 at the Wayback Machine, mars 2009, ii + 91 pp. Synthèse des résultats Archived 2009-10-07 at the Wayback Machine, Mars 2009, 11 pp.
- ^ Institut de veille sanitaire Enquête nationale de prévalence des infections nosocomiales, France, juin 2006, Vol. 1, Tableau 31, p. 24.
- ^ Réseau REA-Raisin « Surveillance des infections nosocomiales en réanimation adulte. France, résultats 2007 » Archived 2009-09-12 at the Wayback Machine, Institut de veille sanitaire, September 2009, ii + 60 pp.
- ^ Vasselle, Alain « Rapport sur la politique de lutte contre les infections nosocomiales », Office parlementaire d’évaluation des politiques de santé, juin 2006, 290 pp. (III.5. Quelle est l’estimation de la mortalité attribuable aux IN ?).
- ^ Lyytikainen O, Kanerva M, Agthe N, Mottonen T and the Finish Prevalence Survey Study Group. National Prevalence Survey on Nosocomial Infections in Finnish Acute Care Hospitals, 2005. 10th Epiet Scientific Seminar. Mahon, Menorca, Spain, 13–15 October 2005 [Poster].
- ^ L’Italie scandalisée par «l’hôpital de l’horreur», Éric Jozsef, Libération, January 17, 2007 (in French)
- ^ Lizioli, A; Privitera, G; Alliata, E; Antonietta Banfi, E.M; Boselli, L; Panceri, M.L; Perna, M.C; Porretta, A.D; Santini, M.G; Carreri, V (June 2003). «Prevalence of nosocomial infections in Italy: result from the Lombardy survey in 2000». Journal of Hospital Infection. 54 (2): 141–148. doi:10.1016/s0195-6701(03)00078-1. PMID 12818589.
- ^ «Facts sheet — Swiss Hand Hygiene Campaign» (in French). Archived from the original (.doc) on 2007-09-30.
- ^ Sax H, Pittet D (2005). «Résultats de l’enquête nationale de prévalence des infections nosocomiales de 2004 (snip04)». Swiss-NOSO (in French). 12 (1): 1–4. Archived from the original on November 11, 2007.
- ^ a b «English National Point Prevalence Survey on Healthcare-associated Infections and Antimicrobial Use, 2011» (PDF). Health Protection Agency. Archived from the original (PDF) on 8 December 2015. Retrieved 28 November 2015.
- ^ Bagot, Martin (24 October 2018). «Deadly hospital infections quadruple as staff struggle to fight superbugs». Daily Mirror. Retrieved 2 December 2018.
- ^ Klevens, R. Monina; Edwards, Jonathan R.; Richards, Chesley L.; Horan, Teresa C.; Gaynes, Robert P.; Pollock, Daniel A.; Cardo, Denise M. (March 2007). «Estimating Health Care-Associated Infections and Deaths in U.S. Hospitals, 2002». Public Health Reports. 122 (2): 160–166. doi:10.1177/003335490712200205. PMC 1820440. PMID 17357358.
- ^ Hospital-acquired infection (HAI) diagnostics market is forecasted to reach $4,386.6 million by 2023, growing at a CAGR of 7.6% during 2017–2023, P&S Intelligence
- ^ Kadar N (January 2019). «Rediscovering Ignaz Philipp Semmelweis (1818-1865)». Am. J. Obstet. Gynecol. 220 (1): 26–39. doi:10.1016/j.ajog.2018.11.1084. PMID 30444981. S2CID 53567650.
- ^ Pommerville, Jeffrey (2014). Fundamentals of microbiology. Burlington, MA: Jones & Bartlett Learning. ISBN 9781449647964.
- ^ Wyklicky, H.; Skopec, M. (Sep–Oct 1983). «Ignaz Philipp Semmelweis, the prophet of bacteriology». Infect Control. 4 (5): 367–70. doi:10.1017/S0195941700059762. PMID 6354955. S2CID 25830725. Archived from the original on 2008-04-04. Retrieved 2015-11-28.
External links[edit]
The dictionary definition of nosocomial at Wiktionary
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Внутрибольничные инфекции – различные инфекционные заболевания, заражение которыми произошло в условиях лечебного учреждения. В зависимости от степени распространения различают генерализованные (бактериемию, септицемию, септикопиемию, бактериальный шок) и локализованные формы внутрибольничных инфекций (с поражением кожи и подкожной клетчатки, дыхательной, сердечно-сосудистой, урогенитальной системы, костей и суставов, ЦНС и т. д.). Выявление возбудителей внутрибольничных инфекций проводится с помощью методов лабораторной диагностики (микроскопических, микробиологических, серологических, молекулярно-биологических). При лечении внутрибольничных инфекций используются антибиотики, антисептики, иммуностимуляторы, физиотерапия, экстракорпоральная гемокоррекция и т. д.
- Этиология и эпидемиология внутрибольничных инфекций
- Классификация внутрибольничных инфекций
- Диагностика внутрибольничных инфекций
- Лечение внутрибольничных инфекций
- Профилактика внутрибольничных инфекций
- Цены на лечение
Общие сведения
Внутрибольничные (госпитальные, нозокомиальные) инфекции — инфекционные заболевания различной этиологии, возникшие у пациента или медицинского сотрудника в связи с пребыванием в лечебно-профилактическом учреждении. Инфекция считается внутрибольничной, если она развилась не ранее 48 часов после поступления больного в стационар. Распространенность внутрибольничных инфекций (ВБИ) в медицинских учреждениях различного профиля составляет 5-12%. Наибольший удельный вес внутрибольничных инфекций приходится на акушерские и хирургические стационары (отделения реанимации, абдоминальной хирургии, травматологии, ожоговой травмы, урологии, гинекологии, отоларингологии, стоматологии, онкологии и др.). Внутрибольничные инфекции представляют собой большую медико-социальную проблему, поскольку утяжеляют течение основного заболевания, увеличивают длительность лечения в 1,5 раза, а количество летальных исходов — в 5 раз.
Внутрибольничные инфекции
Этиология и эпидемиология внутрибольничных инфекций
Основными возбудителями внутрибольничных инфекций (85% от общего числа) выступают условно-патогенные микроорганизмы: грамположительные кокки (эпидермальный и золотистый стафилококк, бета-гемолитический стрептококк, пневмококк, энтерококк) и грамотрицательные палочковидные бактерии (клебсиеллы, эшерихии, энтеробактер, протей, псевдомонады и др.). Кроме этого, в этиологии внутрибольничных инфекций велика удельная роль вирусных возбудителей простого герпеса, аденовирусной инфекции, гриппа, парагриппа, цитомегалии, вирусных гепатитов, респираторно-синцитиальной инфекции, а также риновирусов, ротавирусов, энтеровирусов и пр. Также внутрибольничные инфекции могут быть вызваны условно-патогенными и патогенными грибами (дрожжеподобными, плесневыми, лучистыми). Особенностью внутригоспитальных штаммов условно-патогенных микроорганизмов служит их высокая изменчивость, лекарственная резистентность и устойчивость к воздействию факторов среды (ультрафиолета, дезинфектантов и пр.).
Источниками внутрибольничных инфекций в большинстве случаев выступают пациенты или медицинский персонал, являющиеся бактерионосителями или больными стертыми и манифестными формами патологии. Как показывают исследования, роль третьих лиц (в частности, посетителей стационаров) в распространении ВБИ невелика. Передача различных форм госпитальной инфекции реализуется с помощью воздушно-капельного, фекально-орального, контактного, трансмиссивного механизма. Кроме этого, возможен парентеральный путь передачи внутрибольничной инфекции при проведении различных инвазивных медицинских манипуляций: забора крови, инъекций, вакцинации, инструментальных манипуляций, операций, ИВЛ, гемодиализа и пр. Таким образом в медучреждении возможно заразиться гепатитами В, С и D, гнойно-воспалительными заболеваниями, сифилисом, ВИЧ-инфекцией. Известны случаи внутрибольничных вспышек легионеллеза при приеме больными лечебного душа и вихревых ванн.
Факторами, участвующими в распространении внутрибольничной инфекции, могут выступать контаминированные предметы ухода и обстановки, медицинский инструментарий и аппаратура, растворы для инфузионной терапии, спецодежда и руки медперсонала, изделия медицинского назначения многоразового использования (зонды, катетеры, эндоскопы), питьевая вода, постельные принадлежности, шовный и перевязочный материал и мн. др.
Значимость тех или иных видов внутрибольничной инфекции во многом зависит от профиля лечебного учреждения. Так, в ожоговых отделениях преобладает синегнойная инфекция, которая в основном передается через предметы ухода и руки персонала, а главным источником внутрибольничной инфекции являются сами пациенты. В учреждениях родовспоможения основную проблему представляет стафилококковая инфекция, распространяемая медицинским персоналом-носителем золотистого стафилококка. В урологических отделениях доминирует инфекция, вызываемая грамотрицательной флорой: кишечной, синегнойной палочкой и др. В педиатрических стационарах особую значимость имеет проблема распространения детских инфекций – ветряной оспы, эпидемического паротита, краснухи, кори. Возникновению и распространению внутрибольничной инфекции способствуют нарушение санитарно-эпидемиологического режима ЛПУ (несоблюдение личной гигиены, асептики и антисептики, режима дезинфекции и стерилизации, несвоевременное выявление и изоляция лиц-источников инфекции и т. д.).
К группе риска, в наибольшей степени подверженной развитию внутрибольничной инфекции, относятся новорожденные (особенно недоношенные) и дети раннего возраста; пожилые и ослабленные пациенты; лица, страдающие хроническими заболеваниями (сахарным диабетом, болезнями крови, почечной недостаточностью), иммунодефицитом, онкопатологией. Восприимчивость человека к внутрибольничным инфекциям увеличивается при наличии у него открытых ран, полостных дренажей, внутрисосудистых и мочевых катетеров, трахеостомы и других инвазивных устройств. На частоту возникновения и тяжесть течения внутрибольничной инфекции влияет долгое нахождение пациента в стационаре, длительная антибиотикотерапия, иммуносупрессивная терапия.
Классификация внутрибольничных инфекций
По длительности течения внутрибольничные инфекции делятся на острые, подострые и хронические; по тяжести клинических проявлений – на легкие, среднетяжелые и тяжелые формы. В зависимости от степени распространенности инфекционного процесса различают генерализованные и локализованные формы внутрибольничной инфекции. Генерализованные инфекции представлены бактериемией, септицемией, бактериальным шоком. В свою очередь, среди локализованных форм выделяют:
- инфекции кожи, слизистых и подкожной клетчатки, в т. ч. послеоперационных, ожоговых, травматических ран. В частности, к их числу относятся омфалит, абсцессы и флегмоны, пиодермия, рожа, мастит, парапроктит, грибковые инфекции кожи и др.
- инфекции полости рта (стоматит) и ЛОР-органов (ангина, фарингит, ларингит, эпиглоттит, ринит, синусит, отит, мастоидит)
- инфекции бронхолегочной системы (бронхит, пневмония, плеврит, абсцесс легкого, гангрена легкого, эмпиема плевры, медиастинит)
- инфекции пищеварительной системы (гастрит, энтерит, колит, вирусные гепатиты)
- глазные инфекции (блефарит, конъюнктивит, кератит)
- инфекции урогенитального тракта (бактериурия, уретрит, цистит, пиелонефрит, эндометрит, аднексит)
- инфекции костно-суставной системы (бурсит, артрит, остеомиелит)
- инфекции сердца и сосудов (перикардит, миокардит, эндокардит, тромбофлебиты).
- инфекции ЦНС (абсцесс мозга, менингит, миелит и др.).
В структуре внутрибольничных инфекций на долю гнойно-септических заболеваний приходится 75-80%, кишечных инфекций — 8-12%, гемоконтактных инфекций — 6-7%. На прочие инфекционные заболевания (ротавирусные инфекции, дифтерию, туберкулез, микозы и др.) приходится около 5-6%.
Диагностика внутрибольничных инфекций
Критериями, позволяющими думать о развитии внутрибольничной инфекции, служат: возникновение клинических признаков заболевания не ранее чем через 48 часов после поступления в стационар; связь с проведением инвазивного вмешательства; установление источника инфекции и фактора передачи. Окончательное суждение о характере инфекционного процесса получают после идентификации штамма возбудителя с помощью лабораторных методов диагностики.
Для исключения или подтверждения бактериемии проводится бактериологический посев крови на стерильность, желательно не менее 2-3-х раз. При локализованных формах внутрибольничной инфекции микробиологическое выделение возбудителя может быть произведено из других биологических сред, в связи с чем выполняется посев мочи, кала, мокроты, отделяемого ран, материала из зева, мазка с конъюнктивы, из половых путей на микрофлору. Дополнительно к культуральному методу выявления возбудителей внутрибольничных инфекций используются микроскопия, серологические реакции (РСК, РА, ИФА, РИА), вирусологический, молекулярно-биологический (ПЦР) методы.
Лечение внутрибольничных инфекций
Сложности лечения внутрибольничной инфекции обусловлены ее развитием в ослабленном организме, на фоне основной патологии, а также резистентностью госпитальных штаммов к традиционной фармакотерапии. Больные с диагностированными инфекционными процессами подлежат изоляции; в отделении проводится тщательная текущая и заключительная дезинфекция. Выбор противомикробного препарата основывается на особенностях антибиотикограммы: при внутрибольничной инфекции, вызванной грамположительной флорой наиболее эффективен ванкомицин; грамотрицательными микроорганизмами – карбапенемы, цефалоспорины IV поколения, аминогликозиды. Возможно дополнительное применение специфических бактериофагов, иммуностимуляторов, интерферона, лейкоцитарной массы, витаминотерапии.
При необходимости проводится чрескожное облучение крови (ВЛОК, УФОК), экстракорпоральная гемокоррекция (гемосорбция, лимфосорбция). Симптоматическая терапия осуществляется с учетом клинической формы внутрибольничной инфекции с участием специалистов соответствующего профиля: хирургов, травматологов, пульмонологов, урологов, гинекологов и др.
Профилактика внутрибольничных инфекций
Основные меры профилактики внутрибольничных инфекций сводятся к соблюдению санитарно-гигиенических и противоэпидемических требований. В первую очередь, это касается режима дезинфекции помещений и предметов ухода, применения современных высокоэффективных антисептиков, проведения качественной предстерилизационной обработки и стерилизации инструментария, безукоснительного следования правилам асептики и антисептики.
Медицинский персонал должен соблюдать меры индивидуальной защиты при проведении инвазивных процедур: работать в резиновых перчатках, защитных очках и маске; осторожно обращаться с медицинским инструментарием. Большое значение в профилактике внутрибольничных инфекций имеет вакцинация медработников от гепатита В, краснухи, гриппа, дифтерии, столбняка и других инфекций. Все сотрудники ЛПУ подлежат регулярному плановому диспансерному обследованию, направленному на выявление носительства патогенов. Предупредить возникновение и распространение внутрибольничных инфекций позволит сокращение сроков госпитализации пациентов, рациональная антибиотикотерапия, обоснованность проведения инвазивных диагностических и лечебных процедур, эпидемиологический контроль в ЛПУ.
Вы можете поделиться своей историей болезни, что Вам помогло при лечении внутрибольничных инфекций.
Источники
- Настоящая статья подготовлена по материалам сайта: https://www.krasotaimedicina.ru/
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Все заболевания, имеющие микробную природу происхождения, возникшие после того как человек посетил медицинское учреждение, имеют название «внутрибольничная инфекция».
Пути передачи
Источниками ВБИ считаются:
- пациенты, проходящие стационарное лечение;
- медицинские работники;
- посетители стационарного отделения.
Выделяются следующие пути передачи:
- воздушно-капельный;
- контактный или бытовой;
- через пищу (алиментарный);
- через кровь (парентеральный).
Кроме этого, ВБИ может передаваться:
- через объекты, которые постоянно связанны с высоким уровнем влаги – это рукомойники, резервуары для воды и так далее;
- через медицинские инструменты, аппаратуру, больничную мебель, постельное белье.
Профилактика
Чтобы предотвратить риск заражения внутрибольничной инфекцией, необходимо предпринимать специальные профилактические меры. Они должны носить многосторонний характер.
Профилактика ВБИ подразумевает одновременные действия в нескольких направлениях. Такая профилактика включает в себя санитарно-гигиенические, а также противоэпидемические мероприятия.
Такие меры направлены на то, чтобы строго соблюдались условия санитарного содержания больницы, инструментов, а также аппаратуры, которая используется.
Необходимо четкое соблюдение гигиены среди пациентов, а также медицинского персонала.
Не реже чем один раз в месяц во всех палатах должна проводиться тщательная генеральная уборка. Отдельно убираются все кабинеты и другие функциональные помещения. Генеральная уборка подразумевает дезинфекцию всех поверхностей в помещении, начиная от пола и заканчивая потолком. Дезинфицируется все, вплоть до лампочек.
Два раза в сутки проводится влажный вид уборки помещений. Делается это также с использованием специальных средств и приспособлений. Важно отметить, что генеральная уборка в операционных блоках, родильных залах, перевязочных и манипуляционных должна проводиться намного чаще, минимум один раз в неделю.
Согласно санитарным нормам, помимо такого вида уборки все помещения должны дополнительно дезинфицироваться с помощью специальных бактерицидных ламп. Чтобы максимально избавится от болезнетворных бактерий и микроорганизмов в медицинских учреждениях, необходимо проводить ежедневную дезинфекцию. Только в таком случае удастся добиться максимально положительного результата в борьбе с ВБИ.
Внутрибольничные инфекции: профилактика, возбудители, пути передачи, распространение, источники
Среди инфекционных заболеваний особое место занимают внутрибольничные инфекции (ВБИ), которые называют также госпитальными или нозокомиальными.
.
Согласно определению ВОЗ внутрибольничными инфекциями являются инфекции микробного происхождения, возникающие в результате профессиональной медицинской деятельности. Внутри-больничные инфекции способны возникать как в амбулаторных, так и в стационарных учреждениях, где медицинские работники осуществляют свою профессиональную деятельность.
Внутрибольничные инфекции способны возникнуть путем экзогенного инфицирования или за счет активизации патогенной или условно-патогенной флоры самого человека, когда при неблагоприятном стечении обстоятельств (хирургическое лечение, частые инвазивные манипуляции, снижение защитных сил организма, широкая и длительная госпитализация лиц всех возрастов, циркуляция антибиотикоустойчивых/госпитальных штаммов микроорганизмов, нарушения санитарно-эпидемиологического режима и т.д.) эта флора активизируется и развивается инфекционный процесс.
Инфекции дыхательного тракта, детские инфекции и острые кишечные заболевания занимают весомое место в структуре ВБИ.
Чем больше в медицинском учреждении инвазивных процедур, тем выше риск госпитальной инфекции.Важным компонентом работы с пациентами, особенно с инфекционными больными, является предупреждение передачи инфекции экзогенным путем, что является главной задачей санитарно-эпидемиологического надзора.
Программа инфекционного контроля включает проведение превентивных плановых санитарно-противоэпидемических мероприятий с учетом особенностей, связанных с профилем патологии, и контроль за их выполнением, а также мероприятий в связи с выявленными случаями ВБИ. Все случаи возникновения ВБИ должны регистрироваться. По каждому случаю ВБИ проводится эпидемиологическое расследование и разработка мероприятий для снижения уровня ВБИ и их профилактики.
Программа инфекционного контроля проводится в жизнь госпитальным эпидемиологом, должность которого введена в 1993 г.
В настоящее время в лечебно-профилактических учреждениях начали создавать комиссии по профилактике внутрибольничных инфекций, которые организуют санитарно-эпидемиологические мероприятия и выполняют программу инфекционного контроля.
В штате такой комиссии микробиолог-клиницист, вирусолог, старшие сестры отделений высокого риска ВБИ, главная медсестра учреждения.
Экзогенное инфицирование может происходить контактным, алиментарным и аэрогенным путем, а также при гемотрансфузиях.
Контактный путь передачи инфекции является наиболее частым при экзогенном механизме развития ВБИ. Источником инфекции в этом случае могут быть:
- руки персонала, пациентов;
- оборудование (зонды, аппаратура для ИВЛ, мочевые катетеры, гастроскопы и т.д.);
- спецодежда персонала;
- инструментарий и перевязочный материал;
- предметы ухода за пациентом (белье, вода для умывания и т.п.);
- поверхности в помещениях;
- насекомые (летающие и ползающие).
Профилактика контактного пути передачи ВБИ реализуется мероприятиями по обеззараживанию всего, с чем может соприкоснуться пациент, т.е. дезинфекцией. Мытье рук медицинским персоналом является наиболее важным мероприятием инфекционного контроля.
Алиментарный путь передачи ВБИ реализуется по трем направлениям: при использовании продуктов питания (пища), с жидкостями для питья, при приеме внутрь лекарственных препаратов.
Службы лечебно-профилактического учреждения следят за питанием больных.
Ими предписано информировать пациентов, какие продукты не принимаются и не используются в лечебных учреждениях, как их хранить, установлено, как обрабатывать помещения и посуду буфетных отделений, столовую посуду, как должны быть организованы отделения, и многое другое, касающееся всех подразделений, имеющих отношение к организации питания пациентов.
Трансфузионный путь передачи ВБИ. Безопасность препаратов, которые могут быть введены внутривенно, обеспечивают фармацевтические компании — производители различных препаратов медицинского назначения (лекарственные растворы, диагностические препараты, растворы для парентерального питания).
Безопасность для пациентов крови донорской и препаратов на основе донорской крови обеспечивается выполнением приказов, регламентирующих обследование доноров и заготовку крови и препаратов.
Аэрогенный механизм передачи ВБИ реализуется в виде:
- «оседания» госпитальной флоры самого учреждения на поврежденную поверхность кожных покровов и слизистых оболочек, реализуя аэрогенно-контактный механизм, или вдыхания этой госпитальной флоры с развитием воспалительного процесса на всем протяжении дыхательных путей,
- заноса воздушно-капельных инфекций в отделение.
Для борьбы с ВБИ, возникающими вследствие аэрогенного пути передачи, применяется изолирующий уход, который предполагает изоляцию очага инфекционного заболевания в целях предупреждения развития инфекции или изоляцию пациентов, для которых опасна вторичная инфекция, а также создание в стационарах «комплексов чистых зон».
«Чистая зона» — помещение со стерильной средой, используется для лечения пациентов с иммунодефицитными состояниями.
Источники вби
ЛЕКЦИЯ № 4.
Внутрибольничные инфекции.
Тема: Основы
профилактики внутрибольничных инфекций.
План лекции:
-
Понятие внутрибольничных инфекций, классификация.
-
Характеристика источников ВБИ.
-
Механизмы передачи больничных инфекций.
-
Причины распространения ВБИ в лечебных учреждениях.
-
Основы направления профилактик ВБИ.
Проблема
внутрибольничных инфекций (ВБИ) возникла
с появлением первых больниц. В последующие
годы она приобрела исключительно большое
значение для всех стран мира.
ВБИ возникают у
5-7% больных, поступающих в лечебные
учреждения. Из 100000 больных, зараженных
ВБИ, погибает 25%. Больничные инфекции
увеличивают сроки пребывания больных
в стационарах.
Внутрибольничные
инфекции
– это любое клинически распознаваемое
заболевание микробной этиологии, которое
поражает больного в результате его
пребывания в лечебно-профилактическом
учреждении (больнице) или обращения за
лечебной помощью (вне зависимости от
появления симптомов заболевания во
время пребывания в больнице или после
нее), или сотрудника больницы вследствие
его работы в данном учреждении.
Таким образом, в
понятие ВБИ входят:
- заболевания пациентов стационаров;
- заболевания пациентов, получающих помощь в поликлиниках и на дому;
- случаи внутрибольничного заражения персонала.
По этиологии
различают 5 групп ВБИ:
-
бактериальные;
-
вирусные;
-
микозы;
-
инфекции, вызываемые простейшими;
-
заболевания, вызываемые клещами.
На современном
этапе основными возбудителями ВБИ в
стационарах являются:
-
стафилококки;
-
грам-отрицательные условно-патогенные энтеробактерии;
-
респираторные вирусы.
-
В большинстве
случаев причинным фактором ВБИ, особенно
гнойно-септических инфекций, служат
условно-патогенные микроорганизмы,
которые способны формировать «госпитальные
штаммы». - Под «госпитальным
штаммом» понимают разновидность
микроорганизмов, приспособленных к
обитанию в больничных условиях. - Отличительными
свойствами госпитальных штаммов
являются:
-
высокая резистентность (нечувствительность) к антибиотикам;
-
устойчивость к антисептикам и дезинфектантам;
-
повышенная вирулентность1 для человека.
-
В стационарах
наиболее часто встречаются следующие
группы внутрибольничных инфекций: -
1 группа – диарейные
(кишечные); -
2 группа –
воздушно-капельные (корь, грипп, краснуха); -
3 группа –
гнойно-септические. - На первую и вторую
группу ВБИ приходится лишь 15% всех
заболеваний, на третью – 85%. - В эпидемиологии
выделяют 3 звена эпидемиологического
процесса:
-
источники инфекции;
-
механизм передачи;
-
восприимчивый организм.
Источником
ВБИ в лечебных учреждениях являются
пациенты,
медицинский персонал, значительно
реже лица,
осуществляющие уход
за больными и посетители.
Все
они могут быть носителями
инфекции, а также болеть
(как правило, в легкой или скрытой форме),
находиться в стадии выздоровления или
в инкубационном периоде.
Источником
инфекции могут быть и животные
(грызуны, кошки, собаки).
Пациенты являются
основным источником больничных инфекций.
Особенно велика роль этого источника
в урологических, ожоговых и хирургических
отделениях.
- Медицинский
персонал, как
правило, выступает в качестве источника
ВБИ при инфекциях вызванных золотистым
стафилококком, (гнойно-септические
ВБИ), иногда – при сальмонеллезах
(кишечные), иногда – при инфекциях,
вызванных условно-патогенной флорой. - При этом медицинский
персонал выделяет – «госпитальные»
штаммы возбудителей. - Роль посетителей
и лиц, занятых уходом за больными в
распространении ВБИ весьма ограничена.
Механизмы передачи вби
При ВБИ механизмы
передачи можно разделить на две группы:
естественные
и артифициальные
(искусственно создаваемые).
Естественные
механизмы
передачи ВБИ делят на 3 группы:
- фекально-оральный (кишечные инфекции);
- воздушно-капельный (инфекции дыхательных путей);
- трансмиссивный (через кровососущих насекомых, кровяные инфекции);
- контактно-бытовой (инфекции наружных покровов).
-
вертикальный (от матери к плоду при внутриутробном развитии);
-
во время акта родов (от матери).
Артифициальные
механизмы
передачи возбудителей ВБИ – это
механизмы, создаваемые в условиях
лечебных учреждений:
-
инфекционные;
-
трансфузионные (при переливании крови);
-
ассоциированные (связанные) с операциями;
-
ассоциированные с лечебными процедурами:
- интубация;
- катетеризация.
-
ингалляционный;
-
ассоциированный с диагностическими процедурами:
- взятие крови;
- зондирование желудка, кишечника;
- скопии (бронхоскопия, трахеоскопия, гастроскопия и др.);
- пункции (спинно-мозговые, лимфатических узлов, органов и тканей);
- мануальное обследование (с помощью рук врача).
-
Третьим звеном
эпидемического процесса является
восприимчивый
организм. -
Высокая восприимчивость
организма пациентов больниц к ВБИ
обусловлена следующими особенностями: -
а) среди пациентов
лечебных учреждений преобладают дети
и пожилые люди; -
б) ослабление
организма пациентов основным заболеванием; -
в) снижение
иммунитета пациентов за счет использования
отдельных препаратов и процедур.
Факторы, способствующие распространению вби в лечебных учреждениях
-
Формирование «госпитальных» штаммов микроорганизмов отличающихся лекарственной устойчивостью.
-
Наличие большого количества источников ВБИ в виде пациентов и персонала.
-
Наличие условий для реализации естественных механизмов передачи ВБИ:
- большая плотность населения (пациентов) в лечебных учреждениях;
- тесный контакт медицинского персонала с больными.
-
Формирование мощного искусственного механизма передачи ВБИ.
-
Повышенная восприимчивость пациентов ВБИ, имеющая несколько причин:
- преобладание среди пациентов людей детского и пожилого возраста;
- применение препаратов снижающих иммунитет;
- повреждение целостности кожи и слизистых оболочек при лечебных и диагностических процедурах.
Автор: врач – клинический фармаколог Трубачева Е.С.
Заканчивается 2019 год, который для автора стал знаменательным по очень многим причинам, одна из которых в том, что благодаря интересу компании «Видаль» удалось начать воплощать давнюю идею написания «Азбуки антибиотиков», основной целью которой было не только знакомство коллег с азами антибактериальной терапии, но и с такой важнейшей темой – как для нас, врачей, так и для наших пациентов – внутрибольничным инфицированием, точнее, методами его профилактики. Теперь мы, имея некоторый задел знаний, поговорим о внутрибольничных инфекциях (ВБИ) более подробно.
Еще не так давно, каких-то лет 20 назад, считалось, что стоит пациенту попасть в стационар, как он тут же обсеменяется всей живущей внутри микрофлорой. В принципе, так и было в стационарах, ведущих плановый прием, так как стоило переступить порог отделения, как в пациента тут же начинали колоться антибиотики из арсенала «что дали в аптеке» в качестве предоперационной подготовки. Естественно, первыми жертвами такого подхода становились микробы, которые не обладали никакой антибактериальной устойчивостью и просто мирно жили на человеке, ничем ему не мешая, а на их место закономерно приходило внутрибольничное зверье, пользуясь полученным за счет нерадивых нас селективным преимуществом. Как раз в первую неделю госпитализации весь процесс и укладывался. Потом пациент ложился на операционный стол и не менее закономерно развивалась минимум внутрибольничная раневая инфекция. Врачи убеждались в правоте своего подхода, следующие пациенты получали уже не один, а несколько антибиотиков на входе, их атаковало еще более злющее зверье, которое в результате настолько порочного подхода отращивало все новые и новые навыки антибиотикорезистентности, и в итоге порочный круг замкнулся. Но необходимо добавить, что внутри этого круга было еще и достаточное количество нас – врачей, сестер, санитарок, так или иначе соприкасающихся с пациентом, скорее, часто, чем редко, без перчаток, а если и в них, то с немытыми нормально руками, с масками только на полости рта, не закрывая нос и награждая несчастного все новыми и новыми штаммами уже собственной микрофлоры. И если первый путь заражения пациентов, связанный с превентивным использованием антибиотиков, так или иначе удалось преодолеть (но до сих пор автор регулярно натыкается на попытки оправдания той, 20-летней давности, о том, что пациент самопроизвольно внутрибольничной флорой обрастает), то изжить «грязные» руки пока не удалось нигде, и я до сих пор ощущаю себя Земмельвейсом, или Дон Кихотом, борющимся с ветряными мельницами.
Давайте посмотрим на проблему более конкретно, тем более, что от нее напрямую зависит жизнь самых тяжелых и сложных пациентов. Предупредим сразу, теоретическую часть вопроса вы можете прочитать в огромном количестве публикаций научного и научно-популярного характера. Мы поговорим как врачи-практики, что и откуда берется, и как от этого избавиться.
Зачем нам это надо? Про «ятрогенные преступления» помним? Так вот, ВБИ – это чистейшая и абсолютная ятрогения, и что самое неприятное, в нее уже умеют в ФСБ (смотрите дело хабаровского кардиоцентра), а депутаты с сенаторами додумались до «второго закона Яровой», ужесточающего ответственность за внутрибольничное инфицирование пока только гепатитами и ВИЧ, но кто сказал, что следующим шагом не станет весь остальной перечень возбудителей? А санкции там не шуточные – от 7 до 12 строгого режима. В общем, шутки кончились, и в глазах общественности врача окончательно приравнивают к убийце. Настоящих же специалистов, а тем более экспертов по этой тематике, боимся, исчезающе мало. Автор несколько лет назад опротестовывал экспертизу, в которой хирургов обвиняли в смерти пациента на основании, внимание, обнаружения эпидермального стафилококка в ране! И чего этот стафилококк, мирно обитающий, что на коже, что в ранах, там забыл, правда? И что в голове было у эксперта, когда он писал эту чушь, помноженную на то, что если бы был введен ципрофлоксацин (где ципро, а где эпидермальный стаф, о котором мы обязательно поговорим отдельно), то смерть была бы предотвратимой. И писал это не абы кто, а главный специалист по хирургии. И вот такое чудо в перьях может оказаться вашим могильщиком. Ах да, ту экспертизу мы отбили.
Итак, первое и основное, что уже неоднократно сказано, но что необходимо запомнить, – МИКРОБЫ, ВЫЗЫВАЮЩИЕ ВБИ, НЕ УМЕЮТ НИ ЛЕТАТЬ, НИ ХОДИТЬ, НИ ПОЛЗАТЬ, и оказываются в организме пациента только с нашей медицинской помощью, потому эти состоянии и названы – инфекции, связанные с медицинским вмешательством. А под вмешательством может рассматриваться вообще любое действие с пациентом – перевязка, установка зонда или дренажа, отсасывание мокроты, эндоскопические манипуляции и т.д. и т.п.
Кто более других подвержен рискам ВБИ?
- Соматически тяжелые пациенты
- Пациенты с сопутствующими заболеваниями
- Дети и пожилые пациенты
- Все, вне зависимости от возраста, ранее получавшие антибиотики или находившиеся по любому поводу в ОРИТ, ПИТ или просто в стационаре (если это только не ваше отделение, и вы точно знаете, что с ним происходило)
- Пациенты, переведенные из других ЛПУ (на них обычно просто лютый зоопарк всего, и они опасны не только сами для себя, но еще и для всех остальных пациентов не только отделения, но и вообще больницы)
Какие ЛПУ и отделения наиболее рискованны по ВБИ?
- Стационары, выстроенные в виде единого здания, либо имеющие общие переходы. В больницах, выстроенных в виде отдельных, несообщающихся корпусов, поддерживать cанэпидрежим и режим нераспространения ВБИ несопоставимо проще.
- Стационары, в которых гнойные отделения находятся в одном здании с чистыми, – тут можно убиться вусмерть, но синегнойку с ацинеткой вывести будет невозможно в принципе, если только не обстраивать классический санпропускник на входе и выходе из гнойных в чистые.
- Стационары, чьи отделения не имеют палат-изоляторов. Можно опять же расшибиться в лепешку, но если вы не можете изолировать пациента с устойчивой микрофлорой от остальных, эти самые все остальные и полягут.
- Самыми опасными же являются отделения реанимации и ПИТЫ, ввиду высочайшего процента использования антибиотиков, кроме того, онкологические и онкогематологические отделения, гнойные же отделения скорее опасны для чистых, чем сами для себя.
- Вообще, любой стационар с отсутствующим микробиологическим мониторингом, без собственной бак. лаборатории и службы эпиднадзора в виде эпидемиологов и натасканного на тему клинического фармаколога, – это не самое лучшее место для того, чтобы там оказаться в качестве пациента, тем более врачу (вы же помните, что в каждом из нас свой зоопарк?)
Что делать?
Отвечая на этот вопрос, автор мог бы написать пособие толщиной в «Войну и мир», но постарается уместиться в отведенный ему формат.
1. Мыть руки. Нет, даже вот так – МЫТЬ РУКИ – и делать это правильно. Методику мытья вы все прекрасно знаете. Если не знаете – берите СанПин и внимательно его изучайте по всем пунктам:
12.4. Гигиеническая обработка рук
12.4.1. Гигиеническую обработку рук следует проводить в следующих случаях:
- перед непосредственным контактом с пациентом;
- после контакта с неповрежденной кожей пациента (например, при измерении пульса или артериального давления);
- после контакта с секретами или экскретами организма, слизистыми оболочками, повязками;
- перед выполнением различных манипуляций по уходу за пациентом;
- после контакта с медицинским оборудованием и другими объектами, находящимися в непосредственной близости от пациента;
- после лечения пациентов с гнойными воспалительными процессами, после каждого контакта с загрязненными поверхностями и оборудованием.
12.4.2. Гигиеническая обработка рук проводится двумя способами:
- гигиеническое мытье рук мылом и водой для удаления загрязнений и снижения количества микроорганизмов;
- обработка рук кожным антисептиком для снижения количества микроорганизмов до безопасного уровня.
12.4.3. Для мытья рук применяют жидкое мыло с помощью дозатора (диспенсера). Вытирают руки индивидуальным полотенцем (салфеткой), предпочтительно одноразовым.
12.4.4. Гигиеническую обработку рук спиртосодержащим или другим разрешенным к применению антисептиком (без их предварительного мытья) проводят путем втирания его в кожу кистей рук в количестве, рекомендуемом инструкцией по применению, обращая особое внимание на обработку кончиков пальцев, кожи вокруг ногтей, между пальцами. Непременным условием эффективного обеззараживания рук является поддержание их во влажном состоянии в течение рекомендуемого времени обработки.
12.4.5. При использовании дозатора новую порцию антисептика (или мыла) наливают в дозатор после его дезинфекции, промывания водой и высушивания. Предпочтение следует отдавать локтевым дозаторам и дозаторам на фотоэлементах.
12.4.6. Кожные антисептики для обработки рук должны быть легко доступны на всех этапах лечебно-диагностического процесса. В подразделениях с высокой интенсивностью ухода за пациентами и с высокой нагрузкой на персонал (отделения реанимации и интенсивной терапии и т.п.) дозаторы с кожными антисептиками для обработки рук должны размещаться в удобных для применения персоналом местах (у входа в палату, у постели больного и др.). Следует также предусматривать возможность обеспечения медицинских работников индивидуальными емкостями (флаконами) небольших объемов (до 200 мл) с кожным антисептиком.
12.4.7. Использование перчаток.
12.4.7.1. Перчатки необходимо надевать во всех случаях, когда возможен контакт с кровью или другими биологическими субстратами, потенциально или явно контаминированными микроорганизмами, слизистыми оболочками, поврежденной кожей.
12.4.7.2. Не допускается использование одной и той же пары перчаток при контакте (для ухода) с двумя и более пациентами, при переходе от одного пациента к другому или от контаминированного микроорганизмами участка тела к чистому. После снятия перчаток проводят гигиеническую обработку рук.
12.4.7.3. При загрязнении перчаток выделениями, кровью и т.п. во избежание загрязнения рук в процессе их снятия следует тампоном (салфеткой), смоченным раствором дезинфицирующего средства (или антисептика), убрать видимые загрязнения. Снять перчатки, погрузить их в раствор средства, затем утилизировать. Руки обработать антисептиком.
Перевожу с бюрократического на русский — перед каждым контактом с пациентом, а также при контакте с разными частями тела пациента (там разные микробы живут), моем руки и меняем перчатки. Нет, я не знаю, как нагнуть администрацию, чтобы перчатки были в товарных количествах, но если держать в голове второй «закон Яровой», может, и получится найти слова, чтобы заваливать служебками эпидемиолога (тогда он виноват будет, как и получилось в случае с Хабаровском).
Руки под перчатки надо мыть! Ибо они имеют свойство рваться, причем в самый неподходящий момент. Потом будете следователю долго объяснять, как вы торопились и вообще никогда такого не было, а тут… Лучше все-таки до автоматизма отработать навык, чем потом расхлебывать его отсутствие.
2. Правильно вести документацию. Автор в курсе, как не любят, а где-то даже ненавидят бумажную работу хирурги. Что «лучше семь операций, чем одна история», но судить и сажать будут за историю, а не за операцию. И отбивать вас легче, когда документы в порядке. И одной из обязательных записей должна стать «перед началом манипуляции, перевязки, исследования (нужное подчеркнуть) руки обработаны так-то, надеты перчатки размера такого-то». Да, автор в курсе, что похож на Земмельвейса, но тот-то в итоге оказался прав, а опыт автора показывает, что при таком подходе и дотошности и от ВБИ вполне реально избавиться, и докторов от всяких «экспертов» отбивать.
3. Регулярно терзать эпидемиологическую службу на предмет результатов мониторингов или служебок по расходникам и т. п. Не все же им вас терзать. Приставать лучше всего письменно, чтобы следы этих приставаний оставались, они могут очень сильно пригодиться в будущем.
4. Ну и учиться, учиться и еще раз учиться. Или менять специальность, так как к огромному сожалению все, что связано с медициной, особенно критических состояний, стало слишком опасным.
Но несмотря на такой невеселый разговор, автор и редакция Видаль от всей души хотела бы поздравить Вас с наступающим 2020 годом и выражает надежду, что наш цикл стал полезной частичкой уходящего 2019 года.
Врачи желают своим пациентам только лучшего, и больница — это то место, которое помогает нам поддерживать свое здоровье. Но что, если мы скажем, что более 25% пациентов стационара заражаются инфекциями прямо в больнице?
Внутрибольничные инфекции (ВБИ) связаны с высокой заболеваемостью, смертностью и увеличением стоимости лечения пациента. Это инфекции, которых не было во время госпитализации, но они развились в процессе получения медицинской помощи.
Инфекция может возникнуть в любом заведении, оказывающем медицинскую помощь: в поликлинике и хирургическом центре, амбулаторной клинике и учреждении длительного ухода — доме престарелых, центре реабилитации.
Чаще всего с внутрибольничными инфекциями сталкиваются в отделениях интенсивной терапии — там развивается до 20% всех ВБИ. Риск заражения выше:
- у младенцев;
- людей старшего возраста;
- пациентов с ослабленной иммунной системой;
- людей, у которых есть инвазивные медицинские устройства, такие как внутривенные катетеры, мочевые дренажные катетеры, эндотрахеальные и интубационные трубки (для вспомогательного дыхания на аппарате ИВЛ);
- тех, кто долго находится в больнице;
- пациентов с коморбидными состояниями (когда одновременно есть сразу несколько заболеваний и одно усиливает другое) — сахарный диабет, хронические заболевания легких, почечная недостаточность и т. д.
Пациенты, заразившиеся инфекцией в результате операции, проводят в больнице в среднем дополнительно 6,5 дня. Шансы на повторную госпитализацию у них возрастают в пять раз, а риск летального исхода увеличивается в два раза.
Хотя внутрибольничные инфекции могут быть вызваны различными бактериями, вирусами и грибками, чаще всего причина в бактерии Staphylococcus aureus (золотистый стафилококк). Другие распространенные патогены — Escherichia coli (кишечная палочка), Enterococcus (энтерококки) и Candida (грибок кандида).
ВБИ передаются несколькими путями.
Мочевые катетеры
Мочевой катетер представляет собой трубку, вставленную в мочевой пузырь для сбора мочи. Загрязненные мочевые катетеры — главная причина распространения инфекций мочевыводящих путей в больнице, самых распространенных ВБИ.
Хирургические процедуры
Инфекции в области хирургического вмешательства вызываются патогенами, уже присутствующими на коже пациента или персонала, который находится в операционной.
Продолжительность операции, хирургическая техника и стерильность помещения и инструментов могут повлиять на риск возникновения и распространения инфекции.
Центральные венозные катетеры
Инфекции кровотока могут быть вызваны возбудителями, которые проникают через кожу во время введения катетеров.
Такие инфекции — самые опасные, они чаще всего приводят к летальному исходу.
Воздушно-капельный путь
Самая распространенная воздушно-капельная ВБИ — вентилятор-ассоциированная пневмония. Это респираторная инфекция, которую часто вызывают бактерии с множественной лекарственной устойчивостью. Пневмония сопровождается лихорадкой, повышенным выделение слизи и увеличением количества лейкоцитов в крови.
В больнице слишком много путей, по которым может распространиться инфекция: из внешней среды, от инфицированного пациента, персонала, который может быть заражен. Иногда микроорганизм, вызывающий инфекцию, находится в микробиоте кожи пациента — тогда он считается условно-патогенным. Бывают случаи, когда источник ВБИ невозможно определить.
В результате циркуляции в отделении микроорганизмы мутируют, что позволяет им выживать в условиях стационара. Именно так образуются госпитальные штаммы — опасные микроорганизмы, устойчивые к большинству лекарств.
Их главная опасность заключается в том, что они становятся невосприимчивыми к одному или нескольким антибиотикам.
Госпитальные штаммы очень разнообразны, и в каждой больнице или отделении может образоваться свой.
Общие меры, которые сотрудники больницы используют для предотвращения внутрибольничных инфекций, включают следующее:
- частое мытье рук;
- регулярное использование дезинфицирующих средств для рук на спиртовой основе;
- применение защитного снаряжения — перчаток, халатов и масок при выполнении процедур;
- соблюдение мер предосторожности при изоляции пациентов;
- надлежащее обращение с отходами и правильная их утилизация.
Чтобы предотвратить развитие резистентных бактерий, во многих больницах также действуют программы, ограничивающие использование антибиотиков.
Какие вопросы можно задать врачу, чтобы защититься от ВБИ:
- «Не могли бы вы, пожалуйста, еще раз вымыть руки передо мной?». Если вы не видите, как ваши медсестры и врачи моют свои руки, попросите их сделать это. Также не забывайте мыть свои руки и напоминайте об этом посетителям.
- «Нужен ли мне по-прежнему центральный венозный катетер / мочевой катетер?». Слишком долгое использование катетера увеличивает вероятность заражения; «Не могли бы вы рассказать мне о безопасных методах инъекций?». Этот вопрос поможет проконтролировать, соблюдается ли техника безопасности, когда вам делают уколы. Например, врачи и медсестры никогда не должны использовать один и тот же шприц более чем у одного пациента, даже если игла заменена.
- «Как долго я буду принимать этот антибиотик?». Помните, что антибиотики не действуют против вирусов, подобных тем, которые вызывают обычную простуду;
- «У меня диарея. Это может быть инфекция?». Сообщите своему врачу, если у вас диарея, особенно если вы также принимаете антибиотики.