Возбудители
госпитальной инфекции. Эпидемиологические
проявления госпитальной инфекции (в т.
ч. госпитальных гнойно-септических
инфекций в стационарах различного
профиля). Этиологическая структура ВБИ.
Понятие «госпитальный штамм».
Внутрибольничные
инфекции
(ВБИ, синонимы: госпитальные, нозокомиальные,
больничные инфекции) представляют одну
из наиболее актуальных проблем
здравоохранения во всех странах мира.
Наносимый ими социально-экономический
ущерб огромен и трудноопределим.
Парадоксально, но несмотря на колоссальные
достижения в области лечебно-диагностических
технологий, в частности технологий
стационарного лечения, проблема ВБИ
остаётся одной из наиболее острых и
приобретает всё большую медицинскую и
социальную значимость. Согласно данным
отечественных и зарубежных исследователей,
ВБИ развиваются у 5—20% госпитализированных
больных.
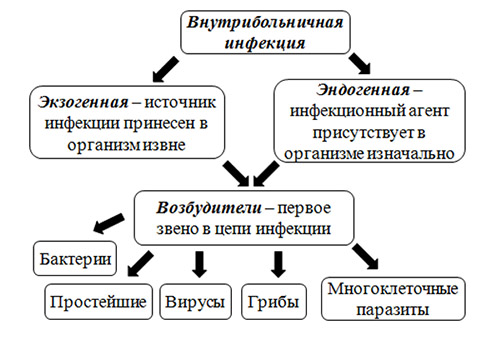
Обширный
перечень возбудителей ВБИ включает
представителей различных таксономических
групп, относящихся к бактериям, вирусам,
простейшим и грибам. По этиологии ВБИ
разделяют на две группы:
• вызванные
облигатными патогенными микроорганизмами;
• вызванные
условно-патогенными микроорганизмами,
в том числе входящими в состав нормальной
микрофлоры человека.
К
первой группе относят «традиционные»
(классические) инфекционные заболевания
— детские инфекции (корь, дифтерию,
скарлатину, краснуху, паротит и др.),
кишечные инфекции (сальмонеллёз,
шигеллёзы и др.), ВГВ, ВГС и многие другие
болезни. Их возникновение в стационаре
может значительно осложнить течение
основного заболевания, особенно в
условиях детских больниц и родовспомогательных
учреждений. На долю этих заболеваний
приходится примерно 15% ВБИ. Возникновение
и распространение в условиях стационаров
инфекционных заболеваний, вызываемых
облигатными патогенными микроорганизмами,
как правило, связано с заносом возбудителя
в лечебные учреждения или заражением
персонала при работе с инфекционным
материалом. Занос Общая эпидемиология.
В
последние десятилетия возросло значение
бактерий рода Nocardia, различных представителей
семейства Enterobacteriaceae, грибов рода Candida,
криптококков, пневмоцист, криптоспоридий
и других простейших. Этиологическая
значимость разных возбудителей меняется
со временем. Так, в последние годы
отмечена тенденция к возрастанию роли
грамотрицательных и снижению роли
грамположительных бактерий в госпитальной
патологии. Однако в конкретных стационарах
определённого профиля спектр основных
возбудителей ВБИ относительно стабилен.
Вид микроорганизмов зависит от
определённых факторов: локализации
патологического процесса, профиля
стационара, состава больных.
• Так,
патология мочевыводящих путей обусловлена
почти исключительно грамотрицательными
микроорганизмами.
• При
инфекциях нижних дыхательных путей
доминируют синегнойная палочка и
пневмококки при иммунодефицитах
(ВИЧ-инфекция), также пневмоцисты.
• В
акушерских стационарах преобладает
грамположительная микрофлора
(стафилококки, стрептококки), в
психиатрических — кишечные инфекции
(брюшной тиф, шигеллёзы), в
гастроэнтерологических — хеликобактериоз,
в хирургических отделениях —
грамотрицательная микрофлора и
стафилококки и т.д.
Особенности эпидемического процесса гнойно-септической инфекции:
• перманентное
течение с вовлечением в него большого
количества больных и медицинского
персонала;
• эпидемический
процесс протекает в замкнутом (больничном)
пространстве;
• существует
вероятность формирования в одном очаге
нескольких механизмов передачи:
аэрозольного, контактно-бытового и др.;
• наряду
с больными и носителями резервуаром
инфекции служит и внешняя среда.
ВБИ
обычно вызывают госпитальные штаммы
микроорганизмов, обладающие множественной
лекарственной устойчивостью, более
высокой вирулентностью и резистентностью
по отношению к неблагоприятным факторам
окружающей среды — высушиванию, действию
ультрафиолетовых лучей и дезинфицирующих
препаратов. Следует помнить, что в
растворах некоторых дезинфектантов
госпитальные штаммы возбудителей могут
не только сохраняться, но и размножаться.
Многие возбудители, например клебсиеллы,
псевдомонады и легионеллы, могут
размножаться во влажной среде — воде
кондиционеров, ингаляторах, душевых
установках, жидких лекарственных формах,
на поверхности умывальных раковин, во
влажном уборочном инвентаре и др. Одна
из причин неполного учёта ВБИ в России
— отсутствие в нормативных документах
чётких определений и критериев выявления
этих инфекций.
Эпидемиологические проявления госпитальной инфекции
Эпидемиологические
особенности ВБИ последних лет.
•
Множественность
источников инфекции, доминирование
больных как источников инфекции в
отделениях гнойной хирургии, ожоговых,
урологических, туберкулёзных стационарах.
Вместе с тем важная роль принадлежит
носителям среди медицинского персонала
при острых кишечных инфекциях в разных
типах стационаров, в том числе в
родовспомогательных учреждениях, при
инфекциях верхних дыхательных путей и
пневмоцистозе — в детских отделениях
и отделениях ВИЧ-инфекции.
• Доминирование
экзогенных заражений в большинстве ЛПУ
при важной роли эндогенного возникновения
инфекции в онкологических стационарах,
отделениях для ВИЧ-инфицированных и
некоторых других типах стационаров.
• Действие
в ЛПУ не только естественных механизмов
передачи, но и мощного артифициального,
искусственно созданного медициной
механизма, связанного большей частью
с инвазивными и лечебными процедурами.
• Наличие
контингентов и факторов риска, характерных
для разных типов стационаров.
Источники
возбудителей ВБИ
антропонозной природы и некоторых
зооантропонозов представлены больными,
медицинским персоналом, лицами,
привлекаемыми к уходу за пациентами
(матерями и другими родственниками) и
посетителями. Роль больных в распространении
ВБИ неоднозначна при различных
нозологических формах и зависит от типа
стационара. Больные становятся основными
источниками инфекции при заболеваниях,
вызываемых эпидермальным стафилококком
или обусловленных грамотрицательными
бактериями. С пациентами связаны заносы
и дальнейшее распространение «классических»
инфекций, вызываемых безусловно-патогенными
микроорганизмами. Больные играют
немаловажную роль в распространении
ВБИ в отделениях на этапе выхаживания
новорождённых, а также в урологических,
ожоговых отделениях, некоторых
хирургических стационарах, особенно
при доминировании заболеваний,
обусловленных грамотрицательными
бактериями. Значима их роль в детских
инфекционных больницах. Медицинский
персонал часто бывает носителем
золотистого стафилококка, возбудителей
кишечных инфекций, у части сотрудников
выявляют хронические заболевания
мочеполового тракта, дыхательной системы
и т.д. Периодически нарушая гигиенические
требования, медицинские работники могут
создавать весьма сложные эпидемиологические
ситуации. Уровень культуры медицинского
персонала при этом имеет исключительно
большое значение, особенно при инфекциях,
распространяющихся контактно-бытовым
путём. Лица, привлекаемые к уходу за
больными, могут быть поставлены на
третье место по значимости как источники
возбудителей ВБИ после больных и
медицинского персонала. Роль носителей,
навещающих пациентов, в распространении
ВБИ весьма ограничена, поскольку больного
навещают практически здоровые люди.
Имеющиеся среди них носители
условно-патогенных бактерий выделяют
негоспитальные штаммы. Попытки
воспрепятствовать посещению родственников
во многих странах не приводят к снижению
заболеваемости ВБИ.
Воздушно-капельный
(аэрозольный)
путь передачи инфекции играет ведущую
роль в распространении стафилококковой
и стрептококковой инфекций. Инфицированный
воздух обусловливает возникновение
вспышек легионеллёза, зарегистрированных
в госпиталях ряда стран мира. При этом
большую роль в распространении инфекции
играли кондиционеры с увлажнителями,
вентиляционные системы, реже заболевания
были связаны с вдыханием водного или
пылевого аэрозоля при физиотерапевтических
процедурах или проводившихся недалеко
от стационара строительных земляных
работ. Следует иметь в виду, что постельные
принадлежности (тюфяки, матрасы, одеяла,
подушки) также могут стать факторами
передачи стафилококков, энтеробактерий
и других возбудителей.
Контактно-бытовой
путь передачи принадлежит главным
образом инфекциям, вызываемым
грамотрицательными бактериями. При
этом нужно учитывать возможность
интенсивного размножения и накопления
этих микроорганизмов во влажной среде,
жидких лекарственных формах, сцеженном
грудном молоке, на влажных щётках для
мытья рук персонала и влажной ветоши.
Факторами передачи инфекции также могут
быть контаминированный инструментарий,
аппаратура для вспомогательного дыхания,
бельё, постельные принадлежности,
поверхности «влажных» предметов (ручек
кранов, раковин и т.д.), инфицированные
руки персонала.
Бытовая
передача реализуется и при стафилококковой
инфекции, особенно в случаях, вызванных
эпидермальным стафилококком. В последние
годы отмечают увеличение внекишечных
форм проявления нозокомиального
сальмонеллёза, когда госпитальные
штаммы Salmonella typhimurium выделяют из гноя,
мочи, крови, жёлчи, экссудатов брюшной
и грудной полостей.
Пищевой
путь передачи может реализоваться при
инфекциях, вызываемых различными
этиологическими агентами. У детей,
находящихся на грудном вскармливании,
возможно заражение стафилококками при
кормлении или докорме сцеженным молоком
или вскармливании матерью, страдающей
маститом. Нарушения технологии
приготовления пищевых продуктов и
наличие нераспознанных источников
инфекции у работников пищевых блоков
приводят к возникновению вспышек
кишечных инфекций в стационарах.
Существенное
значение в распространении ВБИ играет
искусственный,
или артифициальный,
путь передачи (см. рис. 1-16). Значение его
растёт. По сути, мы имеем дело с настоящей
«агрессией» диагностических и лечебных
медицинских технологий. К тому же, по
данным ВОЗ, около 30% инвазивных вмешательств
выполняют необоснованно. Парентеральная
передача возбудителей возможна при
использовании загрязнённых шприцев и
игл, а также при введении инфицированных
препаратов крови. Важную роль играют
невыполнение персоналом правил асептики
и антисептики, нарушения режима
стерилизации и дезинфекции медицинского
инструментария и приборов. Особую
опасность таит переливание крови и её
препаратов. В настоящее время кровь
доноров проверяют лишь на сифилис,
ВИЧ-инфекцию, ВГВ и ВГС, тогда как круг
инфекций, способных передаваться через
кровь, значительно более широк — BTD,
ВГС, TTV-инфекция, ЦМВ-инфекция, листериоз,
токсоплазмоз и др. Описаны случаи
заражения синегнойной и стафилококковой
инфекциями в результате переливания
крови, инфицированной после её получения
от доноров.
Соседние файлы в предмете Эпидемиология
- #
- #
- #
- #
- #
- #
- #
- #
Общие сведения
Понятие о внутрибольничной инфекции
Под внутрибольничной инфекцией (ВБИ) подразумевается инфекция, которая возникает у пациента/медицинского работника при нахождении в условии стационара вне зависимости от появления симптомов заболевания во время его пребывания в стационаре или после выписки. Ее синонимами являются нозокомиальные инфекции или внутригоспитальные, госпитальные и ятрогенные инфекции. Также, нозокомиальные инфекции в современной научной литературе, нормативных документах и публикациях ВОЗ описываются термином «инфекции, связанные с оказанием медицинской помощи» (ИСМП), который, по мнению большинства, является более точным, поскольку подразумевает не только случаи инфекции, присоединившиеся к основному заболеванию у госпитализированных пациентов, но и инфекции, обусловленные оказанием всех видов медицинской помощи в мед. учреждениях различного профиля — амбулаториях, поликлиниках, на дому (при оказании скорой медицинской помощи), санаторно-оздоровительных учреждениях, также включает случаи инфицирования работников медицинских учреждений, связанные с их профессиональной деятельностью.
Частота регистрации ИСМП в разных странах варьирует в широких пределах. Так, в РФ этот показатель составляет 1-1,5% (40-60 тыс. случаев/год), США — 3-5 % (2,5 млн. случаев/год), Великобритании — 5-6 %, Германии —3,5 %, Китае — 7-8 %. Однако, эти показатели, особенно в странах СНГ и, в частности, России не отражают реальную эпидемиологическую ситуацию. Результаты научных исследований ведущих специалистов-эпидемиологов РФ свидетельствуют, что реальное количество ИСМП составляет в среднем около 10% и находится на уровне 2-2,5 миллионов случаев/год. Присоединение ИСМП к основному заболеванию увеличивает продолжительности лечения (пребывания в стационаре) пациента на 7-10 дней, а прямые затраты лечебных учреждений на 65-85 млрд рублей в год. Летальность при различных нозологических формах ИСМП варьирует в пределах 3,5-35%.
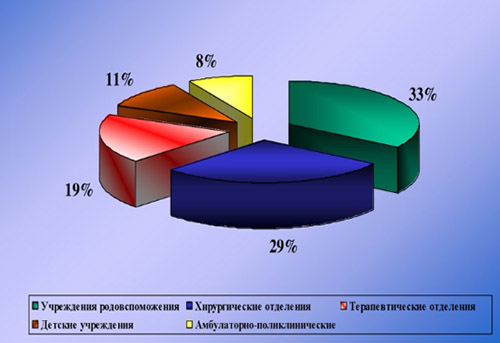
Наибольший удельный вес ИСМП приходится на хирургические и акушерские стационары (отделения травматологии, урологии, реанимации, абдоминальной хирургии, гинекологии, ожоговой травмы, стоматологии, отоларингологии, онкологии). Наиболее драматичны проявления ИСМП в отделениях интенсивной терапии и реанимации, где они в различных нозологических формах регистрируются в 25-30% случаев.
Патогенез
Патогенез внутрибольничных инфекций существенно различается и определяется видом заболевания, этиологическим фактором (видом возбудителя, факторами его вирулентности), механизмом и путями передачи инфекции.
Классификация
Прежде всего, различают две больших группы ИСМП (рис. ниже):
- Экзогенная инфекция — обусловлена заражением пациента инфекционным агентом в условиях посещения/нахождения в ЛПУ.
- Эндогенная инфекция — инфекции, вызванных условно-патогенными микроорганизмами, вегетирующими в пищеварительном тракте, на кожных и слизистых покровах, которые при неблагоприятных условиях становятся патогенными. В структуре ВБИ роль эндогенной инфекции незначительна.
Группы и этиологический фактор ИСМП
В основу классификации ВБИ положены различные факторы. В зависимости от путей/факторов передачи различают воздушно-капельные, контактно-бытовые, контактно-инструментальные, постоперационные, постинфекционные, постэндоскопические, послеродовые, посттрансфузионные, постдиализные, посттравматические, постгемосорбционные и другие инфекции.
В зависимости от степени распространения инфекции различают:
- Генерализованные: бактериемия, септицемия, септикопиемия, токсико-септическая инфекция.
- Локализованные инфекции, включающие:
- Респираторные инфекции (ОРЗ, бронхит, плеврит, пневмония, легочный абсцесс и др.).
- Инфекции подкожной клетчатки/кожи (послеожоговые, послеоперационные, послетравматические), дерматомикозы, постинъекционные — абсцессы/флегмоны подкожной.
- Стоматологические инфекции (абсцесс, стоматит).
- ЛОР-инфекции (ринит, отиты, синуситы, ангина, ларингит, фарингит).
- Урологические инфекции.
- Инфекции пищеварительного тракта (энтерит, колит, гастроэнтероколит, холецистит, гепатиты др.).
- Постоперационные инфекции (перитонит, абсцессы брюшины).
- Инфекции глаза (конъюнктивит).
- Инфекции урологической и половой системы (пиелонефрит, уретрит, цистит, бактериурия, эндометрит, сальпингоофорит).
- Инфекции костно-cуставного аппарата (остеомиелит, бурсит, артрит).
- Инфекции сердечно-сосудистой системы (миокардит, эндокардит, перикардит, инфекции артерий и вен).
- Инфекции ЦНС (менингит).
- По характеру течения: острые, подострые, хронические. По тяжести течения: легкие, тяжёлые и среднетяжелые.
Причины
Этиологическим фактором ИСМП может быть чрезвычайно широкий спектр микроорганизмов (около 250 видов), принадлежащих к разным таксономическим группам: бактерии, вирусы, простейшие, грибы. При этом, инфекционным агентом могут быть патогенные, условно-патогенные микроорганизмы, а в ряде случаев и сапрофитная микрофлора. Наибольшей удельный вес в этиологической структуре ИСМП принадлежит возбудителям гнойно-септических инфекций (80-85%), кишечных инфекций (8-10%), вирусам гепатитов В, С, D (6-7%), инфекции дыхательных путей (2-3%). В целом, структура ВБИ изменчива и зависит преимущественно от профиля отделения/вида стационара и микробного пейзажа конкретного лечебного отделения (рисунок ниже).
К возбудителям ВБИ, имеющими наибольшее значение относятся:
- грамположительная флора: стафилококки (золотистый, эпидермальный), стрептококки (пневмококк, энтерококк, пиогенный стрептококк);
- грамотрицательная флора: энтеробактерии (эшерихия, сальмонелла, шигелла, синегнойная палочка, клебсиелла, протей, иерсиния).
- вирусы (аденовирусной инфекции, простого герпеса, кори, ветряной оспы, гриппа, парагриппа, респираторно-синцитиальной инфекции, эпидпаротита, ротавирусы, риновирусы, энтеровирусы, возбудители вирусных гепатитов);
- грибы (рода Candida, аспергиллы).
Значимость различных видов ИСМП во многом определяется профилем ЛУ. Так, в гинекологических и родильных отделениях ведущую роль играет стафилококковая инфекция (золотистый стафилококк), кишечная палочка, энтерококки, диплоидный грибок (молочница); в ожоговых стационарах — синегнойная инфекция; в урологических отделениях — грамотрицательная микрофлора: кишечная, синегнойная палочка; в детских отделениях — вирусы краснухи, кори, эпидемического паротита, ветряной оспы.
Чрезвычайно большое значение в распространении ВБИ имеют так называемые «госпитальные штаммы», для которых характерны высокая вирулентность, повышенная устойчивость к антибиотикам, ультрафиолетовому облучению, дезинфицирующим растворам, неприхотливость и способность размножаться в различных условиях окружающей среды. Основная причина мутации и селекции микрофлоры с приобретенной устойчивостью — неадекватное использование в лечебном процессе антимикробных средств и создание в ЛПУ благоприятных условий для размножения и роста микроорганизмов.
Формирование госпитального штамма (с приобретенной устойчивостью) обеспечивается за счет их преимущества (доминирования) перед другими представителями микробной популяции. Основными отличиями госпитального штамма микроорганизма от стандартного являются: повышенная вирулентность (патогенность), формирующаяся за счет многократного пассажа через организм больных ЛПУ, высокая устойчивость к воздействию неблагоприятных факторов (дезинфектантам, антисептикам, химиопрепаратам, применяемым в конкретном мед. учреждении) и способность к длительному выживанию, постоянная циркуляция в среде больничного стационара среди больных и персонала.
Основную массу всех форм ВБИ (около 80%) составляют:
- инфекции мочевыделительной системы;
- ОРЗ и вентилятор-ассоциированные пневмонии;
- послеоперационные раневые гнойно-септические инфекции;
- кожные инфекции;
- интраабдоминальные инфекции;
- ангиогенные катетер-ассоциированные инфекции.
Эпидемиология
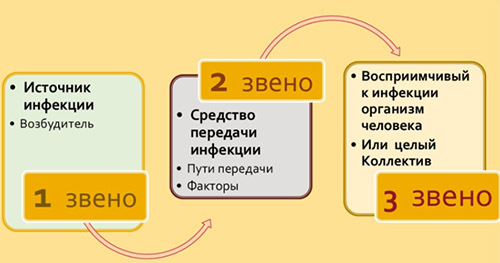
Любая нозологическая форма ВБИ развивается только при наличии всех звеньев эпидемического процесса: источника инфекции, механизма (факторов) передачи и восприимчивого организма человека.
Основные источники внутрибольничной инфекции:
- больные и носители, находящиеся в стационаре;
- персонал лечебных учреждений;
- лица, ухаживающие за больными и посетители стационаров (студенты, лица, навещающие пациентов).
Ведущие механизмы передачи инфекционного возбудителя
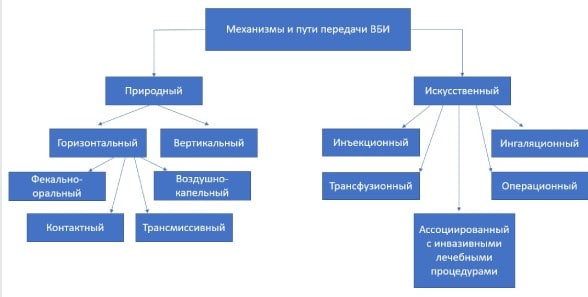
Аэрогенный — процесс заражения осуществляется через воздушную среду. Выделяют:
- воздушно-капельный путь (этим путем возбудитель передается при большинстве ОРЗ, пневмониях) при разговоре, кашле;
- воздушно-пылевой путь (передаются заболевания, возбудитель которых устойчив во внешней среде — кишечные инфекции, туберкулез, зоонозы).
Фекально-оральный:
- Контактно-бытовой путь – инфекционный агент передается через грязные рук, предметы личной гигиены, игрушки, посуду.
- Пищевой (реализуется через зараженные продукты питания при нарушениях технологии приготовления или хранения готовых блюд и пищевых продуктов).
- Водный (через воду).
Контактный:
- Прямой — передача возбудителя непосредственно через физический контакт между резервуаром инфекции (инфицированный индивидуум/контаминированный предмет) с кожей, слизистой или раневой поверхностью восприимчивого организма человека.
- Непрямой — посредством механического переноса инфекционного агента через руки медицинского персонала, предметы обихода, инструменты и оборудование лечебного учреждения. Непрямой контакт является наиболее часто задействованным путем распространения. Этот путь передачи часто называют артифициальным (искусственным) или парентеральным путем передачи возбудителя, который реализуется путем проведения различных инвазивных манипуляций (инъекции, забор крови, инструментальные манипуляции, вакцинацию, местные/общие операции) или использовании специальной аппаратуры при проведении гемодиализа, ИВЛ.
- Гемоконтактный — передается через кровь при обширных хирургические вмешательствах, инфузионной терапии, программном гемодиализе.
Факторы передачи инфекционного агента
- Контаминированный медицинский инструментарий (катетеры, зонды, эндоскопы), шовный/перевязочный материал, трансплантаты, дренажи, медицинская аппаратура, эндопротезы, белье/постельные принадлежности, предметы ухода за больными, руки, волосы, спецодежда и обувь персонала и больных.
- «Влажные объекты» — контаминированные растворы дезинфектантов, антисептиков, питьевые растворы, дистиллированная вода, инфузионные жидкости, краны, раковины, сливные трапы, увлажняющие кондиционеры.
Заболеваемость ИСМП носит преимущественно эндемический характер и обусловлена индивидуальными факторами риска и клиническими процедурами. Значительно реже ИСМП протекают в виде локальных эпидемий. Развитию эпидемических вспышек способствует несвоевременная диагностика стертых форм заболевания и выявление носителей инфекционных агентов, как среди поступающих пациентов, так и среди медицинского персонала, контаминация предметов общего пользования, систематическое нарушение методов асептики при выполнении инструментальных процедур.
Факторы риска развития ИСМП
Специфичны для каждого вида инфекционного возбудителя. Однако, в целом для большинства нозологических форм ИСМП определяющими факторами являются параметры, характеризующие организм хозяина:
- возраст (пожилой/старческий, дети — новорожденные и раннего возраста, особенно недоношенные, со сниженной сопротивляемостью организма и перенесшие родовую травму);
- пациенты, страдающие тяжелыми хроническими заболеваниями, с алиментарной дистрофией;
- длительно находящиеся в стационаре и особенно на постельном режиме;
- беременные/роженицы;
- пациенты, получающие лучевую/иммуносупрессивную терапию;
- имунноскомпрометированные лица;
- больные после обширных хирургических операций, получающие кровезаместительную/инфузионную терапию, с программным гемодиализом, находящиеся на ИВЛ.
Факторы риска ИСМП, связанные с предметами окружающей среды (загрязнение поверхностей, воздуха, воды в распространении инфекции) имеют меньшую значимость.
Что способствует распространению внутрибольничных (нозокомиальных) инфекций?
Возникновению и распространению ИСМП способствуют:
- Создание больничных комплексов ЛПУ с высокой плотностью и концентрацией больных и медицинского персонала, тесно и постоянно общающегося с больными в замкнутой среде (палаты, кабинеты для лечебно-диагностических процедур), что активизирует воздушно-капельный и контактный механизм передачи возбудителей.
- Существование мед. учреждений с недостаточным набором помещений и площадей, что создает перекрест технологических потоков, с недостаточным количеством оборудования и инструментария, перевязочных материалов и медицинского персонала.
- Технологические нарушения в приточно-вытяжной вентиляции (недостаточная или ее отсутствие), водопроводной и канализационной системах.
- Постоянно возрастающая интенсивность артифициального (искусственного) механизма передачи инфекционных агентов путем расширения перечня диагностических и лечебных процедур, инвазивных вмешательств, использования различной медицинской сложной аппаратуры и техники, требующих специфических методов стерилизации. Использование приборов, сложного инструментария и аппаратуры, зачастую травмирует слизистые оболочки и кожу, формируя тем самым «входные ворота» для инфекционных возбудителей.
- Постоянный приток источников инфекционных агентов в виде поступающих в стационар пациентов, в частности с несвоевременным выявлением больных со стертыми формами инфекции и медицинского персонала (больные сотрудники/носители) и их изоляцией.
- Недостаточно продуманная стратегия назначения химиопрепаратов и антибиотиков для лечения, что способствует формированию внутригоспитальных штаммов различных микроорганизмов с множественной лекарственной устойчивостью, стойкостью к действию дезинфицирующих средств и обладающих селективными преимуществам.
- Увеличение и расширение контингента риска за счет достижений современной медицины. Это пациенты пожилого возраста, выхаживаемые глубоко недоношенные дети, лица со сниженным иммунитетом.
- Грубые нарушение санитарно-эпидемиологического режима (несоблюдение режима дезинфекции/стерилизации, личной гигиены, асептики и антисептики).
Симптомы
Симптоматика внутрибольничных инфекций определяется конкретной нозологической формой и симптомами основного заболевания, формой и тяжестью их течения, вирулентностью инфекционного агента и состоянием организма больного.
Анализы и диагностика
К ВБИ относятся случаи, отвечающие следующим критериям:
- Повторное поступление пациента в стационар с установленной инфекцией (с клиническими признаками, данными инструментальных и лабораторных методов исследовани — микробиологических, серологических и методов экспресс-диагностики), являющееся следствием предыдущей госпитализации.
- Период развития клинической симптоматики заболевания ВБИ после поступления в лечебный стационар должен составлять не менее 48 часов и более.
- Выявляется четкая взаимосвязь между симптоматикой заболевания и проведенными вмешательства инвазивного типа (после ингаляции, инъекций, перевязки и т.д.) или в ряде случаев — с выявленным источником инфекционного агента (поступивший больной со стертой формой заболевания/носитель) и фактором ее распространения.
Для точной диагностики заболевания и определения конкретного штамма возбудителя инфекции, требуется проведение лабораторных—бактериологических/серологических исследований различных биоматериалов (мазок из зева, мокрота, кровь, моча, кал, раневое отделяемое).
Лечение
Проблема лечения госпитальных инфекций представляет значительную трудность, что обусловлено неэффективностью большинства широко применяемых антибиотиков, в частности цефалоспоринов. Для лечения таких инфекций применяются карбапенемы (Меропенем, Дорипенем), имеющие широкий спектр антимикробной активности, в частности к микроорганизмам, устойчивым к пенициллинам/цефалоспоринам или в ряде случаев комбинированные лекарственные препараты пенициллинов с ингибиторами бета-лактамаз (Пиперациллин + Тазобактам, Тикарциллин, Амоксициллин-Клавуланат и др.).
Карбапенемы используются для лечения тяжелых нозокомиальных пневмоний и других инфекций верхних дыхательных путей; инфекций органов малого таза, гинекологических, абдоминальных, мочеполовых инфекций; кожи и мягких тканей; сепсиса. Однако, препараты этой группы могут вызывать побочные реакции в виде крапивницы, сыпи, диспепсических расстройств, поражения печени и почек, дисбактериоза.
При выявлении метициллинрезистентных штаммов золотистого стафилококка, являющегося частым возбудителем внутрибольничных резистентных стафилококковых инфекций для лечения, используются гликопептидные антибиотики (Ванкадицин, Тейкопланин-Тева, Ликованум, Таргоцид и др.), которые высокоактивны по отношению к грамположительным аэробным/анаэробным инфекционным агентам — стафилококкам, стрептококкам, пневмококкам, энтерококкам, клостридиям, листериям, коринебактериям и другим. Показаниями к назначению являются тяжелые инфекции, вызванные энтерококками, инфекционный эндокардит, ассоциированный с зеленящими стрептококками, менингит и пневмонии, вызванные пневмококком, катетер-ассоциированный сепсис, перитонит, антибиотик-ассоциированная диарея и других инфекций, угрожающих жизни. В ряде случае гликопептидные антибиотики сочетаются с цефалоспоринами 3 поколения (Цефтибутен, Цефиксим, Цефотаксим, Цефоперазон, Цефтазидим и др.) или фторхинолонами (Офлоксацин, Ципрофлоксацин, Пефлоксацин, Норфлоксацин, Левофлоксацин и другие).
Необходимо отметить, что спектр возбудителей внутригоспитальных осложнений, а также их антибиотикорезистентность существенно различаются в отделениях различного профиля, поэтому при выборе антибиотика следует ориентироваться на чувствительность выделенной микрофлоры к ним, в также учитывать эпидемиологическую ситуацию в каждом конкретном лечебном учреждении.
Кроме антибиотикотерапии назначается специфическое лечение при той или иной конкретной нозологической форме ВБИ с учетом клинических проявлений, тяжести течения, риска развития осложнений. В индивидуальном порядке проводится симптоматическое лечение. В качестве дополнительной терапии назначают иммуностимуляторы: интерферон; бактериофаги, витаминно- минеральные комплексы.
В настоящее время для борьбы с тяжелыми проявлениями ВБИ разработана стратегия деэскалационной терапии, базирующаяся на нескольких принципах:
- Безотлагательное начало проведения антибактериальной терапии.
- Выбор антимикробных препаратов (АМП) с учетом чувствительности микроорганизмов и способности проникать в ткани, при отсутствии таких данных — использование антибиотиков широкого спектра действия.
- Назначение высоких доз антибиотиков, подбираемых индивидуально.
Эта стратегия предполагает безотлагательное назначение стартового антибиотика широкого спектра действия (комбинации антибиотиков) с целью максимально полного охвата спектра вероятных возбудителей с последующим переходом на антибиотик, к которому отсутствует устойчивость согласно данным микробиологического исследования. Именно своевременная и адекватная антимикробная терапия является ключевым условием и благоприятным прогностическим фактором, увеличивающей вероятность благоприятного исхода заболевания.
Доктора
Лекарства
- Карбапенемы (Меропенем, Дорипенем).
- Фторхинолоны (Офлоксацин, Ципрофлоксацин, Пефлоксацин, Норфлоксацин, Левофлоксацин).
- Цефалоспорины 3-поколения (Цефтибутен, Цефиксим, Цефотаксим, Цефоперазон, Цефтазидим).
- Гликопептидные антибиотики (Ванкадицин, Тейкопланин-Тева, Ликованум, Таргоцид).
- Комбинированные препараты (Пиперациллин + Тазобактам, Тикарциллин, Амоксициллин-клавуланат).
Процедуры и операции
Проводятся в соответствии с протоколом и схемами лечения конкретной нозологической формы ВБИ.
Профилактика
Профилактика ИСМП включает чрезвычайно сложный и многоплановый комплекс методических, организационных, эпидемиологических мероприятий и требует существенных материальных затрат и постоянного контроля за условиями предоставления медицинской помощи. Независимо от профиля ЛПУ все мероприятия направлены на:
- минимизацию риска заноса инфекционного агента в лечебно-профилактические учреждения;
- исключение внутригоспитальных заражений;
- предотвращение выноса инфекции за пределы ЛПУ.
В целом, это комплекс мероприятий, включающий неспецифическую профилактику, санитарно- противоэпидемические мероприятия и специфическую профилактику.
Рассмотри кратко только санитарно-противоэпидемические меры профилактики ВБИ и только в отделения хирургического профиля, поскольку в стационарах этого профиля распространённость внутригоспитальной гнойно-септические инфекции является одной их наибольших. Профилактика хирургической внутрибольничной инфекции регламентируется СП 3.1.2485-09 «Профилактика внутрибольничных инфекций в отделениях хирургического профиля ЛУ, являющихся дополнением N 1 к СанПиН 2.1.3.1375-03». С выходом этого документа приказ 720 «Профилактика внутрибольничной инфекции у больных с гнойными хирургическими заболеваниями» утратил актуальность. Мероприятия направлены на:
- Источник инфекции — своевременное выявление больных и медперсонала, особенно с маловыраженной симптоматикой и носителей, их изоляция и санация. Вопрос чрезвычайно сложный, поскольку до настоящего времени отсутствуют эффективные методы своевременного распознавания бациллоносителей.
- Пути распространения — достигается строгим соблюдением положений санитарно- противоэпидемического режима.
Основу санитарно-противоэпидемического режима составляет:
- Дезинфекция объектов внешней среды (посуда, постельные принадлежности, уборочный инвентарь, воздух, полы, стены помещения, выделения больного (кал, мокрота, кровь, моча), санитарно-технические объекты (унитазы, мочеприемники, раковины, ванны), воздух в помещениях стационаров (воздействие ультрафиолетовым излучением) и так далее.
- Соблюдение правил асептики/антисептики при проведении оперативных вмешательств и различных лечебно-диагностических процедур (стерилизация перевязочного материала, спецодежды, медицинского инструментария, аппаратуры), особенно, соприкасающихся с раневой поверхностью.
- Применение эффективных средств и способов обеззараживания операционного поля и рук медицинского персонала.
- Постоянный микробиологический мониторинг возбудителей ВБИ в стационаре и анализ локальной антибиотикорезистентности.
Немаловажна и роль вентиляции, как в палатах, так и особенно в операционных блоках, которые должны быть оборудованы вентиляционными установками, которые обеспечивают преобладание притока воздуха над его вытяжкой.
Профилактика ВБИ и снижение уровня госпитальной летальности также достигается за счет правильной и эффективной антибактериальной терапии, что приводит к снижению вероятности формирования антибиотикорезистентности. Для этого необходимо соблюдать ряд рекомендаций:
- Не использовать системные антибиотики для местной терапии.
- Ограничивать применение антибиотиков, к которым у микроорганизмов того или иного стационара имеет место рост резистентности или отмечается высокий уровень распространенности инфекции.
- Использовать только антибиотики узкого спектра, обладающие высокой активностью в отношении конкретно выделенного возбудителя инфекции.
- Назначать антибиотики в адекватных дозах с выбором оптимального пути их введения в организм.
- Не использовать новые антибиотики, если традиционные препараты имеют аналогичную эффективность.
Последствия и осложнения
Инфекции в значительной степени влияют на тяжесть течения базового заболевания и являются провоцирующим фактором, удлиняющим длительность госпитализации.
Прогноз
Прогноз зависит от целого ряда факторов: нозологической формы ВБИ и формы ее течения, основного заболевания, состояния организма больного и эффективности лечения. В большинстве случаев прогноз благоприятный, тем не менее, в стационарах хирургического профиля, реанимации, у тяжелых пациентов возникновение инфекционного процесса является фактором высокого риска развития генерализованных форм ВБИ (бактериемия, септицемия, токсико-септическая инфекция), снижающих выживаемость пациентов, показатель смертности среди которых достигает 30-35%.
Список источников
- Профилактика внутрибольничных инфекций: учеб. пособие /Д. Н. Емельянов, Л. П. Сливина, Е. И. Калинченко, А. В. Тумаренко. – Волгоград: Изд-во ВолгГМУ, 2011. — 85 с.
- Сергевнин В. И., Горовиц Э. С., Маркович Н. И., Кузнецова М. В., Карпунина Т. И. Внутрибольничные гнойно-септические инфекции новорожденных и родильниц (микробиологические и эпидемиологические аспекты). Пермь: ГОУ ВПО ПГМА Росздрава, 2010. 288 с.
- Покровский В. И., Акимкин В. Г., Брико Н. И., Брусина Е. Б., Зуева Л. П., Ковалишена О. В., Стасенко В. Л., Тутельян А. В., Фельдблюм И. В., Шкарин В. В. Внутрибольничные инфекции: новые горизонты профилактики // Эпидемиология и инфекционные болезни. 2011. № 1. С. 4–7.
- Куракин Э. С. Многоуровневая система эпидемиологического надзора за внутрибольничными инфекциями — современная альтернатива неизбежности внутрибольничных инфекций? // Эпидемиология и инфекционные болезни. 2010. № 1. С. 16–20.
Какой может быть внутрибольничная инфекция? Что вызывает ВБИ? Какие санитарно-гигиенические и противоэпидемические меры предпринять для профилактики инфекций?
Новые требования к инфекционному контролю
Внутрибольничные инфекции (ВБИ, синонимы: ятрогенные инфекции, нозокомиальные инфекции, госпитальные инфекции) возникают вследствие заражения больных в стационарах.
В настоящее время в развитых странах возникает примерно 5-12% госпитальных инфекций по отношению к общему количеству госпитализированных больных. По данным экспертов ВОЗ, в развивающихся странах этот показатель в некоторых случаях превышает 40%! В Украине достоверной статистической информации нет.
Стратегическая задача здравоохранения — обеспечение высокого качества медицинской помощи и создание безопасной среды пребывания в медицинских учреждениях для пациентов и персонала.
Внутрибольничные инфекции, которые в настоящее время в мире принято называть инфекциями, связанными с оказанием медицинской помощи (ИСМД), является важнейшей составляющей этой проблемы – из-за масштабности распространения и последствий для здоровья пациентов, медперсонала и экономики государства в целом.
В мире уровень заболеваемости ИСМД пациентов и персонала в учреждениях здравоохранения признан индикатором качества и безопасности предоставления медицинских услуг. В свое время Генеральный директор ВОЗ Ли Чон Вук отметил, что повышение качества медицинских услуг как величайшее достижение человечества за последние 100 лет было бы абсолютно достоверным, если бы не было болезней, связанных с оказанием медицинской помощи.
Знать природу внутрибольничных инфекций и профилактические меры по противодействию им обязан каждый медицинский работник, поскольку от этого зависит не только его здоровье, но и безопасность пациентов. Именно инфицирование ВБИ в учреждении здравоохранения приводит к продлению срока лечения, а нередко и к летальным случаям.
В настоящее время в ИСМД относят не только те инфекции, которые присоединяются к основному заболеванию госпитализированных пациентов, но и связаны с оказанием других видов медицинской помощи:
- в амбулаторно-поликлинических
- образовательных
- санаторно-оздоровительных учреждениях
- заведениях социальной защиты населения
- при оказании скорой медицинской помощи
- помощи на дому и т.д.
а также случаи инфицирования медицинских работников в результате профессиональной деятельности.
Классификация ВБИ
К внутрибольничным инфекциям относят гнойно-септические, кишечные, вирусные и т.д.
Гнойно-септические инфекции насчитывают около 80 различных возбудителей и составляют 75-80% всех внутрибольничных инфекций. Чаще всего они вызываются стафилококком, синегнойной палочкой. Этот вид ВБИ распространяется воздушномым путем, а также через предметы быта, медицинский инструментарий, руки медицинских работников и т.д. Что касается распространения возбудителей инфекции бытовым путем (через оборудование, медицинский инструментарий), то классификация по степени риска заражения приведена в Таблице.
Кишечные инфекции составляют 7—12% всех внутрибольничных инфекций, причем наиболее распространенная в этой группе инфекция вызывает опасное заболевание — сальмонеллез. Сальмонеллы обладают большой устойчивостью к антибиотикам и антисептикам. Передаются кишечные инфекции через пыль, предметы обихода, медицинский инструментарий, а также воздушным путем. Однако чаще всего носителем возбудителей инфекций является медицинский персонал.
Третью группу ВБИ составляют вирусные инфекции, в частности вирусные гепатиты B, C, D (6-7% всех внутрибольничных инфекций).
И наконец, самая маленькая группа (до 5%) — другие внутрибольничные инфекции, к которым относят грипп, дифтерию, туберкулез и т.д.
Таблица
Классификация по степени риска заражения ВБИ бытовым путем
|
Степень риска |
Предметы, на которых могут сохраняться возбудители инфекций |
Пути деконтаминации |
|
Низкая |
Вещи, контактирующие с нормальной и интактной кожей, или загрязненные поверхности, непосредственно не контактирующие с больными (стены, потолок, пол, мебель и т.д.) |
Очистка и протирание |
|
Средняя |
Оборудование (гастроэнтерологическое, гинекологическое, термометры и т.п.), которое не применяется для инвазивных процедур на кожных покровах или в других стерильных частях организма, но контактирует со слизистыми оболочками, неинтактной кожей или другими частями организма, контаминированными вирулентными микроорганизмами |
Очистка и дезинфекция |
|
Высокая |
Инструменты, проникающие через стерильные ткани, включая полости организма и сосудистую систему (хирургический инструмент, мочевые катетеры, внутрисосудистые катетеры) |
Предстерилизационная очистка и стерилизация. Если нет возможности провести стерилизацию, следует обеспечить дезинфекцию высокого уровня |
⚡ Формуємо обсяг діяльності медзакладу ⚡ Складаємо штатний розпис ⚡ Обираємо систему оплати праці ⚡ Оформлюємо трудові відносини з працівниками ⚡ Готуємося до перевірки ⚡ Держпраці
Внутрибольничная инфекция: причины распространения
Основные причины развития внутрибольничной инфекции:
- формирование госпитальных штаммов микроорганизмов с высокой вирулентностью и множественной лекарственной резистентностью к антибиотикам, которые имеют селективные преимущества и высокую устойчивость к факторам окружающей среды (ультрафиолетового облучения, высушивания, действия дезинфекционных препаратов); – способность к формированию госпитальных штаммов присуща всем условно-патогенным бактериям
- нерациональное использование антибиотиков и отсутствие контроля за циркуляцией штаммов с лекарственной стойкостью; значительную частоту носительства патогенной микрофлоры (например, золотистого стафилококка) среди медицинского персонала (в среднем – 40%)
- создание больших больничных комплексов со специфической экологией – скоплением в стационарах и поликлиниках, особенностями их контингента (преимущественно ослабленные пациенты), относительной замкнутостью помещений (палаты, процедурные кабинеты и т.п.)
- наличие значительного количества пациентов, госпитализирующих с нераспознанными инфекционными болезнями, носителей стертых форм инфекций
- непреодолимые стереотипы клиницистов, которые до сих пор рассматривают большинство ИСМД (пневмонию, пиелонефрит, воспалительные заболевания кожи, подкожной жировой клетчатки и т.п.) как неинфекционную патологию и своевременно или вовсе не принимают необходимые профилактические и противоэпидемические меры.
Контингентом повышенного риска заболевания ВБИ является медицинский персонал
- профессиональные заболевания медицинских работников, имеющих контакт с кровью больных – вирусные гепатиты В, С, Д, ВИЧ инфекция
- наибольший риск заражения парентеральными гепатитами имеют медицинский персонал отделений гемодиализа, работники клинических лабораторий, хирурги, стоматологи, реаниматологи.
- наибольший риск инфицирования медиков связан с первыми 5 годами медицинской практики, когда навыки безопасной работы не являются стереотипом.
Схема 1
Как предотвратить распространение внутрибольничных инфекций: правила
Предотвратить распространение внутрибольничных инфекций можно, если четко выполнять правила, прописанные в нормативных документах и локальных инструкциях по здравоохранению.
При нынешней системе в каждом здравоохранительном учреждении Украины должен быть создан отдел инфекционного контроля, полномочия которого распространяются на все подразделения и службы медицинского учреждения.
В своей деятельности отдел должен руководствоваться положением, разработанным и утвержденным для каждого конкретного заведения.
Случаи инфекционных болезней, связанных с оказанием медпомощи, и антимикробной резистентности устанавливают по критериям, по которым определяются случаи инфекционных и паразитарных заболеваний, подлежащих регистрации, утвержденными приказом Минздрава от 28.12.2015 № 905.
Эпидемиологическое наблюдение за всеми видами инфекционных болезней, связанных с оказанием медпомощи, необязательно. Исключение – катетер-ассоциированные инфекции кровотока, катетер-ассоциированные инфекции мочевыводящих путей, вентилятор-ассоциированные пневмонии и инфекции в области хирургического вмешательства.
Основные задачи ВИК: принятие решений по результатам эпидемиологического анализа, разработка программ и планов эпидемиологического надзора, координация мероприятий с руководством; обеспечение взаимодействия всех служб стационара (отделения), а также взаимодействие с органами, уполномоченными осуществлять государственный санитарно эпидемиологический надзор.
Однако существование ВИК не гарантирует надлежащего результата при наличии финансовых проблем, а также отсутствия четкой системы эпидемиологического надзора и контроля.
✅✅✅ Наказ № 1614: нові правила інфекційного контролю
СОВЕТ. Организуйте обучение работников. Определите лицо, ответственное за обучение и подготовку ПИИК медицинских и немедицинских работников ЗОЗ, и создайте соответствующие годовые планы. Их должен утвердить руководитель ЗОЗ. К обучению привлекайте всех работников ЗОЗ, оценивайте их знания и качество обучения. Этого требуют пункты 7.9 и 7.10 стандартов аккредитации. Требования касаются всех ЗОЗ, оказывающих первичную и вторичную лечебно-профилактическую помощь.
План действий по ПИИК помогает предотвратить инфекционные болезни, связанные с оказанием медицинской помощи, и антимикробную резистентность (АМР). Это устанавливает пункт 2 розділу ІІ Порядку впровадження профілактики інфекцій та інфекційного контролю в закладах охорони здоровʼя, які надають медичну допомогу в стаціонарних умовах, утвержденного Приказом № 1614 (дальше — Порядок № 1614).
Реализация плана должна учитывать мультимодальные стратегии (п. 7.4 стандартов аккредитации).
Мультимодальная стратегия — комплексный способ достичь изменений в системе, микроклимате коллектива и его поведении, что поддерживает прогресс в ПИИК в ЗОЗ и в результате приносит положительные изменения как пациентам, так и работникам ЗОЗ (п. 4 разд. I Порядка № 1614).
При разработке плана действий ВИК рассматривает каждый из семи основных компонентов ПИИК, указанных в пункте 7 раздела I Порядка № 1614, а именно:
- план действий по ПИИК
- СОП, основанные на доказательной базе
- обучение и подготовка
- эпидемиологический надзор за ИПМД
- мониторинг, оценка и обратная связь
- режим работы, штатное расписание и погрузка на кровать
- помещение, материалы и оборудование
Возраст должен использовать как минимум 11 СОП из ПИИК:
стандартные меры защиты (в соответствии с разделом XI Заходів та Засобів щодо попередження інфікування при проведенні догляду за пацієнтами, затверджених наказом МОЗ від 03.08.2020 № 1777; далее — Меры);
- меры защиты, основанные на недопущении инфицирования (в соответствии с мерами)
- профилактика инфицирования во время оперативных вмешательств
- профилактика катетер-ассоциированных инфекций кровотока
- профилактика вентилятор-ассоциированных пневмоний
- профилактика катетер-ассоциированных инфекций мочевыводящих путей
- профилактика передачи множественной резистентности микроорганизмов в антимикробные препараты
- очистка и дезинфекция поверхностей (в соответствии с приложением 8 к Мероприятиям)
- очищение, дезинфекция и стерилизация (репроцессинг) медицинских изделий
- рациональное использование антимикробных препаратов
- готовность к вспышкам инфекционных болезней и управлению ими.
Примеры мер по разработке и внедрению СОП по ПИИК указаны в разделе II приложения 2 к Порядку № 1614. Перед тем как вводить в действие новые СОП, обязательно проведите обучение для работников с отработкой практических навыков.
В ЗОЗ, оказывающих стационарную помощь, должны быть СОП:
- использование медицинских (хирургических) масок
- использование защитных халатов от инфекционных агентов
- использование защитных очков и щитков
- респираторная гигиена и этикет кашля для работников ЗОЗ
- респираторная гигиена и этикет кашля для пациентов
- выполнение инъекций
- обращение с бельем
- обращение с оборудованием
- обращение с инструментарием
- обращение с медицинскими отходами
- очистка помещений
- контактные меры защиты
- капельные меры защиты
- воздушные меры защиты
- профилактика заражения во время оперативных вмешательств
- профилактика катетер-ассоциированных инфекций кровотока
- профилактика вентилятор-ассоциированных пневмоний
- профилактика катетер-ассоциированных инфекций мочевыводящих путей
- профилактика передачи микроорганизмов с множественной и панрезистентной
- очищение, дезинфекция и стерилизация (репроцессинг) медицинских изделий
- рациональное использование антимикробных препаратов
- готовность к вспышкам инфекционных болезней и управлению ими.
- Наставництво в закладі охорони здоров’я: як організувати
- Як держава фінансуватиме БПР лікарів у 2023 році
- Як поліпшити гігієну рук: мультимодальний підхід ВООЗ
- Подарунок до Дня медичного працівника
Профилактические мероприятия ВБИ в лечебных заведениях
Санитарно-гигиенические мероприятия
- режим проветривания, вентиляция, кондиционеры (переносные воздухоочистители, раздельные вентиляционные каналы)
- уборка помещений (регулярность проведения, использование дезинфектантов, дезинфекция уборочного инвентаря)
- дезинфекция постельных принадлежностей, дезинфекционная камера
- разовые комплекты постельного белья
- сооблюдение санитарных норм оборудования боксов, изоляторов для больных ВБИ
- изоляция больных с осложнениями (роддом: мать и ребенок)
Наиболее действенным способом противодействия внутрибольничным инфекциям является выявление и изоляция больных (схема 2).
Схема 2
Помните: ежедневное, тщательное и неуклонное выполнение требований санитарно-гигиенического и противоэпидемического режима при выполнении своих профессиональных обязанностей составляет основу профилактики распространения внутрибольничных инфекций.
⭐ Ми осучаснили наш продукт ⭐ Ми зберегли нашу редакцію, наших експертів та провідних авторів, які знають все про галузь охорони здоров’я в Україні ⭐Працюємо та разом з усією країною рухаємося до Перемоги!
Внутрибольничные инфекции – различные инфекционные заболевания, заражение которыми произошло в условиях лечебного учреждения. В зависимости от степени распространения различают генерализованные (бактериемию, септицемию, септикопиемию, бактериальный шок) и локализованные формы внутрибольничных инфекций (с поражением кожи и подкожной клетчатки, дыхательной, сердечно-сосудистой, урогенитальной системы, костей и суставов, ЦНС и т. д.). Выявление возбудителей внутрибольничных инфекций проводится с помощью методов лабораторной диагностики (микроскопических, микробиологических, серологических, молекулярно-биологических). При лечении внутрибольничных инфекций используются антибиотики, антисептики, иммуностимуляторы, физиотерапия, экстракорпоральная гемокоррекция и т. д.
Общие сведения
Внутрибольничные (госпитальные, нозокомиальные) инфекции — инфекционные заболевания различной этиологии, возникшие у пациента или медицинского сотрудника в связи с пребыванием в лечебно-профилактическом учреждении. Инфекция считается внутрибольничной, если она развилась не ранее 48 часов после поступления больного в стационар. Распространенность внутрибольничных инфекций (ВБИ) в медицинских учреждениях различного профиля составляет 5-12%. Наибольший удельный вес внутрибольничных инфекций приходится на акушерские и хирургические стационары (отделения реанимации, абдоминальной хирургии, травматологии, ожоговой травмы, урологии, гинекологии, отоларингологии, стоматологии, онкологии и др.). Внутрибольничные инфекции представляют собой большую медико-социальную проблему, поскольку утяжеляют течение основного заболевания, увеличивают длительность лечения в 1,5 раза, а количество летальных исходов — в 5 раз.
Внутрибольничные инфекции
Этиология и эпидемиология внутрибольничных инфекций
Основными возбудителями внутрибольничных инфекций (85% от общего числа) выступают условно-патогенные микроорганизмы: грамположительные кокки (эпидермальный и золотистый стафилококк, бета-гемолитический стрептококк, пневмококк, энтерококк) и грамотрицательные палочковидные бактерии (клебсиеллы, эшерихии, энтеробактер, протей, псевдомонады и др.). Кроме этого, в этиологии внутрибольничных инфекций велика удельная роль вирусных возбудителей простого герпеса, аденовирусной инфекции, гриппа, парагриппа, цитомегалии, вирусных гепатитов, респираторно-синцитиальной инфекции, а также риновирусов, ротавирусов, энтеровирусов и пр. Также внутрибольничные инфекции могут быть вызваны условно-патогенными и патогенными грибами (дрожжеподобными, плесневыми, лучистыми). Особенностью внутригоспитальных штаммов условно-патогенных микроорганизмов служит их высокая изменчивость, лекарственная резистентность и устойчивость к воздействию факторов среды (ультрафиолета, дезинфектантов и пр.).
Источниками внутрибольничных инфекций в большинстве случаев выступают пациенты или медицинский персонал, являющиеся бактерионосителями или больными стертыми и манифестными формами патологии. Как показывают исследования, роль третьих лиц (в частности, посетителей стационаров) в распространении ВБИ невелика. Передача различных форм госпитальной инфекции реализуется с помощью воздушно-капельного, фекально-орального, контактного, трансмиссивного механизма. Кроме этого, возможен парентеральный путь передачи внутрибольничной инфекции при проведении различных инвазивных медицинских манипуляций: забора крови, инъекций, вакцинации, инструментальных манипуляций, операций, ИВЛ, гемодиализа и пр. Таким образом в медучреждении возможно заразиться гепатитами В, С и D, гнойно-воспалительными заболеваниями, сифилисом, ВИЧ-инфекцией. Известны случаи внутрибольничных вспышек легионеллеза при приеме больными лечебного душа и вихревых ванн.
Факторами, участвующими в распространении внутрибольничной инфекции, могут выступать контаминированные предметы ухода и обстановки, медицинский инструментарий и аппаратура, растворы для инфузионной терапии, спецодежда и руки медперсонала, изделия медицинского назначения многоразового использования (зонды, катетеры, эндоскопы), питьевая вода, постельные принадлежности, шовный и перевязочный материал и мн. др.
Значимость тех или иных видов внутрибольничной инфекции во многом зависит от профиля лечебного учреждения. Так, в ожоговых отделениях преобладает синегнойная инфекция, которая в основном передается через предметы ухода и руки персонала, а главным источником внутрибольничной инфекции являются сами пациенты. В учреждениях родовспоможения основную проблему представляет стафилококковая инфекция, распространяемая медицинским персоналом-носителем золотистого стафилококка. В урологических отделениях доминирует инфекция, вызываемая грамотрицательной флорой: кишечной, синегнойной палочкой и др. В педиатрических стационарах особую значимость имеет проблема распространения детских инфекций – ветряной оспы, эпидемического паротита, краснухи, кори. Возникновению и распространению внутрибольничной инфекции способствуют нарушение санитарно-эпидемиологического режима ЛПУ (несоблюдение личной гигиены, асептики и антисептики, режима дезинфекции и стерилизации, несвоевременное выявление и изоляция лиц-источников инфекции и т. д.).
К группе риска, в наибольшей степени подверженной развитию внутрибольничной инфекции, относятся новорожденные (особенно недоношенные) и дети раннего возраста; пожилые и ослабленные пациенты; лица, страдающие хроническими заболеваниями (сахарным диабетом, болезнями крови, почечной недостаточностью), иммунодефицитом, онкопатологией. Восприимчивость человека к внутрибольничным инфекциям увеличивается при наличии у него открытых ран, полостных дренажей, внутрисосудистых и мочевых катетеров, трахеостомы и других инвазивных устройств. На частоту возникновения и тяжесть течения внутрибольничной инфекции влияет долгое нахождение пациента в стационаре, длительная антибиотикотерапия, иммуносупрессивная терапия.
Классификация внутрибольничных инфекций
По длительности течения внутрибольничные инфекции делятся на острые, подострые и хронические; по тяжести клинических проявлений – на легкие, среднетяжелые и тяжелые формы. В зависимости от степени распространенности инфекционного процесса различают генерализованные и локализованные формы внутрибольничной инфекции. Генерализованные инфекции представлены бактериемией, септицемией, бактериальным шоком. В свою очередь, среди локализованных форм выделяют:
- инфекции кожи, слизистых и подкожной клетчатки, в т. ч. послеоперационных, ожоговых, травматических ран. В частности, к их числу относятся омфалит, абсцессы и флегмоны, пиодермия, рожа, мастит, парапроктит, грибковые инфекции кожи и др.
- инфекции полости рта (стоматит) и ЛОР-органов (ангина, фарингит, ларингит, эпиглоттит, ринит, синусит, отит, мастоидит)
- инфекции бронхолегочной системы (бронхит, пневмония, плеврит, абсцесс легкого, гангрена легкого, эмпиема плевры, медиастинит)
- инфекции пищеварительной системы (гастрит, энтерит, колит, вирусные гепатиты)
- глазные инфекции (блефарит, конъюнктивит, кератит)
- инфекции урогенитального тракта (бактериурия, уретрит, цистит, пиелонефрит, эндометрит, аднексит)
- инфекции костно-суставной системы (бурсит, артрит, остеомиелит)
- инфекции сердца и сосудов (перикардит, миокардит, эндокардит, тромбофлебиты).
- инфекции ЦНС (абсцесс мозга, менингит, миелит и др.).
В структуре внутрибольничных инфекций на долю гнойно-септических заболеваний приходится 75-80%, кишечных инфекций — 8-12%, гемоконтактных инфекций — 6-7%. На прочие инфекционные заболевания (ротавирусные инфекции, дифтерию, туберкулез, микозы и др.) приходится около 5-6%.
Диагностика внутрибольничных инфекций
Критериями, позволяющими думать о развитии внутрибольничной инфекции, служат: возникновение клинических признаков заболевания не ранее чем через 48 часов после поступления в стационар; связь с проведением инвазивного вмешательства; установление источника инфекции и фактора передачи. Окончательное суждение о характере инфекционного процесса получают после идентификации штамма возбудителя с помощью лабораторных методов диагностики.
Для исключения или подтверждения бактериемии проводится бактериологический посев крови на стерильность, желательно не менее 2-3-х раз. При локализованных формах внутрибольничной инфекции микробиологическое выделение возбудителя может быть произведено из других биологических сред, в связи с чем выполняется посев мочи, кала, мокроты, отделяемого ран, материала из зева, мазка с конъюнктивы, из половых путей на микрофлору. Дополнительно к культуральному методу выявления возбудителей внутрибольничных инфекций используются микроскопия, серологические реакции (РСК, РА, ИФА, РИА), вирусологический, молекулярно-биологический (ПЦР) методы.
Лечение внутрибольничных инфекций
Сложности лечения внутрибольничной инфекции обусловлены ее развитием в ослабленном организме, на фоне основной патологии, а также резистентностью госпитальных штаммов к традиционной фармакотерапии. Больные с диагностированными инфекционными процессами подлежат изоляции; в отделении проводится тщательная текущая и заключительная дезинфекция. Выбор противомикробного препарата основывается на особенностях антибиотикограммы: при внутрибольничной инфекции, вызванной грамположительной флорой наиболее эффективен ванкомицин; грамотрицательными микроорганизмами – карбапенемы, цефалоспорины IV поколения, аминогликозиды. Возможно дополнительное применение специфических бактериофагов, иммуностимуляторов, интерферона, лейкоцитарной массы, витаминотерапии.
При необходимости проводится чрескожное облучение крови (ВЛОК, УФОК), экстракорпоральная гемокоррекция (гемосорбция, лимфосорбция). Симптоматическая терапия осуществляется с учетом клинической формы внутрибольничной инфекции с участием специалистов соответствующего профиля: хирургов, травматологов, пульмонологов, урологов, гинекологов и др.
Профилактика внутрибольничных инфекций
Основные меры профилактики внутрибольничных инфекций сводятся к соблюдению санитарно-гигиенических и противоэпидемических требований. В первую очередь, это касается режима дезинфекции помещений и предметов ухода, применения современных высокоэффективных антисептиков, проведения качественной предстерилизационной обработки и стерилизации инструментария, безукоснительного следования правилам асептики и антисептики.
Медицинский персонал должен соблюдать меры индивидуальной защиты при проведении инвазивных процедур: работать в резиновых перчатках, защитных очках и маске; осторожно обращаться с медицинским инструментарием. Большое значение в профилактике внутрибольничных инфекций имеет вакцинация медработников от гепатита В, краснухи, гриппа, дифтерии, столбняка и других инфекций. Все сотрудники ЛПУ подлежат регулярному плановому диспансерному обследованию, направленному на выявление носительства патогенов. Предупредить возникновение и распространение внутрибольничных инфекций позволит сокращение сроков госпитализации пациентов, рациональная антибиотикотерапия, обоснованность проведения инвазивных диагностических и лечебных процедур, эпидемиологический контроль в ЛПУ.
- Главная
- Журнал «Медицинские новости»
- Архив
- №11, 2006
- Внутрибольничная инфекция в неонатологии
Внутрибольничная инфекция в неонатологии
Белорусский государственный медицинский университет
Внутрибольничные инфекции (ВБИ) являются важнейшей проблемой современной медицины и приобретают все большую медицинскую и социальную значимость. ВБИ (синонимы: госпитальная, внутригоспитальная, больничная, нозокомиальная) – инфекция, заражение которой происходит в лечебно-профилактическом учреждении [1, 4, 12]. Заболеваемость ВБИ на протяжении последних лет обнаруживает тенденцию к росту. Причины данного явления – создание крупных больничных комплексов, где концентрируется большое количество ослабленных лиц, увеличение числа инвазивных диагностических и лечебных процедур, использование сложного медицинского оборудования, стерилизация которого сопряжена с большими трудностями. В результате формируются госпитальные штаммы микроорганизмов, обладающие устойчивостью к лекарственным препаратам и дезинфектантам [2, 5, 8, 16]. Способствующими факторами являются увеличение в популяции групп повышенного риска, в том числе недоношенных детей, лиц с хроническими заболеваниями, демографические сдвиги в обществе, а также снижение резистентности организма в связи с неблагоприятными экологическими условиями [3, 9].
Согласно наблюдениям, ВБИ возникают по меньшей мере у 5–7% больных, находящихся в лечебных учреждениях. По данным официальной статистики, ежегодно в России регистрируется 50–60 тыс. случаев внутрибольничного инфицирования, однако по расчетным данным эта цифра в 40–50 раз больше. Присоединение ВБИ к основному заболеванию увеличивает продолжительность пребывания пациента в стационаре в среднем на 6–8 сут. По минимальным расчетам ущерб, наносимый ВБИ, в России составляет ежегодно около 5,6 млрд руб. Летальность в группе лиц с ВБИ значительно превышает таковую среди аналогичных больных без данной патологии [12,14].
Большинство исследований ВБИ посвящено взрослым. В 60-х годах ХХ в. уровень ВБИ, по данным различных зарубежных педиатрических клиник, составлял от 2,8 до 6,5% [39], в конце 80-х — 6,0% [23]. Регистрация ВБИ новорожденных проводится в России с середины 70-х годов. За этот период произошло снижение заболеваемости более чем в 3 раза (с 56 до 17,9% на 1000 детей, родившихся живыми). Тем не менее данный показатель остается достаточно высоким. Характерная современная особенность детской инфекционной патологии — возрастание частоты ВБИ, клинически проявляющихся в форме гнойно-воспалительных и септических заболеваний, этиологически связанных с группой условно-патогенных микроорганизмов [6, 7].
Повышение качества оказания медицинской помощи новорожденным за счет создания отделений реанимации, оснащения их современным оборудованием, внедрения протоколов и рекомендаций по лечению в неонатальном периоде, рост профессионального уровня подготовки специалистов — все это позволило снизить перинатальную и раннюю неонатальную смертность. Однако решение одних сложных проблем привело к появлению других, не менее значимых, в том числе к росту ВБИ в отделениях реанимации и интенсивной терапии и отделениях выхаживания новорожденных [10, 47].
По данным исследований центров по контролю и профилактике болезней США, Европы и Межведомственного научного совета по ВБИ (Россия), частота развития ВБИ у новорожденных в педиатрических клиниках составляет 4 — 7%. В «проблемных» отделениях, где особенно высок риск госпитального инфицирования, этот показатель достигает 8–11%. К таким отделениям наряду с отделениями хирургии, реанимации и интенсивной терапии относят отделения выхаживания недоношенных детей, так как продолжительность пребывания в стационаре новорожденных с низкой и экстремально низкой массой тела при рождении составляет от 2 до 3 мес [6, 14, 28]. Развитие ВБИ у новорожденных в «проблемных» отделениях приводит к увеличению срока госпитализации, а также финансовых расходов. Например, стоимость лечения новорожденных с ВБИ в отделениях реанимации и интенсивной терапии составляет около 2500–3000 евро в сутки в Европе и 4000–5000 долларов в США [6].
Инфекции в неонатальном периоде отличаются от инфекционных заболеваний других периодов жизни. Новорожденные, особенно недоношенные, обладают сниженной иммунологической резистентностью. Данное обстоятельство, а также наличие факторов риска в процессе госпитализации обусловливают более высокий уровень ВБИ у новорожденных. Так, в США уровень ВБИ в отделениях интенсивной терапии и реанимации новорожденных составляет от 5,9 до 31,8%. При этом необходимо отметить, что диагностика инфекции в неонатальном периоде требует учета различных клинических факторов и не имеет четких лабораторных критериев [11, 34, 37].
Основные факторы риска развития ВБИ у новорожденных [33, 35, 46, 48]:
· малый гестационный возраст (особенно менее 32 нед.);
· морфофункциональная незрелость и наличие перинатальной патологии;
· длительный период госпитализации;
· применение медицинского инструментария (сосудистые катетеры, интубационные трубки, назальные канюли, мочевые катетеры и др.) и оборудования (аппараты ИВЛ, мониторы, электроды, манжетки, ингаляторы, отсосы и др.);
· медикаментозная терапия (антибактериальная, иммуносупрессивная, трансфузии кровезаменителей, плазмы, препаратов для парентерального питания);
· врожденные пороки;
· расстройства энтерального питания;
· хирургические вмешательства.
К факторам, способствующим развитию ВБИ, относится низкий вес новорожденного. Так, на каждые 500 г снижения массы тела наблюдается возрастание уровня ВБИ на 3%. Кроме того, отмечен рост частоты ВБИ в 2,2 раза у младенцев с массой тела менее 1500 г по сравнению с детьми, имеющими большую массу [25, 37]. Частота развития ВБИ у недоношенных детей обратно пропорциональна гестационному возрасту. Наиболее часто ВБИ возникают у недоношенных младенцев, гестационный возраст которых менее 32 нед., у новорожденных с перинатальной патологией и морфофункциональной незрелостью. Особенностью ВБИ у таких детей является развитие осложнения на фоне сниженной иммунологической резистентности организма. Поэтому непосредственно после рождения окружающая среда для младенцев, поступающих в отделение интенсивной терапии и отделение выхаживания, является «враждебной» [21].
Риск развития ВБИ возрастает при увеличении длительности пребывания в лечебном учреждении. В среднем этот показатель у младенцев с ВБИ в 2,65 раза выше по сравнению с новорожденными без данной патологии [39]. Колонизация детей условно-патогенной микрофлорой происходит в первые часы при контакте с медицинским персоналом через руки и через предметы окружающей среды (ИВЛ, катетеризация центральных и периферических сосудов, мониторинг жизненно важных функций организма, диагностические исследования и т.д.). ИВЛ — важный фактор, способствующий развитию ВБИ. Сообщается о возникновении от 3,1 до 143 пневмоний на каждые 1000 суток ИВЛ. При интубации новорожденных в течение 72 ч или реинтубации в 2 раза повышается частота колонизации и инфицирования верхних дыхательных путей. Большинство детей при проведении ИВЛ имеют признаки ВБИ [27, 29].
Наличие внутрисосудистых катетеров позволяет безболезненно выполнять инъекции и значительно облегчает труд медицинского персонала. В то же время это обусловливает вероятность развития катетер-ассоциированных инфекций, уровень которых может достигать 30%. Наличие центрального венозного катетера у младенца весом менее 1500 г увеличивает риск развития сепсиса в 1,7 раза. Особенно высок риск при постановке пупочных катетеров. Нахождение катетера в пупочной вене более 5 сут повышает риск возникновения сепсиса по крайней мере в 21 раз, а в пупочной артерии – в 16 раз [32, 37].
Важным фактором развития ВБИ является антибактериальная терапия. Длительное и не всегда обоснованное лечение с использованием антибиотиков резерва в качестве эмпирической терапии приводит к селекции вирулентных госпитальных штаммов и увеличению частоты ВБИ. При этом не только снижается эффективность лечения, но и изменяется нормальная микрофлора кишечника с нарушением колонизационной резистентности [13, 40]. Нерациональная антибиотикотерапия способствует понижению уровня секреторного IgA, особенно у детей с малым сроком гестации, вследствие чего увеличивается проницаемость естественных слизистых барьеров, в том числе слизистой кишечника. Нарушение локальных механизмов иммунной защиты приводит к активизации условно-патогенной микрофлоры, способствует транслокации микроорганизмов из кишечника и возникновению очагов бактериальной инфекции во внутренних органах [22].
В большинстве случаев антибиотики назначаются новорожденным в связи с подозрением на развитие инфекции, трудностью постановки диагноза и риском летальности. До 75% новорожденных в отделениях интенсивной терапии и реанимации получают антибиотики в первые 3 сут жизни, еще выше этот процент у младенцев со сниженной массой тела при рождении. Исследования свидетельствуют о возрастании риска развития сепсиса при пролонгированном назначении антибиотиков в отсутствие доказанной инфекции [23].
В связи с этим чрезвычайно важно раннее (в первые часы после рождения) энтеральное кормление детей грудным нативным или донорским пастеризованным молоком. Необоснованное применение иммуносупрессивных препаратов (например, глюкокортикоидов) у новорожденных приводит к тяжелому, затяжному или молниеносному течению ВБИ. Следует также учитывать, что многие лекарственные препараты оказывают токсическое действие, угнетают функцию органов кроветворения и иммунной защиты, поэтому назначение каждого медикамента должно быть строго обоснованным [4, 39].
Необходимо помнить, что инфузионные растворы являются питательной средой для микроорганизмов. Некоторые виды грамположительных микробов и C. albicans хорошо размножаются в растворах аминокислот и жировых эмульсий, грамотрицательные бактерии (ГОБ) – в растворах глюкозы. Липидные эмульсии являются источником высококалорийного питания, в то же время они способствуют росту различных микроорганизмов и влияют на функциональную активность нейтрофилов и макрофагов. Риск развития бактериемии коагулазонегативными стафилококками может быть обусловлен липидными эмульсиями. Для инфузии жировых эмульсий рекомендуется использовать только новые системы, исключается добавление к ним других лекарственных средств [18, 26].
Фактор риска развития ВБИ — хирургическое вмешательство, так как операция, вызывая тяжелую травму, существенно снижает иммунологическую резистентность младенца в послеоперационном периоде [15, 17]. Проявления ВБИ в неонатологических отделениях в ряде случаев рассматриваются как внутриутробная инфекция, что искажает реальную клиническую ситуацию, ведет к недооценке санитарно-эпидемиологической обстановки и росту частоты госпитального инфицирования. К перинатальным инфекциям относят заболевания, дебют которых приходится на первые 72 ч после рождения: синдром аспирации инфицированной околоплодной жидкости, рано начавшийся сепсис, менингит, некротический энтероколит и ряд других болезней [39].
В отделениях реанимации и патологии новорожденных в структуре ВБИ пневмонии занимают лидирующее положение. Причем в последнее десятилетие отмечается тенденция к росту частоты пневмоний с 11 до 18%. Данную ситуацию можно объяснить увеличением частоты рождения детей с низкой и экстремально низкой массой тела, которым проводится длительная ИВЛ. Очень низким, по данным регистрации, является уровень ВБИ мочевыводящих путей, удельный вес которых составляет менее 0,1%, между тем как в европейских странах и США они занимают первое место, достигая 31–36%. По данным зарубежных авторов, частота внутрибольничного сепсиса у новорожденных составляет 17%, инфекции кожи и мягких тканей — 15%, менингита — 10%, катетеризационного сепсиса — 1,9%. Разницы в частоте ВБИ у детей в зависимости от пола не установлено. Различия в частоте ВБИ обусловлены особенностями неонатологических отделений [6, 14, 36].
У детей с хирургической патологией частота ВБИ составляет 6,2%. В то же время у новорожденных данный показатель достигает 5,8%, у детей грудного возраста – 8,1%, у детей старшего возраста – 5,5% [19]. Среди ВБИ у новорожденных с хирургической патологией наиболее часто встречается сепсис, далее следуют раневая инфекция, пневмония и инфекция мочевыводящих путей. Отмечается значительно более низкая частота инфекции мочевыводящих путей у новорожденных (9,4%) по сравнению с взрослыми (35,0–40,0%), что, возможно, обусловлено более редкими случаями использования катетеризации мочевого пузыря и частым применением подгузников. Средний интервал времени развития ВБИ после операции составляет 7 сут (от 2 до 45 сут).
ВБИ чаще развиваются у новорожденных, перенесших несколько операций, особенно если длительность хирургического вмешательства превышает 1 ч и выполняется оно в экстренном порядке. Необходимо отметить, что среди детей с хирургической патологией сепсис наиболее часто встречается у новорожденных, тогда как раневая инфекция – у детей старше 1 года. Более низкая частота раневой инфекции у новорожденных, обладающих сниженной резистентностью организма, вероятно, обусловлена тем, что локальные факторы (хирургическая техника, контаминация раны) и длительность операции играют большую роль в развитии инфекции по сравнению с факторами иммунной защиты.
Точная роль ВБИ в летальности новорожденных не известна. Однако несомненно влияние ВБИ на этот показатель, особенно у тяжело больных младенцев. Летальность новорожденных при развитии ВБИ может превышать 25%. Тактика предупреждения развития ВБИ у новорожденных постоянно совершенствуется, главной целью является уменьшение вероятности развития ВБИ у младенцев с высоким риском инфицирования [30].
Данные микробиологического исследования отделений новорожденных позволили выявить существенные изменения этиологической структуры ВБИ в последние годы. До настоящего времени в родильных домах превалирует инфекция, вызванная госпитальными штаммами S. aureus, обладающими множественной лекарственной устойчивостью. Однако вспышки ВБИ, как правило, обусловлены грамотрицательными бактериями (эшерихии, синегнойная палочка, клебсиеллы, протей). В целом в связи с переходом родильных домов на систему работы по принципу мать–дитя и семейно-ориентированное родовспоможение (раннее прикладывание новорожденных к груди, свободное вскармливание, ранняя выписка на 2–4-е сутки после родов) наблюдается тенденция к снижению заболеваемости и уменьшению количества ВБИ [12].
На этапе выхаживания новорожденных ВБИ определяются у 65–70% детей, большая часть которых поступает в стационар уже с очагом инфекции. Первое место в качестве возбудителя занимают ГОБ (28–40% в виде монокультуры и 60–70% в ассоциации с золотистым стафилококком). Среди грамотрицательной микрофлоры чаще всего выделяются клебсиеллы, сине-гнойная палочка, эшерихии, протей. Второе место у стафилококков. При этом следует подчеркнуть превалирование эпидермального стафилококка. По мере увеличения срока пребывания в стационаре возрастает количество детей с ВБИ, обусловленными грибами рода Candida. До 16% новорожденных заболевают кандидозом, для которого характерно поражение большого числа биотопов с преобладанием локализованных форм (молочница, дерматит), однако наблюдаются и генерализованные формы заболевания. Отмечается возникновение групповых случаев менингита, обусловленных C. albicans, резистентных к нистатину, леворину (88–90%) и амфотерицину [7, 10].
Расширяется спектр возбудителей ВБИ за счет появления новых видов ГОБ, принадлежащих в основном к семействам Enterobacteriaceae и Pseudomonadaceae. В возникновении ВБИ у новорожденных доказана роль 23 видов условно-патогенных микроорганизмов, относящихся к семействам Enterobacteriaceae (роды Escherichia, Proteus, Citrobacter, Klebsiella, Enterobacter, Hafnia, Yersinia, Edwardsiella), Pseudomonadaceae (род Pseudomonas), Neisseriaceae (род Acinetobacter) [45, 46].
На протяжении последних 20 лет наблюдается изменение удельного веса отдельных групп и видов микроорганизмов в этиологической структуре ВБИ новорожденных. Так, удельный вес стафилококков (в основном S. aureus) снизился с 65,3 до 4,9%. Обратная зависимость отмечается в отношении энтеробактерий и псевдомонад. Долевое участие энтеробактерий среди возбудителей ВБИ возросло с 25,0 до 59,3%. В 80-х годах ХХ в. наиболее частыми возбудителями были K. pneumoniae, P. mirabilis и E.coli, выделяемые примерно с одинаковой частотой. Затем доля протея постепенно снизилась, и его место стали занимать K. oxytoca и E. cloacae. В первой половине 90-х годов доминирующим этиологическим агентом среди возбудителей ВБИ у новорожденных стала K. pneumoniae [10, 14].
Удельный вес псевдомонад постепенно повышался и достиг в начале 90-х годов пика – 29,5%, оставаясь на этом уровне до сих пор. Однако внутри рода также произошли изменения за счет снижения удельного веса P. aeruginosa и увеличения доли других видов, главным образом P. fluorescens. Долевое участие A. calcoaceticus не превышает 8,6%. Необходимо отметить возрастающую роль грибов, особенно рода Candida [41].
Таким образом, микробиологический мониторинг позволил выявить динамику возбудителей ВБИ у новорожденных – расширение спектра возбудителей и смену этиологической значимости отдельных видов. На смену стафилококковым инфекциям пришли заболевания, обусловленные ГОБ. Выявлена неоднозначная роль грамотрицательной микрофлоры в структуре ВБИ. Так, пневмония у новорожденных со второй половины 80-х годов вызывалась почти исключительно ГОБ, среди которых доминировали K. pneumoniae и P. aeruginоsa, обусловившие по 34,2% случаев заболевания каждый. Преобладание удельного веса ГОБ в посевах крови и крови из пупочной культи стало отмечаться с конца 80-х годов, причем долевое участие этой флоры в этиологической структуре сепсиса достигло 80%, а в этиологии омфалита – 95% [43, 44].
При сепсисе у новорожденных наиболее часто выделяются P. aeruginоsa (25,5%), S. aureus (20,2%), K. pneumoniae (18,4%), P. mirabilis (10,5%); при омфалите – S. aureus (21,3%), K. pneumoniae (18,4%), P. aeruginosa (16,9%), P. mirabilis (15,5%), E. coli (10,6%). Возросла роль S. epidermidis в этиологии сепсиса. Из патологического отделяемого конъюнктивы у новорожденных выделяются S. aureus (28,1%), P. aeruginosa (19,1%), K. pneumoniae (17,4%), S. epidermidis (12,9%). При локализованных инфекциях кожи и подкожной клетчатки ведущим агентом остается S. aureus (54,6%) [10, 12].
Следует отметить возросшую вероятность развития катетер-ассоциированного сепсиса у новорожденных. Результаты микробиологического исследования смывов из просвета удаленных сосудистых катетеров оказываются положительными в 1/3 случаев. Причем среди обнаруженных возбудителей доминирует коагулазонегативный стафилококк. Как известно, данный возбудитель формирует защитный слой, затрудняющий доступ антибиотикам и позволяющий микроорганизмам «прилипать» к сосудистым катетерам. «Загрязнение» катетера пупочной артерии отмечается в 38% случаев при длительности катетеризации 8 сут, пупочной вены – в 28% при стоянии катетера 3,8 сут, центральных вен – в 43% при нахождении катетера 15,8 сут. В качестве возбудителей катетеризационного сепсиса выступают также грибы рода Candida и клебсиелла. Отмечается прямо пропорциональная зависимость между длительностью катетеризации и частотой контаминации катетера. Сообщается о том, что вероятность контаминации значительно возрастает после 30 суток катетеризации центральных вен [20, 31].
Необходимо отметить, что сдвиги в этиологии сопровождаются изменением нозологической структуры ВБИ у новорожденных. Количество локализованных форм хирургической инфекции в пересчете на один случай сепсиса возросло с 2,7 до 21,7. Увеличился удельный вес конъюнктивита с 12,5 до 40,4%, пневмонии — с 1,4 до 8,8%, тогда как доля омфалита уменьшилась с 43,1 до 12,5%. Частота воспалительных заболеваний кожи и подкожной клетчатки имеет тенденцию к росту – с 15,3 до 19,1% [6, 8, 9]. Исследования зарубежных авторов, посвященные данной проблеме, свидетельствуют о том, что при некотором различии в спектре возбудителей ВБИ у новорожденных в различных странах в целом отмечается глобальная тенденция к увеличению доли заболеваний, обусловленных грамотрицательными условно-патогенными микроорганизмами, в частности представителями семейства Enterobacteriaceae [28, 34, 47].
Изучение резистентности возбудителей ВБИ у новорожденных показывает, что клебсиелла наиболее чувствительна к амикацину и цефотаксиму, синегнойная палочка – к амикацину, колистину, тиенаму и цефзулодину. Кишечная палочка в большинстве наблюдений чувствительна к амикацину и цефалоспоринам III поколения (цефотаксим, цефтриаксон и др.). При инфекциях, вызванных коагулазонегативным стафилококком, наиболее эффективны клиндамицин и ванкомицин [13].
Эволюция спектра потенциально патогенной микрофлоры — сложный и малоизученный процесс. На структуру и уровень заболеваемости новорожденных ВБИ может оказывать влияние совокупность ряда факторов. К ним относятся формирование и широкое распространение в родовспомогательных учреждениях штаммов грамотрицательных микроорганизмов, отличающихся высокой вирулентностью, полирезистентностью к антибиотиками, повышенной устойчивостью к дезинфектантам и антисептикам и играющих важную роль в процессе колонизации организма новорожденных [4, 5, 14, 39].
Имеют значение увеличение количества детей из групп риска по реализации инфицирования, профилактическое применение антибиотиков, приводящее к элиминации у детей материнской микрофлоры и усилению колонизации госпитальными штаммами. Оказывает влияние использование современных методов интенсивной терапии, не только способствующих повышению выживаемости новорожденных, но и создающих условия для появления новых возбудителей ВБИ. Следует иметь в виду и нарушения санитарно-гигиенического режима в родильных домах и отделениях новорожденных [7, 27, 36]. Эволюционные изменения возбудителей ВБИ у новорожденных обусловливают необходимость мониторинга этиологической структуры патогенов, изучения их биологических свойств, антибиотико- и антисептикорезистентности, причин и механизмов формирования факторов вирулентности. Полученные данные должны быть основой разработки мер профилактики ВБИ и мероприятий по борьбе с ними [3, 15, 16].
Основные направления профилактики ВБИ [6, 12, 47]:
· оптимизация системы эпидемиологического надзора за ВБИ;
· совершенствование лабораторной диагностики и мониторинга возбудителей ВБИ;
· повышение эффективности дезинфекционных мероприятий;
· повышение эффективности стерилизационных мероприятий;
· разработка стратегии и тактики применения антибиотиков и химиопрепаратов;
· оптимизация профилактики и методов борьбы с ВБИ, имеющих различные пути передачи возбудителей;
· рационализация основных принципов больничной гигиены;
· оптимизация профилактики ВБИ медицинского персонала;
· оценка экономической эффективности мероприятий по профилактике ВБИ.
Большое значение в профилактике ВБИ имеет архитектурная планировка родовспомогательных учреждений. Практикуемое в типовых проектах размещение обсервационного отделения на 1-м этаже способствует циркуляции микроорганизмов по всему зданию. Теплый воздух поднимается снизу вверх, поэтому за счет «неорганизованных» потоков воздуха по лестничным пролетам, лифтовым шахтам и т.д. идет перемещение микроорганизмов как по горизонтали (в пределах этажа), так и по вертикали (между этажами). Обсервационное отделение целесообразно размещать в отдельно стоящих зданиях либо в изолированных пристройках [11].
Одним из факторов, способствующих распространению микроорганизмов в объеме здания, являются дефекты вентиляционной системы, заложенные уже при ее проектировании. Вместо того чтобы удалять загрязненный воздух из палат, система приточно-вытяжной вентиляции позволяет перемещаться значительному количеству микроорганизмов по всему зданию. При контроле за работой вентиляционной системы необходимо обращать внимание на емкости с водой для увлажнения воздуха, так как некоторые микроорганизмы (род Pseudomonas и др.) хорошо размножаются во влажных условиях и в дальнейшем с током воздуха разносятся по всем этажам здания [4].
Целесообразно пересмотреть режим работы отделений патологии беременности. В силу изоляции акушерских стационаров в них сложились благоприятные условия для селекции госпитальных штаммов бактерий в связи с отсутствием конкурирующей микрофлоры. Женщины находятся в этих отделениях длительное время, иногда весь период беременности, что способствует их колонизации. К моменту родов они получают весь набор госпитальных штаммов, циркулирующих в родовспомогательном учреждении. Большую опасность представляют роженицы с патологией урогенитального тракта. В послеродовом периоде у таких родильниц и новорожденных наиболее часто регистрируются ВБИ [11].
Профилактике ВБИ у новорожденных способствует снижение числа инвазивных процедур. Показано, что если частота влагалищных исследований во время родов менее 7, то риск развития эндометрита у родильниц в послеродовом периоде составляет 27%, при увеличении количества исследований — 71% и более [39, 47].
В отличие от зарубежных стран, где кесарево сечение производится в основном в плановом порядке, в странах СНГ экстренное оперативное вмешательство наиболее часто выполняется во втором периоде родов. При этом происходит контаминация операционной раны эндометриальными микроорганизмами. Если при плановом кесаревом сечении частота развития эндометрита составляет 5%, то при экстренных операциях у женщин, относящихся к группам риска, – до 85% (при естественных родах 1–3%). Перспективным направлением предупреждения ВБИ является применение оборудования и материалов одноразового использования [11].
Давно доказано преимущество совместного пребывания после родов матери и ребенка. В ряде акушерских стационаров в связи с сокращением количества родов в последнее время практикуется объединять мать и ребенка через сутки после родов, создавая щадящий режим родильнице. Однако при таком подходе теряется одно из преимуществ совместного пребывания, так как ребенок в первые сутки жизни заселяется не материнскими штаммами микроорганизмов, а бактериями, которые циркулируют в детских палатах [6, 11].
Профилактика ВБИ включает комплекс дезинфекционных мероприятий, направленных на уничтожение патогенных и условно-патогенных микроорганизмов на объектах в окружении пациента. Лучшими средствами для дезинфекции изделий медицинского назначения считаются композиции на основе четвертичных аммониевых соединений, альдегидов, катионных поверхностно-активных веществ (ПАВ) и спиртов. Обладая широким спектром действия, данные соединения оказывают щадящее влияние на материал изделия, не нарушают его функциональные характеристики и обладают моющими свойствами [14, 34]. Основная роль как источника инфекции в родовспомогательных учреждениях принадлежит медицинскому персоналу. В качестве кожных антисептиков для обеззараживания рук медперсонала, обработки инъекционного и операционного поля целесообразно применение средств на основе спиртов (этилового, изопропилового и др.) с добавлением катионных ПАВ [4, 38].
Интерпретацию полученных данных бактериологического исследования необходимо проводить совместно с микробиологом. При выделении возбудителей, чувствительных к антибактериальным препаратам, продолжают назначенное лечение. Показанием для изменения антибактериальной терапии является ухудшение на фоне проводимого лечения клинико-лабораторных данных через 48–72 ч.
Учитывая, что при ВБИ новорожденных большую роль играет синегнойная палочка, для лечения рекомендуется назначение комбинации аминогликозида с цефтазидимом или цефзулодином. При катетеризационном сепсисе в первую очередь показано проведение антимикробной терапии, направленной главным образом против S. epidermidis и грибов рода Candida. В подобных случаях после удаления катетера в качестве антимикотической терапии используется комбинация амфотерицина В и флуцитозина. Поскольку большинство ВБИ вызвано условно-патогенными микроорганизмами, у пациентов, относящихся к контингентам риска, необходимо расширять применение иммуномодуляторов и эубиотиков, стимулирующих выработку факторов неспецифической резистентности организма [13, 39].
При микробиологическом мониторинге, являющемся составной частью эпидемиологического надзора, в центре внимания должны находиться пациент, расшифровка этиологической структуры ВБИ и характеристика госпитальных штаммов микроорганизмов [1, 8, 16]. Нецелесообразны плановые обследования медицинского персонала на носительство золотистого стафилококка и санация выявленных носителей. Эти мероприятия показаны лишь при осложнении эпидемиологической ситуации. Малоэффективны и плановые санитарно-эпидемиологические обследования окружающей среды. Основное внимание обращается на эпидемиологически значимые объекты – контроль стерильности медицинских инструментов, перевязочного материала, а также исследование жидких лекарственных форм и детских молочных смесей [12, 14]. Совместная работа клинициста, эпидемиолога и бактериолога — залог снижения частоты ВБИ в неонатологических отделениях.
Литература
1. Адарченко А.А. // Здравоохранение. – 2000. – N 8. – С. 41–43.
2. Бадиков В.Д., Знаменский А.В., Белов А.Б. и др. // Воен.-мед. журнал. – 2000. – Т. СССХХI, N 9. – С. 51–56.
3. Бусуек Г.П., Генчиков Л.А., Шагинян И.А., Марголина С.А. // ЖМЭИ. – 2002. – N 1. – С. 32–37.
4. Внутрибольничные инфекции / Под ред. Р.П. Венцелла; Пер. с англ. – М.: Медицина, 1990.
5. Гельфанд Б.Р., Гологорский В.А., Лапшина И.Ю. и др. // Анестезиология и реаниматология. – 1997. – N 3. – С. 4–7.
6. Касихина С.А., Милева О.И., Морозова Е.Н., Потапова О.В. // Педиатрия. – 2004. – N 3. – С. 66–69.
7. Ковалева Е.П., Семина Н.А. // Эпидемиология и инфекц. болезни. – 2002. – N 5. – С. 4–6.
8. Красильников А.П. // Здравоохр. Белоруссии. – 1987. – N 2. – С. 59–66.
9. Меньшиков Д.Д., Каншин Н.Н., Пахомова Г.В. и др. // Эпидемиология и инфекц. болезни. – 2000. – N 5. – С. 44–46.
10. Мусина Л.Т., Семина Н.А. Гладкова К.К. // Рос. вестник перинатологии и педиатрии. – 1995. – Т. 40, N 1. – С. 39–42.
Медицинские новости. – 2006. — №11. С. 37-43.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.
Содержание »
Архив »