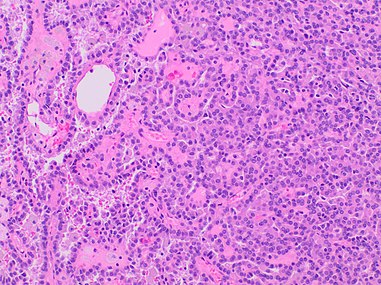
Рак почки (синоним почечно-клеточный рак) является наиболее распространенной злокачественной опухолью почек и составляет более 90 % всех злокачественных опухолей данного органа. Он развивается из эпителия проксимальных канальцев или собирательных трубочек почек.
Опухоль почки является 15-м наиболее распространенным видом рака во всем мире. И, по прогнозам, заболеваемость будет расти в ближайшие годы. В Европе рак почки стал причиной более 50 000 смертей в 2018 году. В настоящее время более 50% случаев рака почки во всем мире диагностируются случайно у бессимптомных людей во время обследования других заболеваний.
По оценкам, к 2020 году будет выявлено 73 750 случаев рака почек (5% всех случаев рака у мужчин и 3% всех случаев рака у женщин), и 14 830 человек умрут от этой болезни. Это опухоль чаще диагностируется у старшей возрастной группы, в возрасте от 60 до 70 лет. Соотношение мужчин и женщин составляет примерно 2 к 1. В отличие от заболеваемости, смертность от которой с 2008 года ежегодно снижается примерно на 1%, что напрямую связано с выявлением и лечением данного заболевания.
Наиболее распространенным типом опухоли, возникающим в почках, является почечно-клеточный рак (он же гипернефрома или опухоль Гравица), составляющий более 9 из 10 случаев рака почки у взрослых. Другие типы включают переходно-клеточный рак почечной лоханки и саркому почки (редкая опухоль).
К факторам риска относится:
- ожирение,
- курение,
- высокое артериальное давление,
- сахарный диабет,
- вирусный гепатит,
- поликистозное заболевание почек,
- хроническая болезнь почек,
- нахождение на гемодиализе (искусственная почка),
- наследственность (наличие гена VHL).
Самым сильным фактором риска развития почечно-клеточного рака является курение. Высокому риску подвергаются не только люди, курящие сигареты, но также курильщики трубок и сигар. Ожирение, особенно у женщин, является еще одним важным фактором риска. Считается, что заболеваемость опухолью почки можно сократить вдвое, отказавшись от курения табака и избыточной массы тела. Другими факторами риска также являются высокое артериальное давление, хроническая почечная недостаточность и профессиональное воздействие определенных химических веществ, таких как трихлорэтилен. Современные исследования предполагают, что ген VHL участвует в развитии семейного типа рака почек.
Умеренное потребление алкоголя (примерно до двух напитков в день), богатая фруктами и овощами диета и длительное употребление жирной рыбы связаны со снижением риска развития опухоли почек.
Рак почки и связь с наследственностью
Около 4% случаев почечно-клеточного рака являются результатом редких наследственных заболеваний. Примерами таких заболеваний является:
- Наследственная папиллярная карцинома. Это заболевание имеет аутосомно-доминантную форму с мутацией гена MET. Оно проявляется двусторонними и множественными папиллярными опухолями.
- Наследственный лейомиоматоз и синдром агрессивной папиллярной карциномы: аутосомно-доминантное заболевание. Существует мутация FH, и связанные с ней признаки включают лейомиоматоз матки. Метастатическое распространение происходит на ранних стадиях заболевания.
- Синдром туберозного склероза: проявляется мутациями генов TSC1 и TSC2, которые транскрибируют белок гамартин и туберин. Синдром проявляется множественными двусторонними почечными ангиомиолипомами.
- Синдром фон Гиппеля-Линдау (VHL) связан с развитием образования кист и опухолей в различных органах, например, нейроэндокринных опухолей поджелудочной железы, кист поджелудочной железы, мозжечковых и спинальных гемангиобластом, кист яичников и феохромоцитомы; наряду с множественными двусторонними опухолевыми узлами светлоклеточного рака почки.
- Синдром Бирта-Хогга-Дубе: аутосомно-доминантное заболевание, связанное с мутациями гена BHD. Синдром проявляется рядом гистологических типов опухолей почек. Сопутствующие признаки включают кисты легких, а также другие варианты опухолевого поражения.
- Наследственный лейомиоматоз и синдром агрессивной папиллярной карциномы: аутосомно-доминантное заболевание. Заболевание связано с мутациями гена FH. У женщин выявляется нередко лейомиоматоз матки. Метастатическое распространение происходит на ранних стадиях заболевания.
Причины заболевания
Современные исследования предполагают, что ген VHL участвует в развитии как случайного, так и семейного типа светлоклеточного рака почки. Около 15% не наследственных форм рака характеризуются изменением зародышевой линии гена MET или увеличением хромосомы 7.
Развитие заболевание рака почки носит мультифакториальный характер, связанный не только с наследственными данными, но и с факторами окружающей среды и образом жизни человека.
Классификация рака почки
Согласно современными данным существует несколько вариантов классифицирования заболевания. В зависимости от полученных данных гистологического исследования, Всемирной организации здравоохранения (ВОЗ) 2016 года выделяют 5 типов рака:
- светлоклеточный рак является наиболее распространенным типом (70-80%),
- папиллярный, папиллярная карцинома составляет около 10-15% всех случаев рака почки,
- хромофобный, хромофобная карцинома, на его долю приходится 4–5%;
- онкоцитарный тип составляет около 2–5%,
- протоковый, карцинома собирательного протока (протока Беллини), около 1%.
TNM классификация почечно-клеточного рака
T – первичная опухоль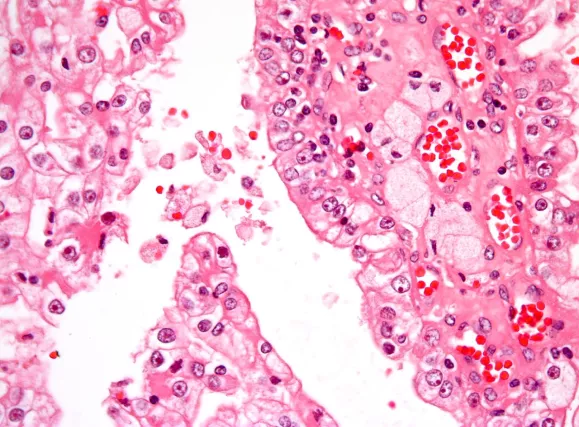
ТX – недостаточно данных для оценки первичной опухоли
Т0 – первичная опухоль не определяется
Т1 – опухоль до 7 см в наибольшем измерении, ограниченная почкой
Т2 – опухоль более 7 см в наибольшем измерении, ограниченная почкой
Т3 – опухоль распространяется в крупные вены либо околопочечные ткани, но не в
Т4 – опухоль распространяется за пределы фасции Героты (включая непрерывное распространение на надпочечник на стороне развития опухоли)
N – регионарные лимфатические узлы
Регионарными лимфатическими узлами являются лимфатические узлы ворот почки, абдоминальные парааортальные (около аорты) и паракавальные (около нижней полой вены) узлы. Сторона поражения не влияет на категорию N.
NX – недостаточно данных для оценки состояния регионарных лимфатических узлов
N0 – нет признаков метастатического поражения регионарных лимфатических узлов
N1 – метастаз в одном лимфатическом узле
N2 – метастазы в нескольких лимфатических узлах
М – отдаленные метастазы
М0 – нет признаков отдаленных метастазов
М1 – имеются отдаленные метастазы
Стадирование
I стадия: опухоль имеет размер до 7 см, не поражает окружающие ткани и находится в пределах почки.
II стадия: опухоль более 7 см, злокачественная, поражает лимфатические узлы ближайшие.
III стадия: опухоль от 10 см, локализуется в почке; новообразование прорастает в лимфоузлы и крупные сосуды кровеносной системы, но не затрагивает другие внутренние органы.
IV стадия: опухоль очень большого размера, имеет метастазы в другие органы, например в надпочечники, кости, легкие, в отдалённые лимфатические узлы и кровеносные сосуды.
Клинические проявления опухоли почки
Почечно-клеточный рак обычно не сопровождается симптомами заболевания вплоть до поздней стадии злокачественного процесса. Более 50% опухолей обнаружены случайно. Только у 10-15% пациентов может наблюдаться так называемая “классическая триада” симптомов опухоли почки, к ним относится:
- боли в поясничной области,
- появление крови в моче,
- пальпируемое образование в проекции почки.
Частыми симптомами заболевания является:
- ощущение слабости,
- повышенная утомляемость,
- похудание,
- боли тянущего характера в поясничной области,
- изменения цвета мочи (мутная, кровь в моче),
- повышение температуры тела до субфебрильных цифр (37-37,5 градусов по Цельсию),
- расстройства мочеиспускания,
- при метастатическом поражении появление болей в костях.
Более 60% пациентов, страдающих опухолью почки, предъявляли жалобы на появление крови в моче. Другими признаками являются: повышенная утомляемость, снижение веса, повышение температуры тела, потливость, повышение температуры тела, головокружение.
При длительном злокачественном процессе в почках происходит разрастание опухоли, ее метастазирование в ближайшие лимфатические узлы, а также в органы.
Метастазирование в кости способствует разрушению костной ткани и вызывает патологические переломы, сдавление спинного мозга и гиперкальциемию (повышение уровня общего кальция в крови).
Мучительная, острая, жгучая боль в спине может присутствовать из-за сдавления спинного мозга вследствие метастаза первичного очага. Варикоцеле (расширение вен мошонки) может развиться из-за инвазии и роста опухоли в почечную вену и нижнюю полую вену, которые могут блокировать вену яичка. Треть пациентов с почечно-клеточным раком имеют метастатическое заболевание при выявлении опухоли: в легкие (75%), кости (20%), печень (18%), центральную нервную систему (8%).
Осложнения опухоли почек
При развитии злокачественного процесса в почках могут быть осложнения, связанные непосредственно с распространением опухоли, а также нежелательными эффектами от проводимой терапии.
К прямым воздействием опухоли можно отнести:
- повышение артериального давления,
- вздутие живота,
- запор,
- метастатическое поражение с нарушением функции других органов (пожелтение кожного покрова, повышение уровня печеночных ферментов при метастазировании в печень,
- боль в костях и сдавление спинного мозга (метастазирование в кости),
- нарушение функции легких (легочное метастазирование),
- варикоцеле (венозное распространение опухоли по сосудам).
Побочные эффекты от целенаправленной системной терапии или хирургического вмешательства могут включать:
- нарушение функции почек и печени,
- повышение артериального давления,
- появление белка в моче,
- кровотечение и тромбоз,
- нарушение сердечной функции,
- эндокринную дисфункцию, например, гипотиреоз (снижении функции щитовидной железы).
Дифференциальная диагностика проводится с рядом других заболеваний мочеполового тракта:
- абсцесс почки,
- киста почки,
- саркома,
- метастатическое поражение почки (метастаз меланомы, рака кожи),
- аденома почки (доброкачественная опухоль),
- острый и хронический пиелонефрит (воспалительное заболевание почки бактериальной этиологии),
- неходжкинская лимфома,
- рак мочевого пузыря.
Диагностика новообразований почек
Краткий перечень основных клинических и лабораторно-инструментальных исследований:
- клинический анализ крови,
- общий анализ мочи,
- цитологическое исследование мочи,
- скорость оседания эритроцитов,
- ультразвуковое исследование органов брюшной полости и забрюшинного пространства,
- рентгенологическое исследование органов грудной клетки,
- гистологическое исследование новообразования почки,
- магнитно-резонансная томография (МРТ) для выявления венозной инвазии и прогрессирования метастатической опухоли.
Первоначальное лабораторное исследование при подозрении на почечно-клеточный рак включает общий анализ мочи с цитологией мочи, особенно если подозреваются уротелиальные опухоли. Оценка анемии и тромбоцитов должна проводиться с помощью полного анализа крови и скорости оседания эритроцитов (СОЭ). Лабораторное исследование функции печени помогают исключить метастазирование в печень и паранеопластическое (неметастатическое) поражение печени.
При подозрении на наследственное заболевание, молодой возраст пациента, либо у пациентов с раком почки и с семейным анамнезом заболевания, следует провести генетическое тестирование с целью выявления генетического заболевания (синдром фон Гиппеля-Линдау, синдром туберозного склероза, наследственная папиллярная карцинома, синдром Бирта-Хогга-Дубе).
Паранеопластический синдром
Опухоль почки злокачественного происхождения часто ассоциируется с паранеопластическими синдромами, которые включают гиперкальциемию (повышения кальция в крови), эритроцитоз (повышенный уровень гемоглобина) и неметастатическую печеночную дисфункцию (синдром Штауффера). Таким образом, согласно современным стандартам специалисты при подозрении опухоли почки также проводят исследования с целью выявления паранеопластических синдромов.
Биомаркеры опухоли почек злокачественного характера
Поскольку симптомы злокачественной опухоли почки часто неспецифичны и обычно проявляются на поздних стадиях заболевания, лабораторные биомаркеров, способные идентифицировать людей с не диагностированным заболеванием, могут быть использованы, как в качестве скринингового теста у бессимптомных людей, так и в качестве диагностического теста в клинической практике.
Разработка биомаркеров – это быстро развивающаяся область в онкологии как потенциальный инструмент диагностики и прогнозирования. Но в настоящий момент ни один биомаркер сыворотки или мочи еще не получил подтверждения для скрининга рака почки.

|
Визуализация опухолевого поражения остается основой для диагностики, скрининга, наблюдения и мониторинга лечения. |
Ультразвуковое исследование почек
Это инструментальное исследование является частым и первичным в выявлении опухоли почек. Врач исследователь может оценить паренхиму почек, наличие образований, степень вовлечения в злокачественный процесс окружающих тканей при достаточной визуализации. При подозрительных поражениях и кистозных поражениях, которые могут быть злокачественными, может быть проведена чрескожная пункционная биопсия почек под контролем ультразвука.
КТ органов брюшной полости, МРТ брюшной полости
Подтверждение опухоли почек проводится с помощью поэтапной компьютерной томографии брюшной полости и таза.
Золотым стандартом диагностики опухоли почек является КТ органов брюшной полости с введением контраста. Оно проводится при отсутствии у пациента аллергической реакции на йодсодержащие препараты и при нарушении функции почек. Исследование позволяет оценить размер опухоли, степень вовлечения в окружающие ткани, наличие поражений сосудов и лимфатических узлов, определить наличие метастатических поражений.
Магнитно-резонансная томография (МРТ) часто используется для выявления венозной инвазии опухоли (прорастании стенки сосудов) и прогрессирования метастатических поражений. Компьютерная томография головы проводится, если подозревается метастазирование в мозг или клиническая картина предполагает метастазирование.
В обязательном порядке пациентам проводится рентген грудной клетки или компьютерная томография для выявления метастазов в легких.
Лечение злокачественного новообразования почки
Варианты терапии опухоли почки зависят от ряда факторов, к которым относится возраст, наличие сопутствующей патологии (сахарный диабет, гипертоническая болезнь, ишемическая болезнь сердца, ожирение) и стадии опухолевого процесса. Поэтому точное определение стадии имеет важное значение для эффективного лечения.
-
При первой стадии проводится резекция (удаление) опухоли с частичной
нефроносохраняющей нефрэктомией. После оперативного лечения в обязательном порядке проводится КТ или МРТ брюшной полости в течение шести месяцев после начала наблюдения, а затем данные исследования повторяют не реже одного раза в год.
-
При второй и третьей стадии осуществляется радикальная нефрэктомия с жестким графиком последующего наблюдения. Оно включает базовую КТ брюшной полости, МРТ или ультразвуковую КТ брюшной полости и грудной клетки через 3-6 месяцев, а затем каждые 3-6 месяцев в течение трех лет, а затем ежегодно до 5 лет.
-
При установлении четвертой стадии рака почек осуществляется системная таргетная молекулярная терапия с использованием ингибиторов тирозинкиназы фактора роста эндотелия сосудов (VEGF-TKI) (например, сунитиниба, сорафениба, пазопаниба и акситиниба) или ингибиторов рапамицина для мишеней млекопитающих (например, темсиролимуса и эверолимуса).
Резекция почки с последующей иммунотерапией улучшает выживаемость у пациентов с метастатическим поражением при опухоли почки по сравнению с только иммунотерапией или таргетной молекулярной терапией. Последующее наблюдение пациентов состоит из предварительной КТ или МРТ грудной клетки, брюшной полости и таза с последующей повторной визуализацией каждые 6-16 недель в зависимости от клинического статуса.
Прогноз и пятилетняя выживаемость
Пятилетняя относительная выживаемость при злокачественном новообразовании почки составляет 75%. Две трети случаев диагностируются на локальной стадии, для которой 5-летняя относительная выживаемость составляет 93%. Прогноз лучше всего прогнозируется по стадии и степени злокачественности, при этом показатели выживаемости, специфичные для рака, составляют приблизительно 85-90% для клинически локализованного при первой и второй стадии рака почек.
Кроме того, пятилетняя выживаемость зависит от гистологического типа, а также от метастатического потенциала и предпочтительного места метастазирования опухоли почки. Замечено, что при светлоклеточном типе опухоли почки чаще всего поражается легкое, а при хромофобном типе опухоли почки чаще метастазирование наблюдается в печень.
Ключом к улучшению выживаемости является ранняя диагностика и своевременное лечение. Строгое соблюдение протоколов лечения позволяет выявить рецидив на ранней стадии для эффективного и надлежащего лечения.
Межпрофессиональный командный подход необходим для физического и психического здоровья пациентов, поддержки и положительных результатов, поскольку восстановление и последующее наблюдение являются строгими и длительными в течение пяти и более лет.
Своевременное обращение к специалистам может позволить выявить заболевание на ранней стадии и начать необходимое лечение. Врачи клиники «УРО-ПРО» обладают высоким профессионализмом и постоянно проходят различные циклы повышения квалификации для соблюдения современных подходов к лечению заболеваний почек.
Не занимайтесь самолечением! При обнаружении симптомов, запишитесь на консультацию к онкологу в клинику «УРО-ПРО». Болезнь всегда легче вылечить на ранних стадиях!
Зернисто-клеточная карцинома почки (Гранулярно-клеточный рак почки)
Зернисто-клеточная карцинома почки – это гистологическая форма почечно-клеточного рака, развивающегося из паренхимы органа. Проявляется ренальными (гематурией, болью, пальпируемой опухолью) и экстраренальными (лихорадкой, слабостью, похуданием и др.) симптомами. Диагноз устанавливается на основе УЗИ почек, экскреторной урографии, ангиографии, МРТ, КТ, радиоизотопной сцинтиграфии. Лечение включает частичную или радикальную нефрэктомию, нередко – адреналэктомию, иммунотерапию; реже – гормонотерапию, химиотерапию или лучевую терапию.
Общие сведения
Зернисто-клеточная карцинома почки (гранулярно-клеточный рак) в клинической урологии встречается в 7-12% от всех случаев почечно-клеточного рака. Макроскопически неоплазии имеют коричневатый цвет, обусловленный скоплением фосфолипидных комплексов в многочисленных митохондриях, заполняющих раковые клетки. При микроскопическом исследовании опухоль представлена полигональными клетками с широкой зернистой цитоплазмой, различной степенью клеточной атипии и полиморфизма, обширными зонами кровоизлияний и некроза. Отличительной чертой новообразования является склонность к инвазии почечной вены.
Зернисто-клеточная карцинома почки
Причины
Судить о причинах зернисто-клеточной формы карциномы почки не представляется возможным. В настоящее время выделены прогностические факторы потенциального риска, повышающие вероятность развития злокачественных опухолей в целом. Замечено, что пик заболеваемости отмечается в возрасте 50-70 лет, причем рак почки 2-3 раза чаще встречается у мужчин. Риск развития патологии выше у представителей негроидной расы.
Главным предрасполагающим фактором считается курение, повышающее вероятность возникновения рака почки в 2 раза. В числе других вероятных причин выделяют генетическую предрасположенность, некоторые наследственные заболевания, иммунодефицит, ожирение, воздействие ионизирующего излучения, нахождение пациента на длительном гемодиализе и др.
Классификация
Распространенность зернисто-клеточного рака почки оценивается по системе TMN:
- Т1 – карцинома расположена в центре почечной паренхимы, не пальпируется и выявляется исключительно рентгенологически.
- Т2 – определяется пальпируемая карцинома без признаков местноинвазивного роста.
- Т3 N1– карцинома прорастает в надпочечник, вены, или окружающие ткани либо имеется одиночный метастаз в регионарный лимфоузел.
- Т4 N1(N2) M0 (М1) – множественные метастазы в лимфоузлы, прорастание в соседние органы, наличие отдаленного метастазирования.
Метастазирование рака почки происходит по кровеносным и лимфатическим путям. Регионарные и отдаленные метастазы обнаруживаются более чем в половине случаев. Зонами регионарного метастазирования служат парааортальные и паракавальные лимфоузлы; отдаленными метастазами чаще поражаются легкие, кости таза, позвоночника, плечевого пояса, свода черепа, ребра. Местная инвазия наблюдается в паранефральную клетчатку, постоперационный рубец, мышцы и подкожную жировую клетчатку передней брюшной стенки.
Симптомы карциномы почки
Клиническая картина складывается из ренальных и экстраренальных проявлений. К ренальным симптомам относится классическая триада – наличие пальпируемой опухоли, гематурии и боли. Обычно присутствуют 1 или 2 симптома триады, но все они, как правило, уже свидетельствуют о распространенном опухолевом процессе. Гематурия при зернисто-клеточной карциноме почки наблюдается в 50-60% случаев, отличается высокой интенсивностью, развивается внезапно и часто не сопровождается болевым синдромом.
Острый болевой приступ может возникнуть после прекращения гематурии, при обтурации мочеточника кровяным сгустком. При неопухолевых поражения почек, протекающих с гематурией (гидронефрозе, мочекаменной болезни), боль, как правило, предшествует появлению крови в моче. В случае рака почки гематурия носит перемежающийся характер, при этом интервалы между кровотечениями постепенно укорачиваются. Боли в поясничной области встречаются почти у половины пациентов; пальпируемая опухоль – у 30-40%. Экстраренальная (внепочечная) симптоматика обычно включает беспричинную лихорадку, ухудшение самочувствия, потерю аппетита, слабость, анемию, похудание.
Осложнения
У 5-10% пациентов с бластоматозным процессом в почках развивается артериальная гипертензия. У мужчин важным симптомом карциномы служит развитие варикоцеле, которое может быть обусловлено сдавлением или опухолевой инвазией почечной вены, одной из яичковых вен либо тромбозом нижней полой вены.
Метастазы карциномы почки в легкие могут явиться случайно находкой при флюорографии или обнаружить себя кровохарканьем. Метастатическое поражение скелета протекает с интенсивными упорными болями, не купирующимися наркотическими средствами. При вовлечении трубчатых костей (бедренной, плечевой) могут развиваться патологические переломы; при заинтересованности позвоночника — параплегии, нарушения функций тазовых органов.
Диагностика
Визуально и пальпаторно могут быть обнаружены только запущенные формы рака почек. При осмотре врач-нефролог может обратить внимание на варикоцеле, отеки на нижних конечностей, расширение подкожных вен на передней брюшной стенке. Пальпация опухоли и степень ее подвижности позволяют судить о распространенности ракового процесса.
Из тестов лабораторной диагностики при обследовании используются общий анализ мочи (эритроцитурия, лейкоцитурия, протеинурия) и общий анализ крови (анемия, повышение СОЭ), биохимические исследования крови, однако все обнаруживаемые в них изменения являются неспецифичными. Патогномоничным признаком почечной карциномы служат изменения метаболизма сывороточных белков (трансферрина, ферритина, альбумина), выявляемые с помощью иммунодиффузного анализа.
Важным этапом онкоурологического обследования является УЗИ почек, посредством которого удается выявить деформацию контуров паренхимы, прорастание опухоли в сосуды, тромбоз вен, увеличенные регионарные лимфоузлы и т. д. Ультрасонография помогает дифференцировать карциному от гидронефроза, пионефроза, поликистоза почек, солитарной кисты почки.
Рентгенологическое обследование начинают с выполнения обзорной урографии, позволяющей судить об изменении конфигурации почки. В дальнейшем проводится экскреторная урография, дающая сведения о морфологическом и функциональном состоянии пораженной и здоровой почки. Для оценки заинтересованности почечных сосудов и степени васкуляризации опухоли прибегают к выполнению УЗДГ и почечной ангиографии; в случае подозрения на опухолевый тромб — нижней кавографии и почечной венографии.
С целью стадирования бластоматозного процесса используется магнитнорезонансная, компьютерная томография, нефросцинтиграфия. Биопсия почки ввиду опасности рассеивания опухоли применяется редко. С целью выявления отдаленного метастазирования показано проведение рентгенографии легких и костей, УЗИ органов брюшной полости.
Лечение карциномы почки
При выявлении операбельной зернисто-клеточной карциномы показана хирургическая тактика. Операция на почке проводится даже в случае обнаружения одиночного метастаза, поскольку позволяет продлить жизнь больному. При ранней диагностике карциномы возможно выполнение частичной нефрэктомии, однако чаще производится тотальная нефрэктомия, нередко с односторонней адреналэктомией и удалением регионарных лимфоузлов, извлечением опухолевых тромбов из почечной и нижней полой вен.
К назначению лучевой терапии, химиотерапии или гормонотерапии прибегают при неоперабельности почечного рака. Лучший прогностический результат достигается проведением иммунотерапии альфа-интерфероном, 5-фторурацилом, интерлейкином-2, которая позволяет повысить сроки выживаемости.
Прогноз и профилактика
Отдаленный прогноз во многом определяется стадией бластоматозного поражения. Течение зернисто-клеточной карциномы почки в большинстве случаев неблагоприятное; прогноз ухудшается при прорастании опухоли в почечную вену, наличии отдаленного метастазирования. Профилактика рака почек требует отказа от курения, исключения неблагоприятных химических и ионизирующих воздействий на организм.
Зернисто-клеточная карцинома почки — лечение в Москве
From Wikipedia, the free encyclopedia
| Papillary renal cell carcinoma | |
|---|---|
 |
|
| Papillary renal cell carcinoma, type 1, characterised by tubulopapillary architecture with admixed foamy histiocytes in the papillary cores. | |
| Specialty | Oncology |
| Symptoms | Hematuria, flank pain, palpable abdominal mass |
| Diagnostic method | Medical Image Test (ultrasound, computed tomography, magnetic resonance imaging) |
| Treatment | Nephrectomy, partial nephretocmy, targeted molecular therapy |
| Prognosis | 82-90% for five-year survival rate |
Papillary renal cell carcinoma (PRCC) is a malignant, heterogeneous tumor originating from renal tubular epithelial cells of the kidney, which comprises approximately 10-15% of all kidney neoplasms.[1] Based on its morphological features, PRCC can be classified into two main subtypes, which are type 1 (basophilic) and type 2 (eosinophilic).[2]
As with other types of renal cell cancer, most cases of PRCC are discovered incidentally without showing specific signs or symptoms of cancer.[3] In advanced stages, hematuria, flank pain, and abdominal mass are the three classic manifestation.[4] While a complete list of the causes of PRCC remains unclear, several risk factors were identified to affect PRCC development, such as genetic mutations, kidney-related disease, environmental and lifestyle risk factors.[5] For pathogenesis, type 1 PRCC is mainly caused by MET gene mutation while type 2 PRCC is associated with several different genetic pathways.[6] For diagnosis, PRCC is detectable through computed tomography (CT) scans or magnetic resonance imaging (MRI), which commonly present a small homogeneous hyposvascular tumor.[7] Nephrectomy or partial nephrectomy is usually recommended for PRCC treatment, often accompanied with several targeted molecular therapies to inhibit metastatic spread.[8][9] PRCC patients are predominantly male with a mean age of 52–66 years.[10] When compared to conventional clear cell renal cell carcinoma (RCC), the prognosis of non-metastatic PRCC is more favorable, whereas a relatively worse outcome was reported in patients with metastatic disease.[11] Globally, the incidence of PRCC ranges between 3,500 to 5,000 cases, while it greatly varies depending on gender, age, and race/ethnicity.[12]
Classification[edit]
In 2014, PRCC was first acknowledged as a renal tumor subtype by the World Health Organization (WHO) considering its distinct genetic, molecular and histologic characteristics.[10] It is further divided into type 1 and type 2 based on morphological features.[13]
Type 1 Papillary Renal Cell Carcinoma[edit]
Type 1 PRCC, also known as a renal tumor caused by a genetic predisposition of hereditary papillary renal cancer syndrome, compromises approximately 25% of all PRCCs.[14][15] In the perspective of immunochemistry, it has a profile of strong CK7 and alpha-methyl acyl-CoA racemase (AMACR) expression at most focal CA-IX expression.[16] Histologically, its epithelium is composed of relatively small-sized simple cuboidal cells lined in a single layer.[17] These cells are well-characterized by basophilic cytoplasm.[18] Due to its solid growth, an extremely compact papillary architecture is often observed.[16] Other morphological characteristics include intracellular hemosiderin and foamy macrophages placed inside of papillary fibrovascular cores or psammoma bodies.[19] In general, the nuclei of type 1 PRCC belong to grade 1-2 of the Fuhrman system.[16]
-
A micrograph of type 1 PRCC, illustrating features of small basophilic cells with scarce cytoplasm. A single layer of cells are surrounding the basal membrane.[20] Foamy macrophages are inside of papillary fibrovascular cores.
-
Type 1 PRCC, this case being more compact at right.
Type 2 Papillary renal cell carcinoma[edit]
A micrograph of Type 2 PRCC, showing cells containing abundant eosinophilic granular cytoplasm with prominent nucleoli.[20]
Accounting for 25% of PRCCs, type 2 PRCC is the pathological subtype that is most commonly associated with hereditary leiomyomatosis and renal cell carcinoma (HLRCC) syndrome.[14][15] When compared to type 1, it shows more variation in protein expression mostly by loss of CK7.[16] In a gross examination, it shows papillae covered by large cells abundant in eosinophilic cytoplasm.[18] Its large spherical nuclei on papillary cores are arranged in a pseudo-stratified manner.[16] Unlike type 1 PRCC, foamy macrophages and psammoma bodies are less common in case of type 2.[15] The majority of type 2 PRCC has high Fuhrman grade nuclei with prominent nucleoli.[16]
Signs and Symptoms[edit]
Due to its asymptomatic nature, PRCC is often undetectable, and the majority of cases are incidentally diagnosed during the radiological workup of unrelated diseases.[3][8] Its clinical manifestations are similar to those of clear cell RCC, which are the classical triad of renal cell carcinoma (hematuria, flank pain and palpable abdominal mass; only 6-10% of patients) or even nonspecific symptoms including fatigue, weight loss, fever, and anorexia.[4][10][21] Since early diagnosis is relatively uncommon, PRCC patients may experience symptoms caused by the metastatic spread to secondary sites. Specifically, metastasis occurs most frequently in the lungs followed by bone and the brain, exhibiting a wide range of symptoms including bone pain to a persistent cough.[8][21]
Causes[edit]
Currently, the exact cause of PRCC remains unclear. Possible risk factors have been identified that contribute to PRCC development, which include genetic mutations, hereditary syndrome, renal injuries, and lifestyle factors. Germline mutation of c-MET oncogene and fumarate hydratase gene elevates the risk of type 1 and type 2 PRCC respectively through distinct signaling pathways.[22][23] Regarding hereditary conditions, patients with hereditary papillary renal cancer syndrome showed a greater risk of type 1 PRCC, whereas those with hereditary leiomyomatosis and renal cell cancer (HLRCC) syndrome have an increased risk of type 2 PRCC.[24][5] Moreover, patients who experienced chronic kidney diseases or acute kidney injury exhibited a higher incidence of PRCC.[25][26] Additionally, other risk factors such as smoking, obesity, and high blood pressure can influence the pathogenesis of PRCC.[5]
Pathogenesis[edit]
An overview of the MET molecular pathway in PRCC[6]
Different molecular mechanisms are involved in PRCC development, which further result in distinct histologic features and clinical outcomes.[citation needed]
Type 1 PRCC is caused by a genetic mutation or a gain in chromosome 7 where the MET gene is positioned, resulting in the promotion of oncogenic pathways in renal epithelial cells.[6] Typically, the MET gene is upregulated for renal tissue repair and regeneration by encoding the receptor tyrosine kinase c-MET of hepatocyte growth factor.[6] However, activation of the oncogenic pathway in the MET gene will manifest invasion, anti-apoptosis, angiogenesis, and metastasis.[6]
Type 2 PRCC is associated with irregularity of several signaling pathways, which includes CDKN2A silencing, mutation in chromatin-modifying genes, and a GpG island methylator phenotype (CIMP).[27] CDKN2A is a tumor suppressor gene, while loss of its expression results in enhanced tumorigenesis and metastasis.[27][28] Moreover, mutation of gene involved in chromatin remodeling (SETD2, BAP1, or PBRM) may lead to higher rate of TFE3/TFEB fusion.[27] Additionally, CIMP papillary renal cell carcinoma tumors exhibited somatic FH gene mutation, which is closely associated with HLRCC syndrome.[23]
Diagnosis[edit]
Currently, cross-sectional imaging with computed tomography (CT) and magnetic resonance imaging (MRI) is known as the best option for diagnosing papillary renal tumors.[29]
Unenhanced (left) and nephrographic phase (right) CT scans display a 1-cm low-attenuation PRCC tumor (arrow) in the right renal cortex[8]
Computed tomography (CT)[edit]
Contrast-enhanced computed tomography (CT) is most commonly used to identify the subtypes of RCC. PRCC can be differentiated from other types of RCC due to its distinguishing features, displaying a small hypovascular renal tumor on T2 weighted images.[7] Typically, PRCC tends to appear homogeneous while clear cell RCC is likely to be in a heterogeneous form when the tumor is less than 3 cm in diameter.[30] Comparatively, in cases of tumors larger than 3 cm in diameter, PRCC is generally heterogeneous with areas of necrosis and hemorrhage compared to chromophobe RCC.[8][31] Solid, small PRCC tumors (<3 cm in diameter) are more easily viewed on nephrographic, excretory phase images rather than on unenhanced, corticomedullary phase images.[8]
Magnetic resonance imaging (MRI)[edit]
Magnetic resonance imaging (MRI) is recommended instead of CT for patients with an allergy to iodinated contrast materials.[8] As some renal tumors do not enhance significantly on CT, MRI examination is required to be performed with more sensitive contrast enhancement.[7] On MRI, the distinct features of PRCC are fibrous capsules and homogeneously low single intensity on both T1- and T2-weighted images.[8][32] Specifically, PRCC exhibits hypointensity due to its dense collagenous matrix or deposition of calcium and hemosiderin within the tumor.[33] Such visual features help PRCC to be differentiated from clear cell RCC, which has heterogeneously higher single intensity shown on T2-weighted images.[8][32] PRCC displays the smallest tumor-to-cortex enhancement at corticomedullary and nephrographic phases when juxtaposed with clear cell and chromophobe RCCs.[32]
Grading System[edit]
Papillary renal cell carcinoma type 1, grade 2: Nucleoli (one annotated by arrows) are conspicuous and eosinophilic at 

The WHO/ISUP system is histological tumor grading system for renal cell carcinoma, suggested by the International Society of Urologic Pathologists (ISUP) in 2012 to diagnose tumor grades based on nucleolar prominence.[34] Currently recommended by the WHO, this four-tiered WHO/ISUP grading system has also been validated for PRCC.[34]
| Grade | Definition |
|---|---|
| 1 | Nucleoli are absent or inconspicuous and basophilic at  400 magnification. 400 magnification.
|
| 2 | Nucloeli are conspicuous and eosinophilic at  400 magnification and visible but not prominent at 400 magnification and visible but not prominent at  100 magnification. 100 magnification.
|
| 3 | Nucleoli are conspicuous and eosinophilic at  100 magnification 100 magnification
|
| 4 | There is extreme nuclear pleomorphism, multinucleate giants cells, and/or rhabdoid an/or sarcomatoid differentiation |
Earlier, the Fuhrman system was largely used, and was similarly based on nuclear features.[36]
Treatment[edit]
First-line treatment for metastatic PRCC has not been standardized. Thus, similar treatment approaches for clear cell RCC have been used for PRCC, even though it has a distinct tumor histology.[9][37]
Surgery[edit]
Nephrectomy or nephron-sharing partial nephrectomy is widely recommended to reduce the risk of metastasis by eliminating all or part of the kidney.[8] Surgery procedures for PRCC depend on the patient’s status and are very similar to procedures performed on RCC patients.[citation needed]
Targeted Therapy[edit]
Several medications that target molecular pathways in RCC have been possible options for advanced and metastatic PRCC.[9] Among different medications, tyrosine kinase inhibitors (TKIs) and mammalian target of rapamycin (mTOR) inhibitors are effective in inhibiting angiogenesis, blocking growth and suppressing spread of the tumor.[38] Sunitinib, sorafenib, and axitinib are TKIs with anti-vascular endothelial growth factor (VEGF), which inhibit cellular signaling by targeting multiple receptor tyrosine kinase.[38][39][40][41] Everolimus and temsirolimus are used in deregulating the mTOR pathway.[42][43] Specifically, mTOR inhibitors have crucial roles in regulating cell growth, cell proliferation and metabolism of highly active tumor cells.[38] Other targeted agents such as MET inhibitors, epidermal growth factor receptor (EGFR) inhibitors, and monoclonal antibodies, are also promising treatment approaches for PRCC.[9] Foretinib is one example of a multikinase inhibitor targeting c-MET.[44] Considering that MET gene mutation is one oncogenic pathway of PRCC, MET inhibitors like tivantinib and volitinib are currently being investigated as a new targeted therapy option.[9][44]
Prognosis[edit]
The five-year survival rate of PRCC has been reported as 82-90%, which is slightly higher than that of other kidney cancers.[45] The reduced survival rate has been positively correlated to several factors, which are high nuclear grade and stage, vascular invasion, DNA aneuploidy, and more.[46] Patients with type 1 PRCC have significantly improved survival rates than those with type 2, which is a reflection of its lower TNM stage with a well-encapsulated tumor.[47] Compared to other common types of RCC, PRCC exhibits a relatively lower risk of tumor recurrence and cancer-related death after nephrectomy.[48] Specifically, the cancer-specific survival rate at five years following surgery with PRCC has reached up to 91%, while clear cell RCC and chromophobe RCC were 72% and 88%, respectively.[46]
Epidemiology[edit]
Among different histologic subtypes of RCC, PRCC is the second most predominant type and accounts for 10-15% of all renal tumors.[49] In the case of the United States, it is estimated that the incidence of PRCC will rise to 3,500 to 5,000 cases annually.[12] Generally, PRCC is more prevalent among men than women, while the reported sex ratio (M: F) varies from 1.8:1 to 3.8:1.[50] The mean age at presentation is identified as 52–66 years old; however, no statistically significant difference was found in the incidence of PRCC between the younger (< 40 years) and older adult groups (>40 years).[10][51] In terms of racial variation, several studies have proven that people with African or Afro-Caribbean ancestry tend to have higher chances of being diagnosed with PRCC. According to the National Cancer Database, PRCC was more common in the Non-Hispanic Black population (38.9%) when compared to other races – Asian American (18.0%), Non-Hispanic White (13.2%), and Hispanic White populations (6.1%).[52]
References[edit]
- ^ Cairns P (2011). «Renal cell carcinoma». Cancer Biomarkers. 9 (1–6): 461–73. doi:10.3233/CBM-2011-0176. PMC 3308682. PMID 22112490.
- ^ Lee J, Chae HK, Lee W, Nam W, Lim B, Choi SY, et al. (2018-12-28). «Comparison of Prognosis in Types 1 and 2 Papillary Renal Cell Carcinoma and Clear Cell Renal Cell Carcinoma in T1 Stage». The Korean Journal of Urological Oncology. 16 (3): 119–125. doi:10.22465/kjuo.2018.16.3.119.
- ^ a b Encyclopedia of Cancer. Academic Press. 2018-10-12. ISBN 978-0-12-812485-7.
- ^ a b Courthod G, Tucci M, Di Maio M, Scagliotti GV (October 2015). «Papillary renal cell carcinoma: A review of the current therapeutic landscape». Critical Reviews in Oncology/Hematology. 96 (1): 100–12. doi:10.1016/j.critrevonc.2015.05.008. hdl:2318/1564896. PMID 26052049.
- ^ a b c «Risk Factors for Kidney Cancer». www.cancer.org. Retrieved 2020-04-08.
- ^ a b c d e Rhoades Smith KE, Bilen MA (November 2019). «A Review of Papillary Renal Cell Carcinoma and MET Inhibitors». Kidney Cancer. 3 (3): 151–161. doi:10.3233/KCA-190058. PMC 6918905. PMID 31867475.
- ^ a b c Couvidat C, Eiss D, Verkarre V, Merran S, Corréas JM, Méjean A, Hélénon O (November 2014). «Renal papillary carcinoma: CT and MRI features». Diagnostic and Interventional Imaging. 95 (11): 1055–63. doi:10.1016/j.diii.2014.03.013. PMID 25443332.
- ^ a b c d e f g h i j Vikram R, Ng CS, Tamboli P, Tannir NM, Jonasch E, Matin SF, et al. (2009-05-01). «Papillary renal cell carcinoma: radiologic-pathologic correlation and spectrum of disease». Radiographics. 29 (3): 741–54, discussion 755–7. doi:10.1148/rg.293085190. PMID 19448113.
- ^ a b c d e Bourlon MT, Meneses-Medina M, Vázquez-Manjarrez S, Bustamante-Romero FM, Gallegos-Garza AC, Lam ET (November 2015). «A Patient With Newly Diagnosed Metastatic Type 2 Papillary Renal Cell Carcinoma». Oncology (Williston Park, N.Y.). 29 (11): 880–6. PMID 26573066.
- ^ a b c d International Agency for Research on Cancer (2004). Pathology and Genetics of Tumours of the Urinary System and Male Genital Organs. IARC. ISBN 978-92-832-2415-0.
- ^ Klatte T, Gallagher KM, Afferi L, Volpe A, Kroeger N, Ribback S, et al. (October 2019). «The VENUSS prognostic model to predict disease recurrence following surgery for non-metastatic papillary renal cell carcinoma: development and evaluation using the ASSURE prospective clinical trial cohort». BMC Medicine. 17 (1): 182. doi:10.1186/s12916-019-1419-1. PMC 6775651. PMID 31578141.
- ^ a b Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, et al. (2005). «Cancer statistics, 2005». CA: A Cancer Journal for Clinicians. 55 (1): 10–30. doi:10.3322/canjclin.55.1.10. PMID 15661684. S2CID 22356919.
- ^ Weidner N, Cote RJ, Suster S, Weiss LM (2009-07-08). Modern Surgical Pathology E-Book. Elsevier Health Sciences. ISBN 978-1-4377-1958-1.
- ^ a b Haas NB, Nathanson KL (January 2014). «Hereditary kidney cancer syndromes». Advances in Chronic Kidney Disease. 21 (1): 81–90. doi:10.1053/j.ackd.2013.10.001. PMC 3872053. PMID 24359990.
- ^ a b c «Papillary renal cell carcinoma (PRCC)». www.pathologyoutlines.com. Retrieved 2020-04-08.
- ^ a b c d e f Warren AY, Harrison D (December 2018). «WHO/ISUP classification, grading and pathological staging of renal cell carcinoma: standards and controversies». World Journal of Urology. 36 (12): 1913–1926. doi:10.1007/s00345-018-2447-8. PMC 6280811. PMID 30123932.
- ^ Chevarie-Davis M, Riazalhosseini Y, Arseneault M, Aprikian A, Kassouf W, Tanguay S, et al. (July 2014). «The morphologic and immunohistochemical spectrum of papillary renal cell carcinoma: study including 132 cases with pure type 1 and type 2 morphology as well as tumors with overlapping features». The American Journal of Surgical Pathology. 38 (7): 887–94. doi:10.1097/PAS.0000000000000247. PMID 24919183. S2CID 1998988.
- ^ a b Bukowski RM, Novick A (2009-12-03). Clinical Management of Renal Tumors. Springer Science & Business Media. ISBN 978-1-60327-149-3.
- ^ «Right Kidney». College of American Pathologists. Retrieved 2020-04-19.
- ^ a b Muglia VF, Prando A (2014-04-10). «Renal cell carcinoma: histological classification and correlation with imaging findings». Radiologia Brasileira. 48 (3): 166–74. doi:10.1590/0100-3984.2013.1927. PMC 4492569. PMID 26185343.
- ^ a b «papillary renal cell carcinoma». www.ebi.ac.uk. Retrieved 2020-04-08.
- ^ «What Causes Kidney Cancer?». www.cancer.org. Retrieved 2020-04-08.
- ^ a b Linehan WM, Spellman PT, Ricketts CJ, Creighton CJ, Fei SS, Davis C, et al. (January 2016). «Comprehensive Molecular Characterization of Papillary Renal-Cell Carcinoma». The New England Journal of Medicine. 374 (2): 135–45. doi:10.1056/NEJMoa1505917. PMC 4775252. PMID 26536169.
- ^ «Hereditary Papillary Renal Carcinoma». Cancer.Net. 2012-06-25. Retrieved 2020-04-08.
- ^ van de Pol JA, van den Brandt PA, Schouten LJ (February 2019). «Kidney stones and the risk of renal cell carcinoma and upper tract urothelial carcinoma: the Netherlands Cohort Study». British Journal of Cancer. 120 (3): 368–374. doi:10.1038/s41416-018-0356-7. PMC 6353869. PMID 30563989.
- ^ Peired AJ, Antonelli G, Angelotti ML, Allinovi M, Guzzi F, Sisti A, et al. (March 2020). «Acute kidney injury promotes development of papillary renal cell adenoma and carcinoma from renal progenitor cells». Science Translational Medicine. 12 (536): eaaw6003. doi:10.1126/scitranslmed.aaw6003. PMID 32213630. S2CID 214671587.
- ^ a b c Malouf GG, Joseph RW, Shah AY, Tannir NM (May 2017). «Non-clear cell renal cell carcinomas: biological insights and therapeutic challenges and opportunities». Clinical Advances in Hematology & Oncology. 15 (5): 409–418. PMID 28591094.
- ^ Zhao R, Choi BY, Lee MH, Bode AM, Dong Z (June 2016). «Implications of Genetic and Epigenetic Alterations of CDKN2A (p16(INK4a)) in Cancer». EBioMedicine. 8: 30–39. doi:10.1016/j.ebiom.2016.04.017. PMC 4919535. PMID 27428416.
- ^ «Genetics of Kidney Cancer (Renal Cell Cancer) (PDQ®)–Health Professional Version». National Cancer Institute. 2013-11-01. Retrieved 2020-04-08.
- ^ Herts BR, Coll DM, Novick AC, Obuchowski N, Linnell G, Wirth SL, Baker ME (February 2002). «Enhancement characteristics of papillary renal neoplasms revealed on triphasic helical CT of the kidneys». AJR. American Journal of Roentgenology. 178 (2): 367–72. doi:10.2214/ajr.178.2.1780367. PMID 11804895.
- ^ Kim JK, Kim TK, Ahn HJ, Kim CS, Kim KR, Cho KS (June 2002). «Differentiation of subtypes of renal cell carcinoma on helical CT scans». AJR. American Journal of Roentgenology. 178 (6): 1499–506. doi:10.2214/ajr.178.6.1781499. PMID 12034628.
- ^ a b c Gurel S, Narra V, Elsayes KM, Siegel CL, Chen ZE, Brown JJ (2013-03-11). «Subtypes of renal cell carcinoma: MRI and pathological features». Diagnostic and Interventional Radiology. 19 (4): 304–11. doi:10.5152/dir.2013.147. PMID 23439256.
- ^ Hiraki Y, Okamoto D, Nishie A, Asayama Y, Ishigami K, Ushijima Y, et al. (August 2019). «Papillary renal cell carcinoma with massive hematoma mimicking hemangioma». Radiology Case Reports. 14 (8): 1003–1006. doi:10.1016/j.radcr.2019.05.025. PMC 6556879. PMID 31198484.
- ^ a b Moch H (July 2016). «[The WHO/ISUP grading system for renal carcinoma]». Der Pathologe. 37 (4): 355–60. doi:10.1007/s00292-016-0171-y. PMID 27271258. S2CID 8644427.
- ^ Moch H, Cubilla AL, Humphrey PA, Reuter VE, Ulbright TM (July 2016). «The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs-Part A: Renal, Penile, and Testicular Tumours». European Urology. 70 (1): 93–105. doi:10.1016/j.eururo.2016.02.029. PMID 26935559.
- ^ Table 3 from: Weiss, Lawrence M.; Gelb, Arnold B.; Jeffrey Medeiros, L. (1995). «Adult Renal Epithelial Neoplasms». American Journal of Clinical Pathology. 103 (5): 624–635. doi:10.1093/ajcp/103.5.624. ISSN 0002-9173.
- ^ Liu K, Ren Y, Pang L, Qi Y, Jia W, Tao L, et al. (2015-07-01). «Papillary renal cell carcinoma: a clinicopathological and whole-genome exon sequencing study». International Journal of Clinical and Experimental Pathology. 8 (7): 8311–35. PMC 4555730. PMID 26339402.
- ^ a b c Zarrabi K, Fang C, Wu S (February 2017). «New treatment options for metastatic renal cell carcinoma with prior anti-angiogenesis therapy». Journal of Hematology & Oncology. 10 (1): 38. doi:10.1186/s13045-016-0374-y. PMC 5288948. PMID 28153029.
- ^ Ravaud, A.; Oudard, S.; De Fromont, M.; Chevreau, C.; Gravis, G.; Zanetta, S.; Theodore, C.; Jimenez, M.; Sevin, E.; Laguerre, B.; Rolland, F.; Ouali, M.; Culine, S.; Escudier, B. (2015-06-01). «First-line treatment with sunitinib for type 1 and type 2 locally advanced or metastatic papillary renal cell carcinoma: a phase II study (SUPAP) by the French Genitourinary Group (GETUG)†». Annals of Oncology. 26 (6): 1123–1128. doi:10.1093/annonc/mdv149. PMID 32018840.
- ^ Stadler WM, Figlin RA, McDermott DF, Dutcher JP, Knox JJ, Miller WH, et al. (March 2010). «Safety and efficacy results of the advanced renal cell carcinoma sorafenib expanded access program in North America». Cancer. 116 (5): 1272–80. doi:10.1002/cncr.24864. PMID 20082451. S2CID 205659715.
- ^ Kamai T, Abe H, Arai K, Murakami S, Sakamoto S, Kaji Y, Yoshida KI (March 2016). «Radical nephrectomy and regional lymph node dissection for locally advanced type 2 papillary renal cell carcinoma in an at-risk individual from a family with hereditary leiomyomatosis and renal cell cancer: a case report». BMC Cancer. 16: 232. doi:10.1186/s12885-016-2272-7. PMC 4794818. PMID 26983443.
- ^ Zanardi E, Verzoni E, Grassi P, Necchi A, Giannatempo P, Raggi D, et al. (June 2015). «Clinical experience with temsirolimus in the treatment of advanced renal cell carcinoma». Therapeutic Advances in Urology. 7 (3): 152–61. doi:10.1177/1756287215574457. PMC 4485412. PMID 26161146.
- ^ Coppin C (May 2010). «Everolimus: the first approved product for patients with advanced renal cell cancer after sunitinib and/or sorafenib». Biologics: Targets and Therapy. 4: 91–101. doi:10.2147/btt.s6748. PMC 2880340. PMID 20531964.
- ^ a b Choueiri TK, Vaishampayan U, Rosenberg JE, Logan TF, Harzstark AL, Bukowski RM, et al. (January 2013). «Phase II and biomarker study of the dual MET/VEGFR2 inhibitor foretinib in patients with papillary renal cell carcinoma». Journal of Clinical Oncology. 31 (2): 181–6. doi:10.1200/JCO.2012.43.3383. PMC 3532390. PMID 23213094.
- ^ Nosé V (2020-02-14). Diagnostic Pathology: Familial Cancer Syndromes E-Book. Elsevier Health Sciences. ISBN 978-0-323-71205-7.
- ^ a b Bostwick DG, Cheng L (2008-01-01). Urologic Surgical Pathology. Elsevier Health Sciences. ISBN 978-0-323-01970-5.
- ^ «MDEdge Oauth». profreg.medscape.com. Retrieved 2020-04-08.
- ^ Zucchi A, Novara G, Costantini E, Antonelli A, Carini M, Carmignani G, et al. (April 2012). «Prognostic factors in a large multi-institutional series of papillary renal cell carcinoma». BJU International. 109 (8): 1140–6. doi:10.1111/j.1464-410X.2011.10517.x. PMID 21871053. S2CID 205545457.
- ^ Singh SR, Rameshwar P (2014-04-21). MicroRNA in Development and in the Progression of Cancer. Springer Science & Business. ISBN 978-1-4899-8065-6.
- ^ Fernandes DS, Lopes JM (2015-01-01). «Pathology, therapy and prognosis of papillary renal carcinoma». Future Oncology. 11 (1): 121–32. doi:10.2217/fon.14.133. hdl:10216/72945. PMID 25572787.
- ^ Suh JH, Oak T, Ro JY, Truong LD, Ayala AG, Shen SS (2009-01-30). «Clinicopathologic features of renal cell carcinoma in young adults: a comparison study with renal cell carcinoma in older patients». International Journal of Clinical and Experimental Pathology. 2 (5): 489–93. PMC 2655150. PMID 19294008.
- ^ Batai K, Harb-De la Rosa A, Zeng J, Chipollini JJ, Gachupin FC, Lee BR (November 2019). «Racial/ethnic disparities in renal cell carcinoma: Increased risk of early-onset and variation in histologic subtypes». Cancer Medicine. 8 (15): 6780–6788. doi:10.1002/cam4.2552. PMC 6826053. PMID 31509346.
External links[edit]
Онкологические заболевания мочевой системы в последние годы значительно участились во всём мире. Наибольшее распространение получил светлоклеточный рак почки, имеющий по МКБ 10 код С 64. Он носит также название гипернефромы. Ежегодно этот диагноз ставят четверти миллиона человек на планете и около 100 тысяч от него умирают.
Главная проблема заключается в позднем обращении за медицинской помощью, обусловленная тем, что первые стадии протекают бессимптомно. Отягощенный семейный анамнез, появление любых неприятных признаков служат поводом для настороженности и обязательного прохождения скрининга.
Особенности формирования светлоклеточного рака почек
Светлоклеточный рак почки имеет свойство быстро расти, на более поздних стадиях даёт тяжёлую клиническую картину. Положительные моменты: хороший отзыв на терапию, опухоль легко отделяется от здоровых тканей, почти никогда не распространяется на парный орган, увеличение размера не делает новообразование более агрессивным.
Опухоль содержит большое количество липидов. Это является причиной её желтого цвета при разрезе, что можно увидеть на фото в пособиях по патанатомии.
Этиологические факторы
Причины возникновения онкологических заболеваний полностью не изучены. Но существуют определённые предрасполагающие факторы, чаще всего приводящие к такой патологии. При диагнозе «Светлоклеточный почечноклеточный рак почки g2» такими предпосылками являются:
- проживание в экологически неблагоприятном городе;
- большое употребление алкоголя;
- курение;
- избыточный вес;
- работа на вредном производстве;
- сахарный диабет;
- питание фастфудом;
- экстирпация матки у женщин;
- генетическая предрасположенность.
Важно знать! Замечена более частая заболеваемость таким видом опухоли мужского населения в возрасте от 50 лет. Сельские жители, проживающие в чистой местности, страдают данной болезнью намного реже.
Этапы развития
Чтобы лучше подобрать лечение, важно определить все характеристики опухоли, знать стадии её развития. Зарождается процесс в паренхиматозных клетках. Из здоровых они превращаются в патологические. Классификация образования происходит по величине, степени злокачественности, наличию метастазов.

На первой стадии размер опухоли не превышает 4 см, она не проникает в близлежащие слои. Следующий этап характеризуется увеличением очага, не выходящего за контуры органа, до 7 см. В дальнейшем происходит прорастание в ткани, располагающиеся рядом, наблюдаются единичные метастазы, чаще всего в лимфатические узлы. Четвертая стадия является финальным распадом, патологический процесс затрагивает многие органы и системы.
Для компактного написания диагноза используют систему TNM. Первая буква характеризует размер и степень распространения опухоли. Далее обозначается наличие поражения в лимфатических узлах. Третий компонент говорит о появлении метастазов в дальних органах.
Процесс образования метастазов
При первом обращении к врачу у четверти пациентов обнаруживаются метастазы. В таком случае светлоклеточная карцинома почки g2 даёт вероятность жизненного прогноза 6-12 месяцев, отдельные больные переживают двухлетний рубеж.
Данный вид опухоли, даже имея малые размеры, способен вызывать патологические очаги в других органах, костях. Чаще всего они обнаруживаются в лёгких, лимфоузлах, печени, надпочечниках, головном мозге. Признаками их возникновения служат:
- сухость, зуд кожных покровов;
- желтый цвет склер, дермы;
- гипертензия, не поддающаяся лекарственной коррекции;
- нарушение зрительной функции, слуха;
- парезы, инсульты;
- кашель с выделением кровавой мокроты;
- сильные боли в костной системе.
Важно знать! Раковые клетки разносятся с помощью лимфы, крови. Особенностью метастазов при светлоклеточном раке является появление отдельных, солитарных очагов. Это позволяет удалять их, достигая продолжительной ремиссии. У 0.6-0.8% пациентов возможна спонтанная регрессия, улучшение состояния.

Комплекс симптомов
Отличительной особенностью онкологических заболеваний является отсутствие явных признаков на ранних стадиях процесса. Появление симптомов свидетельствует о позднем этапе патологии. К ним относятся:
- обильная гематурия;
- боль в области поясницы;
- пальпаторное обнаружение образования;
- высокие цифры артериального давления;
- набухание подкожных вен в области живота;
- потливость;
- неприятные ощущения при мочеиспускании;
- отёки ног, рук.
Обычно постановка диагноза на этом этапе сопровождается обнаружением очагов метастазирования. На более ранние проявления пациенты редко обращают внимание. Это может быть снижение аппетита, сильная утомляемость, анемия, кахексия. Наличие крови в моче незначительно, без лабораторного обследования заметить её невозможно.
Степень опасности
Степень злокачественной опасности принято обозначать буквой G и цифрой. Чем она выше, тем меньше патологические клетки похожи на нормальные. Это свидетельствует о том, что процесс протекает агрессивно. Если это единица, патология развивается медленно, есть время для лечения и вероятность излечения высока.
Двойка говорит об интенсивном разрастании, большой вероятности появления метастазов. Химическая и лучевая терапии в этом случае имеют незначительный эффект: такие клетки выделяют вещества, блокирующие их действие. При диагнозе «Светлоклеточный рак почки g 2» прогнозы для дальнейшей жизни даже после удаления больного органа будут нести высокую степень летальности.

Диагностирование патологии
На первом этапе обследования назначаются клинические анализы крови и мочи. С их помощью невозможно поставить диагноз, но таким способом проводится дифференцирование с другими болезнями мочевыделительной системы. Также определяется степень анемии, состояние других органов и систем. О возникновении патологического процесса на начальной его стадии может свидетельствовать увеличение количества эритроцитов, кальция, повышение маркеров на онкологию. Далее проводят инструментальные исследования:
- УЗИ, позволяющее увидеть размер, конфигурацию органа, его положение.
- Рентгеновские снимки с использованием контраста показывают все изменения в тканях почки.
- Магнитно-резонансная и компьютерная томография определяют размеры опухоли, её проникновение в ткани, выявляют имеющиеся метастазы, даже в отдалённых органах.
- С помощью биопсии выявляется вид рака.
Эти обследования являются самыми информативными. На их основе определяется стадия процесса, разрабатывается методика лечения.
Лечение светлоклеточного рака почки
Клетки такого вида рака очень устойчивы к цитостатикам, лучевой терапии. Поэтому лечение должно быть комплексным.
Важно начать его своевременно, как только болезнь будет диагностирована. При таком подходе прогноз наиболее благоприятен.
Консервативное
Применение химиотерапии проводится не только при невозможности оперативного лечения, но и в качестве подготовки к нему. Такая процедура помогает локализировать, уменьшить образование. Его обязательно проводят и после удаления источника. Метод заключается в лечении с помощью ядов, токсинов.
Препараты вводятся внутривенно капельно, в виде таблеток. Манипуляцию проводят циклично, повторяя через определённые промежутки. Эти средства имеют целый ряд побочных эффектов. К ним относятся:

- тошнота;
- рвота;
- стоматит;
- диарея;
- изменение формулы крови;
- облысение.
Появление таких неприятных симптомов не является поводом для отмены лечения. Брови, ресницы, шевелюра в дальнейшем восстанавливаются.
Лучевая терапия при почечноклеточном раке, в случае его светлоклеточного варианта, является паллиативном методом лечения. Она помогает избавить человека от боли, особенно если метастазами поражены кости.
Оперативное
Оперативный метод лечения является наиболее эффективным при диагнозе светлоклеточнаякарцинома почки g2.Чаще всего применяют нефрэктомию– удаление органа, близлежащих лимфоузлов, клетчатки, надпочечника. Особенно хороший результат такое вмешательство оказывает при отсутствии распространения. Но и при их наличии можно проводить такую операцию. Онкологические клетки метастазов такого варианта заболевания имеют свойство уменьшаться после извлечения главного источника.
Если у пациента почка одна или есть другие противопоказания, применяют резекцию. Опухоль вырезают с захватом прилегающих здоровых тканей с обязательным исследованием гистологии. Это способствует приостановке роста даже на последних стадиях процесса.
Другие виды терапии
Разработаны и другие методики лечения светлоклеточного рака. Одним из них является эмболизация почечной артерии. Таким образом перекрывается доступ питательных веществ к опухоли, достигается уменьшение её размеров.
Криодеструкцию выполняют введением электродов к патологическому очагу и разрушением с помощью замораживания или высоких температур. Методом радиочастотной абляции производится уничтожение опухоли.
Иммунотерапия давно начала применяться для лечения почечноклеточной карциномы. Но раньше эффективность метода была невысокой. Сейчас разработан новый препарат, который хорошо зарекомендовал себя не только при раке g 2, но и при других его формах.

Важно знать! Лечение народными методами не способно исцелить раковую опухоль. Обращение к знахарям только затягивает процесс. Без современных методов медицины, которые необходимо применять незамедлительно при постановке диагноза, время будет упущено, патология зайдет слишком далеко и дальнейший прогноз станет печален.
Домашние рецепты строго по согласованию с лечащим врачом можно применять для поддержания сил организма, укрепления иммунитета, снятия неприятных симптомов во время химиотерапии. Для этого приписывают специальную диету, богатую витаминами, микроэлементами. Не рекомендуется употреблять жирную, острую пищу, различные специи. О курении, приёме алкоголя следует забыть навсегда.
Прогноз после лечения
Светлоклеточный рак почки, обнаруженный на 1 стадии, имеет прогноз излечения 90%. Важными моментами являются локализация опухоли, наличие метастаз, состояние иммунной системы, сопутствующие заболевания. На втором этапе, при условии, что патологические клетки не проникли в лимфу, прогноз также весьма благоприятен. При дальнейшем прогрессировании увеличивается вероятность рецидивов, даже после удаления источника, появляются метастазы в органах, расположенных рядом.
Четвертая стадия не даёт вероятности жизни даже в течение года. Заболевание чаще наблюдается у мужчин среднего и старшего возраста. Появление такой патологии у молодёжи является одним из неблагоприятных факторов, несущих малый процент выживаемости.
Заключение
Внимательное отношение к здоровью, правильное питание, отказ от вредных привычек помогают иммунитету справляться с раковыми клетками, подавляя их рост. При появлении неприятных симптомов, сигнализирующих о неблагополучии в организме, важно без промедления обращаться к врачу.
Своевременная диагностика, подобранная терапия помогут эффективно справиться с болезнью, предотвратить её рецидивирующее течение. Особенно это важно для людей, в роду которых были случаи светлоклеточного рака почки или других разновидностей онкологических патологий.
.png)
Карциномы – это самая распространенная форма рака. Они начинаются в эпителиальных тканях, которые покрывают и защищают органы, выстилают различные полости в теле, а также фильтруют, выделяют и поглощают жидкости.
Что такое рак и как он развивается?
Рак – это опасная для жизни опухоль. Такие новообразования называют злокачественными, поскольку их клетки бесконтрольно размножаются, прорастают в окружающие ткани, распространяются по телу и создают метастазы – дополнительные очаги в других органах.
Заболевание развивается после появления в организме всего одной мутировавшей, или измененной клетки, отличающейся от нормальных. Она возникает из-за различных проблем со здоровьем, влияния химических веществ, радиации, солнечных лучей, наследственных особенностей или случайных сбоев, развивается и создает множество своих копий. Большинство из них выявляется и уничтожается иммунитетом, но некоторым все же удается скрыться от внимания нашей естественной защиты или противостоять ей. Они выживают и постепенно формируют опухоль, разрушающую все, что ее окружает.
На этом их опасные способности не заканчиваются. Нормальные клетки рождаются и функционируют только в одном, строго определенном для них месте. Неправильные же таких ограничений не имеют – они проникают в две важнейшие системы – кровеносную и лимфатическуюЛимфатическая система дополняет сердечно-сосудистую. В ней циркулирует лимфа – жидкость, которая омывает все клетки организма, доставляет в них необходимые вещества и забирает отходы. В лимфатических узлах, выполняющих роль «фильтров», опасные вещества обезвреживаются и выводятся из тела., с их помощью перемещаются в различные части тела, закрепляются в других органах и создают в них метастазы – дополнительные раковые новообразования. Кроме того, у них не работает апоптоз – так называемый механизм «запрограммированной» смерти. Благодаря этому свойству они существуют очень долго и не умирают по окончанию стандартного жизненного цикла.
Со временем рак разрастается, разрушает большое количество важных тканей, нарушает работу организма и убивает его.

Виды карцином
Карцинома – это не одна опухоль, а целое множество их разновидностей. Она развивается в определенном типе клеток эпителия – тонкого слоя ткани, который покрывает и защищает органы, выстилает различные полости в теле, а также фильтрует, выделяет и поглощает жидкости.
Карцинома in situ, предрак, или неинвазивный рак 0 стадии – наличие в организме измененных клеток, находящихся только в том месте, где они появились впервые. Они еще не являются злокачественными – не прорастают в окружающие ткани и не создают метастазыМетастазы – это дополнительные раковые опухоли в органах и тканях, расположенных далеко от основного новообразования., но способны таковыми стать. Такие новообразования могут появиться в любой области организма, в том числе в молочной железе, шейке матки, мочевом пузыре, коже, во рту и даже в слизистой оболочке глаза.
Аденокарцинома. Возникает в железистых клетках, производящих секрет: например, ферменты – необходимые для переваривания пищи белки, или гормоны, сообщающие тканям, как действовать – работать или отдыхать, выделять что-то или поглощать. Поражает множество различных органов: поджелудочную, предстательную, молочную, щитовидную, слюнные и потовые железы, пищевод, желудок, печень, тонкую, слепую, прямую и сигмовидную кишку, яичники, матку, гипофизГипофиз – это небольшая железа, расположенная в основании мозга. Она влияет на рост, развитие и обмен веществ организма., почки и легкие.
Базально-клеточная карцинома, или базалиома. Развивается в базальных клетках, находящихся в нижней части эпидермиса – наружного слоя кожи. Чаще всего возникает на открытых участках тела, подвергающихся воздействию ультрафиолета – лице, голове и шее. Медленно растет и редко поражает другие ткани.
Инвазивная лобулярная карцинома, или дольковый рак молочной железы. Возникает в вырабатывающих молоко дольках, и постепенно прорастает в окружающие структуры. Затем она распространяется в лимфатические узлы – небольшие органы размером с горошину, выполняющие роль фильтров, задерживающих и обезвреживающих опасные вещества, и создает в различных частях тела метастазы – дополнительные новообразования.
Инвазивная протоковая карцинома – самый распространенный вид рака молочной железы. Формируется в клетках протоков, по которым молоко из долек выходит в сосок, повреждает ближайшие ткани и распространяется по организму с помощью лимфатической системыЛимфатическая система дополняет сердечно-сосудистую. В ней циркулирует лимфа – жидкость, которая омывает все клетки организма, доставляет в них необходимые вещества и забирает отходы. В лимфатических узлах, выполняющих роль «фильтров», опасные вещества обезвреживаются и выводятся из тела.. Ее разновидность – тубулярная карцинома – обычно представляет из себя несколько медленно растущих небольших, до 1-2см в диаметре, похожих на трубочки опухолей.
Карцинома Меркеля – редкий и агрессивный, то есть плохо поддающийся лечению тип рака кожи, чаще всего встречающийся у европеоидов старше 70 лет. Образуется в клетках нижней части эпидермисаЭпидермис – это верхний, наружный слой кожи., позволяющих нам ощущать прикосновения.
Крупноклеточная карцинома – развивается в крупных округлых клетках, в большинстве случаев обнаруживается на поверхности легкого, но может возникать и в других его частях. Быстро растет и стремительно метастазирует – создает дополнительные очаги заболевания в других тканях.
Медуллярная карцинома. Формируется в мозговом веществе почки, содержащем структуры, отвечающие за поддержание водного и солевого баланса крови, а также в клетках протоков груди и щитовидной железе.
Мелкоклеточная карцинома. Возникает в легких, мочевом пузыре, слюнных железах и желудке. Быстро развивается, рано создает метастазы и имеет плохой прогноз.
Муцинозная карцинома. Образуется в вырабатывающих муцин – компонент слизи, клетках яичников, потовых и молочных желез, мочевого пузыря, легких, кишечника, аппендикса и эндометрия – ткани, выстилающей внутреннюю поверхность матки,
Папиллярная карцинома. Развивается в клетках щитовидной железы, кожи, почек и мочевого пузыря.
Плоскоклеточный рак. Формируется их плоских клеток, расположенных в эпителии – поверхностном слое тканей, защищающем их от инфекций и травм. Это один из самых распространенных видов злокачественных опухолей, который может начаться в любой части тела, где присутствуют подобные клетки. Чаще всего развивается в коже, пищеводе, во рту, губах, языке, миндалинах, легких, гортани, вульве, половом члене, влагалище, слюнных железах, анальном канале, мочевом пузыре и шейке матки.
Почечно-клеточная карцинома. Возникает в клетках, выстилающих почечные канальцы – небольшие трубочки, по которым проходит так называемая первичная моча – жидкость, из которой различные вещества и лишняя вода всасываются и поступают обратно в организм.
Уротелиальная, или переходно-клеточная карцинома. Образуется в особых клетках внутреннего слоя мочевого пузыря и мочевыводящих путей, способных менять форму, не повреждаясь при растяжении ткани.

Диагностика карциномы
При подозрении на наличие рака и перед назначением любого лечения проводится полное обследование, в ходе которого врачи оценивают общее состояние здоровья пациента и количество пострадавших от карциномы тканей. Для этого специалисты назначают целый ряд процедур:
- Анализы крови и мочи: с их помощью нельзя поставить окончательный диагноз, но можно выяснить, насколько хорошо работают внутренние органы, такие как почки и печень, и обнаружить онкомаркеры – особые белки, которые выделяют некоторые виды опухолей.
- УЗИ – исследование мягких тканей с помощью звуковых волн. Проводится быстро, не наносит вреда организму и практически не имеет противопоказаний, но дает не очень четкую картинку, особенно если изучаемая область находится далеко от датчика аппарата.
- КТ, или компьютерная томография – метод диагностики различных заболеваний с помощью серии рентгеновских снимков, объединяемых в одно, очень подробное изображение.
- МРТ , магнитно-резонансная томография – создание крайне четкой картинки, отображающей состояние мягких тканей благодаря аппарату, использующему действие магнитов и радиоволн.
- Рентген грудной клетки – может потребоваться для выявления поражения легких.
- ПЭТ – позитронно-эмиссионная томография. До проведения данного исследования пациент получает небольшую дозу радиоактивного сахара, который накапливается в измененных клетках. При сканировании содержащие его области выглядят особенно ярко. Данное свойство дает возможность специалистам выявлять любые, даже самые маленькие очаги заболевания, в том числе те, что не видны на КТ и МРТ.
- Биопсия – забор небольшого количества тканей и тщательное изучение свойств их клеток в лаборатории. Это единственный способ, позволяющий точно и безошибочно ставить окончательный диагноз.
При необходимости врачи могут назначить дополнительные процедуры или анализы.
Специалисты онкологического центра «Лапино-2» проводят полную диагностику рака и других опасных опухолей.
Мы выявляем любые проблемы со здоровьем, быстро выполняем обследование на самом современном оборудовании и в максимально сжатые сроки получаем результаты исследований из собственной лаборатории.
У нас работают только настоящие профессионалы своего дела – кандидаты и доктора медицинских наук с большим опытом в области борьбы с онкологией.
В нашем Центре можно не только пройти обследование, но и получить второе мнение – консультацию высококвалифицированного врача любого профиля. Данная услуга позволяет пациенту убедиться в правильности уже поставленного диагноза или выявить неточности уже имеющихся заключений.
Стадии карциномы
Сразу после выявления карциномы врачи устанавливают ее стадию – определяют, какие именно ткани успели пострадать от заболевания, и как далеко распространились измененные клетки. Эта информация дает возможность специалистам представлять примерные прогноза пациента и исходя из них назначать самое подходящее в каждом конкретном случае лечение.
Для стадирования используются международные системы, берущие за основу данные о трех ключевых элементах:
- С помощью буквы «Т» описывается размер основной опухоли и ее прорастание в ближайшие структуры. Ее минимальные габариты обозначаются как «Т1», а максимальные – «Т3» или «Т4», в зависимости от типа рака.
- «N» указывает на количество поврежденных лимфатических узлов – наших «фильтров», задерживающих и обезвреживающих опасные вещества и неправильные клетки. Если все они здоровы, шифр диагноза выглядит как «N0», а если поражены, то после «N» стоит цифра от 1 до 4.
- «М» говорит об отсутствии или наличии метастазов – дополнительных новообразований в других органах. Пока их нет, рядом с «М» стоит 0, и только на последней стадии карциномы в медицинской документации пишется «М1».
Для некоторых видов рака стадия определяется не только данными о T, N и M.
Еще один немаловажный фактор – это дифференцировка опухоли, то есть степень отличия ее клеток от нормальных:
- Высокодифференцированные
новообразования, G1: их клетки под микроскопом выглядят почти так же, как здоровые. Они медленно растут и хорошо поддаются лечению. - Среднедифференцированные, G2: клетки заметно отличаются от обычных.
- Низкодифференцированные, G3: они почти не похожи на нормальные.
- Недифференцированные, G4: их клетки выглядят совсем не так, как те, из которых они превратились в раковые. Они быстро развиваются, стремительно размножаются и плохо реагируют на терапию.
- Даже если степень дифференцировки не принимается во внимание при определении этапа заболевания, она влияет на выбор лечения и прогнозы пациента.
Тип клеток, из которых состоит опухоль, тоже может иметь значение. Например, стадирование плоскоклеточных карцином и аденокарцином пищевода проводится отдельно.
Результаты лабораторных тестов. При раке молочной железы критично наличие на измененных клетках особых белков – рецепторов, которые ускоряют рост новообразования при присоединении к гормонамГормоны – это создаваемые железами химические вещества, которые сообщают тканям, как действовать – работать или отдыхать, выделять что-то или поглощать.
На перспективе лечения карцином щитовидной железы очень сильно отражается возраст человека.
Еще один значимый момент – расположение первичного очага
заболевания в таких органах, как пищевод.
После определения значений для T, N, М и оценки прочих факторов врачи определяют стадию. В большинстве случаев их 4. Они обозначаются римскими цифрами от I до IV:
I. Такие новообразования имеют очень маленькие размеры и растут только в той ткани, в которой впервые возникли.
II. Как правило, на этом этапе поражаются более глубокие слои пораженного органа.
III. К третьей стадии относят более крупные опухоли, повредившие ближайшие структуры, или лимфатические узлы.
IV. На последней, четвертой, обнаруживаются метастазы – дополнительные очаги онкологии в тканях, расположенных далеко от первичного новообразования.
У некоторых видов заболевания есть нулевая стадия. Так называемый предрак, карцинома in situ или неинвазивный рак означает, что в организме присутствуют измененные клетки, но они находятся только в том слое, где впервые появились.

Лечение карциномы
Борьба с раком – сложная задача, требующая участия не одного, даже самого опытного врача, а нескольких докторов различных специальностей – хирурга, онколога, химиотерапевта и других.
Для лечения различных типов карцином применяется несколько методов.
- Часто первым и основным из них является хирургия – удаление пораженных и небольшого количества окружающих их здоровых структур. Если новообразование не крупное и не успело распространить свои клетки в другие области организма, применяются лапароскопические операции, в ходе которых травмируется минимальное количество тканей. Они проводятся через небольшие проколы в коже с помощью специальных инструментов и лапароскопа – тонкой гибкой трубки с видеокамерой и источником света на конце. Подобные вмешательства сокращают сроки пребывания в клинике и позволяют пациентам быстро восстанавливаться. В некоторых случаях приходится изымать не только опухоль, но и весь пострадавший орган – целиком или частично.
- Химиотерапия – прием препаратов, уничтожающих раковые и любые другие быстро делящиеся клетки. Такие вещества попадают в кровоток и воздействуют на все части тела. Подобные средства уменьшают опухоль или не позволяют ей расти, но имеют ряд серьезных побочных эффектов, поскольку оказывают влияние и на здоровые ткани.
- Лучевая терапия – разрушение измененных клеток с помощью радиации. Данный метод используется для борьбы с различными видами карцином. С его помощью специалисты сокращают объемы новообразования, облегчая его хирургическое удаление, уничтожают оставшиеся после операции очаги заболевания и снижают вероятность рецидива – повторного развития рака.
- Гормональная терапия – прием препаратов, которые воздействуют на стимулирующие развитие некоторых видов опухолей гормоныГормоны – это создаваемые железами химические вещества, которые сообщающие тканям, как действовать – работать или отдыхать, выделять что-то или поглощать.. Подобные средства используются для замедления роста новообразований или облегчения вызванных ими симптомов.
- Таргетная терапия – вещества, уничтожающие определенные типы онкологических клеток. Они назначаются для уменьшения размеров или сдерживания темпов развития карциномы и практически не наносят вреда здоровым тканям.
- Иммунотерапия – препараты, которые активируют собственный иммунитет человека и помогают ему более эффективно выявлять и разрушать измененные клетки.
- Пациентам, которых нельзя полностью избавить от рака, назначается паллиативное лечение. Его задача заключается в улучшении качества жизни и облегчении симптомов заболевания, таких как боль, кровотечения, затруднение дыхания и непроходимость кишечника или мочевыводящих путей.
Специалисты онкологического центра «Лапино-2» проводят любое лечение карцином и других типов рака.
У нас работают только настоящие профессионалы своего дела – врачи с огромным опытом в области диагностики и борьбы с опасными для жизни опухолями.
Нашим пациентам не приходится тратить время на очереди и поездки в различные медицинские организации – все процедуры и вмешательства мы выполняем на территории Центра в максимально сжатые сроки.
Мы используем только самое современное оборудование и оригинальные препараты, дающие предсказуемый результат, а наш персонал делает все, чтобы пребывание в клинике было комфортным для каждого посетителя.
Прогнозы и выживаемость при карциноме
Перспективы каждого человека индивидуальны и зависят от множества факторов – типа рака, его распространенности, степени отличия измененных клеток от нормальных, реакции на лечение, возраста и общего состояния здоровья.
Врачи определяют примерные прогнозы, ориентируясь на данные специального показателя – так называемой «пятилетней выживаемости». Он представляет из себя статистическую выборку – количество пациентов на определенной стадии, проживших 5 или более лет с момента постановки диагноза.
Для всех типов заболевания действует единое правило – чем раньше их удается обнаружить и приступить к терапии, тем выше шансы на полное выздоровление.
Для подавляющего большинства опухолей in situ, клетки которых находятся только в той области, где впервые образовались, он составляет около 100%.
Одни из самых распространенных типов подобных опасных новообразований – карциномы легких. Для мелкоклеточных видов средняя продолжительность жизни на начальных этапах рака равняется 20 месяцам, а пятилетняя выживаемость – 20%. При распространении измененных клеток в другие части тела эта цифра падает до менее чем 1%. Для немелкоклеточных на первой стадии она не превышает 70%, а на последней – 10%.

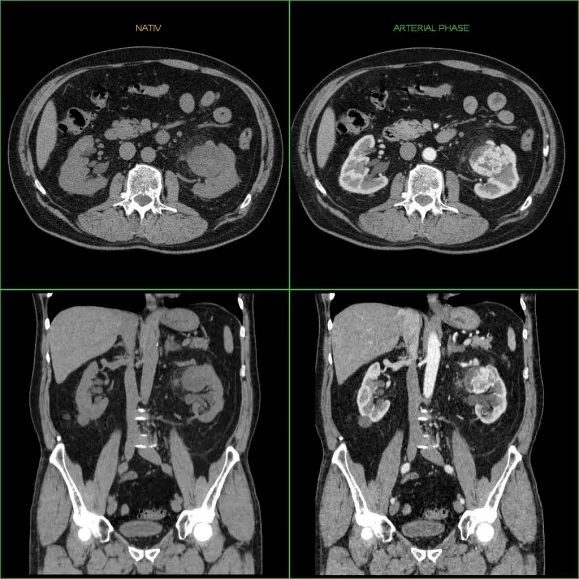
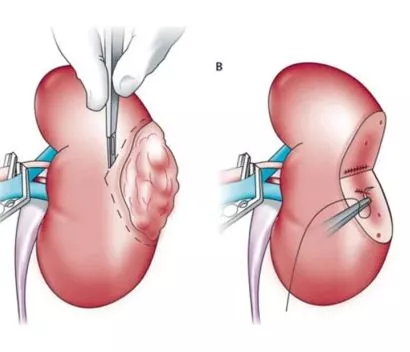 нефроносохраняющей нефрэктомией. После оперативного лечения в обязательном порядке проводится КТ или МРТ брюшной полости в течение шести месяцев после начала наблюдения, а затем данные исследования повторяют не реже одного раза в год.
нефроносохраняющей нефрэктомией. После оперативного лечения в обязательном порядке проводится КТ или МРТ брюшной полости в течение шести месяцев после начала наблюдения, а затем данные исследования повторяют не реже одного раза в год.
![A micrograph of type 1 PRCC, illustrating features of small basophilic cells with scarce cytoplasm. A single layer of cells are surrounding the basal membrane.[20] Foamy macrophages are inside of papillary fibrovascular cores.](https://upload.wikimedia.org/wikipedia/commons/thumb/f/f2/Histopathology_of_papillary_renal_cell_carcinoma_type_1%2C_high_magnification.jpg/381px-Histopathology_of_papillary_renal_cell_carcinoma_type_1%2C_high_magnification.jpg)