Синонимы к слову «перекись»

Прямых синонимов не найдено.
Связанные слова и выражения
- перекись, отбеливатель, азот, ополаскиватель, отбеливание, антибиотик, натрий, спирт, электролиз, ацетон, зелёнка, щёлочь, аммиак, растворитель, хлор
- обесцвечивание, кислота
- пероксид, сульфит, сульфат, адсорбент, уайт-спирит, тетрациклин, коагуляция, лигнин, гидразин, ацетат, хлорирование, пергидроль, гидроксид, коагулянт, сульфамид
- бриллиантовый зелёный
- перманганат калия
- нашатырный спирт
- хлорная известь
- активированный уголь
- едкий натр
- медный купорос
- дистиллированная вода
- азотнокислое серебро
- красный фосфор
- масло чайного дерева
- хозяйственное мыло
- внутривенное вливание
- анилиновые красители
- каменноугольная смола
- хлористый кальций
- борная кислота
- ватный тампон
- пищевая сода
- бикарбонат натрия
- серная мазь
- кристаллический порошок
- поражённое место
- сульфат цинка
- жидкость для снятия лака
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: кабестан — это что-то нейтральное, положительное или отрицательное?
Связанные слова (по тематикам)
- Люди: химик, пострадавший, анестезиолог, врач, медик
- Места: ранка, зелёнка, гематома, кровоподтёк, аптека
- Предметы: перекись, йод, антисептик, водород, марганцовка
- Действия: антисептика, электролиз, заживление, коагуляция, перевязка
- Абстрактные понятия: токсичность, растворимость, ацидоз, билирубин, валентность
Ассоциации к слову «перекись»
Предложения со словом «перекись»
- Лучше всего промыть ссадину 3%-ным раствором перекиси водорода.
- Её руки умело орудовали пинцетом, протирая рану перекисью и смывая запёкшуюся кровь.
- Впитавшиеся в структуру ногтя частички никотина можно удалить с помощью 2 %-ного раствора перекиси водорода.
- (все предложения)
Цитаты из русской классики со словом «перекись»
- Около нее появился мистер Лионель Крэйтон, человек неопределенного возраста, но как будто не старше сорока лет, крепкий, стройный, краснощекий; густые, волнистые волосы на высоколобом черепе серого цвета — точно обесцвечены перекисью водорода, глаза тоже серые и смотрят на все так напряженно, как это свойственно людям слабого зрения, когда они не решаются надеть очки.
- Затем из нагретой перекиси марганца, смешанного с песком, был добыт при помощи аптекарского пузырька, гуттаперчивого конца от эсмарховой кружки, таза, наполненного водой, и банки из-под варенья — кислород. Разожженная пробка, уголь и проволока горели в банке так ослепительно, что глазам становилось больно. Любка хлопала в ладоши и визжала в восторге:
- (все
цитаты из русской классики)
Значение слова «перекись»
-
ПЕ́РЕКИСЬ, -и, ж. Хим. Высшая степень окисления химического элемента. Перекись водорода. Перекись марганца. (Малый академический словарь, МАС)
Все значения слова ПЕРЕКИСЬ
Отправить комментарий
Дополнительно

Синоним слова ПЕРГИДРОЛЬ в словаре Синонимов русского языка
- ПЕРГИДРОЛЬ
-
пероксид
Синонимы русского языка.
2012
Перекись водорода — Синонимы : Пероксид водорода, гидропероксид, водорода диоксид, пергидроль.
Международное название: HYDROGEN PEROXIDE
Перекись водорода или пероксид водорода, H2O2 — это простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом.
Перекись водорода неограниченно растворима в воде, спирте и эфире.
Пероксид водорода является хорошим растворителем.
Разлагается на кислород и воду при нагревании, под действием ультрафиолетового излучения, а также в присутствии ионов переходных металлов и серебра: 2Н2O2 > 2H2O + O2.
Перекись — является альтернативой хлорным дезинфектантам, отлично уничтожает бактерии, вирусы и микробы. Очищает зеленую воду. Подходит для бассейнов с противотоками, фонтанами, гейзерами, SPA-бассейнов. Пригоден для воды высокой степени жесткости.
| Пероксид водорода | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Пероксид водорода |
| Химическая формула | H2O2 |
| Отн. молек. масса | 34,01 а. е. м. |
| Молярная масса | 34,01 г/моль |
| Физические свойства | |
| Плотность вещества | 1.4 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Термические свойства | |
| Температура плавления | −0,432 °C |
| Температура кипения | 150,2 °C |
| Энтальпия (ст. усл.) | -136.11 кДж/моль |
| Химические свойства | |
| pKa | 11.65 |
| Растворимость в воде | неограниченная г/100 мл |
| Классификация | |
| номер CAS | [7722-84-1] |
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.
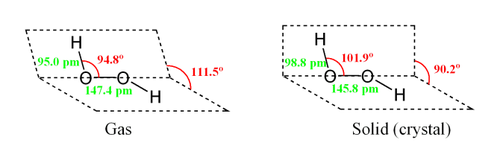
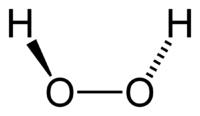
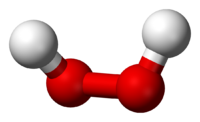
Молекула пероксида водорода имеет следующее строение:
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7·10-29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Окислительно-восстановительные свойства
- 4 Биологические свойства
- 5 Получение
- 6 Применение
- 7 Формы выпуска
- 8 Опасность применения
- 9 Ссылки
- 10 Литература
Физические свойства
Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н2О2, который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см3). Замерзает Н2О2 при температуре, немного меньшей, чем температура замерзания воды – при минус 0,41° С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н2О2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30° С, а 60%-ный – при минус 53° С. Кипит Н2О2 при температуре более высокой, чем обычная вода, – при 150,2° С. Смачивает стекло Н2О2 хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н2О2, жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.
Чистый Н2О2, как и сахарный сироп, сильно преломляет свет. Действительно, коэффициент преломления безводного Н2О2 (1,41) намного больше, чем у воды (1,33). Однако то ли в результате неверного толкования, то ли из-за плохого перевода с французского, практически во всех учебниках до сих пор пишут, что чистый пероксид водорода – «густая сиропообразная жидкость», и даже объясняют это теоретически – образованием водородных связей. Но ведь вода тоже образует водородные связи. На самом деле вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды, но нельзя сказать, что прохладная вода густая, как сироп.
Химические свойства
Разлагается на кислород и воду при нагревании, под действием ультрафиолетового излучения, а также в присутствии ионов переходных металлов и серебра:
- 2Н2O2 → 2H2O + O2
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет очень слабые кислотные свойства (К = 1,4·10–12). При действии концентрированного раствора Н2O2 на гидроксиды в ряде случаев можно выделить пероксиды металлов (Li2O2, MgO2 и др.):
- Н2O2 + 2NaOH → Na2O2 + 2H2O
Пероксидная группа -O-O- входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.), которые можно рассматривать как соли пероксида водорода. Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5 и пероксидосерная H2S2O8 кислоты.
Окислительно-восстановительные свойства
Пероксид водорода обладает сильными окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН–, например: Н2О2 + 2КI + Н2SO4 = I2 + K2SO4 + 2H2O
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
- O22– – 2e– → O2
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
- 5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + 2MnSO4 + K2SO4 + 8H2O
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Перекись водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАД(Ф)H-оксидаза, циклоксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в перекись водорода.
Получение
Пероксид водорода получаются в промышленности по реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
- (CH3)2СН(ОН) + O2 → CH3C(O)CH3 + H2O2
Ценным побочным продуктом этой реакции является ацетон.
В лабораторных условиях для получения пероксида водорода используют реакцию
- BaO2 + H2SO4 → H2O2 + BaSO4
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Применение
3 % раствор перекиси водорода
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов. В медицине растворы пероксида водорода применяются как антисептическое средство. При контакте с поврежденной кожей и слизистыми пероксид водорода под влиянием фермента каталазы распадается с выделением кислорода, что способствует сворачиванию крови и создает неблагоприятные условия для развития микроорганизмов. Однако такое действие непродолжительно и обладает слабым эффектом. Тем не менее, пероксид водорода (аптечное название — перекись водорода, 3 %) применяется при первичной обработке ран (в том числе открытых). Перекись водорода очень эффективна для лечения небольших царапин, особенно у детей — она не «щиплет», не имеет запаха, бесцветна. Однако она может вызывать небольшое жжение в районе открытой раны. Стоимость пузырька такого раствора (на 2009 год) — около 6 руб. В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 3, 30, 38, 50, 60, 85, 90 и 98%. 30% водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем.
Опасность применения
Несмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен.
Ссылки
NIST Chemistry WebBook
Литература
- Ахметов Н.С. «Общая и неорганическая химия» М.:Высшая школа, 2001
- Карапетьянц М.Х. Дракин С.И. Общая и неорганическая химия. М.: Химия 1994
Wikimedia Foundation.
2010.
Перекись водорода можно найти едва ли не в каждой домашней и автомобильной аптечке. Однако эта прозрачная жидкость – не только эффективный антисептик и средство для обработки ран.
Благодаря своим окислительно-восстановительным свойствам пероксид водорода востребован в промышленности, аналитической химии и даже в реактивной технике.
Название – пероксид водорода.
Синоним – перекись водорода или просто перекись.
Международное наименование — Hydrogen peroxide.
Идентификатор CAS – 7722-84-1.
Идентификатор ЕС – 231-765-0.
ГОСТ Р – 177-88.
Формула перекиси водорода – H2O2.
Свойства
Концентрированный пероксид представляет собой вязкую прозрачную жидкость с удельным весом 1,4 г/см3.
Из-за высокой полярности молекулы пероксид водорода крайне неустойчив, причем при высоких концентрациях может разлагаться со взрывом. Во все растворы крепостью выше 30% (пергидроль) добавляют специальные агенты-стабилизаторы, например, фосфат натрия. Перекись не горюча, но при контакте с металлами, солями и органическими веществами выделяется значительная энергия и атомарный кислород, что может привести к пожару.
Температура плавления перекиси -1°C (практически как у воды), температура кипения гораздо выше температуры кипения воды и составляет +150°C.
Интересный факт. При контакте со многими органическими веществами, например с ферментом каталазой, происходит расщепление пероксида водорода с выделением атомарного кислорода и образованием пены. Именно в этом заключается антисептический эффект при обработке ран. Однако клинические исследования доказали, что обрабатывать мелкие ссадины перекисью стоит лишь при отсутствии других антисептиков. Вместе с микробами пероксид поражает и клетки кожи. Применение пероксида водорода оправдано при санации глубоких ран, особенно гнойных. Также 3%-ный раствор перекиси водорода показано закапывать в уши при серных пробках.
Производство
С 30-х годов прошлого века основным способом промышленного производства перекиси остается окисление водорода воздуха в присутствии органического катализатора алкилантрагидрохинона. Реакция идет в среде бензола и спиртов и завершается экстракцией пероксида водорода водой. Процесс требует применения сложного промышленного оборудования и строгого соблюдения технологических регламентов и правил безопасности.
Меры предосторожности
Концентрированные растворы H2O2 чреваты не только взрывом и пожаром при попадании в них посторонних веществ, но и ожогами при контакте с кожей и слизистыми оболочками. Работать с перекисью следует в специальной одежде и с применением СИЗ.
Расфасовка
Для бытовых целей пероксид водорода концентрацией от 3 до 9% разливают в стеклянные пластиковые емкости 100-1000 мл. Более концентрированные растворы разливают в следующие виды тары:
• Стеклянные бутыли емкостью 20 литров
• Полиэтиленовые бочки вместимостью от 20 до 60 литров
• Алюминиевые контейнеры емкостью 133 и 160 литров
• Железнодорожные цистерны
Все емкости для товарной транспортировки и хранения пероксида водорода оборудуются клапаном для выхода газов и маркируются в соответствии с классом опасности химического продукта.
Номенклатура
Товарная перекись водорода делится на четыре класса:
• Медицинскую 30-40%
• Техническую класса А 35-40%
• Техническую класса Б высшего сорта 35-40%
• Техническую класса Б первого сорта 30-40%
В медицинской перекиси и в технической перекиси класса А массовая доля серной кислоты не должна превышать соответственно 0,3 и 0,35%. Для продукта класса Б требований по содержанию H2SO4 нет.
Пероксид водорода концентрацией выше 40% серийно не поставляется.
Применение
Продукт применяют в качестве:
• Антисептического средства в хирургической практике
• Кровоостанавливающего средства в стоматологии
• Дезинфицирующего агента при обработке помещений и инструментов
• Средства для отбеливания тканей и целлюлозы
• Катализатора химических реакций
• Маркера в аналитической химии
• Пенообразующего агента при производстве пустотных материалов
• Компонента при изготовлении эпоксидных смол
• Окислителя для авиационных и ракетных двигателей
Купить пероксид водорода
Если вашему медицинскому учреждению или производственному предприятию регулярно нужны товарные партии пероксида водорода, купить химический продукт лучше с центрального склада компании «Альфахимсинтез» в городе Дзержинск Нижегородской области. Товар отгружается самовывозом и с доставкой по России и за рубеж. Каждая партия обеспечивается сертификатами качества и протоколами лабораторного контроля.
При незначительных или разовых потребностях в пероксиде водорода Москва — наилучшая локация для его приобретения по цене завода изготовителя. Наш столичный склад к вашим услугам.
Цена отгружаемой перекиси водорода рассчитывается за литр продукта и зависит от:
• Класса перекиси (медицинская, техническая класса А или Б, высшего или первого сорта)
• Размера партии
• Вида товарной упаковки
• Персональных условий сотрудничества
По вопросам регулярных отгрузок и разовых закупок перекиси водорода свяжитесь с отделом продаж +7(8313) 39 77 66