Сигдуо Лонг аналоги
💊 Аналоги препарата Сигдуо Лонг®
✅ Более 222 аналогов Сигдуо Лонг®
Выбранный препарат
Сигдуо Лонг таб. с модифицированным высвобождением, покр. пленочной оболочкой, 5 мг+1000 мг: 60 шт.
Результаты поиска аналогов
Полные аналоги препарата не найдены
Информация о групповых и нозологических аналогах предназначена
только для
специалистов.
Групповые и нозологические аналоги не являются полными аналогами препаратов, решение об их использовании может быть принято только специалистом при назначении терапии в отсутствие препаратов первой линии.
Групповые аналоги: 39
| Название | Форма выпуска | Владелец рег. уд. | ||
|
Амарил® М |
Таб., покр. пленочной оболочкой, 2 мг+500 мг: 30 шт. рег. №: ЛП-(000166)-(РГ-RU ) Предыдущий рег. №: ЛП-000130 |
SANOFI-AVENTIS GROUPE (Франция) Произведено: HANDOK (Республика Корея) |
||
|
Асиглия® Мет |
Таб., покр. пленочной оболочкой 850 мг+50 мг рег. №: ЛП-(000695)-(РГ-RU ) Таб., покр. пленочной оболочкой 1000 мг+50 мг рег. №: ЛП-(000695)-(РГ-RU ) |
KRKA (Словения) |
||
|
Велметия® |
Таб., покр. пленочной обол., 850 мг+50 мг: 56 шт. рег. №: ЛП-004547 Таб., покр. пленочной обол., 1000 мг+50 мг: 56 шт. рег. №: ЛП-004547 |
BERLIN-CHEMIE (Германия) Произведено: БЕРЛИН-ФАРМА (Россия) |
||
|
Випдомет® |
|
Таб., покр. пленочной оболочкой, 12.5 мг+1000 мг: 14, 28 или 56 шт. рег. №: ЛП-004576 Таб., покр. пленочной оболочкой, 12.5 мг+500 мг: 14, 28 или 56 шт. рег. №: ЛП-004576 |
НИЖФАРМ (Россия) Произведено: TAKEDA (Германия) ТАКЕДА ФАРМАСЬЮТИКАЛС (Россия) Фасовка, упаковка и выпускающий контроль качества: TAKEDA IRELAND (Ирландия) ТАКЕДА ФАРМАСЬЮТИКАЛС (Россия) контакты: ШТАДА (Россия) |
|
|
Випдомет® 850 |
Таб., покр. пленочной оболочкой, 12.5 мг+850 мг: 14, 28 или 56 шт. рег. №: ЛП-005825 |
TAKEDA PHARMACEUTICALS U.S.A. (США) Произведено: TAKEDA (Германия) Выпускающий контроль качества: TAKEDA IRELAND (Ирландия) контакты: ШТАДА (Россия) |
||
|
Галвус Мет® |
Таб., покр. пленочной оболочкой, 50 мг+1000 мг: 6, 10, 18, 30, 36, 50, 60, 72, 108, 120, 180, 216 или 360 шт. рег. №: ЛСР-001749/09 |
NOVARTIS PHARMA (Швейцария) Произведено: NOVARTIS PHARMA STEIN (Швейцария) Упаковка и выпускающий контроль качества: NOVARTIS PHARMA STEIN (Швейцария) |
||
|
Галвус Мет® |
Таб., покр. пленочной оболочкой, 50 мг+1000 мг: 6, 10, 18, 30, 36, 50, 60, 72, 108, 120, 180, 216 или 360 шт. рег. №: ЛСР-001749/09 |
NOVARTIS PHARMA (Швейцария) Произведено: NOVARTIS PHARMA PRODUCTIONS (Германия) NOVARTIS SINGAPORE PHARMACEUTICAL MANUFACTURING (Сингапур) Упаковка и выпускающий контроль качества: NOVARTIS PHARMA PRODUCTIONS (Германия) |
||
|
Галвус Мет® |
Таб., покр. пленочной оболочкой, 50 мг+500 мг: 6, 10, 18, 30, 36, 50, 60, 72, 108, 120, 180, 216 или 360 шт. рег. №: ЛСР-001749/09 |
NOVARTIS PHARMA (Швейцария) Произведено: NOVARTIS PHARMA STEIN (Швейцария) Упаковка и выпускающий контроль качества: NOVARTIS PHARMA STEIN (Швейцария) |
||
|
Галвус Мет® |
Таб., покр. пленочной оболочкой, 50 мг+500 мг: 6, 10, 18, 30, 36, 50, 60, 72, 108, 120, 180, 216 или 360 шт. рег. №: ЛСР-001749/09 |
NOVARTIS PHARMA (Швейцария) Произведено: NOVARTIS PHARMA PRODUCTIONS (Германия) NOVARTIS SINGAPORE PHARMACEUTICAL MANUFACTURING (Сингапур) НОВАРТИС НЕВА (Россия) Упаковка и выпускающий контроль качества: NOVARTIS PHARMA PRODUCTIONS (Германия) НОВАРТИС НЕВА (Россия) |
||
|
Галвус Мет® |
Таб., покр. пленочной оболочкой, 50 мг+850 мг: 6, 10, 18, 30, 36, 50, 60, 72, 108, 120, 180, 216 или 360 шт. рег. №: ЛСР-001749/09 |
NOVARTIS PHARMA (Швейцария) Произведено: NOVARTIS PHARMA STEIN (Швейцария) Упаковка и выпускающий контроль качества: NOVARTIS PHARMA STEIN (Швейцария) |
||
|
Галвус Мет® |
Таб., покр. пленочной оболочкой, 50 мг+850 мг: 6, 10, 18, 30, 36, 50, 60, 72, 108, 120, 180, 216 или 360 шт. рег. №: ЛСР-001749/09 |
NOVARTIS PHARMA (Швейцария) Произведено: NOVARTIS PHARMA PRODUCTIONS (Германия) NOVARTIS SINGAPORE PHARMACEUTICAL MANUFACTURING (Сингапур) Упаковка и выпускающий контроль качества: NOVARTIS PHARMA PRODUCTIONS (Германия) |
||
|
Глибенкламид+Метформин |
Таб., покр. пленочной оболочкой, 2.5 мг+400 мг: 5, 10, 15, 20, 25, 30, 40, 45, 50, 60, 75, 80, 90, 100, 120, 150, 200, 225, 250 или 300 шт. рег. №: ЛП-007896 |
АТОЛЛ (Россия) Произведено: ОЗОН (Россия) |
||
|
Глибенкламид+Метформин |
Таб., покр. пленочной оболочкой, 2.5 мг+500 мг: 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 75, 80, 90, 100, 120, 125, 150, 175, 200, 225, 250 или 300 шт. рег. №: ЛП-005084 |
АТОЛЛ (Россия) Произведено: ОЗОН (Россия) |
||
|
Глибенкламид+Метформин |
Таб., покр. пленочной оболочкой, 5 мг+500 мг: 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 75, 80, 90, 100, 120, 125, 150, 175, 200, 225, 250 или 300 шт. рег. №: ЛП-005084 |
АТОЛЛ (Россия) Произведено: ОЗОН (Россия) |
||
|
Глибенфаж |
Таб., покр. пленочной оболочкой, 2.5 мг+ 500 мг: 10, 20, 30, 40, 60, 90, 100 или 120 шт. рег. №: ЛП-004612 |
ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) |
||
|
Глибенфаж |
Таб., покр. пленочной оболочкой, 5 мг+ 500 мг: 10, 20, 30, 40, 60, 90, 100 или 120 шт. рег. №: ЛП-004612 |
ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) |
||
|
Глибенфор |
Таб., покр. пленочной оболочкой, 2.5 мг+500 мг: 20, 30, 40, 60, 80 или 90 шт. рег. №: ЛП-006453 Таб., покр. пленочной оболочкой, 5 мг+500 мг: 20, 30, 40, 60, 80 или 90 шт. рег. №: ЛП-006453 |
БИОСИНТЕЗ (Россия) |
||
|
Глибомет® |
Таб., покр. пленочной оболочкой, 2.5 мг+400 мг: 40, 60 или 100 шт. рег. №: П N012183/01 |
Laboratori GUIDOTTI S.p.A. (Италия) Произведено: BERLIN-CHEMIE (Германия) MENARINI-VON HEYDEN (Германия) контакты: БЕРЛИН-ХЕМИ/МЕНАРИНИ ФАРМА ГмбХ (Германия) |
||
|
Глидика®М |
Таб., покр. плен. оболочкой 1 мг+250 мг: 30, 60 или 90 шт. рег. №: ЛП-005081 Таб., покр. плен. оболочкой 2 мг+500 мг: 30 или 60 шт. рег. №: ЛП-005081 |
КАНОНФАРМА ПРОДАКШН (Россия) |
||
|
Гликсамби |
Таб., покр. пленочной оболочкой, 5 мг+10 мг: 10 или 30 шт. рег. №: ЛП-(000633)-(РГ-RU ) Предыдущий рег. №: ЛП-004108 Таб., покр. пленочной оболочкой, 5 мг+25 мг: 10 или 30 шт. рег. №: ЛП-(000633)-(РГ-RU ) Предыдущий рег. №: ЛП-004108 |
BOEHRINGER INGELHEIM INTERNATIONAL (Германия) Произведено: BOEHRINGER INGELHEIM PHARMA (Германия) |
||
|
Глимекомб® |
Таб. 40 мг+500 мг: 60 шт. рег. №: ЛСР-009886/09 |
Химико-фармацевтический комбинат АКРИХИН (Россия) контакты: АКРИХИН АО (Россия) |
||
|
Глюкованс® |
Таб., покр. пленочной оболочкой, 2.5 мг+500 мг: 30 или 60 шт. рег. №: ЛС-000304 Таб., покр. пленочной оболочкой, 5 мг+500 мг: 30 или 60 шт. рег. №: ЛС-000304 |
Мерк (Россия) Произведено: MERCK SANTE (Франция) контакты: МЕРК ООО (Россия) |
||
|
Глюконорм® |
Таб., покр. пленочной оболочкой, 2.5 мг+400 мг: 40 шт. рег. №: ЛСР-009610/09 |
M.J. BIOPHARM (Индия) Упаковано: ФАРМСТАНДАРТ-ТОМСКХИМФАРМ (Россия) |
||
|
Глюконорм® Плюс |
Таб., покр. пленочной оболочкой, 2.5 мг+500 мг: 30 шт. рег. №: ЛП-004249 |
ФАРМСТАНДАРТ-ТОМСКХИМФАРМ (Россия) |
||
|
Глюконорм® Плюс |
Таб., покр. пленочной оболочкой, 5 мг+500 мг: 30 шт. рег. №: ЛП-004249 |
ФАРМСТАНДАРТ-ТОМСКХИМФАРМ (Россия) |
||
|
Инкресинк® |
|
Таб., покр. пленочной оболочкой, 25 мг+15 мг: 28 шт. рег. №: ЛП-(000188)-(РГ-RU ) Таб., покр. пленочной оболочкой, 25 мг+30 мг: 28 шт. рег. №: ЛП-(000188)-(РГ-RU ) |
TAKEDA PHARMACEUTICALS U.S.A. (США) Произведено: TAKEDA (Германия) Выпускающий контроль качества: TAKEDA IRELAND (Ирландия) Фасовка, упаковка и выпускающий контроль качества: TAKEDA IRELAND (Ирландия) контакты: ШТАДА (Россия) |
|
|
Комбоглиз Пролонг® |
Таб. с модифицированным высвобождением, покр. пленочной оболочкой, 1000 мг+2.5 мг: 28 или 56 шт. рег. №: ЛП-002068 |
ASTRAZENECA UK (Великобритания) Производство, фасовка, упаковка и выпускающий контроль качества: ASTRAZENECA PHARMACEUTICALS LP (США) |
||
|
Комбоглиз Пролонг® |
Таб. с модифицированным высвобождением, покр. пленочной оболочкой, 1000 мг+5 мг: 28 шт. рег. №: ЛП-002068 |
ASTRAZENECA UK (Великобритания) Производство, фасовка, упаковка и выпускающий контроль качества: ASTRAZENECA PHARMACEUTICALS LP (США) |
||
|
Комбоглиз Пролонг® |
Таб. с модифицированным высвобождением, покр. пленочной оболочкой, 500 мг+5 мг: 28 шт. рег. №: ЛП-002068 |
ASTRAZENECA UK (Великобритания) Производство, фасовка, упаковка и выпускающий контроль качества: ASTRAZENECA PHARMACEUTICALS LP (США) |
||
|
Кутерн |
Таб. покр. пленочной оболочкой, 10 мг+5 мг: 30 шт. рег. №: ЛП-005718 |
ASTRAZENECA (Швеция) Произведено: ASTRAZENECA PHARMACEUTICALS LP (США) Расфасовано и упаковано: ASTRAZENECA (Швеция) |
||
|
Метаглиптин Медисорб |
Таб., покр. пленочной оболочкой, 50 мг+500 мг: 7, 10, 14, 20, 21, 28, 30, 35, 40, 42, 49, 50, 56, 60, 63, 70, 80, 84, 90, 98, 100, 112, 120, 126 или 140 шт. рег. №: ЛП-007118 Таб., покр. пленочной оболочкой, 50 мг+850 мг: 7, 10, 14, 20, 21, 28, 30, 35, 40, 42, 49, 50, 56, 60, 63, 70, 80, 84, 90, 98, 100, 112, 120, 126 или 140 шт. рег. №: ЛП-007118 Таб., покр. пленочной оболочкой, 50 мг+1000 мг: 7, 10, 14, 20, 21, 28, 30, 35, 40, 42, 49, 50, 56, 60, 63, 70, 80, 84, 90, 98, 100, 112, 120, 126 или 140 шт. рег. №: ЛП-007118 |
МЕДИСОРБ (Россия) |
||
|
Метглиб |
Таб., покр. пленочной оболочкой, 2.5 мг+400 мг: 10, 20, 30, 40, 60 или 90 шт. рег. №: ЛП-001954 |
КАНОНФАРМА ПРОДАКШН (Россия) |
||
|
Метглиб® Форс |
Таб., покр. пленочной оболочкой, 2.5 мг+500 мг: 10, 20, 30, 40, 60 или 90 шт. рег. №: ЛП-003571 Таб., покр. пленочной оболочкой, 2.5 мг+500 мг: 30, 40, 60 или 90 шт. рег. №: ЛП-003571 Таб., покр. пленочной оболочкой, 5 мг+500 мг: 10, 20, 30, 40, 60 или 90 шт. рег. №: ЛП-003571 Таб., покр. пленочной оболочкой, 5 мг+500 мг: 30, 40, 60 или 90 шт. рег. №: ЛП-003571 |
КАНОНФАРМА ПРОДАКШН (Россия) Произведено: РАДУГА ПРОДАКШН (Россия) КАНОНФАРМА ПРОДАКШН (Россия) НПО ФармВИЛАР (Россия) Упаковано: НПО ФармВИЛАР (Россия) РАДУГА ПРОДАКШН (Россия) КАНОНФАРМА ПРОДАКШН (Россия) |
||
|
Сатерекс® Мет |
Таб., покр. пленочной оболочкой, 30 мг и 500 мг: 84 шт. рег. №: ЛП-006578 Таб., покр. пленочной оболочкой, 30 мг и 1000 мг: 84 шт. рег. №: ЛП-006578 |
ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) |
||
|
Сатерекс®Мет |
Таб., покр. пленочной оболочкой 30 мг и 500 мг рег. №: ЛП-(001161)-(РГ-RU ) Таб., покр. пленочной оболочкой 30 мг и 1000 мг рег. №: ЛП-(001161)-(РГ-RU ) |
ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) |
||
|
Синджарди |
Таб., покр. пленочной оболочкой, 500 мг+5 мг: 30, 60, 90 или 180 шт. рег. №: ЛП-004736 Таб., покр. пленочной оболочкой, 500 мг+12.5 мг: 30, 60, 90 или 180 шт. рег. №: ЛП-004736 Таб., покр. пленочной оболочкой, 850 мг+5 мг: 30, 60, 90 или 180 шт. рег. №: ЛП-004736 Таб., покр. пленочной оболочкой, 850 мг+12.5 мг: 30, 60, 90 или 180 шт. рег. №: ЛП-004736 Таб., покр. пленочной оболочкой, 1000 мг+12.5 мг: 30, 60, 90 или 180 шт. рег. №: ЛП-004736 Таб., покр. пленочной оболочкой, 1000 мг+5 мг: 30, 60, 90 или 180 шт. рег. №: ЛП-004736 |
BOEHRINGER INGELHEIM INTERNATIONAL (Германия) Произведено: BOEHRINGER INGELHEIM PHARMA (Германия) BOEHRINGER INGELHEIM ELLAS (Греция) контакты: БЕРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНЕШНЛ ГмбХ (Германия) |
||
|
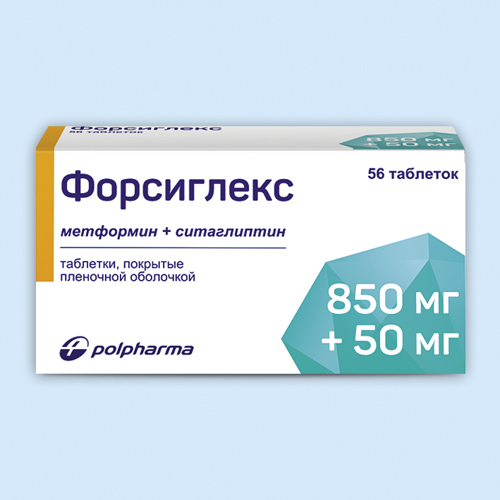
Форсиглекс |
|
Таб., покр. пленочной оболочкой, 500 мг+50 мг: 56 шт. рег. №: ЛП-006228 Таб., покр. пленочной оболочкой, 850 мг+50 мг: 56 шт. рег. №: ЛП-006228 Таб., покр. пленочной оболочкой, 1000 мг+50 мг: 56 шт. рег. №: ЛП-006228 |
Pharmaceutical Works «POLPHARMA» (Польша) контакты: АКРИХИН АО (Россия) |
|
|
Янумет |
Таб., покр. пленочной оболочкой, 500 мг+50 мг: 14, 28, 56, 84 или 98 шт. рег. №: ЛП-(000149)-(РГ-RU ) Предыдущий рег. №: ЛП-000046 Таб., покр. пленочной оболочкой, 850 мг+50 мг: 14, 28, 56, 84 или 98 шт. рег. №: ЛП-(000149)-(РГ-RU ) Предыдущий рег. №: ЛП-000046 Таб., покр. пленочной оболочкой, 1000 мг+50 мг: 14, 28, 56, 84 или 98 шт. рег. №: ЛП-(000149)-(РГ-RU ) Предыдущий рег. №: ЛП-000046 |
MERCK SHARP & DOHME (Нидерланды) Произведено: PATHEON PUERTO RICO (Пуэрто-Рико) Химико-фармацевтический комбинат АКРИХИН (Россия) Фасовка, упаковка и выпускающий контроль качества: MERCK SHARP & DOHME (Нидерланды) Химико-фармацевтический комбинат АКРИХИН (Россия) |
||
|
Янумет® Лонг |
Таб. с пролонгированным высвобождением, покр. пленочной оболочкой, 500 мг+50 мг: 7, 10, 14, 28, 30, 56, 60, 90, 180 или 1000 шт. рег. №: ЛП-(000566)-(РГ-RU ) Предыдущий рег. №: ЛП-004332 Таб. с пролонгированным высвобождением, покр. пленочной оболочкой, 1000 мг+50 мг: 7, 10, 14, 28, 30, 56, 60, 90, 180 или 1000 шт. рег. №: ЛП-(000566)-(РГ-RU ) Предыдущий рег. №: ЛП-004332 Таб. с пролонгированным высвобождением, покр. пленочной оболочкой, 1000 мг+100 мг: 7, 10, 14, 28, 30, 56, 60, 90, 180 или 1000 шт. рег. №: ЛП-(000566)-(РГ-RU ) Предыдущий рег. №: ЛП-004332 |
MERCK SHARP & DOHME (Нидерланды) Произведено: MSD INTERNATIONAL GmbH (PUERTO RICO BRANCH) (Пуэрто-Рико) Выпускающий контроль качества: MERCK SHARP & DOHME (Нидерланды) |
Нозологические аналоги: 183
| Название | Форма выпуска | Владелец рег. уд. | ||
|
Агарта® |
Таб. 50 мг: 28 шт. рег. №: ЛП-(000266)-(РГ-RU ) |
GEDEON RICHTER (Венгрия) Произведено: GEDEON RICHTER ROMANIA (Румыния) ГЕДЕОН РИХТЕР-РУС (Россия) Упаковка и выпускающий контроль качества: GEDEON RICHTER ROMANIA (Румыния) ГЕДЕОН РИХТЕР-РУС (Россия) |
||
|
Амарил® |
Таб. 1 мг: 30, 60, 90 или 120 шт. рег. №: П N015530/01 Таб. 2 мг: 30, 60, 90 или 120 шт. рег. №: П N015530/01 Таб. 3 мг: 30, 60, 90 или 120 шт. рег. №: П N015530/01 Таб. 4 мг: 30, 60, 90 или 120 шт. рег. №: П N015530/01 |
SANOFI-AVENTIS DEUTSCHLAND (Германия) Произведено: SANOFI (Италия) контакты: САНОФИ |
||
|
Асиглия® |
Таб., покр. пленочной оболочкой 25 мг рег. №: ЛП-(000655)-(РГ-RU ) Таб., покр. пленочной оболочкой 50 мг рег. №: ЛП-(000655)-(РГ-RU ) Таб., покр. пленочной оболочкой 100 мг рег. №: ЛП-(000655)-(РГ-RU ) |
KRKA (Словения) |
||
|
Астрозон |
Таб. 30 мг: 30 или 60 шт. рег. №: ЛСР-010488/08 |
ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА (Россия) |
||
|
Баета® |
Р-р д/п/к введения 250 мкг/1 мл: картриджи в шприц-ручках 1.2 мл или 2.4 мл рег. №: ЛС-002221 |
ASTRAZENECA UK (Великобритания) Произведено: BAXTER PHARMACEUTICAL SOLUTIONS (США) Расфасовано: BAXTER PHARMACEUTICAL SOLUTIONS (США) SHARP CORPORATION (США) Упаковано: ENESTIA BELGIUM (Бельгия) Выпускающий контроль качества: ASTRAZENECA (Швеция) контакты: АстраЗенека Фармасьютикалз ООО (Россия) |
||
|
Виктоза® |
Р-р д/п/к введения 6 мг/1 мл: картридж в шприц-ручке 3 мл 1, 2 или 3 шт. рег. №: ЛСР-004405/10 |
NOVO NORDISK (Дания) |
||
|
Вилдаглиптин |
Таб. 50 мг: 10, 14, 20, 28, 40, 56, 60, 84, 120 или 168 шт. рег. №: ЛП-007839 |
АТОЛЛ (Россия) Произведено: ОЗОН (Россия) |
||
|
Вилдаглиптин Канон |
Таб. 50 мг рег. №: ЛП-008157 |
КАНОНФАРМА ПРОДАКШН (Россия) |
||
|
Вилдаглиптин Медисорб |
Таб. 50 мг: 7, 10, 14, 20, 21, 28, 30, 35, 40, 42, 49, 50, 56, 60, 63, 70, 80, 84, 90, 98, 100, 112, 120, 126 или 140 шт. рег. №: ЛП-005958 |
МЕДИСОРБ (Россия) |
||
|
Вилдаглиптин-СЗ |
Таб. 50 мг рег. №: ЛП-(000907)-(РГ-RU ) |
СЕВЕРНАЯ ЗВЕЗДА (Россия) |
||
|
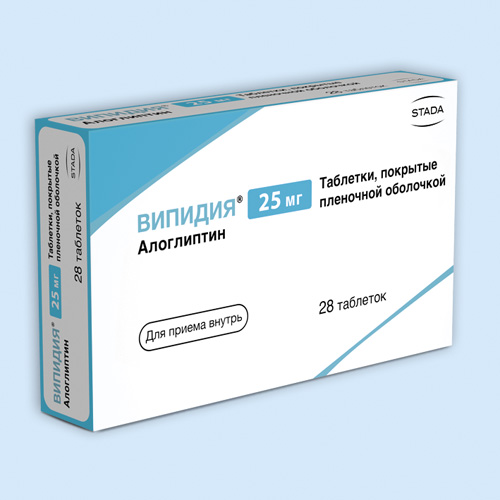
Випидия® |
|
Таб., покр. пленочной оболочкой, 12.5 мг: 28 шт. рег. №: ЛП-002644 Таб., покр. пленочной оболочкой, 25 мг: 28 шт. рег. №: ЛП-002644 |
STADA Arzneimittel (Германия) Произведено: TAKEDA IRELAND (Ирландия) ТАКЕДА ФАРМАСЬЮТИКАЛС (Россия) контакты: ШТАДА (Россия) |
|
|
Галвус® |
Таб. 50 мг: 14, 28, 56, 84, 112 или 168 шт. рег. №: ЛП-(000761)-(РГ-RU ) Предыдущий рег. №: ЛСР-008119/08 |
NOVARTIS PHARMA (Швейцария) Произведено: SIEGFRIED BARBERA (Испания) НОВАРТИС НЕВА (Россия) Фасовка и упаковка: SIEGFRIED BARBERA (Испания) Фасовка, упаковка и выпускающий контроль качества: НОВАРТИС НЕВА (Россия) Выпускающий контроль качества: NOVARTIS FARMACEUTICA (Испания) |
||
|
Глемауно |
Таб. 1 мг: 30 шт. рег. №: ЛП-000519 Таб. 2 мг: 30 шт. рег. №: ЛП-000519 Таб. 3 мг: 30 шт. рег. №: ЛП-000519 Таб. 4 мг: 30 шт. рег. №: ЛП-000519 |
WOCKHARDT (Индия) |
||
|
Глибекс |
Таб. 1.75 мг: 120 шт. рег. №: П N014959/01-2003 |
M.J. BIOPHARM (Индия) |
||
|
Глибекс |
Таб. 3.5 мг: 120 шт. рег. №: П N014959/01-2003 |
M.J. BIOPHARM (Индия) |
||
|
Глибекс |
Таб. 5 мг: 120 шт. рег. №: П N014959/01-2003 |
M.J. BIOPHARM (Индия) |
||
|
Глибенкламид |
Таб. 1.75 мг: 10, 14, 20, 25, 28, 30, 40, 42, 50, 56, 60, 70, 75, 80, 84, 90, 100, 112, 120, 125, 140, 150, 180, 200, 240, 300, 400 или 500 шт. рег. №: ЛП-003742 Таб. 3.5 мг: 10, 14, 20, 25, 28, 30, 40, 42, 50, 56, 60, 70, 75, 80, 84, 90, 100, 112, 120, 125, 140, 150, 180, 200, 240, 300, 400 или 500 шт. рег. №: ЛП-003742 Таб. 5 мг: 10, 14, 20, 25, 28, 30, 40, 42, 50, 56, 60, 70, 75, 80, 84, 90, 100, 112, 120, 125, 140, 150, 180, 200, 240, 300, 400 или 500 шт. рег. №: ЛП-003742 |
АТОЛЛ (Россия) Произведено: ОЗОН (Россия) |
||
|
Глибенкламид |
Таб. 1.75 мг: 10, 20, 30, 60 или 120 шт. рег. №: ЛП-005650 Таб. 3.5 мг: 10, 20, 30, 60 или 120 шт. рег. №: ЛП-005650 |
ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА (Россия) |
||
|
Глибенкламид |
Таб. 5 мг: 10, 20, 30 или 50 шт. рег. №: ЛП-000933 |
БИОСИНТЕЗ (Россия) |
||
|
Глибенкламид |
Таб. 5 мг: 40 или 50 шт. рег. №: ЛС-002056 |
ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА (Россия) |
||
|
Глибенкламид |
Таб. 5 мг: 50 шт. рег. №: ЛС-002499 |
МОСХИМФАРМПРЕПАРАТЫ им. Н.А.Семашко (Россия) |
||
|
Глибенкламида таблетки 0.005 г |
Таб. 5 мг: 50 шт. рег. №: 95/370/10 |
БИОСИНТЕЗ (Россия) |
||
|
Глидиаб® |
Таб. 80 мг: 60 шт. рег. №: Р N000001/01 |
Химико-фармацевтический комбинат АКРИХИН (Россия) контакты: АКРИХИН АО (Россия) |
||
|
Глидиаб® МВ |
Таб. с модифиц. высвобождением 30 мг: 30 или 60 шт. рег. №: ЛС-000002 |
Химико-фармацевтический комбинат АКРИХИН (Россия) контакты: АКРИХИН АО (Россия) |
||
|
Глидиаб® МВ |
Таб. с модифиц. высвобождением 30 мг: 30 или 60 шт. рег. №: ЛП-(000069)-(РГ-RU ) |
Химико-фармацевтический комбинат АКРИХИН (Россия) |
||
|
Гликлада® |
Таб. пролонгир. действия 60 мг: 30, 60, 90 или 120 шт. рег. №: ЛП-002725 |
KRKA d.d., Novo mesto (Словения) |
||
|
Гликлада® |
Таб. с пролонгир. высвобождением 30 мг: 30, 60 или 90 шт. рег. №: ЛП-(000116)-(РГ-RU ) Предыдущий рег. №: ЛСР-005824/09 |
KRKA (Словения) Вторичная упаковка и выпускающий контроль качества: KRKA d.d., Novo mesto (Словения) КРКА-РУС (Россия) |
||
|
Гликлазид |
Таб. 80 мг: 10, 20, 30, 40, 50, 60 или 100 шт. рег. №: ЛП-006674 |
УСОЛЬЕ-СИБИРСКИЙ ХИМФАРМЗАВОД (Россия) |
||
|
Гликлазид Канон |
Таб. с пролонгированным высвобождением 30 мг: 30 или 60 шт. рег. №: ЛП-003964 Таб. с пролонгированным высвобождением 60 мг: 30 или 60 шт. рег. №: ЛП-003964 |
КАНОНФАРМА ПРОДАКШН (Россия) |
||
|
Гликлазид МВ |
Таб. с модифиц. высвобождением 30 мг: 10, 20, 30, 40, 50, 60, 80, 90, 100, 120, 150, 180, 200 или 300 шт. рег. №: ЛП-002218 |
АТОЛЛ (Россия) Произведено: ОЗОН (Россия) |
||
|
Гликлазид МВ |
Таб. с модифиц. высвобождением 60 мг: 10, 14, 20, 25, 28, 30, 40, 42, 50, 56, 60, 75, 84, 90, 100, 120, 125, 140, 150, 180, 250 или 300 шт. рег. №: ЛП-003109 |
АТОЛЛ (Россия) Произведено: ОЗОН (Россия) |
||
|
Гликлазид МВ Фармстандарт |
Таб. с пролонгированным высвобождением 30 мг: 30 или 60 шт. рег. №: ЛП-003625 |
ФАРМСТАНДАРТ-ТОМСКХИМФАРМ (Россия) |
||
|
Гликлазид МВ Фармстандарт |
Таб. с пролонгированным высвобождением 60 мг: 30 или 60 шт. рег. №: ЛП-003625 |
ФАРМСТАНДАРТ-ТОМСКХИМФАРМ (Россия) |
||
|
Гликлазид МВ-Вертекс |
Таб. с пролонгированным высвобождением 30 мг: 30, 60 или 90 шт. рег. №: ЛП-005762 |
ВЕРТЕКС (Россия) |
||
|
Гликлазид МВ-Вертекс |
Таб. с пролонгированным высвобождением 60 мг: 30, 60 или 90 шт. рег. №: ЛП-005762 |
ВЕРТЕКС (Россия) |
||
|
Гликлазид Пролонг-АКОС |
Таб. с пролонгир. высвобождением 30 мг: 10, 20, 30, 60, 100 или 120 шт. рег. №: ЛП-007266 Таб. с пролонгир. высвобождением 60 мг: 10, 20, 30, 60, 100 или 120 шт. рег. №: ЛП-007266 |
АЛИУМ (Россия) Произведено: СИНТЕЗ (Россия) |
||
|
Гликлазид-СЗ |
Таб. с пролонгир. высвобождением 60 мг: 30, 60 или 90 шт. рег. №: ЛП-№(001556)-(РГ-R U) Предыдущий рег. №: ЛП-004551 |
СЕВЕРНАЯ ЗВЕЗДА (Россия) контакты: СЕВЕРНАЯ ЗВЕЗДА НАО (Россия) |
||
|
Глимепирид |
Таб. 1 мг: 30, 60 или 100 шт. рег. №: ЛП-005629 |
ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА (Россия) |
||
|
Глимепирид |
Таб. 1 мг: от 10 до 600 шт. рег. №: ЛП-(000760)-(РГ-RU ) Предыдущий рег. №: ЛП-003488 Таб. 2 мг: от 10 до 600 шт. рег. №: ЛП-(000760)-(РГ-RU ) Предыдущий рег. №: ЛП-003488 Таб. 3 мг: от 10 до 600 шт. рег. №: ЛП-(000760)-(РГ-RU ) Предыдущий рег. №: ЛП-003488 Таб. 4 мг: от 10 до 600 шт. рег. №: ЛП-(000760)-(РГ-RU ) Предыдущий рег. №: ЛП-003488 |
АТОЛЛ (Россия) Произведено: ОЗОН (Россия) |
||
|
Глимепирид |
Таб. 2 мг: 10, 15, 30, 60 или 100 шт. рег. №: ЛП-004195 |
РАФАРМА (Россия) |
||
|
Глимепирид |
Таб. 2 мг: 30 шт. рег. №: ЛП-002967 |
ФАРМПРОЕКТ (Россия) |
||
|
Глимепирид |
Таб. 2 мг: 30, 60 или 100 шт. рег. №: ЛП-(000441)-(РГ-RU ) Предыдущий рег. №: ЛСР-009962/09 Таб. 3 мг: 30, 60 или 100 шт. рег. №: ЛП-(000441)-(РГ-RU ) Предыдущий рег. №: ЛСР-009962/09 |
ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА (Россия) |
||
|
Глимепирид |
Таб. 3 мг: 10, 15, 30, 60 или 100 шт. рег. №: ЛП-004195 |
РАФАРМА (Россия) |
||
|
Глимепирид |
Таб. 3 мг: 30 шт. рег. №: ЛП-002967 |
ФАРМПРОЕКТ (Россия) |
||
|
Глимепирид |
Таб. 4 мг: 10, 15, 30, 60 или 100 шт. рег. №: ЛП-004195 |
РАФАРМА (Россия) |
||
|
Глимепирид |
Таб. 4 мг: 30 шт. рег. №: ЛП-002967 |
ФАРМПРОЕКТ (Россия) |
||
|
Глимепирид |
Таб. 4 мг: 30, 60 или 100 шт. рег. №: ЛП-(000403)-(РГ-RU ) Предыдущий рег. №: ЛП-001795 |
ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА (Россия) |
||
|
Глимепирид Канон |
Таб. 1 мг: 10, 30, 60, 90, 100 или 120 шт. рег. №: ЛП-001446 |
КАНОНФАРМА ПРОДАКШН (Россия) |
||
|
Глимепирид Канон |
Таб. 2 мг: 10, 30, 60, 90, 100 или 120 шт. рег. №: ЛП-001446 |
КАНОНФАРМА ПРОДАКШН (Россия) |
||
|
Глимепирид Канон |
Таб. 3 мг: 10, 30, 60, 90, 100 или 120 шт. рег. №: ЛП-001446 |
КАНОНФАРМА ПРОДАКШН (Россия) |
||
|
Глимепирид-Вертекс |
Таб. 1 мг: 30 или 60 шт. рег. №: ЛП-002219 |
ВЕРТЕКС (Россия) |
||
|
Глимепирид-Вертекс |
Таб. 2 мг: 30 или 60 шт. рег. №: ЛП-002219 |
ВЕРТЕКС (Россия) |
||
|
Глимепирид-Вертекс |
Таб. 3 мг: 30 или 60 шт. рег. №: ЛП-002219 |
ВЕРТЕКС (Россия) |
||
|
Глимепирид-Вертекс |
Таб. 4 мг: 30 или 60 шт. рег. №: ЛП-002219 |
ВЕРТЕКС (Россия) |
||
|
Глимепирид-Вертекс |
Таб. 6 мг: 30 или 60 шт. рег. №: ЛП-002219 |
ВЕРТЕКС (Россия) |
||
|
Глимепирид-СЗ |
Таб. 2 мг: 30, 60 или 90 шт. рег. №: ЛП-005504 |
СЕВЕРНАЯ ЗВЕЗДА (Россия) |
||
|
Глимепирид-СЗ |
Таб. 3 мг: 30, 60 или 90 шт. рег. №: ЛП-005504 |
СЕВЕРНАЯ ЗВЕЗДА (Россия) |
||
|
Глимепирид-СЗ |
Таб. 4 мг: 30, 60 или 90 шт. рег. №: ЛП-005504 |
СЕВЕРНАЯ ЗВЕЗДА (Россия) |
||
|
Глимепирид-Тева |
Таб. 1 мг: 30 шт. рег. №: ЛСР-005208/08 |
PLIVA HRVATSKA (Хорватия) Произведено: USV (Индия) |
||
|
Глимепирид-Тева |
Таб. 2 мг: 30 шт. рег. №: ЛСР-005208/08 |
PLIVA HRVATSKA (Хорватия) Произведено: USV (Индия) |
||
|
Глимепирид-Тева |
Таб. 3 мг: 30 шт. рег. №: ЛСР-005208/08 |
PLIVA HRVATSKA (Хорватия) Произведено: USV (Индия) |
||
|
Глипвило® |
Таб. 50 мг рег. №: ЛП-(000662)-(РГ-RU ) |
KRKA (Словения) |
||
|
Глюкофаж® |
Таб., покр. пленочной оболочкой, 1000 мг: 30, 45, 50, 60 или 120 шт. рег. №: П N014600/01 |
MERCK SANTE (Франция) Произведено: MERCK (Испания) НАНОЛЕК (Россия) |
||
|
Глюкофаж® |
Таб., покр. пленочной оболочкой, 1000 мг: 30, 45, 50, 60 или 120 шт. рег. №: П N014600/01 |
MERCK SANTE (Франция) Произведено: MERCK SANTE (Франция) |
||
|
Глюкофаж® |
Таб., покр. пленочной оболочкой, 500 мг: 30, 50, 60 или 100 шт. рег. №: П N014600/01 |
MERCK SANTE (Франция) Произведено: MERCK (Испания) НАНОЛЕК (Россия) |
||
|
Глюкофаж® |
Таб., покр. пленочной оболочкой, 500 мг: 30, 50, 60 или 100 шт. рег. №: П N014600/01 |
MERCK SANTE (Франция) Произведено: MERCK SANTE (Франция) |
||
|
Глюкофаж® |
Таб., покр. пленочной оболочкой, 850 мг: 30, 60 или 100 шт. рег. №: П N014600/01 |
MERCK SANTE (Франция) Произведено: MERCK (Испания) НАНОЛЕК (Россия) |
||
|
Глюкофаж® |
Таб., покр. пленочной оболочкой, 850 мг: 30, 60 или 100 шт. рег. №: П N014600/01 |
MERCK SANTE (Франция) Произведено: MERCK SANTE (Франция) |
||
|
Глюкофаж® Лонг |
Таб. с пролонгир. высвобождением 500 мг: 30 или 60 шт. рег. №: ЛСР-002098/10 Таб. с пролонгир. высвобождением 750 мг: 30 или 60 шт. рег. №: ЛП-000509 Таб. с пролонгир. высвобождением 1000 мг: 28, 30, 56 или 60 шт. рег. №: ЛП-002396 |
MERCK SANTE (Франция) Произведено: MERCK SANTE (Франция) MERCK HEALTHCARE (Германия) НАНОЛЕК (Россия) контакты: МЕРК ООО (Россия) |
||
|
Глюмедекс |
Таб. 2 мг: 30 шт. рег. №: ЛСР-003007/08 |
SHIN POONG PHARMACEUTICAL (Республика Корея) |
||
|
Глюренорм® |
Таб. 30 мг: 30, 60 или 120 шт. рег. №: ЛП-(000093)-(РГ-RU ) |
BOEHRINGER INGELHEIM INTERNATIONAL (Германия) Произведено: BOEHRINGER INGELHEIM ELLAS (Греция) контакты: БЕРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНЕШНЛ ГмбХ (Германия) |
||
|
Голда МВ |
Таб. с модифицированным высвобождением 30 мг: 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 150, 180, 200 или 300 шт. рег. №: ЛП-(000402)-(РГ-RU ) Предыдущий рег. №: ЛП-004364 Таб. с модифицированным высвобождением 60 мг: 7, 10, 14, 20, 25, 28, 30, 40, 42, 50, 56, 60, 70, 75, 80, 84, 90, 100, 120, 125, 140, 150, 180, 250 или 300 шт. рег. №: ЛП-(000402)-(РГ-RU ) Предыдущий рег. №: ЛП-004364 |
ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) |
||
|
Голдлайн® Комби |
Набор таб. с пролонгир. высвобождением и капс.: таб. 500 мг (10-90 шт.) и капс. 10 мг+158.5 мг (10-90 шт.) рег. №: ЛП-007728 Набор таб. с пролонгир. высвобождением и капс.: таб. 500 мг (10-90 шт.) и капс. 15 мг+153.5 мг (10-90 шт.) рег. №: ЛП-007728 Набор таб. с пролонгир. высвобождением и капс.: таб. 750 мг (10-90 шт.) и капс. 10 мг+158.5 мг (10-90 шт.) рег. №: ЛП-007728 Набор таб. с пролонгир. высвобождением и капс.: таб. 750 мг (10-90 шт.) и капс. 15 мг+153.5 мг (10-90 шт.) рег. №: ЛП-007728 Набор таб. с пролонгир. высвобождением и капс.: таб. 1000 мг (10-90 шт.) и капс. 10 мг+158.5 мг (10-90 шт.) рег. №: ЛП-007728 Набор таб. с пролонгир. высвобождением и капс.: таб. 1000 мг (10-90 шт.) и капс. 15 мг+153.5 мг (10-90 шт.) рег. №: ЛП-007728 |
IZVARINO PHARMA (Швеция) Произведено: ИЗВАРИНО ФАРМА (Россия) |
||
|
Дапаглифлозин Канон |
Таб., покр. пленочной оболочкой 5 мг рег. №: ЛП-008204 Таб., покр. пленочной оболочкой 10 мг рег. №: ЛП-008204 |
КАНОНФАРМА ПРОДАКШН (Россия) |
||
|
Дапафорс® |
Таб., покр. пленочной оболочкой 10 мг рег. №: ЛП-(001492)-(РГ-RU ) |
KRKA (Словения) |
||
|
Джардинс® |
Таб., покр. пленочной оболочкой, 10 мг: 10 или 30 шт. рег. №: ЛП-002735 Таб., покр. пленочной оболочкой, 25 мг: 10 или 30 шт. рег. №: ЛП-002735 |
BOEHRINGER INGELHEIM INTERNATIONAL (Германия) Произведено: BOEHRINGER INGELHEIM PHARMA (Германия) ROTTENDORF PHARMA (Германия) Упаковка и выпускающий контроль качества: BOEHRINGER INGELHEIM PHARMA (Германия) ROTTENDORF PHARMA (Германия) контакты: БЕРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНЕШНЛ ГмбХ (Германия) |
||
|
Диабеталонг® |
Таб. с пролонгированным высвобождением 30 мг: 30 шт. рег. №: ЛСР-008619/09 |
СИНТЕЗ (Россия) |
||
|
Диабеталонг® |
Таб. с пролонгированным высвобождением 60 мг: 10, 20, 30, 60, 100 или 120 шт. рег. №: ЛП-(000939)-(РГ-RU ) Предыдущий рег. №: ЛП-003155 |
СИНТЕЗ (Россия) |
||
|
Диабетон® МВ |
Таб. с модифицир. высвобождением 30 мг: 30 или 60 шт. рег. №: П N011940/01 |
Les Laboratoires Servier (Франция) Произведено: Les Laboratoires Servier Industrie (Франция) СЕРВЬЕ РУС (Россия) |
||
|
Диабетон® МВ |
Таб. с модифицир. высвобождением 60 мг: 30 или 60 шт. рег. №: ЛП-(000531)-(РГ-RU ) Предыдущий рег. №: ЛСР-006030/09 Таб. с модифицир. высвобождением 60 мг: 28, 30 или 60 шт. рег. №: ЛП-(000531)-(РГ-RU ) Предыдущий рег. №: ЛСР-006030/09 |
Les Laboratoires Servier (Франция) Произведено: СЕРВЬЕ РУС (Россия) Произведено, расфасовано и упаковано: Les Laboratoires Servier Industrie (Франция) |
||
|
Диабефарм® |
Таб. 80 мг: 30 или 60 шт. рег. №: Р N003217/01 |
ФАРМАКОР ПРОДАКШН (Россия) |
||
|
Диабефарм® МВ |
Таб. с модиф. высвобождением 30 мг: 28, 30, 56 или 60 шт. рег. №: ЛСР-004790/07 |
ФАРМАКОР ПРОДАКШН (Россия) |
||
|
Диабефарм® МВ |
Таб. с пролонгир. высвобождением 60 мг: 30, 60, 90 или 120 шт. рег. №: ЛП-005359 |
ФАРМАКОР ПРОДАКШН (Россия) |
||
|
Диабинакс |
Таб. 20 мг: 10 или 20 шт. рег. №: П N014190/01 Таб. 40 мг: 10 или 20 шт. рег. №: П N014190/01 Таб. 80 мг: 10, 20 или 60 шт. рег. №: П N014190/01 |
SHREYA LIFE SCIENCES (Индия) |
||
|
Диаглинид® |
Таб. 1 мг: 30 или 60 шт. рег. №: ЛП-001261 Таб. 2 мг: 30 или 60 шт. рег. №: ЛП-001261 Таб. 500 мкг: 30 или 60 шт. рег. №: ЛП-001261 |
Химико-фармацевтический комбинат АКРИХИН (Россия) контакты: АКРИХИН АО (Россия) |
||
|
Диамерид® |
Таб. 1 мг: 30 или 60 шт. рег. №: ЛП-000029 Таб. 2 мг: 30 или 60 шт. рег. №: ЛП-000029 Таб. 3 мг: 30 или 60 шт. рег. №: ЛП-000029 Таб. 4 мг: 30 или 60 шт. рег. №: ЛП-000029 |
Химико-фармацевтический комбинат АКРИХИН (Россия) |
||
|
Диамерид® |
Таб. 1 мг: 30 шт. рег. №: ЛП-(000063)-(РГ-RU ) Таб. 2 мг: 30 шт. рег. №: ЛП-(000063)-(РГ-RU ) Таб. 3 мг: 30 шт. рег. №: ЛП-(000063)-(РГ-RU ) Таб. 4 мг: 30 шт. рег. №: ЛП-(000063)-(РГ-RU ) |
Химико-фармацевтический комбинат АКРИХИН (Россия) контакты: АКРИХИН АО (Россия) |
||
|
Диаформин® ОД |
Таб. с пролонгир. высвобождением 500 мг: 30, 60 или 90 шт. рег. №: ЛП-000636 |
SUN PHARMACEUTICAL INDUSTRIES (Индия) |
||
|
Земигло |
Таб., покр. пленочной оболочкой, 50 мг: 28 или 56 шт. рег. №: ЛП-005247 |
SANOFI (Франция) Произведено: LG CHEM (Республика Корея) |
||
|
Иглинид |
Таб. 0.5 мг: 30, 60 или 90 шт. рег. №: ЛП-(000676)-(РГ-RU ) Предыдущий рег. №: ЛП-004383 Таб. 1 мг: 30, 60 или 90 шт. рег. №: ЛП-(000676)-(РГ-RU ) Предыдущий рег. №: ЛП-004383 Таб. 2 мг: 30, 60 или 90 шт. рег. №: ЛП-(000676)-(РГ-RU ) Предыдущий рег. №: ЛП-004383 |
ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) |
||
|
Инвокана® |
Таб., покр. пленочной оболочкой, 100 мг: 10, 30, 90 или 100 шт. рег. №: ЛП-002977 Таб., покр. пленочной оболочкой, 300 мг: 10, 30, 90 или 100 шт. рег. №: ЛП-002977 |
ДЖОНСОН & ДЖОНСОН (Россия) Произведено: JANSSEN ORTHO (Пуэрто-Рико) JANSSEN-CILAG S.p.A. (Италия) Упаковка и выпускающий контроль качества: JANSSEN-CILAG S.p.A. (Италия) контакты: МЕРК ООО (Россия) |
||
|
Инстолит |
Таб. 1 мг: 30, 60, 90, 100 или 120 шт. рег. №: ЛП-(000789)-(РГ-RU ) Предыдущий рег. №: ЛП-004334 Таб. 2 мг: 30, 60, 90, 100 или 120 шт. рег. №: ЛП-(000789)-(РГ-RU ) Предыдущий рег. №: ЛП-004334 Таб. 3 мг: 30, 60, 90, 100 или 120 шт. рег. №: ЛП-(000789)-(РГ-RU ) Предыдущий рег. №: ЛП-004334 Таб. 4 мг: 30, 60, 90, 100 или 120 шт. рег. №: ЛП-(000789)-(РГ-RU ) Предыдущий рег. №: ЛП-004334 |
ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) |
||
|
Кселевия® |
Таб., покр. пленочной оболочкой, 100 мг: 28 шт. рег. №: ЛП-004456 |
BERLIN-CHEMIE (Германия) Произведено: БЕРЛИН-ФАРМА (Россия) |
||
|
МАНИНИЛ® |
Таб. 1.75 мг: 120 шт. рег. №: П N012252/01 Таб. 3.5 мг: 120 шт. рег. №: П N012253/01 Таб. 5 мг: 120 шт. рег. №: П N011519/01 |
BERLIN-CHEMIE (Германия) Произведено: MENARINI-VON HEYDEN (Германия) контакты: БЕРЛИН-ХЕМИ/МЕНАРИНИ ФАРМА ГмбХ (Германия) |
||
|
Мерифатин |
Таб., покр. пленочной оболочкой, 500 мг: 10, 15, 20, 30, 40, 50, 60, 80, 90, 100 или 120 шт. рег. №: ЛП-(000591)-(РГ-RU ) Предыдущий рег. №: ЛП-004363 Таб., покр. пленочной оболочкой, 850 мг: 10, 15, 20, 30, 40, 50, 60, 80, 90, 100 или 120 шт. рег. №: ЛП-(000591)-(РГ-RU ) Предыдущий рег. №: ЛП-004363 Таб., покр. пленочной оболочкой, 1000 мг: 10, 15, 20, 30, 40, 50, 60, 80, 90, 100 или 120 шт. рег. №: ЛП-(000591)-(РГ-RU ) Предыдущий рег. №: ЛП-004363 |
ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) Произведено: ФАРМАСИНТЕЗ (Россия) ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) |
||
|
Мерифатин МВ |
Таб. с пролонгир. высвобождением, 500 мг: от 10 до 120 шт. рег. №: ЛП-(000787)-(РГ-RU ) Предыдущий рег. №: ЛП-005280 Таб. с пролонгир. высвобождением, 750 мг: от 10 до 120 шт. рег. №: ЛП-(000787)-(РГ-RU ) Предыдущий рег. №: ЛП-005280 Таб. с пролонгир. высвобождением, 1000 мг: от 10 до 120 шт. рег. №: ЛП-(000787)-(РГ-RU ) Предыдущий рег. №: ЛП-005280 |
ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) Произведено: ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) ФАРМАСИНТЕЗ (Россия) |
||
|
Метадиен |
Таб. пролонгированного действия 500 мг: 100 шт. рег. №: ЛСР-005999/10 |
WOCKHARDT (Индия) |
||
|
Метфорвел |
Таб., покр. пленочной оболочкой, 500 мг: 10, 20, 30, 40, 50 или 60 шт. рег. №: ЛП-005107 Таб., покр. пленочной оболочкой, 850 мг: 10, 20, 30, 40, 50 или 60 шт. рег. №: ЛП-005107 |
ВЕЛФАРМ (Россия) |
||
|
Метформин |
Таб. 1000 мг: 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 180, 240, 300, 360, 420, 480, 540, 600 или 720 шт. рег. №: ЛП-002189 |
АТОЛЛ (Россия) Произведено: ОЗОН (Россия) |
||
|
Метформин |
Таб. 500 мг: 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 180, 240, 300, 360, 420, 480, 540, 600 или 720 шт. рег. №: ЛП-002189 |
АТОЛЛ (Россия) Произведено: ОЗОН (Россия) |
||
|
Метформин |
Таб. 850 мг: 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 180, 240, 300, 360, 420, 480, 540, 600 или 720 шт. рег. №: ЛП-002189 |
АТОЛЛ (Россия) Произведено: ОЗОН (Россия) |
||
|
Метформин |
Таб., покр. пленочной обол., 500 мг: 30, 40, 50 или 60 шт. рег. №: ЛП-004046 Таб., покр. пленочной обол., 850 мг: 20, 30, 40, 60 или 80 шт. рег. №: ЛП-004046 Таб., покр. пленочной обол., 1000 мг: 30, 45, 50 или 60 шт. рег. №: ЛП-004046 |
ПРОМОМЕД РУС (Россия) Произведено: БИОХИМИК (Россия) |
||
|
Метформин |
Таб., покр. пленочной оболочкой 500 мг рег. №: ЛП-008633 |
LOK-BETA PHARMACEUTICALS (I) (Индия) |
||
|
Метформин |
|
Таб., покр. пленочной оболочкой, 1000 мг: 10, 30, 60, 100 или 120 шт. рег. №: ЛП-003848 |
БИОСИНТЕЗ (Россия) |
|
|
Метформин |
Таб., покр. пленочной оболочкой, 1000 мг: 15, 30 или 60 шт. рег. №: ЛП-002975 |
РАФАРМА (Россия) |
||
|
Метформин |
Таб., покр. пленочной оболочкой, 1000 мг: 30 шт. рег. №: ЛП-004380 |
БОРИСОВСКИЙ ЗАВОД МЕДИЦИНСКИХ ПРЕПАРАТОВ (Республика Беларусь) |
||
|
Метформин |
|
Таб., покр. пленочной оболочкой, 1000 мг: 30, 60, 90 или 120 шт. рег. №: ЛП-004257 |
ИЗВАРИНО ФАРМА (Россия) |
|
|
Метформин |
Таб., покр. пленочной оболочкой, 500 мг: 10, 30, 60, 100 или 120 шт. рег. №: ЛП-003848 |
БИОСИНТЕЗ (Россия) |
||
|
Метформин |
Таб., покр. пленочной оболочкой, 500 мг: 15, 30 или 60 шт. рег. №: ЛП-002975 |
РАФАРМА (Россия) |
||
|
Метформин |
Таб., покр. пленочной оболочкой, 500 мг: 30 или 60 шт. рег. №: ЛП-005966 Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт. рег. №: ЛП-005966 |
ЛЕКВАЛИС (Россия) Произведено: ИНТЕРФАРМА (Россия) |
||
|
Метформин |
Таб., покр. пленочной оболочкой, 500 мг: 30 или 60 шт. рег. №: ЛП-005463 |
МАРБИОФАРМ (Россия) |
||
|
Метформин |
Таб., покр. пленочной оболочкой, 500 мг: 30 или 60 шт. рег. №: ЛП-005456 Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт. рег. №: ЛП-005456 Таб., покр. пленочной оболочкой, 1000 мг: 30 или 60 шт. рег. №: ЛП-005456 |
ИРБИТСКИЙ ХФЗ (Россия) |
||
|
Метформин |
Таб., покр. пленочной оболочкой, 500 мг: 30 или 60 шт. рег. №: ЛСР-000779/08 Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт. рег. №: ЛСР-000779/08 |
ФАРМАЦЕВТ (Россия) |
||
|
Метформин |
Таб., покр. пленочной оболочкой, 500 мг: 30 шт. рег. №: ЛП-004380 |
БОРИСОВСКИЙ ЗАВОД МЕДИЦИНСКИХ ПРЕПАРАТОВ (Республика Беларусь) |
||
|
Метформин |
|
Таб., покр. пленочной оболочкой, 500 мг: 30, 60, 90 или 120 шт. рег. №: ЛП-004257 |
ИЗВАРИНО ФАРМА (Россия) |
|
|
Метформин |
Таб., покр. пленочной оболочкой, 850 мг: 15, 30 или 60 шт. рег. №: ЛП-002975 |
РАФАРМА (Россия) |
||
|
Метформин |
Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт. рег. №: ЛП-005463 |
МАРБИОФАРМ (Россия) |
||
|
Метформин |
Таб., покр. пленочной оболочкой, 850 мг: 30 шт. рег. №: ЛП-004380 |
БОРИСОВСКИЙ ЗАВОД МЕДИЦИНСКИХ ПРЕПАРАТОВ (Республика Беларусь) |
||
|
Метформин |
|
Таб., покр. пленочной оболочкой, 850 мг: 30, 60, 90 или 120 шт. рег. №: ЛП-004257 |
ИЗВАРИНО ФАРМА (Россия) |
|
|
Метформин Авексима |
Таб., покр. пленочной оболочкой, 500 мг: 10, 12, 20, 24, 30, 36, 40, 48, 50, 60, 72 шт. рег. №: ЛП-005441 |
АВЕКСИМА СИБИРЬ (Россия) |
||
|
Метформин Авексима |
Таб., покр. пленочной оболочкой, 850 мг: 10, 12, 20, 24, 30, 36, 40, 48, 50, 60, 72 шт. рег. №: ЛП-005441 |
АВЕКСИМА СИБИРЬ (Россия) |
||
|
Метформин Канон |
Таб., покр. пленочной оболочкой, 500 мг: 30, 50, 60, 90, 100 или 120 шт. рег. №: ЛП-001724 Таб., покр. пленочной оболочкой, 850 мг: 30, 50, 60, 90, 100 или 120 шт. рег. №: ЛП-001724 Таб., покр. пленочной оболочкой, 1000 мг: 30, 50, 60, 90, 100 или 120 шт. рег. №: ЛП-001724 |
КАНОНФАРМА ПРОДАКШН (Россия) Произведено: КАНОНФАРМА ПРОДАКШН (Россия) НПО ФармВИЛАР (Россия) РАДУГА ПРОДАКШН (Россия) |
||
|
Метформин Лонг |
Таб. пролонгированного действия, покр. пленочной оболочкой, 1000 мг: 10, 20, 30, 60, 100 или 120 шт. рег. №: ЛП-003855 |
БИОСИНТЕЗ (Россия) |
||
|
Метформин Лонг |
Таб. пролонгированного действия, покр. пленочной оболочкой, 850 мг: 10, 20, 30, 60, 100 или 120 шт. рег. №: ЛП-003855 |
БИОСИНТЕЗ (Россия) |
||
|
Метформин Лонг |
Таб. с пролонгир. высвобождением 500 мг рег. №: ЛП-008316 Таб. с пролонгир. высвобождением 750 мг рег. №: ЛП-008316 Таб. с пролонгир. высвобождением 1000 мг рег. №: ЛП-008316 |
ВЕЛФАРМ (Россия) |
||
|
Метформин Лонг |
Таб. с пролонгированным высвобождением 500 мг: 3, 5, 6, 9, 10, 15, 18, 20, 27, 30, 36, 40, 45, 50, 60, 90, 100 или 120 шт. рег. №: ЛП-005288 Таб. с пролонгированным высвобождением 750 мг: 3, 5, 6, 9, 10, 15, 18, 20, 27, 30, 36, 40, 45, 50, 60, 90, 100 или 120 шт. рег. №: ЛП-005288 Таб. с пролонгированным высвобождением 1000 мг: 3, 5, 6, 9, 10, 15, 18, 20, 27, 30, 36, 40, 45, 50, 60, 90, 100 или 120 шт. рег. №: ЛП-005288 |
АТОЛЛ (Россия) Произведено: ОЗОН (Россия) |
||
|
Метформин Лонг Канон |
Таб. с пролонгированным высвобождением 1000 мг: 30 или 60 шт. рег. №: ЛП-004315 |
КАНОНФАРМА ПРОДАКШН (Россия) |
||
|
Метформин Лонг Канон |
Таб. с пролонгированным высвобождением 500 мг: 30 или 60 шт. рег. №: ЛП-004315 |
КАНОНФАРМА ПРОДАКШН (Россия) |
||
|
Метформин Лонг Канон |
Таб. с пролонгированным высвобождением 750 мг: 30 или 60 шт. рег. №: ЛП-004315 |
КАНОНФАРМА ПРОДАКШН (Россия) |
||
|
Метформин МВ |
|
Таб. с пролонгированным высвобождением 1000 мг: 30, 60, 90 или 120 шт. рег. №: ЛП-004302 |
ИЗВАРИНО ФАРМА (Россия) |
|
|
Метформин МВ |
|
Таб. с пролонгированным высвобождением 500 мг: 30, 60, 90 или 120 шт. рег. №: ЛП-004302 |
ИЗВАРИНО ФАРМА (Россия) |
|
|
Метформин МВ |
|
Таб. с пролонгированным высвобождением 750 мг: 30, 60, 90 или 120 шт. рег. №: ЛП-004302 |
ИЗВАРИНО ФАРМА (Россия) |
|
|
Метформин МВ |
|
Таб. с пролонгированным высвобождением 850 мг: 30, 60, 90 или 120 шт. рег. №: ЛП-004302 |
ИЗВАРИНО ФАРМА (Россия) |
|
|
Метформин МВ-Тева |
Таб. пролонгированного действия 500 мг: 30, 60 или 120 шт. рег. №: ЛП-001968 |
Teva Pharmaceutical Industries (Израиль) |
||
|
Метформин МС |
Таб., покр. пленочной обол., 500 мг: 20, 30, 40, 50, 60 или 100 шт. рег. №: ЛП-004568 Таб., покр. пленочной обол., 850 мг: 20, 30, 40, 50, 60 или 100 шт. рег. №: ЛП-004568 Таб., покр. пленочной обол., 1000 мг: 20, 30, 40, 50, 60 или 100 шт. рег. №: ЛП-004568 |
МЕДИСОРБ (Россия) |
||
|
Метформин Пролонг-Акрихин |
Таб. пролонгированного действия, покр. пленочной оболочкой, 1000 мг: 30 или 60 шт. рег. №: ЛП-002674 |
Химико-фармацевтический комбинат АКРИХИН (Россия) |
||
|
Метформин Пролонг-Акрихин |
Таб. пролонгированного действия, покр. пленочной оболочкой, 750 мг: 30 или 60 шт. рег. №: ЛП-003700 |
Химико-фармацевтический комбинат АКРИХИН (Россия) |
||
|
Метформин Санофи |
Таб., покр. пленочной оболочкой, 500 мг: 30, 60 или 90 шт. рег. №: ЛСР-003625/10 Таб., покр. пленочной оболочкой, 850 мг: 30, 60 или 90 шт. рег. №: ЛСР-003625/10 Таб., покр. пленочной оболочкой, 1000 мг: 10, 30, 60 или 90 шт. рег. №: ЛСР-003625/10 |
САНОФИ РОССИЯ (Россия) Произведено: SANOFI INDIA (Индия) |
||
|
Метформин-Акрихин |
Таб. 500 мг: 30, 60 или 100 шт. рег. №: Р N003192/01 Таб., покр. пленочной оболочкой, 1 г: 30 или 60 шт. рег. №: ЛСР-005803/08 Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт. рег. №: ЛСР-005803/08 |
Химико-фармацевтический комбинат АКРИХИН (Россия) контакты: АКРИХИН АО (Россия) |
||
|
Метформин-Алси |
Таб., покр. пленочной оболочкой, 500 мг: 30 или 60 шт. рег. №: ЛП-006773 Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт. рег. №: ЛП-006773 |
АЛСИ Фарма (Россия) |
||
|
Метформин-ВЕРТЕКС |
Таб., покр. пленочной оболочкой, 1000 мг: 30, 60, 100 или 120 шт. рег. №: ЛП-005387 |
ВЕРТЕКС (Россия) |
||
|
Метформин-Вертекс |
Таб., покр. пленочной оболочкой, 500 мг: 30, 60, 100 или 120 шт. рег. №: ЛП-004690 Таб., покр. пленочной оболочкой, 850 мг: 30, 60, 100 или 120 шт. рег. №: ЛП-004690 |
ВЕРТЕКС (Россия) |
||
|
Метформин-Рихтер |
|
Таб., покр. пленочной оболочкой, 500 мг: 60 шт. рег. №: ЛС-001149 Таб., покр. пленочной оболочкой, 850 мг: 60 шт. рег. №: ЛС-001149 |
GEDEON RICHTER (Венгрия) Произведено: ГЕДЕОН РИХТЕР-РУС (Россия) Выпускающий контроль качества: ГЕДЕОН РИХТЕР-РУС (Россия) контакты: ГЕДЕОН РИХТЕР ОАО (Венгрия) |
|
|
Метформин-СЗ |
Таб. с пролонгированным высвобождением 500 мг: 20, 30 или 60 шт. рег. №: ЛП-006994 Таб. с пролонгированным высвобождением 750 мг: 20, 30 или 60 шт. рег. №: ЛП-006994 Таб. с пролонгированным высвобождением 1000 мг: 20, 30 или 60 шт. рег. №: ЛП-006994 |
СЕВЕРНАЯ ЗВЕЗДА (Россия) контакты: СЕВЕРНАЯ ЗВЕЗДА НАО (Россия) |
||
|
Метформин-Тева |
Таб., покр. пленочной оболочкой, 500 мг: 30 или 60 шт. рег. №: ЛП-000028 Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт. рег. №: ЛП-000028 Таб., покр. пленочной оболочкой, 1000 мг: 30 или 60 шт. рег. №: ЛП-000028 |
Teva Pharmaceutical Industries (Израиль) контакты: ТЕВА (Израиль) |
||
|
Оземпик® |
Р-р д/п/к введения 1.34 мг/1 мл: картридж в шприц-ручке 1.5 мл (0.25 мг/доза или 0.5 мг/доза) и 3 мл (1 мг/доза) рег. №: ЛП-005726 |
NOVO NORDISK (Дания) контакты: НОВО НОРДИСК ООО (Россия) |
||
|
Онглиза® |
Таб., покр. пленочной оболочкой, 2.5 мг: 30 шт. рег. №: ЛП-(000475)-(РГ-RU ) Предыдущий рег. №: ЛСР-008697/10 Таб., покр. пленочной оболочкой, 5 мг: 30 шт. рег. №: ЛП-(000475)-(РГ-RU ) Предыдущий рег. №: ЛСР-008697/10 |
ASTRAZENECA UK (Великобритания) Произведено: ASTRAZENECA PHARMACEUTICALS LP (США) Фасовка, упаковка и выпускающий контроль качества: ASTRAZENECA UK (Великобритания) контакты: АстраЗенека Фармасьютикалз ООО (Россия) |
||
|
Пиоглар |
Таб. 15 мг: 10, 30 или 50 шт. рег. №: ЛС-001671 |
RANBAXY LABORATORIES (Индия) |
||
|
Пиоглар |
Таб. 30 мг: 10, 30 или 50 шт. рег. №: ЛС-001671 |
RANBAXY LABORATORIES (Индия) |
||
|
Пиоглит |
Таб. 15 мг: 30 шт. рег. №: ЛСР-010500/08 Таб. 30 мг: 30 шт. рег. №: ЛСР-010500/08 |
SUN PHARMACEUTICAL INDUSTRIES (Индия) |
||
|
Ребелсас® |
Таб. 3 мг: 30 шт. рег. №: ЛП-006910 Таб. 7 мг: 30 шт. рег. №: ЛП-006910 Таб. 14 мг: 30 шт. рег. №: ЛП-006910 |
NOVO NORDISK (Дания) Товарный знак компании: NOVO NORDISK (Дания) контакты: НОВО НОРДИСК ООО (Россия) |
||
|
Ринформин Лонг |
Таб. с пролонгированным высвобождением 500 мг: 30 или 60 шт. рег. №: ЛП-005420 |
ГЕРОФАРМ (Россия) |
||
|
Ринформин Лонг |
Таб. с пролонгированным высвобождением 750 мг: 30 или 60 шт. рег. №: ЛП-005420 |
ГЕРОФАРМ (Россия) |
||
|
Ринформин® |
Таб., покр. пленочной оболочкой, 500 мг: 30 или 60 шт. рег. №: ЛП-005951 Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт. рег. №: ЛП-005951 Таб., покр. пленочной оболочкой, 1000 мг: 30 или 60 шт. рег. №: ЛП-005951 |
ГЕРОФАРМ (Россия) |
||
|
Сатерекс® |
Таб., покр. пленочной оболочкой, 20 мг: 28, 30, 56, 60, 70, 84, 90, 98, 112 или 120 шт. рег. №: ЛП-003598 Таб., покр. пленочной оболочкой, 30 мг: 28, 30, 56, 60, 70, 84, 90, 98, 112 или 120 шт. рег. №: ЛП-003598 |
САТЕРЕКС (Россия) Произведено: ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) |
||
|
Сиглетик |
|
Таб., покр. пленочной оболочкой, 25 мг: 10, 14, 28 или 56 шт. рег. №: ЛП-(000626)-(РГ-RU ) Таб., покр. пленочной оболочкой, 50 мг: 14, 15, 28 или 56 шт. рег. №: ЛП-(000626)-(РГ-RU ) Таб., покр. пленочной оболочкой, 100 мг: 10, 14, 28 или 56 шт. рег. №: ЛП-(000626)-(РГ-RU ) |
Pharmaceutical Works «POLPHARMA» (Польша) Произведено и упаковано: Pharmaceutical Works «POLPHARMA» (Польша) PHARMACARE (Палестина) Выпускающий контроль качества: Pharmaceutical Works «POLPHARMA» (Польша) PHARMACARE PREMIUM (Мальта) контакты: АКРИХИН АО (Россия) |
|
|
Сиофор® 1000 |
Таб., покр. оболочкой, 1000 мг: 30, 60 или 120 шт. рег. №: ЛС-002180 |
BERLIN-CHEMIE/MENARINI PHARMA (Германия) Произведено: BERLIN-CHEMIE (Германия) |
||
|
Сиофор® 1000 |
Таб., покр. оболочкой, 1000 мг: 30, 60 или 120 шт. рег. №: ЛС-002180 |
BERLIN-CHEMIE/MENARINI PHARMA (Германия) Произведено: DRAGENOPHARM APOTHEKER PUESCHL (Германия) |
||
|
Сиофор® 500 |
Таб., покр. оболочкой, 500 мг: 30, 60 или 120 шт. рег. №: П N013673/01 |
BERLIN-CHEMIE/MENARINI PHARMA (Германия) Произведено: MENARINI-VON HEYDEN (Германия) |
||
|
Сиофор® 500 |
Таб., покр. оболочкой, 500 мг: 30, 60 или 120 шт. рег. №: П N013673/01 |
BERLIN-CHEMIE/MENARINI PHARMA (Германия) Произведено: BERLIN-CHEMIE (Германия) |
||
|
Сиофор® 850 |
Таб., покр. оболочкой, 850 мг: 30, 60 или 120 шт. рег. №: П N013674/01 |
BERLIN-CHEMIE/MENARINI PHARMA (Германия) Произведено: DRAGENOPHARM APOTHEKER PUESCHL (Германия) |
||
|
Сиофор® 850 |
Таб., покр. оболочкой, 850 мг: 30, 60 или 120 шт. рег. №: П N013674/01 |
BERLIN-CHEMIE/MENARINI PHARMA (Германия) Произведено: MENARINI-VON HEYDEN (Германия) |
||
|
Сиофор® 850 |
Таб., покр. оболочкой, 850 мг: 30, 60 или 120 шт. рег. №: П N013674/01 |
BERLIN-CHEMIE/MENARINI PHARMA (Германия) Произведено: BERLIN-CHEMIE (Германия) |
||
|
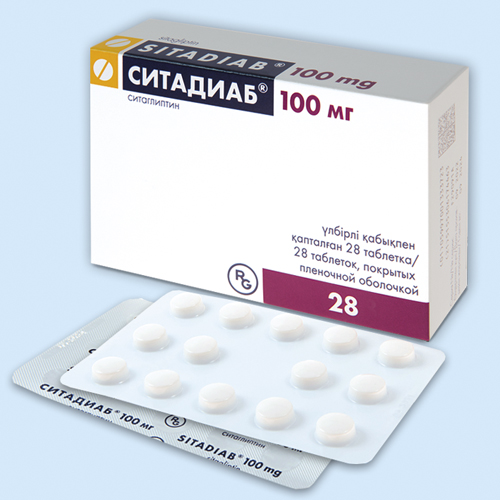
Ситадиаб® |
|
Таб., покр. пленочной оболочкой, 100 мг: 28 шт. рег. №: ЛП-(000724)-(РГ-RU ) |
GEDEON RICHTER (Венгрия) Произведено: GEDEON RICHTER ROMANIA (Румыния) ГЕДЕОН РИХТЕР-РУС (Россия) Упаковка и выпускающий контроль качества: ГЕДЕОН РИХТЕР-РУС (Россия) контакты: ГЕДЕОН РИХТЕР ОАО (Венгрия) |
|
|
Статиглин |
Таб. 1.75 мг: 14, 20, 25, 30, 42, 50, 56, 60, 75, 80, 84, 90, 100, 112, 120, 150, 180 или 240 шт. рег. №: ЛП-(000736)-(РГ-RU ) Предыдущий рег. №: ЛП-004405 Таб. 3.5 мг: 14, 20, 25, 30, 42, 50, 56, 60, 75, 80, 84, 90, 100, 112, 120, 150, 180 или 240 шт. рег. №: ЛП-(000736)-(РГ-RU ) Предыдущий рег. №: ЛП-004405 Таб. 5 мг: 14, 20, 25, 30, 42, 50, 56, 60, 75, 80, 84, 90, 100, 112, 120, 150, 180 или 240 шт. рег. №: ЛП-(000736)-(РГ-RU ) Предыдущий рег. №: ЛП-004405 |
ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) |
||
|
Стиглатра |
Таб., покрытые пленочной оболочкой, 5 мг: 28 или 30 шт. рег. №: ЛП-005959 Таб., покрытые пленочной оболочкой, 15 мг: 28 или 30 шт. рег. №: ЛП-005959 |
МСД ФАРМАСЬЮТИКАЛС (Россия) Произведено: SCHERING-PLOUGH LABO (Бельгия) PFIZER MANUFACTURING DEUTSCHLAND (Германия) |
||
|
Субетта® |
|
Таб. д/рассасывания: 100 шт. рег. №: ЛП-(000028)-(РГ-RU ) |
МАТЕРИА МЕДИКА ХОЛДИНГ НПФ (Россия) контакты: МАТЕРИА МЕДИКА ХОЛДИНГ НПФ ООО (Россия) |
|
|
Суглат |
Таб., покрытые пленочной оболочкой, 50 мг: 10, 30, 60 или 90 шт. рег. №: ЛП-005535 |
ASTELLAS PHARMA EUROPE (Нидерланды) Произведено и расфасовано: ASTELLAS PHARMA TECH (Япония) Упаковка и выпускающий контроль качества: ASTELLAS PHARMA EUROPE (Нидерланды) ЗиО-ЗДОРОВЬЕ (Россия) |
||
|
Тражента® |
Таб., покр. пленочной оболочкой, 5 мг: 14, 28, 30 или 56 шт. рег. №: ЛП-001430 |
BOEHRINGER INGELHEIM INTERNATIONAL (Германия) Произведено: WEST-WARD COLUMBUS (США) DRAGENOPHARM APOTHEKER PUESCHL (Германия) контакты: БЕРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНЕШНЛ ГмбХ (Германия) |
||
|
Трулисити® |
Р-р д/п/к введения 0.75 мг/0.5 мл: шприц-ручки 4 шт. рег. №: ЛП-003682 Р-р д/п/к введения 1.5 мг/0.5 мл: шприц-ручки 4 шт. рег. №: ЛП-003682 |
ELI LILLY VOSTOK (Швейцария) Производство и первичная упаковка: ELI LILLY and Company (США) Вторичная упаковка и выпускающий контроль качества: ELI LILLY and Company (США) ELI LILLY ITALIA (Италия) ФАРМСТАНДАРТ-УфаВИТА (Россия) контакты: ЭЛИ ЛИЛЛИ ВОСТОК С.А. (Швейцария) |
||
|
Форметин ® Лонг |
Таб. с пролонг. высвобождением 1000 мг: 30, 40, 50, 60 или 70 шт. рег. №: ЛП-004110 |
ФАРМСТАНДАРТ-ТОМСКХИМФАРМ (Россия) |
||
|
Форметин ® Лонг |
Таб. с пролонг. высвобождением 500 мг: 30, 40, 50, 60 или 70 шт. рег. №: ЛП-004110 |
ФАРМСТАНДАРТ-ТОМСКХИМФАРМ (Россия) |
||
|
Форметин ® Лонг |
Таб. с пролонг. высвобождением 750 мг: 30, 40, 50, 60 или 70 шт. рег. №: ЛП-004110 |
ФАРМСТАНДАРТ-ТОМСКХИМФАРМ (Россия) |
||
|
Форметин ® Лонг |
Таб. с пролонг. высвобождением 850 мг: 30, 40, 50, 60 или 70 шт. рег. №: ЛП-004110 |
ФАРМСТАНДАРТ-ТОМСКХИМФАРМ (Россия) |
||
|
Форметин® |
Таб. 0.5 г: 60 шт. рег. №: ЛСР-003304/07 |
ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА (Россия) |
||
|
Форметин® |
Таб. 0.85 г: 60 шт. рег. №: ЛСР-003304/07 |
ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА (Россия) |
||
|
Форметин® |
Таб. 0.85 г: 60 шт. рег. №: ЛСР-003304/07 Таб. 0.5 г: 60 шт. рег. №: ЛСР-003304/07 |
ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА (Россия) Произведено: ФАРМСТАНДАРТ-ТОМСКХИМФАРМ (Россия) контакты: ФАРМСТАНДАРТ АО (Россия) |
||
|
Форметин® |
Таб. 1 г: 60 шт. рег. №: ЛСР-003304/07 |
ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА (Россия) Произведено: ФАРМСТАНДАРТ-ТОМСКХИМФАРМ (Россия) |
||
|
Форсига |
Таб., покр. пленочной оболочкой, 5 мг: 30 шт. рег. №: ЛП-002596 Таб., покр. пленочной оболочкой, 10 мг: 30 шт. рег. №: ЛП-002596 |
ASTRAZENECA UK (Великобритания) Произведено: ASTRAZENECA PHARMACEUTICALS LP (США) АСТРАЗЕНЕКА ИНДАСТРИЗ (Россия) Первичная упаковка, вторичная упаковка и выпускающий контроль качества: ASTRAZENECA UK (Великобритания) АСТРАЗЕНЕКА ИНДАСТРИЗ (Россия) контакты: АстраЗенека Фармасьютикалз ООО (Россия) |
||
|
Эводин® |
Таб., покр. пленочной оболочкой, 5 мг: 28 шт. рег. №: ЛП-(000415)-(РГ-RU ) Предыдущий рег. №: ЛП-005584 |
ГЕРОФАРМ (Россия) контакты: ГЕРОФАРМ ООО (Россия) |
||
|
Юглин |
Таб. 30 мг: 30, 60 или 120 шт. рег. №: ЛП-004519 |
ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) |
||
|
Янувия® |
Таб., покр. пленочной оболочкой, 25 мг: 14, 28, 56, 84 или 98 шт. рег. №: ЛСР-003200/07 Таб., покр. пленочной оболочкой, 50 мг: 14, 28, 56, 84 или 98 шт. рег. №: ЛСР-003200/07 Таб., покр. пленочной оболочкой, 100 мг: 14, 28, 56, 84 или 98 шт. рег. №: ЛСР-003200/07 |
MERCK SHARP & DOHME (Нидерланды) Произведено и расфасовано: ORGANON PHARMA (UK) (Великобритания) Химико-фармацевтический комбинат АКРИХИН (Россия) Упаковка и выпускающий контроль качества: ORGANON PHARMA (UK) (Великобритания) MERCK SHARP & DOHME (Нидерланды) Химико-фармацевтический комбинат АКРИХИН (Россия) |
||
|
Яситара |
Таб., покр. пленочной оболочкой, 25 мг: 14, 28, 56, 84 или 98 шт. рег. №: ЛП-(000666)-(РГ-RU ) Предыдущий рег. №: ЛП-004566 Таб., покр. пленочной оболочкой, 50 мг: 14, 28, 56, 84 или 98 шт. рег. №: ЛП-(000666)-(РГ-RU ) Предыдущий рег. №: ЛП-004566 Таб., покр. пленочной оболочкой, 100 мг: 14, 28, 56, 84 или 98 шт. рег. №: ЛП-(000666)-(РГ-RU ) Предыдущий рег. №: ЛП-004566 |
ФАРМАСИНТЕЗ-ТЮМЕНЬ (Россия) |
Классификация аналогов
-
Полные аналоги – препараты, имеющие в составе идентичные активные вещества и схожие формы
выпуска. -
Групповые аналоги (доступны специалистам) – препараты, содержащие активные вещества
со схожим механизмом действия и имеющие схожие формы выпуска. -
Нозологические аналоги (доступны специалистам) – могут быть использованы специалистами
при назначении терапии в отсутствие препаратов «первой линии».
Сигдуо Лонг — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005093
Торговое наименование:
Сигдуо Лонг®
Группировочное наименование:
дапаглифлозин + метформин
Лекарственная форма:
таблетки с модифицированным высвобождением, покрытые плёночной оболочкой
Состав
Одна таблетка с модифицированным высвобождением, покрытая плёночной оболочкой 5 мг + 1000 мг, содержит:
Слой метформина пролонгированного действия
Действующее вещество: метформина гидрохлорид в смеси с 0,5% магния стеарата1 1005,04 мг (1000,00 мг метформина гидрохлорида + 5,04 мг магния стеарата)
Вспомогательные вещества: кармеллоза натрия 49,99 мг, гипромеллоза 2208 234,98 мг, кремния диоксид 13,00 мг, магния стеарат 1,99 мг
Слой дапаглифлозина
Действующее вещество: дапаглифлозина пропандиола моногидрат 6,15 мг (в пересчете на дапаглифлозин 5 мг)
Вспомогательные вещества: целлюлоза микрокристаллическая РН3022 226,35 мг, лактоза 48,00 мг, кросповидон 12,00 мг, кремния диоксид 4,50 мг, магния стеарат3 3,00 мг
Плёночная оболочка: Опадрай® II розовый 85F945924 40,13 мг5.
Одна таблетка с модифицированным высвобождением, покрытая плёночной оболочкой 10 мг + 1000 мг, содержит:
Слой метформина пролонгированного действия
Действующее вещество: метформина гидрохлорид в смеси с 0,5% магния стеарата1 1005,04 мг (1000,00 мг метформина гидрохлорида + 5,04 мг магния стеарата)
Вспомогательные вещества: кармеллоза натрия 49,99 мг, гипромеллоза 2208 234,98 мг, кремния диоксид 13,00 мг, магния стеарат 1,99 мг.
Слой дапаглифлозина
Действующее вещество: дапаглифлозина пропандиола моногидрат 12,30 мг (в пересчете на дапаглифлозин 10 мг)
Вспомогательные вещества: целлюлоза микрокристаллическая РН3022 220,20 мг, лактоза 48,00 мг, кросповидон 12,00 мг, кремния диоксид 4,50 мг, магния стеарат3 3,00 мг
Плёночная оболочка: Опадрай® II жёлтый 85F123726 40,13 мг5.
1 Данная смесь состоит из 99,5% (м/м) метформина гидрохлорида и 0,5% (м/м) магния стеарата.
2 Количество может меняться в зависимости от чистоты дапаглифлозина и используемого актуального количества магния стеарата.
3 Целевое суммарное количество магния стеарата составляет 1,0% (м/м) от слоя дапаглифлозина.
4 Опадрай II розовый 85F94592 содержит (% м/м): спирт поливиниловый частично гидролизованный 40,00% (Е1203), титана диоксид 22,00% (Е171), макрогол 3350 20,20% (Е1521), тальк 14,80% (Е553b), краситель железа оксид красный 3,00% (Е172).
5 Количество оболочечного материала основано на целевом увеличении массы таблетки 2,5% (м/м). Фактическое количество может меняться в диапазоне 2,0-3,2% (м/м) для достижения приемлемого физического внешнего вида.
6 Опадрай® II жёлтый 85F12372 содержит (% м/м): спирт поливиниловый частично гидролизованный 40,00% (Е1203), титана диоксид 21,08% (Е171), макрогол 3350 20,20% (Е1521), тальк 14,80% (Е553b), краситель железа оксид жёлтый 3,92% (Е172).
Описание
Таблетки 5 мг + 1000 мг:
Овальные двояковыпуклые таблетки, покрытые плёночной оболочкой от розового до темно-розового цвета, с гравировкой «1071» и «5/1000» на одной стороне.
Таблетки 10 мг + 1000 мг:
Овальные двояковыпуклые таблетки, покрытые плёночной оболочкой от жёлтого до тёмно-жёлтого цвета, с гравировкой «1073» и «10/1000» на одной стороне.
Фармакотерапевтическая группа:
гипогликемическое средство для перорального применения (ингибитор натрийзависимого переносчика глюкозы 2 типа + бигуанид)
Код ATX:
A10BD15
Фармакологические свойства
Механизм действия
Препарат Сигдуо Лонг® объединяет два гипогликемических препарата с дополняющими механизмами действия для улучшения гликемического контроля у пациентов с сахарным диабетом 2 типа (СД 2): дапаглифлозин, селективный обратимый ингибитор натрийзависимого переносчика глюкозы 2 типа (SGLT2), и метформин, представитель класса бигуанидов.
Дапаглифлозин
SGLT2 экспрессируется в проксимальных почечных канальцах и является основным переносчиком, участвующим в процессе реабсорбции глюкозы. Ингибируя SGLT2, дапаглифлозин уменьшает реабсорбцию глюкозы и снижает почечный порог для глюкозы, что приводит к повышению ее выведения почками.
Метформин
Метформин улучшает толерантность к глюкозе у пациентов с СД 2, снижая концентрацию глюкозы плазмы натощак и постпрандиальную концентрацию глюкозы. Метформин уменьшает продукцию глюкозы печенью, снижает всасывание глюкозы в кишечнике и повышает чувствительность к инсулину, увеличивая периферическое поглощение и утилизацию глюкозы. Метформин не вызывает гипогликемию у пациентов с СД 2 или здоровых людей (кроме особых ситуаций, см. раздел «Особые указания»), и гиперинсулинемию. Во время терапии метформином секреция инсулина не меняется, хотя концентрации инсулина натощак и в ответ на прием пищи в течение дня могут снижаться.
Фармакодинамика
Дапаглифлозин
После приема дапаглифлозина здоровыми добровольцами и пациентами с СД 2 наблюдалось увеличение количества выводимой почками глюкозы. При приеме дапаглифлозина в дозе 5 мг в сутки или 10 мг в сутки в течение 12 недель пациентами с СД 2 в сутки почками выводилось примерно 70 г глюкозы. При приеме дапаглифлозина в дозе 20 мг в сутки выведение глюкозы практически достигало максимума. Выведение глюкозы почками при применении дапаглифлозина также приводит к увеличению объема мочи (см. раздел «Побочное действие»).
Клиническая эффективность
Стартовая комбинированная терапия с метформином пролонгированного действия
Безопасность и эффективность стартовой комбинированной терапии дапаглифлозином и метформином пролонгированного действия изучались в 2 контролируемых исследованиях продолжительностью 24 недели у пациентов с СД 2 и неадекватным контролем гликемии, ранее не получавших гипогликемической терапии.
Применение дапаглифлозина и метформина пролонгированного действия (суточная доза 2 г) обеспечивало значимое снижение концентрации гликозилированного гемоглобина (HbA1c) и концентрации глюкозы в плазме крови натощак (ГПН) по сравнению с монотерапией метформином или дапаглифлозином. Также комбинированная терапия дапаглифлозином и метформином пролонгированного действия обеспечила значимое снижение массы тела по сравнению с монотерапией метформином пролонгированного действия.
Добавление дапаглифлозина к терапии метформином обычного высвобождения
Безопасность и эффективность добавления дапаглифлозина к терапии метформином обычного высвобождения изучались в контролируемом исследовании продолжительностью 24 недели у пациентов с СД 2 и неадекватным контролем гликемии. Добавление дапаглифлозина в дозе 10 мг к терапии метформином приводило к значимому снижению концентрации HbA1c и концентрации ГПН, а также к уменьшению массы тела по сравнению с плацебо на 24 неделе лечения. Также отмечено статистически значимое (р<0,05) по сравнению с группой монотерапии метформином среднее снижение систолического артериального давления (САД) на 4,5 мм рт. ст. и 5,3 мм рт. ст. у пациентов, получавших дапаглифлозин 5 мг и 10 мг, соответственно.
Добавление дапаглифлозина или глипизида к терапии метформином обычного высвобождения
Безопасность и эффективность добавления дапаглифлозина к терапии метформином обычного высвобождения по сравнению с глипизидом изучались в контролируемом исследовании продолжительностью 52 недели у пациентов с СД 2 и неадекватным контролем гликемии.
Дапаглифлозин не менее эффективно, чем глипизид, снижал среднее значение концентрации HbA1c к 52 неделе лечения. В группе дапаглифлозина было отмечено значимое снижение среднего значения массы тела к 52 неделе лечения, в то время как в группе глипизида наблюдалось увеличение этого показателя. В группе дапаглифлозина по сравнению с группой глипизида было достигнуто статистически значимое (р<0,0001) снижение САД на 5,0 мм рт. ст.
Фармакокинетика
Препарат Сигдуо Лонг® биоэквивалентен дапаглифлозину (препарат Форсига) и метформину пролонгированного действия (препарат Глюкофаж® Лонг) при их совместном применении в соответствующих дозах.
Показатели экспозиции дапаглифлозина и метформина пролонгированного действия после приема препарата Сигдуо Лонг® здоровыми добровольцами были сопоставимы после стандартного приема пищи и натощак. В случае приема препарата Сигдуо Лонг® после стандартного приема пищи было отмечено снижение максимальной концентрации (Cmax) дапаглифлозина на 35% и увеличение времени её достижения (Тmax) на 1-2 ч по сравнению с приемом препарата натощак. Это различие не является клинически значимым. Прием пищи не оказывал значимого влияния на фармакокинетические параметры метформина.
Абсорбция
Дапаглифлозин
После приема дапаглифлозина внутрь натощак Сmax обычно достигается в течение 2 часов. Значения Сmax и AUC (площадь под кривой зависимости концентрации от времени) увеличиваются пропорционально дозе дапаглифлозина в диапазоне терапевтических доз. Абсолютная биодоступность дапаглифлозина при приеме внутрь в дозе 10 мг составляет 78%. Прием пищи оказывал умеренное влияние на фармакокинетику дапаглифлозина у здоровых добровольцев. Прием пищи с высоким содержанием жиров снижал Сmax дапаглифлозина на 50%, удлинял Тmax примерно на 1 час, но не влиял на AUC по сравнению с приемом натощак. Эти изменения не являются клинически значимыми, поэтому дапаглифлозин можно принимать независимо от приема пищи.
Метформин
После приема внутрь метформина пролонгированного действия Сmax достигается через 4-8 часов (медиана 7 часов). Степень абсорбции метформина из таблеток пролонгированного действия увеличивается примерно на 50% (оценивалось по изменению AUC) при приеме во время еды. Прием пищи не влиял на Тmax и Сmax.
Распределение
Дапаглифлозин
Дапаглифлозин примерно на 91% связывается с белками. У пациентов с нарушениями функции почек или печени этот показатель не изменялся.
Метформин
Не проводились исследования распределения метформина пролонгированного действия, однако кажущийся объем распределения метформина после однократного приема внутрь таблеток метформина обычного высвобождения в дозе 850 мг, в среднем, составил 654±358 л. Метформин в незначительной степени связывается с белками плазмы крови. Метформин проникает в эритроциты.
Метаболизм
Дапаглифлозин
Метаболизм дапаглифлозина, главным образом, происходит под действием фермента уридиндифосфат-глюкуронилтрансферазы 1А9 (UGT1A9); изоферменты цитохрома CYP вовлечены в метаболизм у человека в меньшей степени. Дапаглифлозин метаболизируется с образованием, главным образом, неактивного метаболита дапаглифлозин-3-О-глюкуронида. После приема внутрь 50 мг 14С-дапаглифлозина 61% принятой дозы метаболизируется в дапаглифлозин-3-О-глюкуронид.
Метформин
Исследования с однократным внутривенным введением препарата здоровым добровольцам показывают, что метформин выводится в неизмененном виде почками, не подвергается метаболизму в печени (у человека не выявлены метаболиты) и не выводится через кишечник. Исследования по изучению метаболизма метформина в таблетках пролонгированного действия не проводились.
Выведение
Дапаглифлозин
Дапаглифлозин и его метаболиты выводятся, преимущественно, почками, и только менее 2% выводится в неизмененном виде. После приема 50 мг 14С-дапаглифлозина было обнаружено 96% радиоактивности – 75% в моче и 21% – в фекалиях. Примерно 15% радиоактивности, обнаруженной в фекалиях, приходилось на неизмененный дапаглифлозин. Т1/2 (период полувыведения из плазмы) после однократного приема дапаглифлозина в дозе 10 мг составляет примерно 12,9 ч.
Метформин
Почечный клиренс примерно в 3,5 раза выше клиренса креатинина (КК), что указывает на то, что канальцевая секреция является основным путем выведения метформина. После приема внутрь примерно 90% абсорбированного препарата выводится почками в течение первых 24 ч, при этом период полувыведения из плазмы равен примерно 6,2 ч. В крови период полувыведения составляет примерно 17,6 ч, следовательно, эритроцитарная масса может быть частью распределения.
Фармакокинетика у особых групп пациентов
Нарушение функции почек
Дапаглифлозин
В равновесном состоянии (прием дапаглифлозина 1 раз в сутки в дозе 20 мг в течение 7 дней) у пациентов с СД 2 и нарушением функции почек легкой, средней или тяжелой степени (определяемой по расчетной скорости клубочковой фильтрации (рСКФ)) геометрическая средняя системной экспозиции была на 45%, в 2,04 и 3,03 раза выше, чем у пациентов с СД 2 и нормальной функцией почек, соответственно. Повышение системной экспозиции дапаглифлозина у пациентов с СД 2 и нарушением функции почек не сопровождалось соответствующим увеличением количества глюкозы, выводимой почками в течение суток.
Суточная экскреция глюкозы почками в равновесном состоянии у пациентов с СД 2 и нарушением функции почек легкой, средней или тяжелой степени была, соответственно, на 42%, 80% и 90% ниже, по сравнению с пациентами с СД 2 и нормальной функцией почек. Неизвестно, оказывает ли гемодиализ влияние на экспозицию дапаглифлозина (см. разделы «Способ применения и дозы» и «Особые указания»).
Метформин
У пациентов с нарушением функции почек (по результатам измерений КК) период полувыведения метформина из плазмы и крови удлиняется, и почечный клиренс снижается.
Нарушение функции печени
Дапаглифлозин
У пациентов с нарушением функции печени легкой или средней степени тяжести (классы А и В по Чайлд-Пью) средние значения Сmax и AUC дапаглифлозина после однократного приема в дозе 10 мг были, соответственно, на 12% и 36% выше по сравнению с аналогичными показателями у здоровых добровольцев. Данные различия не являются клинически значимыми. У пациентов с нарушением функции печени тяжелой степени (класс С по Чайлд-Пью) средние значения Сmax и AUC дапаглифлозина были на 40% и 67% выше, соответственно, по сравнению со здоровыми добровольцами.
Метформин
Фармакокинетические исследования метформина у пациентов с нарушением функции печени не проводились.
Пожилой возраст
Дапаглифлозин
По результатам популяционного фармакокинетического анализа, возраст не оказывает клинически значимого влияния на системную экспозицию дапаглифлозина. поэтому коррекция дозы в зависимости от возраста пациента не требуется.
Метформин
Ограниченные данные контролируемых исследований фармакокинетики метформина у здоровых добровольцев пожилого возраста позволяют предположить, что общий плазменный клиренс метформина понижается, период полувыведения увеличивается, а Сmax повышается по сравнению со значениями этих параметров у здоровых добровольцев молодого возраста. По этим данным, изменение параметров фармакокинетики метформина с увеличением возраста, в основном, обусловлено изменением функции почек.
Дети
Не проводились исследования фармакокинетики препарата Сигдуо Лонг® у детей (см. раздел «Противопоказания»).
Пол
Дапаглифлозин
По результатам популяционного фармакокинетического анализа, пол не оказывает клинически значимого влияния на системную экспозицию дапаглифлозина, поэтому коррекция дозы в зависимости от пола пациента не рекомендуется.
Метформин
Фармакокинетические параметры метформина у здоровых добровольцев и пациентов с СД 2 существенно не различались в зависимости от пола. В контролируемых клинических исследованиях у пациентов с СД 2 гипогликемический эффект метформина у мужчин и женщин был сопоставим.
Расовая и этническая принадлежность
Дапаглифлозин
По результатам популяционного фармакокинетического анализа, клинически значимых различий системной экспозиции у представителей европеоидной, негроидной и монголоидной рас не выявлено; коррекция дозы с учетом расовой принадлежности не требуется.
Метформин
Не проводились исследования параметров фармакокинетики метформина в зависимости от расовой принадлежности пациента. В клинических исследованиях у пациентов с СД 2 гипогликемический эффект метформина у представителей европеоидной, негроидной рас и пациентов испанского происхождения был сопоставим.
Масса тела
Дапаглифлозин
По результатам популяционного фармакокинетического анализа, масса тела не оказывает клинически значимого влияния на системную экспозицию дапаглифлозина, поэтому коррекция дозы в зависимости от массы тела пациента не требуется.
Показания к применению
Сахарный диабет 2 типа в дополнение к диете и физическим упражнениям для улучшения гликемического контроля у взрослых пациентов, для которых целесообразна комбинированная терапия дапаглифлозином и метформином.
Противопоказания
- Повышенная индивидуальная чувствительность к любому компоненту препарата.
- Сахарный диабет 1 типа.
- Нарушение функции почек от средней до тяжелой степени тяжести (рСКФ<60 мл/мин/1,73 м²), терминальная стадия почечной недостаточности или пациенты, получающие гемодиализ.
- Наследственная непереносимость лактозы, недостаточность лактазы и глюкозо-галактозная непереносимость.
- Беременность и период грудного вскармливания.
- Детский возраст до 18 лет (безопасность и эффективность не изучены).
- Пациенты, принимающие «петлевые» диуретики (см. раздел «Взаимодействие с другими лекарственными средствами»), или со сниженным объемом циркулирующей крови (ОЦК), например, вследствие острых заболеваний (таких как желудочно-кишечные заболевания).
- Пожилые пациенты в возрасте 75 лет и старше (для начала терапии дапаглифлозином).
- Нарушение функции печени.
- Острые заболевания, при которых имеется риск развития нарушения функции почек: дегидратация (при рвоте, диарее), лихорадка, тяжелые инфекционные заболевания, состояния гипоксии (шок, сепсис, инфекции почек, бронхолегочные заболевания).
- Острый или хронический метаболический ацидоз, включая диабетический кетоацидоз, с комой или без комы. В случае диабетического кетоацидоза следует применять препараты инсулина.
- Клинически выраженные проявления острых и хронических заболеваний, которые могут привести к развитию тканевой гипоксии (дыхательная недостаточность, сердечная недостаточность, острый инфаркт миокарда).
- Серьезные хирургические операции и травмы (когда показано проведение инсулинотерапии).
- Хронический алкоголизм и острое отравление этанолом.
- Лактоацидоз (в т.ч. в анамнезе).
- Период не менее 48 ч до и в течение 48 ч после проведения радиоизотопных или рентгенологических исследований с введением йодсодержащих контрастных средств.
- Соблюдение гипокалорийной диеты (<1000 ккал/сут).
С осторожностью:
инфекции мочевыводящих путей; риск снижения ОЦК; пожилые пациенты; повышенное значение гематокрита; пациенты в возрасте старше 60 лет, выполняющие тяжелую физическую работу.
Применение при беременности и в период грудного вскармливания
Применение препарата Сигдуо Лонг®, а также его действующих веществ, дапаглифлозина и метформина, в период беременности не изучено, поэтому препарат противопоказан во время беременности. В случае диагностирования беременности терапия препаратом Сигдуо Лонг® должна быть прекращена.
Неизвестно, проникает ли дапаглифлозин, метформин и/или их метаболиты в грудное молоко человека. Нельзя исключить риск для новорожденных/младенцев. Препарат Сигдуо Лонг® противопоказан в период грудного вскармливания.
Способ применения и дозы
Внутрь, один раз в сутки во время завтрака. Таблетки следует проглатывать целиком, не разжевывая, не измельчая и не разламывая.
Дозу следует подбирать индивидуально, учитывая эффективность и переносимость проводимой терапии. При необходимости дозу повышают постепенно, чтобы уменьшить риск побочных эффектов метформина со стороны желудочно-кишечного тракта. Максимальная суточная доза дапаглифлозина составляет 10 мг, метформина пролонгированного действия – 2 г.
Если препарат Сигдуо Лонг® был назначен пациенту, принимающему метформин пролонгированного действия в вечернее время, следует пропустить прием последней вечерней дозы метформина пролонгированного действия накануне приема первой дозы препарата Сигдуо Лонг®.
Пациентам со сниженным ОЦК необходима коррекция этого состояния до начала терапии препаратом Сигдуо Лонг®.
Неактивные ингредиенты препарата Сигдуо Лонг® могут выводиться через кишечник в виде мягкой, влажной массы, которая может сохранять форму принятой таблетки.
Применение у особых групп пациентов
Нарушение функции печени
У пациентов с нарушением функции печени применение метформина может приводить к лактоацидозу. Поэтому препарат Сигдуо Лонг® противопоказан пациентам с нарушением функции печени.
Нарушение функции почек
До начала терапии препаратом Сигдуо Лонг® и периодически на фоне терапии следует оценивать функцию почек. Препарат Сигдуо Лонг® противопоказан пациентам с нарушением функции почек от средней до тяжелой степени (рСКФ<60 мл/мин/1,73 м²), с терминальной стадией почечной недостаточности и пациентам, получающим гемодиализ (см. разделы «Противопоказания», «Побочное действие» и «Особые указания»).
При нарушении функции почек легкой степени (рСКФ≥60 мл/мин/1,73 м²) нет необходимости корректировать дозу препарата.
Дети
Безопасность и эффективность дапаглифлозина у пациентов младше 18 лет не изучались (см. раздел «Противопоказания»).
Пожилой возраст
У пациентов пожилого возраста нет необходимости корректировать дозу препарата. Однако при выборе дозы следует учитывать, что у этой категории пациентов более вероятны нарушение функции почек и риск снижения ОЦК. Рекомендуется более частый контроль состояния функции почек у пациентов пожилого возраста. Поскольку клинический опыт применения дапаглифлозина у пациентов 75 лет и старше ограничен, противопоказано начинать терапию дапаглифлозином в данной возрастной группе.
Побочное действие
Дапаглифлозин и метформин
Оценка безопасности проводилась на основании объединенных данных 8 краткосрочных плацебо-контролируемых исследований, в которых дапаглифлозин применялся в комбинации с метформином (в данной комбинации и в дополнение к другой гипогликемической терапии). В этих исследованиях 983 пациента получали дапаглифлозин в дозе 10 мг один раз в сутки и метформин, и 1185 пациентов получали плацебо и метформин.
Общая частота нежелательных явлений в группе дапаглифлозина в дозе 10 мг и метформина составила 60,3% по сравнению с 58,2% в группе плацебо и метформина. У 4% пациентов в группе дапаглифлозина 10 мг и метформина терапия была отменена из-за нежелательных реакций по сравнению с 3,3% в группе плацебо и метформина. Наиболее частыми нежелательными явлениями, приводившими к отмене терапии и отмеченными, как минимум, у 3 пациентов в группе дапаглифлозина 10 мг и метформина, были нарушение функции почек (0,7%), повышение концентрации креатинина в сыворотке крови (0,2%), уменьшение КК (0,2%) и инфекции мочевыводящих путей (0,2%).
В Таблице 1 приведены нежелательные реакции по данным 8 краткосрочных плацебо-контролируемых исследований, вне зависимости от оценки исследователем причинно-следственной связи, которые были отмечены, как минимум, у 2% пациентов, принимавших дапаглифлозин и метформин, и, как минимум, на 1% чаще по сравнению с пациентами, получавшими метформин и плацебо.
Таблица 1. Нежелательные реакции в плацебо-контролируемых исследованиях1 (вне зависимости от оценки исследователем причинно-следственной связи), отмеченные с частотой ≥2% у пациентов, получавших дапаглифлозин и метформин, и, как минимум, на 1% чаще по сравнению с пациентами, получавшими метформин и плацебо (за исключением гипогликемии)2
| Системно-органный класс | Термин предпочтительного употребления | Дапаглифлозин 10 мг и метформин N=983 |
| Инфекции и инвазии | Генитальные инфекции3 | Часто |
| Инфекции и инвазии | Инфекции мочевыводящих путей4 | Часто |
| Нарушения со стороны почек и мочевыводящих путей | Полиурия5 | Часто |
1 8 плацебо-контролируемых исследований включали 2 исследования стартовой комбинированной терапии с метформином, 2 исследования добавления к терапии метформином, 1 исследование добавления к терапии инсулином, 1 исследование добавления к терапии ситаглиптином и 2 исследования добавления к комбинированной гипогликемической терапии. Приведенные данные относятся к краткосрочной терапии (до 24 недель) независимо от назначения дополнительных гипогликемических средств.
2 См. подраздел «Гипогликемия».
3 Включает следующие предпочтительные термины(перечислены в порядке убывания частоты): вульвовагинальная грибковая инфекция, баланит, вагинальная инфекция, генитальная грибковая инфекция, генитальная инфекция, вульвовагинальный кандидоз, кандидозный баланит, вульвовагинит, генитальный кандидоз, вульвит, баланопостит, генитальная инфекция у мужчин, инфекция мочеполового тракта, абсцесс пениса, инфекция пениса, постит, абсцесс вульвы и бактериальный вагинит.
4 Включает следующие предпочтительные термины (перечислены в порядке убывания частоты): инфекция мочевыводящих путей, цистит, инфекция мочевыводящих путей, вызванная бактериями рода Escherichia, инфекция мочеполового тракта, пиелонефрит, тригонит, уретрит, инфекция почек и простатит.
5 Включает следующие предпочтительные термины (перечислены в порядке убывания частоты): Поллакиурия, полиурия и увеличение объема выделяемой мочи.
Метформин
В плацебо-контролируемых исследованиях метформина пролонгированного действия в качестве монотерапии диарея и тошнота/рвота отмечались более чем у 5% пациентов и чаще, чем в группе плацебо (диарея у 9,6% и 2,6% пациентов, тошнота/рвота у 6,5% и 1,5% пациентов, соответственно). У 0,6% пациентов, получавших метформин пролонгированного действия, диарея привела к прекращению терапии.
Объединенные данные 12 плацебо-контролируемых исследований дапаглифлозина 5 мг и 10 мг
Дапаглифлозин
В 4 исследованиях дапаглифлозин применялся в качестве монотерапии, а в 8 исследованиях – в качестве дополнения к базовой сахароснижающей терапии или в комбинации с метформином. В этих исследованиях 2338 пациентов получали дапаглифлозин, в среднем, в течение 21 недели. 1393 пациента получали плацебо, 1145 пациентов – дапаглифлозин 5 мг, 1193 пациента – дапаглифлозин 10 мг один раз в сутки.
Объединенные данные 13 плацебо-контролируемых исследований дапаглифлозина 10 мг
Оценка безопасности и переносимости дапаглифлозина 10 мг проводилась на основании объединенных данных 13 плацебо-контролируемых исследований: в 3 исследованиях дапаглифлозин изучался в режиме монотерапии, в 9 исследованиях – в качестве дополнительной терапии к проводимой сахароснижающей терапии, и в 1 исследовании в стартовой комбинации с метформином. В этих исследованиях 2360 пациентов получали дапаглифлозин в дозе 10 мг, в среднем, в течение 22 недель.
Описание отдельных нежелательных реакций
Снижение ОЦК
Дапаглифлозин вызывает осмотический диурез, который может приводить к снижению ОЦК. Нежелательные реакции, связанные со снижением ОЦК (включая сообщения об обезвоживании, гиповолемии, ортостатической гипотензии и артериальной гипотензии), приведены в Таблице 2 (объединенные данные 12 и 13 краткосрочных плацебо-контролируемых исследований дапаглифлозина) (см. раздел «Особые указания»).
Таблица 2. Нежелательные реакции, связанные со снижением ОЦК1, в клинических исследованиях дапаглифлозина
| Объединенные данные 12 плацебо-контролируемых исследований | Объединенные данные 13 плацебо-контролируемых исследований | ||||
| Плацебо | Дапаглифлозин 5 мг |
Дапаглифлозин 10 мг |
Плацебо | Дапаглифлозин 10 мг |
|
| Общее количество пациентов N (%) | N=1393 5 (0,4%) |
N=1145 7 (0,6%) |
N=1193 9 (0,8%) |
N=2295 17 (0,7%) |
N=2360 27 (1,1%) |
| Подгруппы пациентов n (%) | |||||
| Пациенты, принимающие «петлевые» диуретики | n=55 1 (1,8%) |
n=40 0 |
n=31 3 (9,7%) |
n=267 4 (1,5%) |
n=236 6 (2,5%) |
| Пациенты с нарушением функции почек средней тяжести (60>рСКФ≥30 мл/мин/1,73 м²) | n=107 2 (1,9%) |
n=107 1 (0,9%) |
n=89 1 (1,1%) |
n=268 4 (1,5%) |
n=265 5 (1,9%) |
| Пациенты ≥65 лет | n=276 1 (0,4%) |
n=216 1 (0,5%) |
n=204 3 (1,5%) |
n=711 6 (0,8%) |
n=665 11 (1,7%) |
1 Снижение ОЦК включало следующие нежелательные реакции: дегидратация, гиповолемия, ортостатическая гипотензия и артериальная гипотензия.
Нарушение функции почек
На фоне применения дапаглифлозина отмечалось повышение концентрации креатинина в сыворотке крови и снижение рСКФ. У пациентов с нормальной функцией почек или нарушением функции почек легкой степени при включении в исследование концентрация креатинина и рСКФ возвращались к исходному значению на 24 неделе.
Нежелательные реакции, связанные с нарушением функции почек, включая почечную недостаточность и повышение концентрации креатинина в сыворотке, чаще отмечались у пациентов, принимавших дапаглифлозин (см. Таблицу 3). Эти нежелательные реакции чаще отмечались у пациентов пожилого возраста и у пациентов с нарушением функции почек (см. Таблицу 3). Стойкое снижение рСКФ наблюдалось у пациентов с нарушением функции почек средней степени тяжести (60>СКФ≥30 мл/мин/1,73 м²).
Таблица 3. Доля пациентов, как минимум, с одной нежелательной реакцией, связанной с нарушением функции почек
| Объединенные данные 6 плацебо-контролируемых исследований (до 104 недель)1 | Объединенные данные 9 плацебо-контролируемых исследований (до 104 недель)2 | ||||
| Исходные характеристики | Плацебо | Дапаглифлозин 5 мг |
Дапаглифлозин 10 мг |
Плацебо | Дапаглифлозин 10 мг |
| Общая популяция Пациенты (%), как минимум, с одной нежелательной реакцией |
n=785 13 (1,7%) |
n=767 14 (1,8%) |
n=859 16 (1,9%) |
n=1956 82 (4,2%) |
n=2026 136 (6,7%) |
| Пациенты ≥65 лет Пациенты (%), как минимум, с одной нежелательной реакцией |
n=190 4 (2,1%) |
n=162 5 (3,1%) |
n=159 6 (3,8%) |
n=655 52 (7,9%) |
n=620 87 (14,0%) |
| Пациенты с 60>рСКФ≥30 мл/мин/1,73 м² Пациенты (%), как минимум, с одной нежелательной реакцией |
n=77 5 (6,5%) |
n=88 7 (8,0%) |
n=75 9 (12,0%) |
n=249 40 (16,1%) |
n=251 71 (28,3%) |
| Пациенты ≥65 лет с 60>рСКФ≥30 мл/мин/1,73 м² Пациенты (%), как минимум, с одной нежелательной реакцией |
n=41 2 (4,9%) |
n=43 3 (7,0%) |
n=35 4 (11,4%) |
n=141 27 (19,1%) |
n=134 47 (35,1%) |
1 Пациенты из 12 плацебо-контролируемых исследований с продленным периодом.
2 Пациенты из 13 плацебо-контролируемых исследований с продленным периодом.
В исследовании с участием пациентов с нарушением функции почек средней степени тяжести (60>рСКФ≥30 мл/мин/1,73 м²) продолжительностью до 104 недель у 13 пациентов были отмечены переломы костей (5 случаев в группе дапаглифлозина 5 мг; 8 случаев в группе дапаглифлозина 10 мг; в группе плацебо переломов не зарегистрировано). В 11 из 13 случаев переломы произошли в первые 52 недели лечения, в 8 из 13 случаев – у пациентов с исходным значением рСКФ от 30 до 45 мл/мин/1,73 м². Закономерности в отношении локализации переломов отмечено не было.
Гипогликемия
В плацебо-контролируемых исследованиях добавления дапаглифлозина к терапии метформином продолжительностью 24 недели тяжелых эпизодов гипогликемии отмечено не было; легкие эпизоды гипогликемии отмечены у 1,5% пациентов в группе дапаглифлозина 5 мг, 0,7% пациентов в группе дапаглифлозина 10 мг, в группе плацебо эпизодов гипогликемии не было.
В исследовании добавления дапаглифлозина к терапии метформином по сравнению с глипизидом продолжительностью 52 недели в группе дапаглифлозина не было отмечено тяжелых эпизодов гипогликемии, в группе глипизида такие эпизоды были отмечены у 0,7% пациентов: легкие эпизоды гипогликемии отмечены у 1,7% пациентов в группе дапаглифлозина 10 мг и у 36% пациентов в группе глипизида.
Грибковые генитальные инфекции
Грибковые генитальные инфекции чаще отмечались в группе дапаглифлозина. Грибковые генитальные инфекции были отмечены у 0,9%, 5,7% и 4,8% пациентов, принимавших плацебо, дапаглифлозин 5 мг и дапаглифлозин 10 мг, соответственно (объединенные данные 12 плацебо-контролируемых исследований дапаглифлозина 5 мг и 10 мг). У 0,2% пациентов в группе дапаглифлозина 10 мг из-за генитальной инфекции препарат был отменен (в группе плацебо случаев отмены терапии из-за аналогичной нежелательной реакции не было). Грибковые генитальные инфекции чаще отмечались у женщин, а также у пациентов, у которых до начала приема препарата отмечались эпизоды аналогичной инфекции (10,0%, 23,1% и 25,0% по сравнению с 0,8%, 5,9% и 5,0% в группах плацебо, дапаглифлозина 5 мг, дапаглифлозина 10 мг, соответственно). Наиболее частыми у женщин были вульвовагинальные грибковые инфекции, а у мужчин – баланит.
Реакции гиперчувствительности
На фоне приема дапаглифлозина сообщалось о реакциях гиперчувствительности (таких как ангионевротический отек, крапивница, гиперчувствительность). В рамках программы клинических исследований серьезные анафилактические реакции, тяжелые кожные реакции и ангионевротический отек отмечены у 0,3% пациентов, получавших дапаглифлозин, и у 0,2% пациентов в группе сравнения. При возникновении реакций гиперчувствительности следует отменить дапаглифлозин, проводить лечение в соответствии с принятой практикой и наблюдение за пациентом до полного разрешения симптомов.
Результаты лабораторных исследований
Увеличение гематокрита
Дапаглифлозин
Увеличение гематокрита у пациентов, получавших дапаглифлозин, отмечалось с 1 по 16 недели лечения (объединенные данные 13 плацебо-контролируемых исследований дапаглифлозина 10 мг). Максимальное увеличение гематокрита, по сравнению с исходными значениями, наблюдалось на 16 неделе. На 24 неделе среднее изменение гематокрита по сравнению с исходным значением составило -0,33% в группе плацебо и 2,3% в группе дапаглифлозина 10 мг. К 24 неделе повышенное значение гематокрита >55% было зарегистрировано у 0,4% пациентов в группе плацебо и 1,3% пациентов в группе дапаглифлозина 10 мг.
Повышение концентрации неорганического фосфора в сыворотке крови
Дапаглифлозин
Повышение концентрации неорганического фосфора в сыворотке крови по сравнению с исходной отмечалось на 24 неделе у пациентов, получавших дапаглифлозин 10 мг, по сравнению с группой плацебо (среднее повышение составило 0,13 мг/дл и -0,04 мг/дл, соответственно) (объединенные данные 13 плацебо-контролируемых исследований дапаглифлозина 10 мг). Гиперфосфатемия (концентрация неорганического фосфора в сыворотке ≥5,6 мг/дл для пациентов 17-65 лет и ≥5,1 мг/дл для пациентов в возрасте ≥66 лет) также чаще отмечалась в группе дапаглифлозина 10 мг по сравнению с группой плацебо на 24 неделе (1,7% и 0,9% пациентов, соответственно).
Повышение концентрации холестерина липопротеидов низкой плотности (ХС ЛПНП)
Дапаглифлозин
Изменение концентрации липидов в сыворотке крови отмечено у пациентов, получавших дапаглифлозин, по сравнению с группой плацебо (объединенные данные 13 плацебо-контролируемых исследований дапаглифлозина 10 мг). Среднее процентное увеличение концентрации общего холестерина в сыворотке крови на 24 неделе составило 2,5% и 0,0% в группе дапаглифозина 10 мг и плацебо, соответственно, а ХС ЛПНП 2,9% в группе дапаглифлозина 10 мг по сравнению с -1,0% в группе плацебо.
Концентрация витамина В12
Метформин
На фоне приема метформина может снизиться концентрация витамина В12 в сыворотке. Пациентам, получающим препарат Сигдуо Лонг®, следует ежегодно оценивать гематологические параметры, и при выявлении изменений проводить соответствующее обследование и лечение (см. раздел «Особые указания»).
Опыт пострегистрационного применения
Дапаглифлозин
При пострегистрационном применении были отмечены следующие нежелательные реакции:
Неуточненной частоты: сыпь.
Достоверно оценить причинно-следственную связь и частоту нежелательных реакций не представляется возможным, поскольку сведения были получены в виде спонтанных сообщений, а размер популяции пациентов точно не был определен.
Передозировка
Дапаглифлозин
В рамках программы клинических исследований дапаглифлозина случаев передозировки отмечено не было. В случае передозировки необходимо проводить поддерживающую терапию, учитывая состояние пациента. Выведение дапаглифлозина с помощью гемодиализа не изучалось.
Метформин
Зарегистрированы случаи передозировки метформина, в том числе, при приеме более 50 г. Примерно в 10% случаев развивалась гипогликемия, но ее причинная связь с приемом метформина не установлена. Примерно в 32% случаев передозировки метформина у пациентов наблюдался лактоацидоз. Метформин выводится при диализе, при этом клиренс достигает 170 мл/мин. Поэтому при предполагаемой передозировке препарата, содержащего метформин, целесообразен гемодиализ.
Взаимодействие с другими лекарственными средствами
Фармакокинетические исследования взаимодействий препарата Сигдуо Лонг® не проводились, однако такие исследования были проведены для дапаглифлозина и метформина, входящих в состав препарата Сигдуо Лонг®.
Дапаглифлозин
В ходе исследований in vitro дапаглифлозин и дапаглифлозин-3-О-глюкуронид не ингибировали изоферменты системы цитохрома Р450 CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4 и не индуцировали изоферменты CYP1A2, CYP2B6 или CYP3A4. Дапаглифлозин является слабым субстратом гликопротеина Р (P-gp), а дапаглифлозин-3-О-глюкуронид – субстратом активного транспортера ОАТЗ. Дапаглифлозин и дапаглифлозин-3-О-глюкуронид значимо не ингибируют активные транспортеры P-gp, ОСТ2, ОАТ1 и ОАТ3. В целом, не ожидается влияния дапаглифлозина на фармакокинетику препаратов, которые являются субстратами P-gp, ОСТ2, ОАТ1 и ОАТ3, при их одновременном применении.
Влияние других лекарственных препаратов на дапаглифлозин
Исследования взаимодействий, в основном, с приемом однократной дозы препарата, показали, что метформин, пиоглитазон, ситаглиптин, глимепирид, воглибоза, гидрохлоротиазид, буметанид, валсартан или симвастатин не оказывают влияния на фармакокинетику дапаглифлозина.
После совместного применения дапаглифлозина и рифампицина, индуктора различных активных транспортеров и ферментов, участвующих в метаболизме лекарственных препаратов, отмечено снижение системной экспозиции (AUC) дапаглифлозина на 22% без клинически значимого влияния на количество глюкозы, выводимой почками в течение суток. Не рекомендуется корректировать дозу препарата.
После совместного применения дапаглифлозина и мефенамовой кислоты (ингибитора UGT1A9) отмечено увеличение на 51% системной экспозиции дапаглифлозина без клинически значимого влияния на количество глюкозы, выводимой почками в течение суток. Не рекомендуется корректировать дозу препарата.
Влияние дапаглифлозина на другие лекарственные препараты
В исследованиях взаимодействий с участием здоровых добровольцев, в основном, однократно принимавших дозу препарата, дапаглифлозин не влиял на фармакокинетические параметры метформина, пиоглитазона, ситаглиптина, глимепирида, гидрохлоротиазида, буметанида, валсартана, симвастатина, дигоксина или варфарина. Применение однократной дозы дапаглифлозина 20 мг и симвастатина приводило к повышению на 19% AUC симвастатина. Повышение экспозиции симвастатина и симвастатиновой кислоты не считается клинически значимым.
Метформин
Влияние других лекарственных препаратов на метформин
Исследования взаимодействий с приемом однократной дозы препаратов показали, что глибенкламид, фуросемид, нифедипин, пропранолол, ибупрофен не оказывают влияния на фармакокинетику метформина.
Ингибиторы карбоангидразы: топирамат и другие ингибиторы карбоангидразы (такие как зонисамид, ацетазоламид или диклофенамид) часто вызывают снижение концентрации бикарбонатов в сыворотке крови и неанионный интервал, гиперхлоремический метаболический ацидоз. Совместное применение этих препаратов с препаратом Сигдуо Лонг® может повышать риск лактоацидоза. Такие пациенты нуждаются в более частом контроле.
Препараты, замедляющие выведение метформина: сопутствующее применение препаратов, которые влияют на транспортные системы почечных канальцев, участвующие в выведении метформина почками (ингибиторы ОСТ2 и МАТЕ, такие как ранолазин, вандетаниб, долутегравир и циметидин), может увеличивать системную экспозицию метформина и риск лактоацидоза. Необходимо оценить ожидаемую пользу и возможный риск совместного применения этих препаратов.
Влияние метформина на другие лекарственные препараты
Исследования взаимодействий с приемом однократной дозы препаратов показали, что метформин не оказывает влияния на фармакокинетику глибенкламида, фуросемида, нифедипина, пропранолола, ибупрофена и циметидина.
Лекарственные препараты, способные вызвать гипергликемию
Прием некоторых лекарственных препаратов, таких как диуретики (в том числе, тиазидные), кортикостероиды, фенотиазины, гормоны щитовидной железы, эстрогены, оральные контрацептивы, фенитоин, никотиновая кислота, симпатомиметики, блокаторы кальциевых каналов и изониазид, может предрасполагать к развитию гипергликемии и ухудшению гликемического контроля. При совместном применении данных препаратов с препаратом Сигдуо Лонг® необходим тщательный контроль гликемии, а при их отмене – наблюдение за пациентом из-за возможности развития гипогликемии.
В исследованиях взаимодействия с участием здоровых добровольцев при однократном приеме препаратов не отмечалось взаимодействия метформина и пропранолола, метформина и ибупрофена.
Применение препаратов, которые могут вызвать гипогликемию
Метформин
Гипогликемия не развивается у пациентов, принимающих только метформин в обычном режиме, но может развиться при гипокалорийной диете, или если активная физическая нагрузка не компенсируется калорийностью рациона, или при совместном применении с другими гипогликемическими препаратами (такими как производные сульфонилмочевины и инсулин) или алкоголем. Пожилые, ослабленные или плохо питающиеся пациенты и пациенты с недостаточностью функции надпочечников или гипофиза или алкогольной интоксикацией наиболее чувствительны к гипогликемическим эффектам. У пожилых людей и пациентов, принимающих бета-адреноблокаторы, диагностика гипогликемии может быть затруднена.
Оценка теста на 1,5-ангидроглюцитол
Дапаглифлозин
У пациентов, получающих ингибиторы SGLT2, не рекомендуется использовать тест определения 1,5-ангидроглюцитола для контроля гликемии. Следует использовать альтернативные методы контроля.
Оценки результатов анализа мочи
Дапаглифлозин
Ингибиторы SGLT2 увеличивают выведение глюкозы почками. Поэтому результаты определения глюкозы в моче у пациентов, принимающих препарат Сигдуо Лонг®, будут положительными. Следует использовать альтернативные методы контроля.
Алкоголь
Алкоголь усиливает влияние метформина на метаболизм лактата. Пациентов следует информировать о недопустимости приема больших доз алкоголя на фоне терапии препаратом Сигдуо Лонг®.
Особые указания
Лактоацидоз
При пострегистрационном применении метформина были отмечены случаи лактоацидоза, в том числе, с летальным исходом. В этих случаях лактоацидоз имел скрытое начало и сопровождался неспецифическими симптомами, такими как недомогание, миалгия, боль в животе, дыхательная недостаточность и повышенная сонливость. При тяжелом ацидозе отмечались гипотермия, артериальная гипотензия и резистентные брадиаритмии. При лактоацидозе, связанном с приемом метформина, были отмечены повышенная концентрация лактата в крови (более 5 ммоль/л), ацидоз с анионным интервалом (без наличия кетонурии и кетонемии) и увеличение соотношения лактат/пируват; концентрация метформина в плазме крови обычно превышала 5 мкг/мл. Метформин уменьшает утилизацию лактата в печени, концентрация лактата в крови при этом увеличивается, что способствует развитию лактоацидоза, особенно у пациентов с факторами риска.
При подозрении на лактоацидоз у пациента, принимающего метформин, следует безотлагательно начать проведение общих поддерживающих мероприятий в условиях стационара и немедленно прекратить прием препарата Сигдуо Лонг®.
При вероятном или подтвержденном лактоацидозе на фоне приема препарата Сигдуо Лонг® рекомендуется немедленно начать гемодиализ для коррекции ацидоза и выведения кумулированного метформина (метформин выводится при гемодиализе, клиренс составляет до 170 мл/мин в условиях хорошей гемодинамики). Гемодиализ часто приводил к разрешению симптоматики и выздоровлению.
Следует информировать пациентов и членов их семей о симптомах лактоацидоза, а также о необходимости прекратить терапию препаратом Сигдуо Лонг® и обратиться к врачу при появлении этих симптомов.
Далее по тексту приведены рекомендации по снижению риска и коррекции лактоацидоза в случае наличия известных факторов риска.
Нарушение функции почек
Лактоацидоз, связанный с приемом метформина при пострегистрационном применении, чаще всего возникал у пациентов со значительным нарушением функции почек. Метформин, в основном, выводится почками, поэтому с увеличением степени тяжести нарушения функции почек повышается риск кумуляции метформина и развития лактоацидоза. Рекомендации по оценке функции почек (см. разделы «Фармакокинетика» и «Способ применения и дозы»):
- До начала терапии препаратом Сигдуо Лонг® следует определить рСКФ.
- Препарат Сигдуо Лонг® противопоказан пациентам с рСКФ<60мл/мин/1,73 м² (см. раздел «Противопоказания»).
- У всех пациентов, принимающих препарат Сигдуо Лонг®, следует оценивать рСКФ, как минимум, ежегодно. У пациентов из группы риска нарушения функции почек (например, у пациентов пожилого возраста) функцию почек необходимо контролировать чаще.
Взаимодействия с другими лекарственными препаратами
Совместное применение препарата Сигдуо Лонг® с препаратами, которые могут влиять на функцию почек, может привести к значительным гемодинамическим изменениям, вызвать изменения кислотно-щелочного баланса или способствовать кумуляции метформина (например, катионные препараты) (см. раздел «Взаимодействие с другими лекарственными средствами»). Поэтому следует более часто контролировать состояние таких пациентов.
Пациенты в возрасте 65 лет и старше
Риск лактоацидоза, связанного с приемом метформина, увеличивается с возрастом, поскольку риск нарушения функции печени, почек или сердечной недостаточности у пожилых пациентов выше по сравнению с пациентами более молодого возраста. У пожилых пациентов функцию почек необходимо контролировать чаще (см. раздел «Способ применения и дозы»).
Радиологические исследования с введением контрастных веществ
При проведении радиологических исследований с внутрисосудистым введением йодсодержащих контрастных веществ были выявлены случаи острого нарушения функции почек и развития лактоацидоза у пациентов, получающих метформин. Необходимо за 48 ч до выполнения такой процедуры приостановить терапию препаратом Сигдуо Лонг®, определить рСКФ через 48 ч после процедуры и возобновить прием препарата только после подтверждения стабильной функции почек.
Хирургические вмешательства и другие процедуры
Ограничение приема пищи и жидкости во время хирургических или других процедур может повысить риск снижения ОЦК, артериальной гипотензии и нарушения функции почек. Следует приостановить прием препарата Сигдуо Лонг® при ограничении приема пищи и жидкости.
Гипоксия
Несколько случаев лактоацидоза, связанного с пострегистрационным применением метформина, развилось на фоне острой сердечной недостаточности (особенно в сочетании с гипоперфузией и гипоксемией). Сосудистый коллапс (шок), острый инфаркт миокарда, сепсис и другие состояния, характеризующиеся гипоксемией, связаны с лактоацидозом и могут также вызывать преренальную азотемию. При возникновении таких состояний следует прекратить прием препарата Сигдуо Лонг®.
Чрезмерное употребление алкоголя
Алкоголь усиливает влияние метформина на метаболизм лактата и может способствовать развитию лактоацидоза. Пациентов следует информировать о недопустимости приема больших доз алкоголя на фоне терапии препаратом Сигдуо Лонг®.
Нарушение функции печени
Применение метформина пациентами с нарушением функции печени в некоторых случаях приводило к лактоацидозу, вероятно, из-за нарушения утилизации лактата в печени и повышению его концентрации в крови. Поэтому препарат Сигдуо Лонг® противопоказан пациентам с нарушением функции печени.
Артериальная гипотензия
Дапаглифлозин способствует снижению ОЦК. После начала терапии дапаглифлозином может возникать артериальная гипотензия с клиническими проявлениями, особенно у пациентов с нарушением функции почек (рСКФ менее 60 мл/мин/1,73 м²), пациентов пожилого возраста и пациентов, принимающих «петлевые» диуретики. Перед назначением препарата Сигдуо Лонг® таким пациентам следует провести оценку и коррекцию ОЦК, а после начала терапии – проводить наблюдение для выявления симптомов артериальной гипотензии.
Кетоацидоз
При появлении у пациента, получающего препарат Сигдуо Лонг®, признаков и симптомов тяжелого метаболического ацидоза, необходимо исключить кетоацидоз, независимо от концентрации глюкозы в крови, поскольку при кетоацидозе на фоне приема препарата Сигдуо Лонг® концентрация глюкозы в крови может быть менее 13,9 ммоль/л. При подозрении на кетоацидоз следует прекратить прием препарата Сигдуо Лонг®, провести необходимое обследование и назначить соответствующее лечение. При лечении кетоацидоза применяются препараты инсулина, внутривенное введение растворов, в том числе, глюкозы.
Во многих случаях при пострегистрационном применении, особенно у пациентов с сахарным диабетом 1 типа, кетоацидоз не был своевременно диагностирован, и лечение было начато с опозданием, поскольку концентрация глюкозы в крови была ниже типичной для кетоацидоза (часто ниже 13,9 ммоль/л). Первые признаки и симптомы кетоацидоза соответствовали дегидратации и тяжелому метаболическому ацидозу – тошнота, рвота, боль в животе, общее плохое самочувствие и одышка. Во многих, но не во всех случаях, были выявлены предрасполагающие факторы – снижение дозы инсулина, острое заболевание с лихорадкой, снижение калорийности рациона из-за заболевания или хирургического вмешательства, недостаточная секреция инсулина из-за заболевания поджелудочной железы (сахарный диабет 1 типа, панкреатит в анамнезе или хирургическое вмешательство на поджелудочной железе) или злоупотребление алкоголем.
Перед началом применения препарата Сигдуо Лонг® необходимо оценить факторы риска кетоацидоза, в том числе, недостаточную выработку инсулина поджелудочной железой, вызванную различными причинами, снижение калорийности рациона и злоупотребление алкоголем. При наблюдении за пациентами, принимающими препарат Сигдуо Лонг®, следует помнить о возможности развития кетоацидоза и необходимости временного прекращения терапии при клинических ситуациях, предрасполагающих к развитию кетоацидоза (таких как длительное голодание из-за острого заболевания или хирургического вмешательства).
Нарушение функции почек и острая почечная недостаточность
Дапаглифлозин способствует уменьшению ОЦК и может вызвать нарушение функции почек (см. раздел «Побочное действие»). При пострегистрационном применении дапаглифлозина были отмечены случаи острой почечной недостаточности (в том числе, у пациентов в возрасте до 65 лет), в некоторых случаях потребовавшие госпитализации и диализа.
До назначения препарата Сигдуо Лонг® следует оценить возможные факторы риска острой почечной недостаточности, такие как гиповолемия. хроническая почечная недостаточность, хроническая сердечная недостаточность и прием сопутствующих препаратов (диуретики, ингибиторы ангиотензинпревращающего фермента, блокаторы рецепторов ангиотензина II, нестероидные противовоспалительные препараты). При ограничении приема пищи и жидкости (например, при остром заболевании или голодании), потере жидкости (например, при заболевании желудочно-кишечного тракта или воздействии высоких температур) следует предусмотреть временное прекращение терапии препаратом Сигдуо Лонг® и наблюдение за пациентом для выявления возможных симптомов острой почечной недостаточности. При развитии острой почечной недостаточности следует немедленно отменить препарат Сигдуо Лонг® и начать соответствующее лечение.
На фоне приема дапаглифлозина были отмечены случаи повышения концентрации креатинина в сыворотке крови и снижения рСКФ, особенно у пациентов пожилого возраста и пациентов с нарушением функции почек. После начала терапии препаратом Сигдуо Лонг® могут возникнуть нежелательные реакции, связанные с нарушением функции почек (см. раздел «Побочное действие»). Функцию почек следует оценить до начала приема препарата Сигдуо Лонг® и периодически – на фоне терапии. Препарат Сигдуо Лонг® противопоказан пациентам с рСКФ<60мл/мин/1,73 м² (см. разделы «Противопоказания» и «Способ применения и дозы»).
Уросепсис и пиелонефрит
При пострегистрационном применении ингибиторов SGLT2, в том числе, дапаглифлозина, были отмечены случаи тяжелых инфекций мочевыводящих путей, включая пиелонефрит и уросепсис, которые потребовали госпитализации. Терапия ингибиторами SGLT2 увеличивает риск инфекций мочевыводящих путей. Следует наблюдать за пациентами для выявления возможных симптомов инфекции мочевыводящих путей и, при необходимости, незамедлительно начинать лечение (см. раздел «Побочное действие»).
Концентрация витамина В12
В контролируемых клинических исследованиях метформина длительностью 29 недель примерно у 7% пациентов наблюдалось снижение в сыворотке крови ранее нормальной концентрации витамина В12 до субнормальных значений без клинических проявлений. Однако такое снижение очень редко сопровождается развитием анемии, и концентрация быстро восстанавливается после отмены метформина или дополнительного приема витамина В12. Пациентам, получающим препарат Сигдуо Лонг®, следует ежегодно оценивать гематологические параметры, и при выявлении изменений проводить соответствующее обследование и лечение (см. раздел «Побочное действие»).
У некоторых пациентов (например, в случае недостаточного поступления с пищей или нарушения всасывания витамина В12 и кальция) существует предрасположенность к снижению концентрации витамина В12 до субнормальных значений. У таких пациентов может быть целесообразным определение концентрации витамина В12 в сыворотке крови каждые 2-3 года терапии.
Грибковые генитальные инфекции
У пациентов, получающих дапаглифлозин, может повышаться риск грибковых генитальных инфекций. Риск генитальных инфекций выше у пациентов, у которых до начала приема препарата отмечались эпизоды аналогичной инфекции (см. раздел «Побочное действие»). Следует контролировать состояние пациентов для выявления возможных симптомов и проводить соответствующее лечение в случае такой инфекции.
Повышение концентрации ХС ЛПНП
У пациентов, получающих дапаглифлозин, может повышаться концентрация ХС ЛПНП в сыворотке. На фоне терапии препаратом Сигдуо Лонг® следует контролировать концентрацию ХС ЛПНП и, при необходимости, назначать лечение в соответствии с принятой практикой.
Рак мочевого пузыря
В 22 клинических исследованиях рак мочевого пузыря был диагностирован у 10 из 6045 пациентов (0,17%) из группы дапаглифлозина и у 1 из 3512 пациентов (0,03%) из группы плацебо/препарата сравнения. После исключения из анализа пациентов, принимавших препарат менее 1 года на момент диагностики рака мочевого пузыря, в группе дапаглифлозина было 4 случая рака мочевого пузыря, а в группе плацебо/препарата сравнения случаев рака не было. На момент начала исследования группы были сбалансированы в отношении факторов риска рака мочевого пузыря и гематурии (потенциальный индикатор недиагностированной опухоли). Малое количество случаев не позволяет сделать вывод о причинно-следственной связи с приемом дапаглифлозина.
Тем не менее, препарат Сигдуо Лонг® не следует назначать пациентам с раком мочевого пузыря. Нет данных, позволяющих оценить возможное влияние дапаглифлозина на уже имеющуюся опухоль мочевого пузыря. У пациентов с раком мочевого пузыря в анамнезе перед назначением препарата Сигдуо Лонг® следует оценить пользу от контроля гликемии и возможный неуточненный риск рецидива рака мочевого пузыря.
Макроваскулярные осложнения
Исследования, убедительно показывающие снижение риска макроваскулярных осложнений при применении препарата Сигдуо Лонг®, не проводились.
Влияние на способность к управлению транспортными средствами и механизмами
Исследований по изучению влияния препарата Сигдуо Лонг® на способность к управлению транспортными средствами и механизмами не проводилось.
Форма выпуска
Таблетки с модифицированным высвобождением, покрытые плёночной оболочкой 5 мг + 1000 мг, 10 + 1000 мг.
Таблетки 5 мг + 1000 мг:
По 6 таблеток в блистер из фольги алюминиевой.
По 10 блистеров с инструкцией по применению в картонную пачку с контролем первого вскрытия.
Таблетки 10 мг + 1000 мг:
По 6 таблеток в блистер из фольги алюминиевой.
По 5 блистеров с инструкцией по применению в картонную пачку с контролем первого вскрытия.
Хранение
При температуре не выше 30 °С.
Хранить в местах, недоступных для детей.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Наименование и юридический адрес держателя (владельца) регистрационного удостоверения
АстраЗенека АБ, SE-151 85 Содерталье, Швеция
AstraZeneca АВ, SE-151 85 Sodertalje, Sweden
Производитель, фасовщик (первичная упаковка), упаковщик (вторичная (потребительская) упаковка), выпускающий контроль качества
АстраЗенека Фармасьютикалс ЛП, США
4601 Хайуэй 62 Ист, Маунт Вернон, Индиана, 47620, США
AstraZeneca Pharmaceuticals LP, USA
4601 Highway 62 East, Mount Vernon, Indiana, 47620, USA
Наименование, адрес организации, уполномоченной держателем или владельцем регистрационного удостоверения лекарственного препарата для медицинского применения на принятие претензий от потребителя:
Представительство АстраЗенека ЮК Лимитед, Великобритания, в г. Москве и ООО АстраЗенека Фармасьютикалз
125284 Москва, ул. Беговая д. 3, стр. 1
Купить Сигдуо Лонг в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Описание препарата Сигдуо Лонг® (таблетки с модифицированным высвобождением, покрытые пленочной оболочкой, 5 мг+1000 мг) основано на официальной инструкции, утверждено компанией-производителем в 2019 году
Дата согласования: 25.11.2019
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Фотографии упаковок

25.11.2019
Действующее вещество
ATX
Фармакологическая группа
Состав
| Таблетки с модифицированным высвобождением, покрытые пленочной оболочкой 5 мг + 1000 мг | 1 табл. |
| Слой метформина пролонгированного действия | |
| действующее вещество: | |
| метформина гидрохлорид в смеси с 0,5% магния стеарата1 | 1005,04 мг |
| (1000 мг метформина гидрохлорида + 5,04 мг магния стеарата) | |
| вспомогательные вещества: кармеллоза натрия — 49,99 мг; гипромеллоза 2208 — 234,98 мг; кремния диоксид — 13 мг; магния стеарат — 1,99 мг | |
| Слой дапаглифлозина | |
| действующее вещество: | |
| дапаглифлозина пропандиола моногидрат | 6,15 мг |
| (в пересчете на дапаглифлозин — 5 мг) | |
| вспомогательные вещества: МКЦ РН3022 — 226,35 мг; лактоза — 48 мг; кросповидон — 12 мг; кремния диоксид — 4,5 мг; магния стеарат3 — 3 мг | |
| оболочка пленочная: Опадрай® II розовый 85F945924 — 40,13 мг5 |
| Таблетки с модифицированным высвобождением, покрытые пленочной оболочкой 10 мг + 1000 мг | 1 табл. |
| Слой метформина пролонгированного действия | |
| действующее вещество: | |
| метформина гидрохлорид в смеси с 0,5% магния стеарата1 | 1005,04 мг |
| (1000 мг метформина гидрохлорида + 5,04 мг магния стеарата) | |
| вспомогательные вещества: кармеллоза натрия — 49,99 мг; гипромеллоза 2208 — 234,98 мг; кремния диоксид — 13 мг; магния стеарат — 1,99 мг | |
| Слой дапаглифлозина | |
| действующее вещество: | |
| дапаглифлозина пропандиола моногидрат | 12,3 мг |
| (в пересчете на дапаглифлозин — 10 мг) | |
| вспомогательные вещества: МКЦ РН3022 — 220,2 мг; лактоза — 48 мг; кросповидон — 12 мг; кремния диоксид — 4,5 мг; магния стеарат3 — 3 мг | |
| оболочка пленочная: Опадрай® II желтый 85F123726 — 40,13 мг5 |
1 Данная смесь состоит из 99,5% (м/м) метформина гидрохлорида и 0,5% (м/м) магния стеарата.
2 Количество может меняться в зависимости от чистоты дапаглифлозина и используемого актуального количества магния стеарата.
3 Целевое суммарное количество магния стеарата составляет 1% (м/м) от слоя дапаглифлозина.
4 Опадрай II розовый 85F94592 содержит (% м/м): спирт поливиниловый частично гидролизованный 40% (Е1203), титана диоксид 22% (Е171), макрогол 3350 20,2% (Е1521), тальк 14,8% (Е553b), краситель железа оксид красный 3% (Е172).
5 Количество оболочечного материала основано на целевом увеличении массы таблетки 2,5% (м/м). Фактическое количество может меняться в диапазоне 2–3,2% (м/м) для достижения приемлемого физического внешнего вида.
6 Опадрай II желтый 85F12372 содержит (% м/м): спирт поливиниловый частично гидролизованный 40% (Е1203), титана диоксид 21,08% (Е171), макрогол 3350 20,2% (Е1521), тальк 14,8% (Е553b); краситель железа оксид желтый 3,92% (Е172).
Описание лекарственной формы
Таблетки 5 мг + 1000 мг: овальные, двояковыпуклые, покрытые пленочной оболочкой от розового до темно-розового цвета, с гравировкой «1071» и «5/1000» на одной стороне.
Таблетки 10 мг + 1000 мг: овальные, двояковыпуклые, покрытые пленочной оболочкой от желтого до темно- желтого цвета, с гравировкой «1073» и «10/1000» на одной стороне.
Фармакологическое действие
Фармакологическое действие
—
гипогликемическое.
Фармакодинамика
Механизм действия
Препарат Сигдуо Лонг® объединяет два гипогликемических препарата с дополняющими механизмами действия для улучшения гликемического контроля у пациентов с сахарным диабетом типа 2 (СД 2): дапаглифлозин, селективный обратимый ингибитор натрийзависимого переносчика глюкозы 2-го типа (SGLT2), и метформин, представитель класса бигуанидов. Дапаглифлозин SGLT2 экспрессируется в проксимальных почечных канальцах и является основным переносчиком, участвующим в процессе реабсорбции глюкозы. Ингибируя SGLT2, дапаглифлозин уменьшает реабсорбцию глюкозы и снижает почечный порог для глюкозы, что приводит к повышению ее выведения почками.
Метформин. Метформин улучшает толерантность к глюкозе у пациентов с СД 2, снижая концентрацию глюкозы плазмы натощак и постпрандиальную концентрацию глюкозы. Метформин уменьшает продукцию глюкозы печенью, снижает всасывание глюкозы в кишечнике и повышает чувствительность к инсулину, увеличивая периферическое поглощение и утилизацию глюкозы. Метформин не вызывает гипогликемию у пациентов с СД 2 или здоровых людей (кроме особых ситуаций, см. «Особые указания») и гиперинсулинемию. Во время терапии метформином секреция инсулина не меняется, хотя концентрации инсулина натощак и в ответ на прием пищи в течение дня могут снижаться.
Дапаглифлозин. После приема дапаглифлозина здоровыми добровольцами и пациентами с СД 2 наблюдалось увеличение количества выводимой почками глюкозы. При приеме дапаглифлозина в дозе 5 мг/сут или 10 мг/сут в течение 12 нед пациентами с СД 2 почками выводилось примерно 70 г/сут глюкозы. При приеме дапаглифлозина в дозе 20 мг/сут выведение глюкозы практически достигало максимума. Выведение глюкозы почками при применении дапаглифлозина также приводит к увеличению объема мочи (см. «Побочные действия»).
Клиническая эффективность
Стартовая комбинированная терапия с метформином пролонгированного действия. Безопасность и эффективность стартовой комбинированной терапии дапаглифлозином и метформином пролонгированного действия изучались в 2 контролируемых исследованиях продолжительностью 24 нед у пациентов с СД 2 и неадекватным контролем гликемии, ранее не получавших гипогликемической терапии. Применение дапаглифлозина и метформина пролонгированного действия (суточная доза 2 г) обеспечивало значимое снижение концентрации HbAlc и концентрации глюкозы в плазме крови натощак (ГПН) по сравнению с монотерапией метформином или дапаглифлозином. Также комбинированная терапия дапаглифлозином и метформином пролонгированного действия обеспечила значимое снижение массы тела по сравнению с монотерапией метформином пролонгированного действия.
Добавление дапаглифлозина к терапии метформином обычного высвобождения. Безопасность и эффективность добавления дапаглифлозина к терапии метформином обычного высвобождения изучались в контролируемом исследовании продолжительностью 24 нед у пациентов с СД 2 и неадекватным контролем гликемии. Добавление дапаглифлозина в дозе 10 мг к терапии метформином приводило к значимому снижению концентрации HbAlc и концентрации ГПН, а также уменьшению массы тела по сравнению с плацебо на 24-й нед лечения. Также отмечено статистически значимое (р<0,05) по сравнению с группой монотерапии метформином среднее снижение сАД на 4,5 и 5,3 мм рт.ст. у пациентов, получавших дапаглифлозин 5 и 10 мг, соответственно.
Добавление дапаглифлозина или глипизида к терапии метформином обычного высвобождения. Безопасность и эффективность добавления дапаглифлозина к терапии метформином обычного высвобождения по сравнению с глипизидом изучались в контролируемом исследовании продолжительностью 52 нед у пациентов с СД 2 и неадекватным контролем гликемии. Дапаглифлозин не менее эффективно, чем глипизид, снижал среднее значение концентрации HbAlc к 52-й нед лечения. В группе дапаглифлозина было отмечено значимое снижение среднего значения массы тела к 52-й нед лечения, в то время как в группе глипизида наблюдалось увеличение этого показателя. В группе дапаглифлозина по сравнению с группой глипизида было достигнуто статистически значимое (р<0,0001) снижение сАД на 5 мм рт.ст.
Фармакокинетика
Препарат Сигдуо Лонг® биоэквивалентен дапаглифлозину (препарат Форсига) и метформину пролонгированного действия (препарат Глюкофаж® Лонг) при их совместном применении в соответствующих дозах. Показатели экспозиции дапаглифлозина и метформина пролонгированного действия после приема препарата Сигдуо Лонг® здоровыми добровольцами были сопоставимы после стандартного приема пищи и натощак. В случае приема препарата Сигдуо Лонг® после стандартного приема пищи было отмечено снижение Cmax дапаглифлозина на 35% и увеличение времени ее достижения Tmax на 1–2 ч по сравнению с приемом препарата натощак. Это различие не является клинически значимым. Прием пищи не оказывал значимого влияния на фармакокинетические параметры метформина.
Абсорбция
Дапаглифлозин. После приема дапаглифлозина внутрь натощак Cmax обычно достигается в течение 2 ч. Значения Cmax и AUC увеличиваются пропорционально дозе дапаглифлозина в диапазоне терапевтических доз. Абсолютная биодоступность дапаглифлозина при приеме внутрь в дозе 10 мг составляет 78%. Прием пищи оказывал умеренное влияние на фармакокинетику дапаглифлозина у здоровых добровольцев. Прием пищи с высоким содержанием жиров снижал Cmax дапаглифлозина на 50%, увеличивал Tmax примерно на 1 ч, но не влиял на AUC по сравнению с приемом натощак. Эти изменения не являются клинически значимыми, поэтому дапаглифлозин можно принимать независимо от приема пищи.
Метформин. После приема внутрь метформина пролонгированного действия Cmax достигается через 4–8 ч (медиана — 7 ч). Степень абсорбции метформина из таблеток пролонгированного действия увеличивается примерно на 50% (оценивалось по изменению AUC) при приеме во время еды. Прием пищи не влиял на Tmax и Cmax.
Распределение
Дапаглифлозин. Дапаглифлозин примерно на 91% связывается с белками. У пациентов с нарушениями функции почек или печени этот показатель не изменялся.
Метформин. Не проводились исследования распределения метформина пролонгированного действия, однако кажущийся Vd метформина после однократного приема внутрь таблеток метформина обычного высвобождения в дозе 850 мг в среднем составил (654±358) л. Метформин в незначительной степени связывается с белками плазмы крови. Метформин проникает в эритроциты.
Метаболизм
Дапаглифлозин. Метаболизм дапаглифлозина главным образом происходит под действием фермента УДФ-ГТ 1А9; изоферменты цитохрома CYP вовлечены в метаболизм у человека в меньшей степени. Дапаглифлозин метаболизируется с образованием главным образом неактивного метаболита дапаглифлозин-3-О-глюкуронида. После приема внутрь 50 мг 14С-дапаглифлозина 61% принятой дозы метаболизируется в дапаглифлозин-3-О-глюкуронид.
Метформин. Исследования с однократным в/в введением препарата здоровым добровольцам показывают, что метформин выводится в неизмененном виде почками, не подвергается метаболизму в печени (у человека не выявлены метаболиты) и не выводится через кишечник. Исследования по изучению метаболизма метформина в таблетках пролонгированного действия не проводились.
Выведение
Дапаглифлозин. Дапаглифлозин и его метаболиты выводятся преимущественно почками, и только менее 2% выводится в неизмененном виде. После приема 50 мг 14С-дапаглифлозина было обнаружено 96% радиоактивности — 75% в моче и 21% в фекалиях. Примерно 15% радиоактивности, обнаруженной в фекалиях, приходилось на неизмененный дапаглифлозин. T1/2 из плазмы после однократного приема дапаглифлозина в дозе 10 мг составляет примерно 12,9 ч.
Метформин. Почечный клиренс примерно в 3,5 раза выше Cl креатинина, что указывает на то, что канальцевая секреция является основным путем выведения метформина. После приема внутрь примерно 90% абсорбированного препарата выводится почками в течение первых 24 ч, при этом T1/2 из плазмы равен примерно 6,2 ч. В крови T1/2 составляет примерно 17,6 ч, следовательно, эритроцитарная масса может быть частью распределения.
Особые группы пациентов
Нарушение функции почек
Дапаглифлозин. В равновесном состоянии (прием дапаглифлозина 1 раз в сутки в дозе 20 мг в течение 7 дней) у пациентов с СД 2 и нарушением функции почек легкой, средней или тяжелой степени (определяемой по расчетной СКФ (рСКФ) геометрическая средняя системной экспозиции была на 45%, в 2,04 и 3,03 раза выше, чем у пациентов с СД 2 и нормальной функцией почек соответственно. Повышение системной экспозиции дапаглифлозина у пациентов с СД 2 и нарушением функции почек не сопровождалось соответствующим увеличением количества глюкозы, выводимой почками в течение суток. Суточная экскреция глюкозы почками в равновесном состоянии у пациентов с СД 2 и нарушением функции почек легкой, средней или тяжелой степени была, соответственно на 42, 80 и 90% ниже по сравнению с пациентами с СД 2 и нормальной функцией почек. Неизвестно, оказывает ли гемодиализ влияние на экспозицию дапаглифлозина (см. «Способ применения и дозы» и «Особые указания»).
Метформин. У пациентов с нарушением функции почек (по результатам измерений Cl креатинина) T1/2 метформина из плазмы и крови удлиняется, и почечный клиренс снижается.
Нарушение функции печени
Дапаглифлозин. У пациентов с нарушением функции печени легкой или средней степени тяжести (классы А и В по Чайлд-Пью) средние значения Cmax и AUC дапаглифлозина после однократного приема в дозе 10 мг были соответственно на 12 и 36% выше по сравнению с аналогичными показателями у здоровых добровольцев. Данные различия не являются клинически значимыми. У пациентов с нарушением функции печени тяжелой степени (класс С по Чайлд-Пью) средние значения Cmax и AUC дапаглифлозина были на 40 и 67% выше соответственно по сравнению с этими данными у здоровых добровольцев.
Метформин. Фармакокинетические исследования метформина у пациентов с нарушением функции печени не проводились.
Пожилой возраст
Дапаглифлозин. По результатам популяционного фармакокинетического анализа, возраст не оказывает клинически значимого влияния на системную экспозицию дапаглифлозина. поэтому коррекция дозы в зависимости от возраста пациента не требуется.
Метформин. Ограниченные данные контролируемых исследований фармакокинетики метформина у здоровых добровольцев пожилого возраста позволяют предположить, что общий плазменный клиренс метформина понижается, T1/2увеличивается, а Cmax повышается по сравнению со значениями этих параметров у здоровых добровольцев молодого возраста. По этим данным, изменение параметров фармакокинетики метформина с увеличением возраста в основном обусловлено изменением функции почек.
Дети
Не проводились исследования фармакокинетики препарата Сигдуо Лонг® у детей (см. «Противопоказания»).
Пол
Дапаглифлозин. По результатам популяционного фармакокинетического анализа, пол не оказывает клинически значимого влияния на системную экспозицию дапаглифлозина, поэтому коррекция дозы в зависимости от пола пациента не рекомендуется.
Метформин. Фармакокинетические параметры метформина у здоровых добровольцев и пациентов с СД 2 существенно не различались в зависимости от пола. В контролируемых клинических исследованиях у пациентов с СД 2 гипогликемический эффект метформина у мужчин и женщин был сопоставим.
Расовая и этническая принадлежность
Дапаглифлозин. По результатам популяционного фармакокинетического анализа, клинически значимых различий системной экспозиции у представителей европеоидной, негроидной и монголоидной рас не выявлено; коррекция дозы с учетом расовой принадлежности не требуется.
Метформин. Не проводились исследования параметров фармакокинетики метформина в зависимости от расовой принадлежности пациента. В клинических исследованиях у пациентов с СД 2 гипогликемический эффект метформина у представителей европеоидной, негроидной рас и пациентов испанского происхождения был сопоставим.
Масса тела
Дапаглифлозин. По результатам популяционного фармакокинетического анализа, масса тела не оказывает клинически значимого влияния на системную экспозицию дапаглифлозина, поэтому коррекция дозы в зависимости от массы тела пациента не требуется.
Показания
Сахарный диабет типа 2 в дополнение к диете и физическим упражнениям для улучшения гликемического контроля у взрослых пациентов, для которых целесообразна комбинированная терапия дапаглифлозином и метформином.
Противопоказания
повышенная индивидуальная чувствительность к любому компоненту препарата;
сахарный диабет типа 1;
нарушение функции почек от средней до тяжелой степени (рСКФ<60 мл/мин/1,73 м2), терминальная стадия почечной недостаточности или пациенты, получающие гемодиализ;
наследственная непереносимость лактозы, недостаточность лактазы и глюкозо-галактозная непереносимость;
беременность;
период грудного вскармливания;
детский возраст до 18 лет (безопасность и эффективность не изучены);
пациенты, принимающие петлевые диуретики (см.«Взаимодействие»), или со сниженным объемом циркулирующей крови (ОЦК), например вследствие острых заболеваний (таких как желудочно-кишечные заболевания);
пожилые пациенты в возрасте 75 лет и старше (для начала терапии дапаглифлозином);
нарушение функции печени;
острые заболевания, при которых имеется риск развития нарушения функции почек: дегидратация (при рвоте, диарее), лихорадка, тяжелые инфекционные заболевания, состояния гипоксии (шок, сепсис, инфекции почек, бронхолегочные заболевания);
острый или хронический метаболический ацидоз, включая диабетический кетоацидоз, с комой или без комы. В случае диабетического кетоацидоза следует применять препараты инсулина;
клинически выраженные проявления острых и хронических заболеваний, которые могут привести к развитию тканевой гипоксии (дыхательная недостаточность, сердечная недостаточность, острый инфаркт миокарда);
серьезные хирургические операции и травмы (когда показано проведение инсулинотерапии);
хронический алкоголизм и острое отравление этанолом;
лактоацидоз (в т.ч. в анамнезе);
период не менее 48 ч до и в течение 48 ч после проведения радиоизотопных или рентгенологических исследований с введением йодсодержащих контрастных средств;
соблюдение гипокалорийной диеты (<1000 ккал/сут).
С осторожностью: инфекции мочевыводящих путей; риск снижения ОЦК; пожилые пациенты; повышенное значение гематокрита; пациенты в возрасте старше 60 лет, выполняющие тяжелую физическую работу.
Применение при беременности и кормлении грудью
Применение препарата Сигдуо Лонг®, а также его действующих веществ, дапаглифлозина и метформина, в период беременности не изучено, поэтому препарат противопоказан во время беременности. В случае диагностирования беременности терапия препаратом Сигдуо Лонг® должна быть прекращена.
Неизвестно, проникает ли дапаглифлозин, метформин и/или их метаболиты в грудное молоко человека. Нельзя исключить риск для новорожденных/младенцев. Препарат Сигдуо Лонг® противопоказан в период грудного вскармливания.
Способ применения и дозы
Внутрь, 1 раз в сутки во время завтрака. Таблетки следует проглатывать целиком, не разжевывая, не измельчая и не разламывая. Дозу следует подбирать индивидуально, учитывая эффективность и переносимость проводимой терапии. При необходимости дозу повышают постепенно, чтобы уменьшить риск побочных эффектов метформина со стороны ЖКТ.
Максимальная суточная доза дапаглифлозина составляет 10 мг, метформина пролонгированного действия — 2 г. Если препарат Сигдуо Лонг® был назначен пациенту, принимающему метформин пролонгированного действия в вечернее время, следует пропустить прием последней вечерней дозы метформина пролонгированного действия накануне приема первой дозы препарата Сигдуо Лонг®. Пациентам со сниженным ОЦК необходима коррекция этого состояния до начала терапии препаратом Сигдуо Лонг®. Неактивные ингредиенты препарата Сигдуо Лонг® могут выводиться через кишечник в виде мягкой, влажной массы, которая может сохранять форму принятой таблетки.
Особые группы пациентов
Нарушение функции печени. У пациентов с нарушением функции печени применение метформина может приводить к лактоацидозу. Поэтому препарат Сигдуо Лонг® противопоказан пациентам с нарушением функции печени.
Нарушение функции почек. До начала терапии препаратом Сигдуо Лонг® и периодически на фоне терапии следует оценивать функцию почек. Препарат Сигдуо Лонг® противопоказан пациентам с нарушением функции почек от средней до тяжелой степени (рСКФ <60 мл/мин/1,73 м2), с терминальной стадией почечной недостаточности и пациентам, получающим гемодиализ (см. «Противопоказания», «Побочные действия» и «Особые указания»). При нарушении функции почек легкой степени (рСКФ ≥60 мл/мин/1,73 м2) нет необходимости корректировать дозу препарата.
Дети. Безопасность и эффективность дапаглифлозина у пациентов младше 18 лет не изучались (см. «Противопоказания»).
Пожилой возраст. У пациентов пожилого возраста нет необходимости корректировать дозу препарата. Однако при выборе дозы следует учитывать, что у этой категории пациентов более вероятны нарушение функции почек и риск снижения ОЦК.
Рекомендуется более частый контроль состояния функции почек у пациентов пожилого возраста. Поскольку клинический опыт применения дапаглифлозина у пациентов 75 лет и старше ограничен, противопоказано начинать терапию дапаглифлозином в данной возрастной группе.
Побочные действия
Дапаглифлозии и метформин
Оценка безопасности проводилась на основании объединенных данных 8 краткосрочных плацебо-контролируемых исследований, в которых дапаглифлозин применялся в комбинации с метформином (в данной комбинации и в дополнение к другой гипогликемической терапии). В этих исследованиях 983 пациента получали дапаглифлозин в дозе 10 мг 1 раз в сутки и метформин, и 1185 пациентов получали плацебо и метформин.
Общая частота нежелательных явлений в группе дапаглифлозина в дозе 10 мг и метформина составила 60,3% по сравнению с 58,2% в группе плацебо и метформина. У 4% пациентов в группе дапаглифлозина 10 мг и метформина терапия была отменена из-за нежелательных реакций по сравнению с 3,3% в группе плацебо и метформина. Наиболее частыми нежелательными явлениями, приводившими к отмене терапии и отмеченными как минимум у 3 пациентов в группе дапаглифлозина 10 мг и метформина, были нарушение функции почек (0,7%), повышение концентрации креатинина в сыворотке крови (0,2%), уменьшение Cl креатинина (0,2%) и инфекции мочевыводящих путей (0,2%).
В Таблице 1 приведены нежелательные реакции по данным 8 краткосрочных плацебо-контролируемых исследований, вне зависимости от оценки исследователем причинно-следственной связи, которые были отмечены, как минимум, у 2% пациентов, принимавших дапаглифлозин и метформин, и как минимум на 1% чаще по сравнению с пациентами, получавшими метформин и плацебо.
Таблица 1
Нежелательные реакции в плацебо-контролируемых исследованиях1 (вне зависимости от оценки исследователем причинно-следственной связи), отмеченные с частотой ≥2% у пациентов, получавших дапаглифлозин и метформин, и, как минимум, на 1% чаще по сравнению с пациентами, получавшими метформин и плацебо (за исключением гипогликемии)2
| Системно-органный класс Термин предпочтительного употребления |
Дапаглифлозии 10 мг и метформин N=983 |
| Инфекции и инвазии Генитальные инфекции3 |
Часто |
| Инфекции и инвазии Инфекции мочевыводящих путей4 |
Часто |
| Нарушения со стороны почек и мочевыводящих путей Полиурия5 |
Часто |
18 плацебо-контролируемых исследований включали 2 исследования стартовой комбинированной терапии с метформином, 2 исследования добавления к терапии метформином, 1 исследование добавления к терапии инсулином, 1 исследование добавления к терапии ситаглиптином и 2 исследования добавления к комбинированной гипогликемической терапии. Приведенные данные относятся к краткосрочной терапии (до 24 нед) независимо от назначения дополнительных гипогликемических средств.
2См. подраздел Гипогликемия.
3Включает следующие предпочтительные термины (перечислены в порядке убывания частоты): вульвовагинальная грибковая инфекция, баланит, вагинальная инфекция, генитальная грибковая инфекция, генитальная инфекция, вульвовагинальный кандидоз, кандидозный баланит, вульвовагинит, генитальный кандидоз, вульвит, баланопостит, генитальная инфекция у мужчин, инфекция мочеполового тракта, абсцесс пениса, инфекция пениса, постит, абсцесс вульвы и бактериальный вагинит.
4Включает следующие предпочтительные термины (перечислены в порядке убывания частоты): инфекция мочевыводящих путей, цистит, инфекция мочевыводящих путей, вызванная бактериями рода Escherichia, инфекция мочеполового тракта, пиелонефрит, тригонит, уретрит, инфекция почек и простатит.
5Включает следующие предпочтительные термины (перечислены в порядке убывания частоты): поллакиурия, полиурия и увеличение объема выделяемой мочи.
Метформин
В плацебо-контролируемых исследованиях метформина пролонгированного действия в качестве монотерапии диарея и тошнота/рвота отмечались более чем у 5% пациентов и чаще, чем в группе плацебо (диарея у 9,6 и 2,6% пациентов, тошнота/рвота у 6,5 и 1,5% пациентов, соответственно). У 0,6% пациентов, получавших метформин пролонгированного действия, диарея привела к прекращению терапии.
Объединенные данные 12 плацебо-контролируемых исследований дапаглифлозина 5 и 10 мг
Дапаглифлозин
В 4 исследованиях дапаглифлозин применялся в качестве монотерапии, а в 8 исследованиях — в качестве дополнения к базовой сахароснижающей терапии или в комбинации с метформином. В этих исследованиях 2338 пациентов получали дапаглифлозин, в среднем, в течение 21 нед. 1393 пациента получали плацебо, 1145 пациентов — дапаглифлозин 5 мг, 1193 пациента — дапаглифлозин 10 мг 1 раз в сутки.
Объединенные данные 13 плацебо-контролируемых исследований дапаглифлозина 10 мг
Оценка безопасности и переносимости дапаглифлозина 10 мг проводилась на основании объединенных данных 13 плацебо-контролируемых исследований: в 3 исследованиях дапаглифлозин изучался в режиме монотерапии, в 9 исследованиях — в качестве дополнительной терапии к проводимой сахароснижающей терапии и в 1 исследовании в стартовой комбинации с метформином. В этих исследованиях 2360 пациентов получали дапаглифлозин в дозе 10 мг, в среднем в течение 22 нед.
Описание отдельных нежелательных реакций
Снижение ОЦК. Дапаглифлозин вызывает осмотический диурез, который может приводить к снижению ОЦК. Нежелательные реакции, связанные со снижением ОЦК (включая сообщения об обезвоживании, гиповолемии, ортостатической гипотензии и артериальной гипотензии), приведены в Таблице 2 (объединенные данные 12 и 13 краткосрочных плацебо- контролируемых исследований дапаглифлозина) (см. «Особые указания»).
Таблица 2
Нежелательные реакции, связанные со снижением ОЦК1, в клинических исследованиях дапаглифлозина
| Объединенные данные 12 плацебо-контролируемых исследований | Объединенные данные 13 плацебо-контролируемых исследований | ||||
| Плацебо | Дапаглифлозин, 5 мг | Дапаглифлозин, 10 мг | Плацебо | Дапаглифлозин, 10 мг | |
| Общее количество пациентов N (%) | N=1393 5 (0,4%) |
N=1145 7 (0,6%) |
N=1193 9 (0,8%) |
N=2295 17 (0,7%) |
N=2360 27 (1,1%) |
| Подгруппы пациентов n (%) | |||||
| Пациенты, принимающие петлевые диуретики | n=55 1 (1,8%) |
n=40 0 |
n=31 3 (9,7%) |
n=267 4 (1,5%) |
n=236 6 (2,5%) |
| Пациенты с нарушением функции почек средней тяжести (60>рСКФ≥30 мл/мин/1,73 м2) | n=107 2 (1,9%) |
n=107 1 (0,9%) |
n=89 1 (1,1%) |
n=268 4 (1,5%) |
n=265 5(1,9%) |
| Пациенты ≥65 лет | n=276 1 (0,4%) |
n=216 1 (0,5%) |
n=204 3 (1,5%) |
n=711 6 (0,8%) |
n=665 11 (1,7%) |
1Снижение ОЦК включало следующие нежелательные реакции: дегидратация, гиповолемия, ортостатическая гипотензия и артериальная гипотензия.
Нарушение функции почек. На фоне применения дапаглифлозина отмечалось повышение концентрации креатинина в сыворотке крови и снижение рСКФ. У пациентов с нормальной функцией почек или нарушением функции почек легкой степени при включении в исследование концентрация креатинина и рСКФ возвращались к исходному значению на 24-й нед.
Нежелательные реакции, связанные с нарушением функции почек, включая почечную недостаточность и повышение концентрации креатинина в сыворотке, чаще отмечались у пациентов, принимавших дапаглифлозин (см. Таблицу 3). Эти нежелательные реакции чаще отмечались у пациентов пожилого возраста и у пациентов с нарушением функции почек (см. Таблицу 3). Стойкое снижение рСКФ наблюдалось у пациентов с нарушением функции почек средней степени тяжести (60 >СКФ≥ 30 мл/мин/1,73 м2).
Таблица 3
Доля пациентов, как минимум, с одной нежелательной реакцией, связанной с нарушением функции почек
| Объединенные данные 6 плацебо- контролнруемых исследований (до 104 нед)1 | Объединенные данные 9 плацебо-контролируемых исследований (до 104 нед)2 | ||||
| Исходные характеристики | Плацебо | Дапаглифлозин, 5 мг | Дапаглифлозин, 10 мг | Плацебо | Дапаглифлозин, 10 мг |
| Общая популяция Пациенты (%), как минимум, с одной нежелательной реакцией |
n=785 13 (1,7%) |
n=767 14 (1,8%) |
n=859 16 (1,9%) |
n=1956 82 (4,2%) |
n=2026 136 (6,7%) |
| Пациенты ≥65 лет Пациенты (%) как минимум с одной нежелательной реакцией |
n=190 4 (2,1%) |
п=162 5(3,1%) |
n=159 6 (3,8%) |
n=655 52 (7,9%) |
n=620 87 (14%) |
| Пациенты с 60>рСКФ≥30 мл/мин/1,73 м2 Пациенты (%), как минимум, с одной нежелательной реакцией |
n=77 5 (6,5%) |
n=88 7 (8%) |
n=75 9 (12%) |
n=249 40 (16,1%) |
n=251 71 (28,3%) |
| Пациенты ≥65 лет с 60>рСКФ≥30 мл/мин/1,73 м2 Пациенты (%), как минимум, с одной нежелательной реакцией |
n=41 2 (4,9%) |
n=43 3 (7%) |
n=35 4 (11,4%) |
n=141 27 (19,1%) |
n=134 47 (35,1%) |
1 Пациенты из 12 плацебо-контролируемых исследований с продленным периодом.
2 Пациенты из 13 плацебо-контролируемых исследований с продленным периодом.
В исследовании с участием пациентов с нарушением функции почек средней степени тяжести (60> рСКФ ≥30 мл/мин/1,73 м2) продолжительностью до 104 нед у 13 пациентов были отмечены переломы костей (5 случаев в группе дапаглифлозина 5 мг; 8 случаев в группе дапаглифлозина 10 мг; в группе плацебо переломов не зарегистрировано). В 11 из 13 случаев переломы произошли в первые 52 нед лечения, в 8 из 13 случаев — у пациентов с исходным значением рСКФ от 30 до 45 мл/мин/1,73 м2. Закономерности в отношении локализации переломов отмечено не было.
Гипогликемия. В плацебо-контролируемых исследованиях добавления дапаглифлозина к терапии метформином продолжительностью 24 нед тяжелых эпизодов гипогликемии отмечено не было; легкие эпизоды гипогликемии отмечены у 1,5% пациентов в группе дапаглифлозина 5 мг, 0,7% пациентов в группе дапаглифлозина 10 мг, в группе плацебо эпизодов гипогликемии не было.
В исследовании добавления дапаглифлозина к терапии метформином по сравнению с глипизидом продолжительностью 52 нед в группе дапаглифлозина не было отмечено тяжелых эпизодов гипогликемии, в группе глипизида такие эпизоды были отмечены у 0,7% пациентов: легкие эпизоды гипогликемии отмечены у 1,7% пациентов в группе дапаглифлозина 10 мг и у 36% пациентов в группе глипизида.
Грибковые генитальные инфекции. Грибковые генитальные инфекции чаще отмечались в группе дапаглифлозина. Грибковые генитальные инфекции были отмечены у 0,9, 5,7 и 4,8% пациентов, принимавших плацебо, дапаглифлозин 5 мг и дапаглифлозин 10 мг соответственно (объединенные данные 12 плацебо-контролируемых исследований дапаглифлозина 5 и 10 мг). У 0,2% пациентов в группе дапаглифлозина 10 мг из-за генитальной инфекции препарат был отменен (в группе плацебо случаев отмены терапии из-за аналогичной нежелательной реакции не было). Грибковые генитальные инфекции чаще отмечались у женщин, а также у пациентов, у которых до начала приема препарата отмечались эпизоды аналогичной инфекции (10; 23,1 и 25% по сравнению с 0,8, 5,9 и 5% в группах плацебо, дапаглифлозина 5 мг, дапаглифлозина 10 мг соответственно). Наиболее частыми у женщин были вульвовагинальные грибковые инфекции, а у мужчин — баланит.
Реакции гиперчувствительности. На фоне приема дапаглифлозина сообщалось о реакциях гиперчувствительности (таких как ангионевротический отек, крапивница, гиперчувствительность). В рамках программы клинических исследований серьезные анафилактические реакции, тяжелые кожные реакции и ангионевротический отек отмечены у 0,3% пациентов, получавших дапаглифлозин, и у 0,2% пациентов в группе сравнения. При возникновении реакций гиперчувствительности следует отменить дапаглифлозин, проводить лечение в соответствии с принятой практикой и наблюдение за пациентом до полного разрешения симптомов.
Результаты лабораторных исследований
Увеличение гематокрита
Дапаглифлозин. Увеличение гематокрита у пациентов, получавших дапаглифлозин, отмечалось с 1 по 16-ю нед лечения (объединенные данные 13 плацебо-контролируемых исследований дапаглифлозина 10 мг). Максимальное увеличение гематокрита, по сравнению с исходными значениями, наблюдалось на 16-й нед. На 24-й нед среднее изменение гематокрита по сравнению с исходным значением составило −0,33% в группе плацебо и 2,3% в группе дапаглифлозина 10 мг. К 24-й нед повышенное значение гематокрита >55% было зарегистрировано у 0,4% пациентов в группе плацебо и 1,3% пациентов в группе дапаглифлозина 10 мг.
Повышение концентрации неорганического фосфора в сыворотке крови
Дапаглифлозин. Повышение концентрации неорганического фосфора в сыворотке крови по сравнению с исходной отмечалось на 24-й нед у пациентов, получавших дапаглифлозин 10 мг, по сравнению с группой плацебо (среднее повышение составило 0,13 мг/дл и −0,04 мг/дл соответственно) (объединенные данные 13 плацебо-контролируемых исследований дапаглифлозина 10 мг). Гиперфосфатемия (концентрация неорганического фосфора в сыворотке ≥5,6 мг/дл для пациентов 17–65 лет и ≥5,1 мг/дл для пациентов в возрасте >66 лет) также чаще отмечалась в группе дапаглифлозина 10 мг по сравнению с группой плацебо на 24-й нед (1,7 и 0,9% пациентов соответственно).
Повышение концентрации Хс ЛПНП
Дапаглифлозин. Изменение концентрации липидов в сыворотке крови отмечено у пациентов, получавших дапаглифлозин, по сравнению с группой плацебо (объединенные данные 13 плацебо-контролируемых исследований дапаглифлозина 10 мг). Среднее процентное увеличение концентрации общего Хс в сыворотке крови на 24-й нед составило 2,5 и 0% в группе дапаглифозина 10 мг и плацебо соответственно, а Хс ЛПНП 2,9% в группе дапаглифлозина 10 мг по сравнению с −1% в группе плацебо.
Концентрация витамина В12
Метформин. На фоне приема метформина может снизиться концентрация витамина В12 в сыворотке. Пациентам, получающим препарат Сигдуо Лонг®, следует ежегодно оценивать гематологические параметры и при выявлении изменений проводить соответствующее обследование и лечение (см. «Особые указания»).
Опыт пострегистрационного применения
Дапаглифлозин. При пострегистрационном применении были отмечены следующие нежелательные реакции: неуточненнной частоты — сыпь. Достоверно оценить причинно-следственную связь и частоту нежелательных реакций не представляется возможным, поскольку сведения были получены в виде спонтанных сообщений, а размер популяции пациентов точно не был определен.
Взаимодействие
Фармакокинетические исследования взаимодействий препарата Сигдуо Лонг® не проводились, однако такие исследования были проведены для дапаглифлозина и метформина, входящих в состав препарата Сигдуо Лонг®.
Дапаглифлозин
В ходе исследований in vitro дапаглифлозин и дапаглифлозин-3-О-глюкуронид не ингибировали изоферменты системы цитохрома Р450 CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4 и не индуцировали изоферменты CYP1A2, CYP2B6 или CYP3A4. Дапаглифлозин является слабым субстратом P-gp, а дапаглифлозин-3-О-глюкуронид — субстратом активного транспортера ОАТ3. Дапаглифлозин и дапаглифлозин-3-О-глюкуронид значимо не ингибируют активные транспортеры P-gp, ОСТ2, ОАТ1 и ОАТ3. В целом не ожидается влияния дапаглифлозина на фармакокинетику препаратов, которые являются субстратами P-gp, ОСТ2, ОАТ1 и ОАТ3, при их одновременном применении.
Влияние других лекарственных препаратов на дапаглифлозин
Исследования взаимодействий в основном с приемом однократной дозы препарата показали, что метформин, пиоглитазон, ситаглиптин, глимепирид, воглибоза, гидрохлоротиазид, буметанид, валсартан или симвастатин не оказывают влияния на фармакокинетику дапаглифлозина. После совместного применения дапаглифлозина и рифампицина, индуктора различных активных транспортеров и ферментов, участвующих в метаболизме лекарственных препаратов, отмечено снижение AUC дапаглифлозина на 22% без клинически значимого влияния на количество глюкозы, выводимой почками в течение суток. Не рекомендуется корректировать дозу препарата. После совместного применения дапаглифлозина и мефенамовой кислоты (ингибитора УДФ-ГТ1A9) отмечено увеличение на 51% системной экспозиции дапаглифлозина без клинически значимого влияния на количество глюкозы, выводимой почками в течение суток. Не рекомендуется корректировать дозу препарата.
Влияние дапаглифлозина на другие лекарственные препараты
В исследованиях взаимодействий с участием здоровых добровольцев в основном однократно принимавших дозу препарата, дапаглифлозин не влиял на фармакокинетические параметры метформина, пиоглитазона, ситаглиптина, глимепирида, гидрохлоротиазида, буметанида, валсартана, симвастатина, дигоксина или варфарина. Применение однократной дозы дапаглифлозина 20 мг и симвастатина приводило к повышению на 19% AUC симвастатина. Повышение экспозиции симвастатина и симвастатиновой кислоты не считается клинически значимым.
Метформин
Влияние других лекарственных препаратов на метформин
Исследования взаимодействий с приемом однократной дозы препаратов показали, что глибенкламид, фуросемид, нифедипин, пропранолол, ибупрофен не оказывают влияния на фармакокинетику метформина.
Ингибиторы карбоангидразы. Топирамат и другие ингибиторы карбоангидразы (такие как зонисамид, ацетазоламид или диклофенамид) часто вызывают снижение концентрации бикарбонатов в сыворотке крови и неанионный интервал, гиперхлоремический метаболический ацидоз. Совместное применение этих препаратов с препаратом Сигдуо Лонг® может повышать риск лактоацидоза. Такие пациенты нуждаются в более частом контроле.
Препараты, замедляющие выведение метформина. Сопутствующее применение препаратов, которые влияют на транспортные системы почечных канальцев, участвующие в выведении метформина почками (ингибиторы ОСТ2 и МАТЕ, такие как ранолазин, вандетаниб, долутегравир и циметидин), может увеличивать системную экспозицию метформина и риск развития лактоацидоза. Необходимо оценить ожидаемую пользу и возможный риск при совместном применении этих препаратов.
Влияние метформина на другие лекарственные препараты
Исследования взаимодействий с приемом однократной дозы препаратов показали, что метформин не оказывает влияния на фармакокинетику глибенкламида, фуросемида, нифедипина, пропранолола, ибупрофена и циметидина.
Лекарственные препараты, способные вызвать гипергликемию. Прием некоторых лекарственных препаратов, таких как диуретики (в т.ч. тиазидные), кортикостероиды, фенотиазины, гормоны щитовидной железы, эстрогены, оральные контрацептивы, фенитоин, никотиновая кислота, симпатомиметики, БКК и изониазид, может предрасполагать к развитию гипергликемии и ухудшению гликемического контроля. При совместном применении данных препаратов с препаратом Сигдуо Лонг® необходим тщательный контроль гликемии, а при их отмене — наблюдение за пациентом из-за возможности развития гипогликемии. В исследованиях взаимодействия с участием здоровых добровольцев при однократном приеме препаратов не отмечалось взаимодействия метформина и пропранолола, метформина и ибупрофена.
Применение препаратов, которые могут вызвать гипогликемию
Метформин. Гипогликемия не развивается у пациентов, принимающих только метформин в обычном режиме, но может развиться при гипокалорийной диете, или если активная физическая нагрузка не компенсируется калорийностью рациона, или при совместном применении с другими гипогликемическими препаратами (такими как производные сульфонилмочевины и инсулин) или алкоголем. Пожилые, ослабленные или плохо питающиеся пациенты и пациенты с недостаточностью функции надпочечников или гипофиза или алкогольной интоксикацией наиболее чувствительны к гипогликемическим эффектам. У пожилых людей и пациентов, принимающих бета-адреноблокаторы, диагностика гипогликемии может быть затруднена.
Оценка теста на 1,5-ангидроглюцитол
Дапаглифлозин. У пациентов, получающих ингибиторы SGLT2, не рекомендуется использовать тест определения 1,5-ангидроглюцитола для контроля гликемии. Следует использовать альтернативные методы контроля.
Оценки результатов анализа мочи
Дапаглифлозин. Ингибиторы SGLT2 увеличивают выведение глюкозы почками. Поэтому результаты определения глюкозы в моче у пациентов, принимающих препарат Сигдуо Лонг®, будут положительными. Следует использовать альтернативные методы контроля.
Алкоголь
Алкоголь усиливает влияние метформина на метаболизм лактата. Пациентов следует информировать о недопустимости приема больших доз алкоголя на фоне терапии препаратом Сигдуо Лонг®.
Передозировка
Дапаглифлозин
В рамках программы клинических исследований дапаглифлозина случаев передозировки отмечено не было. В случае передозировки необходимо проводить поддерживающую терапию, учитывая состояние пациента. Выведение дапаглифлозина с помощью гемодиализа не изучалось.
Метформин
Симптомы: зарегистрированы случаи передозировки метформина, в т.ч. при приеме более 50 г. Примерно в 10% случаев развивалась гипогликемия, но ее причинная связь с приемом метформина не установлена. Примерно в 32% случаев передозировки метформина у пациентов наблюдался лактоацидоз.
Лечение: метформин выводится при диализе, при этом клиренс достигает 170 мл/мин. Поэтому при предполагаемой передозировке препарата, содержащего метформин, целесообразен гемодиализ.
Особые указания
Лактоацидоз
При пострегистрационном применении метформина были отмечены случаи лактоацидоза, в т.ч. с летальным исходом. В этих случаях лактоацидоз имел скрытое начало и сопровождался неспецифическими симптомами, такими как недомогание, миалгия. боль в животе, дыхательная недостаточность и повышенная сонливость. При тяжелом ацидозе отмечались гипотермия, артериальная гипотензия и резистентные брадиаритмии. При лактоацидозе, связанном с приемом метформина, были отмечены повышенная концентрация лактата в крови (более 5 ммоль/л), ацидоз с анионным интервалом (без наличия кетонурии и кетонемии) и увеличение соотношения лактат/пируват; концентрация метформина в плазме крови обычно превышала 5 мкг/мл. Метформин уменьшает утилизацию лактата в печени, концентрация лактата в крови при этом увеличивается, что способствует развитию лактоацидоза, особенно у пациентов с факторами риска.
При подозрении на лактоацидоз у пациента, принимающего метформин, следует безотлагательно начать проведение общих поддерживающих мероприятий в условиях стационара и немедленно прекратить прием препарата Сигдуо Лонг®.
При вероятном или подтвержденном лактоацидозе на фоне приема препарата Сигдуо Лонг® рекомендуется немедленно начать гемодиализ для коррекции ацидоза и выведения кумулированного метформина (метформин выводится при гемодиализе, клиренс составляет до 170 мл/мин в условиях хорошей гемодинамики). Гемодиализ часто приводил к разрешению симптоматики и выздоровлению.
Следует информировать пациентов и членов их семей о симптомах лактоацидоза, а также о необходимости прекратить терапию препаратом Сигдуо Лонг® и обратиться к врачу при появлении этих симптомов.
Далее по тексту приведены рекомендации по снижению риска и коррекции лактоацидоза в случае наличия известных факторов риска.
Нарушение функции почек. Лактоацидоз, связанный с приемом метформина при пострегистрационном применении, чаще всего возникал у пациентов со значительным нарушением функции почек. Метформин в основном выводится почками, поэтому с увеличением степени тяжести нарушения функции почек повышается риск кумуляции метформина и развития лактоацидоза. Рекомендации по оценке функции почек (см. «Фармакокинетика» и «Способ применения и дозы»):
— до начала терапии препаратом Сигдуо Лонг® следует определить рСКФ;
— препарат Сигдуо Лонг® противопоказан пациентам с рСКФ <60мл/мин/1,73 м2 (см. «Противопоказания»);
— у всех пациентов, принимающих препарат Сигдуо Лонг®, следует оценивать рСКФ как минимум ежегодно. У пациентов из группы риска нарушения функции почек (например, у пациентов пожилого возраста) функцию почек необходимо контролировать чаще.
Взаимодействия с другими лекарственными препаратами. Совместное применение препарата Сигдуо Лонг® с препаратами, которые могут влиять на функцию почек, может привести к значительным гемодинамическим изменениям, вызвать изменения кислотно-щелочного баланса или способствовать кумуляции метформина (например, катионные препараты) (см. «Взаимодействие»). Поэтому следует более часто контролировать состояние таких пациентов.
Пациенты в возрасте 65 лет и старше. Риск развития лактоацидоза, связанного с приемом метформина, увеличивается с возрастом, поскольку риск нарушения функции печени, почек или сердечной недостаточности у пожилых пациентов выше по сравнению с пациентами более молодого возраста. У пожилых пациентов функцию почек необходимо контролировать чаще (см. «Способ применения и дозы»).
Радиологические исследования с введением контрастных веществ. При проведении радиологических исследований с внутрисосудистым введением йодсодержащих контрастных веществ были выявлены случаи острого нарушения функции почек и развития лактоацидоза у пациентов, получающих метформин. Необходимо за 48 ч до выполнения такой процедуры приостановить терапию препаратом Сигдуо Лонг®, определить рСКФ через 48 ч после процедуры и возобновить прием препарата только после подтверждения стабильной функции почек.
Хирургические вмешательства и другие процедуры. Ограничение приема пищи и жидкости во время хирургических или других процедур может повысить риск снижения ОЦК, артериальной гипотензии и нарушения функции почек. Следует приостановить прием препарата Сигдуо Лонг® при ограничении приема пищи и жидкости.
Гипоксия. Несколько случаев лактоацидоза, связанного с пострегистрационным применением метформина, развилось на фоне острой сердечной недостаточности (особенно в сочетании с гипоперфузией и гипоксемией). Сосудистый коллапс (шок), острый инфаркт миокарда, сепсис и другие состояния, характеризующиеся гипоксемией, связаны с лактоацидозом и могут также вызывать преренальную азотемию. При возникновении таких состояний следует прекратить прием препарата Сигдуо Лонг®.
Чрезмерное употребление алкоголя. Алкоголь усиливает влияние метформина на метаболизм лактата и может способствовать развитию лактоацидоза. Пациентов следует информировать о недопустимости приема больших доз алкоголя на фоне терапии препаратом Сигдуо Лонг®.
Нарушение функции печени. Применение метформина пациентами с нарушением функции печени в некоторых случаях приводило к лактоацидозу, вероятно, из-за нарушения утилизации лактата в печени и повышению его концентрации в крови. Поэтому препарат Сигдуо Лонг® противопоказан пациентам с нарушением функции печени.
Артериальная гипотензия
Дапаглифлозин способствует снижению ОЦК. После начала терапии дапаглифлозином может возникать артериальная гипотензия с клиническими проявлениями, особенно у пациентов с нарушением функции почек (рСКФ <60 мл/мин/1,73 м2), пациентов пожилого возраста и пациентов, принимающих петлевые диуретики. Перед назначением препарата Сигдуо Лонг® таким пациентам следует провести оценку и коррекцию ОЦК, а после начала терапии — проводить наблюдение для выявления симптомов артериальной гипотензии.
Кетоацидоз
При появлении у пациента, получающего препарат Сигдуо Лонг®, признаков и симптомов тяжелого метаболического ацидоза, необходимо исключить кетоацидоз, независимо от концентрации глюкозы в крови, поскольку при кетоацидозе на фоне приема препарата Сигдуо Лонг® концентрация глюкозы в крови может быть менее 13,9 ммоль/л. При подозрении на кетоацидоз следует прекратить прием препарата Сигдуо Лонг®, провести необходимое обследование и назначить соответствующее лечение. При лечении кетоацидоза применяются препараты инсулина, в/в введение растворов, в т.ч. глюкозы. Во многих случаях при пострегистрационном применении, особенно у пациентов с сахарным диабетом типа 1, кетоацидоз не был своевременно диагностирован, и лечение было начато с опозданием, поскольку концентрация глюкозы в крови была ниже типичной для кетоацидоза (часто ниже 13,9 ммоль/л). Первые признаки и симптомы кетоацидоза соответствовали дегидратации и тяжелому метаболическому ацидозу — тошнота, рвота, боль в животе, общее плохое самочувствие и одышка. Во многих, но не во всех случаях были выявлены предрасполагающие факторы — снижение дозы инсулина, острое заболевание с лихорадкой, снижение калорийности рациона из-за заболевания или хирургического вмешательства, недостаточная секреция инсулина из-за заболевания поджелудочной железы (сахарный диабет типа 1, панкреатит в анамнезе или хирургическое вмешательство на поджелудочной железе) или злоупотребление алкоголем. Перед началом применения препарата Сигдуо Лонг® необходимо оценить факторы риска кетоацидоза, в т.ч. недостаточную выработку инсулина поджелудочной железой, вызванную различными причинами, снижение калорийности рациона и злоупотребление алкоголем. При наблюдении за пациентами, принимающими препарат Сигдуо Лонг®, следует помнить о возможности развития кетоацидоза и необходимости временного прекращения терапии при клинических ситуациях, предрасполагающих к развитию кетоацидоза (таких как длительное голодание из-за острого заболевания или хирургического вмешательства).
Нарушение функции почек и острая почечная недостаточность
Дапаглифлозин способствует уменьшению ОЦК и может вызвать нарушение функции почек (см. «Побочные действия»). При пострегистрационном применении дапаглифлозина были отмечены случаи острой почечной недостаточности (в т.ч. у пациентов в возрасте до 65 лет), в некоторых случаях потребовавшие госпитализации и диализа. До назначения препарата Сигдуо Лонг® следует оценить возможные факторы риска развития острой почечной недостаточности, такие как гиповолемия, ХПН, ХСН и прием сопутствующих препаратов (диуретики, ингибиторы АПФ, АРА II, НПВП). При ограничении приема пищи и жидкости (например, при остром заболевании или голодании), потере жидкости (например, при заболевании ЖКТ или воздействии высоких температур) следует предусмотреть временное прекращение терапии препаратом Сигдуо Лонг® и наблюдение за пациентом для выявления возможных симптомов острой почечной недостаточности.
При развитии острой почечной недостаточности следует немедленно отменить препарат Сигдуо Лонг® и начать соответствующее лечение. На фоне приема дапаглифлозина были отмечены случаи повышения концентрации креатинина в сыворотке крови и снижения рСКФ, особенно у пациентов пожилого возраста и пациентов с нарушением функции почек. После начала терапии препаратом Сигдуо Лонг® могут возникнуть нежелательные реакции, связанные с нарушением функции почек (см. «Побочные действия»). Функцию почек следует оценить до начала приема препарата Сигдуо Лонг® и периодически — на фоне терапии.
Препарат Сигдуо Лонг® противопоказан пациентам с рСКФ <60мл/мин/1,73 м2 (см. «Противопоказания» и «Способ применения и дозы»).
Уросепсис и пиелонефрит
При пострегистрационном применении ингибиторов SGLT2, в т.ч. дапаглифлозина, были отмечены случаи тяжелых инфекций мочевыводящих путей, включая пиелонефрит и уросепсис, которые потребовали госпитализации. Терапия ингибиторами SGLT2 увеличивает риск развития инфекций мочевыводящих путей. Следует наблюдать за пациентами для выявления возможных симптомов инфекции мочевыводящих путей и при необходимости незамедлительно начинать лечение (см. «Побочные действия»).
Концентрация витамина В12
В контролируемых клинических исследованиях метформина длительностью 29 нед примерно у 7% пациентов наблюдалось снижение в сыворотке крови ранее нормальной концентрации витамина В12 до субнормальных значений без клинических проявлений. Однако такое снижение очень редко сопровождается развитием анемии, и концентрация быстро восстанавливается после отмены метформина или дополнительного приема витамина В12. Пациентам, получающим препарат Сигдуо Лонг®, следует ежегодно оценивать гематологические параметры и при выявлении изменений проводить соответствующее обследование и лечение (см. «Побочные действия»). У некоторых пациентов (например, в случае недостаточного поступления с пищей или нарушения всасывания витамина В12 и кальция) существует предрасположенность к снижению концентрации витамина В12 до субнормальных значений. У таких пациентов может быть целесообразным определение концентрации витамина В12 в сыворотке крови каждые 2–3 года терапии.
Грибковые генитальные инфекции
У пациентов, получающих дапаглифлозин, может повышаться риск развития грибковых генитальных инфекций. Риск развития генитальных инфекций выше у пациентов, у которых до начала приема препарата отмечались эпизоды аналогичной инфекции (см. «Побочные действия»). Следует контролировать состояние пациентов для выявления возможных симптомов и проводить соответствующее лечение в случае такой инфекции.
Повышение концентрации Хс-ЛПНП
У пациентов, получающих дапаглифлозин, может повышаться концентрация Хс-ЛПНП в сыворотке. На фоне терапии препаратом Сигдуо Лонг® следует контролировать концентрацию Хс-ЛПНП и при необходимости назначать лечение в соответствии с принятой практикой.
Рак мочевого пузыря
В 22 клинических исследованиях рак мочевого пузыря был диагностирован у 10 из 6045 пациентов (0,17%) из группы дапаглифлозина и у 1 из 3512 пациентов (0,03%) из группы плацебо/препарата сравнения. После исключения из анализа пациентов, принимавших препарат менее 1 года на момент диагностики рака мочевого пузыря, в группе дапаглифлозина было 4 случая рака мочевого пузыря, а в группе плацебо/препарата сравнения случаев рака не было.
На момент начала исследования группы были сбалансированы в отношении факторов риска развития рака мочевого пузыря и гематурии (потенциальный индикатор недиагностированной опухоли). Малое количество случаев не позволяет сделать вывод о причинно-следственной связи с приемом дапаглифлозина. Тем не менее препарат Сигдуо Лонг® не следует назначать пациентам с раком мочевого пузыря. Нет данных, позволяющих оценить возможное влияние дапаглифлозина на уже имеющуюся опухоль мочевого пузыря. У пациентов с раком мочевого пузыря в анамнезе перед назначением препарата Сигдуо Лонг® следует оценить пользу от контроля гликемии и возможный неуточненный риск рецидива рака мочевого пузыря.
Макроваскулярные осложнения
Исследования, убедительно показывающие снижение риска развития макроваскулярных осложнений при применении препарата Сигдуо Лонг®, не проводились.
Влияние на способность к управлению транспортными средствами и механизмами. Исследований по изучению влияния препарата Сигдуо Лонг® на способность к управлению транспортными средствами и механизмами не проводилось.
Форма выпуска
Таблетки с модифицированным высвобождением, покрытые пленочной оболочкой, 5+1000 мг, 10+1000 мг.
Таблетки, 5+1000 мг: по 6 табл. в блистере из фольги алюминиевой. По 10 бл. помещают в картонную пачку с контролем первого вскрытия.
Таблетки, 10+1000 мг: по 6 табл. в блистере из фольги алюминиевой. По 5 бл. помещают в картонную пачку с контролем первого вскрытия.
Производитель
Производитель, фасовщик (первичная упаковка), упаковщик (вторичная (потребительская) упаковка), выпускающий контроль качества АстраЗенека Фармасьютикалс ЛП, США 4601 Хайуэй 62 Ист, Маунт Вернон, Индиана, 47620, США AstraZeneca Pharmaceuticals LP, USA 4601 Highway 62 East, Mount Vernon, Indiana, 47620, USA.
Наименование, адрес организации, уполномоченной держателем или владельцем регистрационного удостоверения лекарственного препарата для медицинского применения на принятие претензий от потребителя: представительство АстраЗенека ЮК Лимитед, Великобритания, в Москве и ООО АстраЗенека Фармасьютикалз.
Наименование и юридический адрес держателя (владельца) регистрационного удостоверения: АстраЗенека АБ, SE-151 85 Содерталье, Швеция, AstraZeneca АВ, SE-151 85 Sodertalje, Sweden.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 30 °C.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Таблетки 5 мг + 1000 мг — 1 таб. :
- Cлой метформина пролонгированного действия: метформинагидрохлорид в смеси с магния стеаратом — 1005. 04 мг, в т. ч. метформина гидрохлорид — 1000 мг; магния стеарат — 5. 04 мг;
- Вспомогательные вещества: кармеллоза натрия — 49. 99 мг,гипромеллоза 2208 — 234. 98 мг, кремния диоксид — 13 мг, магниястеарат — 1. 99 мг;
- Cлой дапаглифлозина: дапаглифлозина пропандиола моногидрат -6. 15 мг, в пересчете на дапаглифлозин — 5 мг;
- Вспомогательные вещества: целлюлоза микрокристаллическая PH302- 226. 35 мг, лактоза — 48 мг, кросповидон — 12 мг, кремния диоксид- 4. 5 мг, магния стеарат — 3 мг;
- Состав пленочной оболочки: Опадрай® II розовый 85F94592 — 40. 13мг.
6 шт. — блистеры из фольги алюминиевой (10) — пачки картонные сконтролем первого вскрытия.
Таблетки с модифицированным высвобождением, покрытые пленочнойоболочкой, 5 мг + 1000 мг от розового до темно-розового цвета,овальные, двояковыпуклые, с гравировкой 1071 и 5/1000 на однойстороне.
Механизм действия
Препарат Сигдуо Лонг* объединяет два гипогликемических препаратас дополняющими механизмами действия для улучшения гликемическогоконтроля у пациентов с сахарным диабетом 2 типа (СД 2):дапаглифлозин, селективный обратимый ингибитор натрийзависимогопереносчика глюкозы 2 типа (SGLT2), и метформин, представителькласса бигуанидов
Дапаглифлозин
SGLT2 экспрессируется в проксимальных почечных канальцах иявляется основным переносчиком, участвующим в процессе реабсорбцииглюкозы. Ингибируя SGLT2, дапаглифлозин уменьшает реабсорбциюглюкозы и снижает почечный порог для глюкозы, что приводит кповышению ее выведения почками.
Метформин
Метформин улучшает толерантность к глюкозе у пациентов с СД 2,снижая концентрацию глюкозы плазмы натощак и постпрандиальнуюконцентрацию глюкозы. Метформин уменьшает продукцию глюкозыпеченью, снижает всасывание глюкозы в кишечнике и повышаетчувствительность к инсулину, увеличивая периферическое поглощение иутилизацию глюкозы. Метформин не вызывает гипогликемию у пациентовс СД 2 или здоровых людей (кроме особых ситуаций), игиперинсулинемию. Во время терапии метформином секреция инсулина неменяется, хотя концентрации инсулина натощак и в ответ на приемпищи в течение дня могут снижаться
Фармакодинамика
Дапаглифлозин
После приема дапаглифлозина здоровыми добровольцами и пациентамис СД 2 наблюдалось увеличение количества выводимой почками глюкозы. При приеме дапаглифлозина в дозе 5 мг/сут или 10 мг/сут в течение12 недель пациентами с СД 2 в сутки почками выводилось примерно 70г глюкозы. При приеме дапаглифлозина в дозе 20 мг/сут выведениеглюкозы практически достигало максимума. Выведение глюкозы почкамипри применении дапаглифлозина также приводит к увеличению объемамочи.
Клиническая эффективность
Стартовая комбинированная терапия с метформиномпролонгированного действия
Безопасность и эффективность стартовой комбинированной терапиидапаглифлозином и метформином пролонгированного действия изучалисьв 2 контролируемых исследованиях продолжительностью 24 недели упациентов с СД 2 и неадекватным контролем гликемии, ранее неполучавших гипогликемической терапии.
Применение дапаглифлозина и метформина пролонгированногодействия (суточная доза 2 г) обеспечивало значимое снижениеконцентрации гликозилированного гемоглобина (HbA1c) и концентрацииглюкозы в плазме крови натощак (ГПН) по сравнению с монотерапиейметформином или дапаглифлозином. Также комбинированная терапиядапаглифлозином и метформином пролонгированного действия обеспечилазначимое снижение массы тела по сравнению с монотерапиейметформином пролонгированного действия.
Добавление дапаглифлозина к терапии метформином обычноговысвобождения
Безопасность и эффективность добавления дапаглифлозина к терапииметформином обычного высвобождения изучались в контролируемомисследовании продолжительностью 24 недели у пациентов с СД 2 инеадекватным контролем гликемии. Добавление дапаглифлозина в дозе10 мг к терапии метформином приводило к значимому снижениюконцентрации HbA1c и концентрации ГПН, а также к уменьшению массытела по сравнению с плацебо на 24 неделе лечения. Также отмеченостатистически значимое (р
Добавление дапаглифлозина или глипизида к терапии метформиномобычного высвобождения
Безопасность и эффективность добавления дапаглифлозина к терапииметформином обычного высвобождения по сравнению с глипизидомизучались в контролируемом исследовании продолжительностью 52недели у пациентов с СД 2 и неадекватным контролем гликемии.
Дапаглифлозин не менее эффективно, чем глипизид, снижал среднеезначение концентрации HbA1c к 52 неделе лечения. В группедапаглифлозина было отмечено значимое снижение среднего значениямассы тела к 52 неделе лечения, в то время как в группе глипизиданаблюдалось увеличение этого показателя. В группе дапаглифлозина посравнению с группой глипизида было достигнуто статистическизначимое (р
Препарат Сигдуо Лонг® биоэквивалентен дапаглифлозину (препаратФорсига) и метформину пролонгированного действия (препаратГлюкофаж® Лонг) при их совместном применении в соответствующихдозах.
Показатели экспозиции дапаглифлозина и метформинапролонгированного действия после приема препарата Сигдуо Лонг®здоровыми добровольцами были сопоставимы после стандартного приемапищи и натощак. В случае приема препарата Сигдуо Лонг® послестандартного приема пищи было отмечено снижение Cmax дапаглифлозинана 35% и увеличение времени ее достижения (Тmах) на 1-2 ч посравнению с приемом препарата натощак. Это различие не являетсяклинически значимым. Прием пищи не оказывал значимого влияния нафармакокинетические параметры метформина.
Всасывание
Дапаглифлозин. После приема дапаглифлозина внутрь натощак Сmахобычно достигается в течение 2 ч. Значения Сmах и AUC увеличиваютсяпропорционально дозе дапаглифлозина в диапазоне терапевтическихдоз. Абсолютная биодоступность дапаглифлозина при приеме внутрь вдозе 10 мг составляет 78%. Прием пищи оказывал умеренное влияние нафармакокинетику дапаглифлозина у здоровых добровольцев. Прием пищис высоким содержанием жиров снижал Сmах дапаглифлозина на 50%,удлинял Тmах примерно на 1 ч, но не влиял на AUC по сравнению сприемом натощак. Эти изменения не являются клинически значимыми,поэтому дапаглифлозин можно принимать независимо от приемапищи.
Метформин. После приема внутрь метформина пролонгированногодействия Сmах достигается через 4-8 ч (медиана 7 ч). Степеньабсорбции метформина из таблеток пролонгированного действияувеличивается примерно на 50% (оценивалось по изменению AUC) приприеме во время еды. Прием пищи не влиял на Тmах и Сmах.
Распределение
Дапаглифлозин. Связывание дапаглифлозина с белками составляетпримерно 91%. У пациентов с нарушениями функции почек или печениэтот показатель не изменялся.
Метформин. Не проводились исследования распределения метформинапролонгированного действия, однако кажущийся Vd метформина послеоднократного приема внутрь таблеток метформина обычноговысвобождения в дозе 850 мг, в среднем, составил 654±358 л. Метформин в незначительной степени связывается с белками плазмыкрови. Метформин проникает в эритроциты.
Метаболизм
Дапаглифлозин. Метаболизм дапаглифлозина, главным образом,происходит под действием ферментауридиндифосфат-глюкуронилтрансферазы 1А9 (UGT1A9); изоферментыцитохрома CYP вовлечены в метаболизм у человека в меньшей степени. Дапаглифлозин метаболизируется с образованием, главным образом,неактивного метаболита дапаглифлозин-3-О-глюкуронида. После приемавнутрь 50 мг 14С-дапаглифлозина 61% принятой дозы метаболизируетсяв дапаглифлозин-3-О-глюкуронид.
Метформин. Исследования с однократным в/в введением препаратаздоровым добровольцам показывают, что метформин выводится внеизмененном виде почками, не подвергается метаболизму в печени (учеловека не выявлены метаболиты) и не выводится через кишечник. Исследования по изучению метаболизма метформина в таблеткахпролонгированного действия не проводились.
Выведение
Дапаглифлозин. Дапаглифлозин и его метаболиты выводятся,преимущественно, почками, и только менее 2% выводится внеизмененном виде. После приема 50 мг 14С-дапаглифлозина былообнаружено 96% радиоактивности — 75% в моче и 21% — в кале. Примерно 15% радиоактивности, обнаруженной в кале, приходилось нанеизмененный дапаглифлозин. T1/2 из плазмы после однократногоприема дапаглифлозина в дозе 10 мг составляет примерно 12. 9 ч.
Метформин. Почечный клиренс примерно в 3. 5 раза выше КК, чтоуказывает на то, что канальцевая секреция является основным путемвыведения метформина. После приема внутрь примерно 90%абсорбированного препарата выводится почками в течение первых 24 ч,при этом T1/2 из плазмы равен примерно 6. 2 ч. В крови T1/2составляет примерно 17. 6 ч, следовательно, эритроцитарная массаможет быть частью распределения.
Фармакокинетика у особых групп пациентов
Нарушение функции почек
Дапаглифлозин. В равновесном состоянии (прием дапаглифлозина 1раз/сут в дозе 20 мг в течение 7 дней) у пациентов с СД 2 инарушением функции почек легкой, средней или тяжелой степени(определяемой по расчетной СКФ (рСКФ)) геометрическая средняясистемной экспозиции была на 45%, в 2. 04 и 3. 03 раза выше, чем упациентов с СД 2 и нормальной функцией почек соответственно. Повышение системной экспозиции дапаглифлозина у пациентов с СД 2 инарушением функции почек не сопровождалось соответствующимувеличением количества глюкозы, выводимой почками в течениесуток.
Суточная экскреция глюкозы почками в равновесном состоянии упациентов с СД 2 и нарушением функции почек легкой, средней илитяжелой степени была, соответственно, на 42%, 80% и 90% ниже, посравнению с пациентами с СД 2 и нормальной функцией почек. Неизвестно, оказывает ли гемодиализ влияние на экспозициюдапаглифлозина.
Метформин. У пациентов с нарушением функции почек (порезультатам измерений КК) T1/2 метформина из плазмы и кровиудлиняется, и почечный клиренс снижается.
Нарушение функции печени
Дапаглифлозин. У пациентов с нарушением функции печени легкойили средней степени тяжести (классы А и В по Чайлд-Пью) средниезначения Сmах и AUC дапаглифлозина после однократного приема в дозе10 мг были, соответственно, на 12% и 36% выше по сравнению саналогичными показателями у здоровых добровольцев. Данные различияне являются клинически значимыми. У пациентов с нарушением функциипечени тяжелой степени (класс С по Чайлд-Пью) средние значения Сmахи AUC дапаглифлозина были на 40% и 67% выше, соответственно, посравнению со здоровыми добровольцами.
Метформин. Фармакокинетические исследования метформина упациентов с нарушением функции печени не проводились.
Пожилой возраст
Дапаглифлозин. По результатам популяционногофармакокинетического анализа, возраст не оказывает клиническизначимого влияния на системную экспозицию дапаглифлозина. поэтомукоррекция дозы в зависимости от возраста пациента не требуется.
Метформин. Ограниченные данные контролируемых исследованийфармакокинетики метформина у здоровых добровольцев пожилоговозраста позволяют предположить, что общий плазменный клиренсметформина понижается, T1/2 увеличивается, а Сmах повышается посравнению со значениями этих параметров у здоровых добровольцевмолодого возраста. По этим данным, изменение параметровфармакокинетики метформина с увеличением возраста, в основном,обусловлено изменением функции почек.
Дети
Не проводились исследования фармакокинетики препарата СигдуоЛонг® у детей.
Пол
Дапаглифлозин. По результатам популяционногофармакокинетического анализа, пол не оказывает клинически значимоговлияния на системную экспозицию дапаглифлозина, поэтому коррекциядозы в зависимости от пола пациента не рекомендуется.
Метформин. Фармакокинетические параметры метформина у здоровыхдобровольцев и пациентов с СД 2 существенно не различались взависимости от пола. В контролируемых клинических исследованиях упациентов с СД 2 гипогликемический эффект метформина у мужчин иженщин был сопоставим.
Расовая и этническая принадлежность
Дапаглифлозин. По результатам популяционногофармакокинетического анализа, клинически значимых различийсистемной экспозиции у представителей европеоидной, негроидной имонголоидной рас не выявлено; коррекция дозы с учетом расовойпринадлежности не требуется.
Метформин. Не проводились исследования параметровфармакокинетики метформина в зависимости от расовой принадлежностипациента. В клинических исследованиях у пациентов с СД 2гипогликемический эффект метформина у представителей европеоидной,негроидной рас и пациентов испанского происхождения былсопоставим.
Масса тела
Дапаглифлозин. По результатам популяционногофармакокинетического анализа, масса тела не оказывает клиническизначимого влияния на системную экспозицию дапаглифлозина, поэтомукоррекция дозы в зависимости от массы тела пациента нетребуется.
Cахарный диабет 2 типа в дополнение к диете и физическимупражнениям для улучшения гликемического контроля у взрослыхпациентов, для которых целесообразна комбинированная терапиядапаглифлозином и метформином.
Внутрь, 1 раз/сут во время завтрака. Таблетки следуетпроглатывать целиком, не разжевывая, не измельчая и неразламывая.
Дозу следует подбирать индивидуально, учитывая эффективность ипереносимость проводимой терапии. При необходимости дозу повышаютпостепенно, чтобы уменьшить риск побочных эффектов метформина состороны ЖКТ.
Максимальная суточная доза дапаглифлозина составляет 10 мг,метформина пролонгированного действия — 2 г.
Если препарат Сигдуо Лонг® был назначен пациенту, принимающемуметформин пролонгированного действия в вечернее время, следуетпропустить прием последней вечерней дозы метформинапролонгированного действия накануне приема первой дозы препаратаСигдуо Лонг®.
Пациентам со сниженным ОЦК необходима коррекция этого состояниядо начала терапии препаратом Сигдуо Лонг®.
Неактивные ингредиенты препарата Сигдуо Лонг® могут выводитьсячерез кишечник в виде мягкой, влажной массы, которая можетсохранять форму принятой таблетки.
Применение у особых групп пациентов
Нарушение функции печени. У пациентов с нарушением функциипечени применение метформина может приводить к лактоацидозу. Поэтому препарат Сигдуо Лонг® противопоказан пациентам с нарушениемфункции печени.
Нарушение функции почек. До начала терапии препаратом СигдуоЛонг® и периодически на фоне терапии следует оценивать функциюпочек. Препарат Сигдуо Лонг® противопоказан пациентам с нарушениемфункции почек от средней до тяжелой степени (рСКФ
При нарушении функции почек легкой степени (рСКФ>=60 мл/мин/1. 73м2) нет необходимости корректировать дозу препарата.
Дети. Безопасность и эффективность дапаглифлозина у пациентовмладше 18 лет не изучались.
Пожилой возраст. У пациентов пожилого возраста нет необходимостикорректировать дозу препарата. Однако при выборе дозы следуетучитывать, что у этой категории пациентов более вероятны нарушениефункции почек и риск снижения ОЦК. Рекомендуется более частыйконтроль состояния функции почек у пациентов пожилого возраста. Поскольку клинический опыт применения дапаглифлозина у пациентов 75лет и старше ограничен, противопоказано начинать терапиюдапаглифлозином в данной возрастной группе.
Применение препарата Сигдуо Лонг®, а также его действующихвеществ, дапаглифлозина и метформина, в период беременности неизучено, поэтому препарат противопоказан во время беременности. Вслучае диагностирования беременности терапия препаратом СигдуоЛонг® должна быть прекращена.
Неизвестно, проникает ли дапаглифлозин, метформин и/или ихметаболиты в грудное молоко человека. Нельзя исключить риск дляноворожденных/младенцев. Препарат Сигдуо Лонг® противопоказан впериод грудного вскармливания.
- повышенная индивидуальная чувствительность к любому компонентупрепарата;
- сахарный диабет 1 типа;
- нарушение функции почек от средней до тяжелой степени тяжести(рСКФ
- нарушение функции печени;
- острые заболевания, при которых имеется риск развития нарушенияфункции почек: дегидратация (при рвоте, диарее), лихорадка, тяжелыеинфекционные заболевания, состояния гипоксии (шок, сепсис, инфекциипочек, бронхолегочные заболевания);
- острый или хронический метаболический ацидоз, включаядиабетический кетоацидоз, с комой или без комы (в случаедиабетического кетоацидоза следует применять препаратыинсулина);
- линически выраженные проявления острых и хроническихзаболеваний, которые могут привести к развитию тканевой гипоксии(дыхательная недостаточность, сердечная недостаточность, острыйинфаркт миокарда);
- серьезные хирургические операции и травмы (когда показанопроведение инсулинотерапии);
- хронический алкоголизм и острое отравление этанолом;
- лактоацидоз (в т. ч. в анамнезе);
- период не менее 48 ч до и в течение 48 ч после проведениярадиоизотопных или рентгенологических исследований с введениемйодсодержащих контрастных средств;
- детский возраст до 18 лет (безопасность и эффективность неизучены);
- пациенты, принимающие петлевые диуретики или со сниженнымОЦК, например, вследствие острых заболеваний (таких какжелудочно-кишечные заболевания);
- пожилые пациенты в возрасте 75 лет и старше (для начала терапиидапаглифлозином);
- соблюдение гипокалорийной диеты (
- наследственная непереносимость лактозы, недостаточность лактазыи глюкозо-галактозная непереносимость;
- беременность;
- период грудного вскармливания.
С осторожностью: инфекции мочевыводящих путей; риск сниженияОЦК; пожилые пациенты; повышенное значение гематокрита; пациенты ввозрасте старше 60 лет, выполняющие тяжелую физическую работу.
Дапаглифлозии и метформин
Оценка безопасности проводилась на основании объединенных данных8 краткосрочных плацебо-контролируемых исследований, в которыхдапаглифлозии применялся в комбинации с метформином (в даннойкомбинации и в дополнение к другой гипогликемической терапии). Вэтих исследованиях 983 пациента получали дапаглифлозии в дозе 10 мг1 раз/сут и метформин, и 1185 пациентов получали плацебо иметформин.
Общая частота нежелательных явлений в группе дапаглифлозина вдозе 10 мг и метформина составила 60. 3% по сравнению с 58. 2% вгруппе плацебо и метформина. У 4% пациентов в группе дапаглифлозина10 мг и метформина терапия была отменена из-за нежелательныхреакций по сравнению с 3. 3% в группе плацебо и метформина. Наиболеечастыми нежелательными явлениями, приводившими к отмене терапии иотмеченными, как минимум, у 3 пациентов в группе дапаглифлозина 10мг и метформина, были нарушение функции почек (0. 7%), повышениеконцентрации креатинина в сыворотке крови (0. 2%), уменьшение КК(0,2%) и инфекции мочевыводящих путей (0. 2%).
Нежелательные реакции по данным 8 краткосрочныхплацебо-контролируемых исследований, вне зависимости от оценкиисследователем причинно- следственной связи, которые были отмечены,как минимум, у 2% пациентов, принимавших дапаглифлозии и метформин,и, как минимум, на 1% чаще по сравнению с пациентами, получавшимиметформин и плацебо.
Метформин
В плацебо-контролируемых исследованиях метформинапролонгированного действия в качестве монотерапии диарея итошнота/рвота отмечались более чем у 5% пациентов и чаще, чем вгруппе плацебо (диарея у 9. 6% и 2. 6% пациентов, тошнота/рвота у6. 5% и 1. 5% пациентов соответственно). У 0. 6% пациентов, получавшихметформин пролонгированного действия, диарея привела к прекращениютерапии
Объединенные данные 12 плацебо-контролируемых исследованийдапаглифлозина 5 мг и 10 мг
Дапаглифлозин. В 4 исследованиях дапаглифлозин применялся вкачестве монотерапии, а в 8 исследованиях — в качестве дополнения кбазовой сахароснижающей терапии или в комбинации с метформином. Вэтих исследованиях 2338 пациентов получали дапаглифлозин, всреднем, в течение 21 недели. 1393 пациента получали плацебо, 1145пациентов — дапаглифлозин 5 мг, 1193 пациента — дапаглифлозин 10 мг1 раз/сут.
Объединенные данные 13 плацебо-контролируемых исследованийдапаглифлозина 10мг
Оценка безопасности и переносимости дапаглифлозина 10 мгпроводилась на основании объединенных данных 13плацебо-контролируемых исследований: в 3 исследованияхдапаглифлозин изучался в режиме монотерапии, в 9 исследованиях — вкачестве дополнительной терапии к проводимой сахароснижающейтерапии, и в 1 исследовании в стартовой комбинации с метформином. Вэтих исследованиях 2360 пациентов получали дапаглифлозин в дозе 10мг в среднем в течение 22 недель.
Описание отдельных нежелательных реакций
Снижение ОЦК
апаглифлозин вызывает осмотический диурез, который можетприводить к снижению ОЦК. Нежелательные реакции, связанные соснижением ОЦК (включая сообщения об обезвоживании, гиповолемии,ортостатической гипотензии и артериальной гипотензии).
На фоне применения дапаглифлозина отмечалось повышениеконцентрации креатинина в сыворотке крови и снижение рСКФ. Упациентов с нормальной функцией почек или нарушением функции почеклегкой степени при включении в исследование концентрация креатининаи рСКФ возвращались к исходному значению на 24 неделе.
Нежелательные реакции, связанные с нарушением функции почек,включая почечную недостаточность и повышение концентрациикреатинина в сыворотке, чаще отмечались у пациентов, принимавшихдапаглифлозин. Эти нежелательные реакции чаще отмечались упациентов пожилого возраста и у пациентов с нарушением функциипочек. Стойкое снижение рСКФ наблюдалось у пациентов с нарушениемфункции почек средней степени тяжести (60>СКФ>=30 мл/мин/1. 73м2).
В исследовании с участием пациентов с нарушением функции почексредней степени тяжести (60>рСКФ>=30 мл/мин/1. 73 м2)продолжительностью до 104 недель у 13 пациентов были отмеченыпереломы костей (5 случаев в группе дапаглифлозина 5 мг; 8 случаевв группе дапаглифлозина 10 мг; в группе плацебо переломов незарегистрировано). В 11 из 13 случаев переломы произошли в первые52 недели лечения, в 8 из 13 случаев — у пациентов с исходнымзначением рСКФ от 30 до 45 мл/мин/1,73 м2. Закономерности вотношении локализации переломов отмечено не было.
Гипогликемия
В плацебо-контролируемых исследованиях добавления дапаглифлозинак терапии метформином продолжительностью 24 недели тяжелых эпизодовгипогликемии отмечено не было; легкие эпизоды гипогликемии отмеченыу 1,5% пациентов в группе дапаглифлозина 5 мг, 0. 7% пациентов вгруппе дапаглифлозина 10 мг, в группе плацебо эпизодов гипогликемиине было.
В исследовании добавления дапаглифлозина к терапии метформиномпо сравнению с глипизидом продолжительностью 52 недели в группедапаглифлозина не было отмечено тяжелых эпизодов гипогликемии, вгруппе глипизида такие эпизоды были отмечены у 0. 7% пациентов:легкие эпизоды гипогликемии отмечены у 1. 7% пациентов в группедапаглифлозина 10 мг и у 36% пациентов в группе глипизида.
Грибковые генитальные инфекции
Грибковые генитальные инфекции чаще отмечались в группедапаглифлозина. Грибковые генитальные инфекции были отмечены у0. 9%, 5. 7% и 4. 8% пациентов, принимавших плацебо, дапаглифлозин 5мг и дапаглифлозин 10 мг соответственно (объединенные данные 12плацебо-контролируемых исследований дапаглифлозина 5 мг и 10 мг). У0. 2% пациентов в группе дапаглифлозина 10 мг из-за генитальнойинфекции препарат был отменен (в группе плацебо случаев отменытерапии из-за аналогичной нежелательной реакции не было). Грибковыегенитальные инфекции чаще отмечались у женщин, а также у пациентов,у которых до начала приема препарата отмечались эпизоды аналогичнойинфекции (10. 0%, 23. 1% и 25. 0% по сравнению с 0. 8%, 5. 9% и 5. 0% вгруппах плацебо, дапаглифлозина 5 мг, дапаглифлозина 10 мгсоответственно). Наиболее частыми у женщин были вульвовагинальныегрибковые инфекции, а у мужчин — баланит.
Реакции гиперчувствительности
На фоне приема дапаглифлозина сообщалось о реакцияхгиперчувствительности (таких как ангионевротический отек,крапивница, гиперчувствительность). В рамках программы клиническихисследований серьезные анафилактические реакции, тяжелые кожныереакции и ангионевротический отек отмечены у 0. 3% пациентов,получавших дапаглифлозин, и у 0. 2% пациентов в группе сравнения. При возникновении реакций гиперчувствительности следует отменитьдапаглифлозин, проводить лечение в соответствии с принятойпрактикой и наблюдение за пациентом до полного разрешениясимптомов.
Результаты лабораторных исследований
Увеличение гематокрита
Дапаглифлозин. Увеличение гематокрита у пациентов, получавшихдапаглифлозин, отмечалось с 1 по 16 недели лечения (объединенныеданные 13 плацебо-контролируемых исследований дапаглифлозина 10мг). Максимальное увеличение гематокрита, по сравнению с исходнымизначениями, наблюдалось на 16 неделе. На 24 неделе среднееизменение гематокрита по сравнению с исходным значением составило-0. 33% в группе плацебо и 2. 3% в группе дапаглифлозина 10 мг. К 24неделе повышенное значение гематокрита >55% былозарегистрировано у 0. 4% пациентов в группе плацебо и 1. 3% пациентовв группе дапаглифлозина 10 мг
Повышение концентрации неорганического фосфора в сывороткекрови.
Дапаглифлозин. Повышение концентрации неорганического фосфора всыворотке крови по сравнению с исходной отмечалось на 24 неделе упациентов, получавших дапаглифлозин 10 мг, по сравнению с группойплацебо (среднее повышение составило 0. 13 мг/дл и -0. 04 мг/дл,соответственно) (объединенные данные 13 плацебо-контролируемыхисследований дапаглифлозина 10 мг). Гиперфосфатемия (концентрациянеорганического фосфора в сыворотке >=5. 6 мг/дл для пациентов 17-65лет и >=5. 1 мг/дл для пациентов в возрасте >=66 лет) также чащеотмечалась в группе дапаглифлозина 10 мг по сравнению с группойплацебо на 24 неделе (1. 7% и 0. 9% пациентов соответственно).
Повышение концентрации холестерина ЛПНП.
Дапаглифлозин. Изменение концентрации липидов в сыворотке кровиотмечено у пациентов, получавших дапаглифлозин, по сравнению сгруппой плацебо (объединенные данные 13 плацебо- контролируемыхисследований дапаглифлозина 10 мг). Среднее процентное увеличениеконцентрации общего холестерина в сыворотке крови на 24 неделесоставило 2. 5% и 0. 0% в группе дапаглифозина 10 мг и плацебо,соответственно, а холестерина ЛПНП 2. 9% в группе дапаглифлозина 10мг по сравнению с -1. 0% в группе плацебо.
Концентрация витамина В12.
Метформин. На фоне приема метформина может снизитьсяконцентрация витамина В12 в сыворотке. Пациентам, получающимпрепарат Сигдуо Лонг®, следует ежегодно оценивать гематологическиепараметры, и при выявлении изменений проводить соответствующееобследование и лечение.
Опыт пострегистрационного применения
Дапаглифлозин
При пострегистрационном применении были отмечены следующиенежелательные реакции: неуточненнной частоты — сыпь.
Достоверно оценить причинно-следственную связь и частотунежелательных реакций не представляется возможным, посколькусведения были получены в виде спонтанных сообщений, а размерпопуляции пациентов точно не был определен.
Дапаглифлозин
В рамках программы клинических исследований дапаглифлозинаслучаев передозировки отмечено не было. В случае передозировкинеобходимо проводить поддерживающую терапию, учитывая состояниепациента. Выведение дапаглифлозина с помощью гемодиализа неизучалось.
Метформин
Зарегистрированы случаи передозировки метформина, в т. ч. приприеме более 50 г. Примерно в 10% случаев развивалась гипогликемия,но ее причинная связь с приемом метформина не установлена. Примернов 32% случаев передозировки метформина у пациентов наблюдалсялактоацидоз. Метформин выводится при диализе, при этом клиренсдостигает 170 мл/мин. Поэтому при предполагаемой передозировкепрепарата, содержащего метформин, целесообразен гемодиализ.
Фармакокинетические исследования взаимодействия препарата СигдуоЛонг® не проводились, однако такие исследования были проведены длядапаглифлозина и метформина, входящих в состав препарата СигдуоЛонг®.
Дапаглифлозин
В ходе исследований in vitro дапаглифлозин идапаглифлозин-3-О-глюкуронид не ингибировали изоферменты системыцитохрома Р450 CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4 и неиндуцировали изоферменты CYP1A2, CYP2B6 или CYP3A4. Дапаглифлозинявляется слабым субстратом гликопротеина Р (P-gp), адапаглифлозин-3-О- глюкуронид — субстратом активного транспортераОАТ3. Дапаглифлозин и дапаглифлозин-3-О-глюкуронид значимо неингибируют активные транспортеры P-gp, ОСТ2, ОАТ1 и ОАТ3. В целом,не ожидается влияния дапаглифлозина на фармакокинетику препаратов,которые являются субстратами P-gp, ОСТ2, ОАТ1 и ОАТ3, при иходновременном применении.
Влияние других лекарственных препаратов на дапаглифлозин
Исследования взаимодействия, в основном, с приемом однократнойдозы препарата, показали, что метформин, пиоглитазон, ситаглиптин,глимепирид, воглибоза, гидрохлоротиазид, буметанид, валсартан илисимвастатин не оказывают влияния на фармакокинетикудапаглифлозина.
После совместного применения дапаглифлозина и рифампицина,индуктора различных активных транспортеров и ферментов, участвующихв метаболизме лекарственных препаратов, отмечено снижение системнойэкспозиции (AUC) дапаглифлозина на 22% без клинически значимоговлияния на количество глюкозы, выводимой почками в течение суток. Не рекомендуется корректировать дозу препарата.
После совместного применения дапаглифлозина и мефенамовойкислоты (ингибитора UGT1A9) отмечено увеличение на 51% системнойэкспозиции дапаглифлозина без клинически значимого влияния наколичество глюкозы, выводимой почками в течение суток. Нерекомендуется корректировать дозу препарата.
Влияние дапаглифлозина на другие лекарственные препараты
В исследованиях взаимодействия с участием здоровых добровольцев,в основном, однократно принимавших дозу препарата, дапаглифлозин невлиял на фармакокинетические параметры метформина, пиоглитазона,ситаглиптина, глимепирида, гидрохлоротиазида, буметанида,валсартана, симвастатина, дигоксина или варфарина. Применениеоднократной дозы дапаглифлозина 20 мг и симвастатина приводило кповышению на 19% AUC симвастатина. Повышение экспозициисимвастатина и симвастатиновой кислоты не считается клиническизначимым.
Метформин
Влияние других лекарственных препаратов на метформин
Исследования взаимодействия с приемом однократной дозыпрепаратов показали, что глибенкламид, фуросемид, нифедипин,пропранолол, ибупрофен не оказывают влияния на фармакокинетикуметформина.
Ингибиторы карбоангидразы:топирамат и другие ингибиторыкарбоангидразы (такие как зонисамид, ацетазоламид или диклофенамид)часто вызывают снижение концентрации бикарбонатов в сыворотке кровии неанионный интервал, гиперхлоремический метаболический ацидоз. Совместное применение этих препаратов с препаратом Сигдуо Лонг®может повышать риск лактоацидоза. Такие пациенты нуждаются в болеечастом контроле.
Препараты, замедляющие выведение метформина: сопутствующееприменение препаратов, которые влияют на транспортные системыпочечных канальцев, участвующие в выведении метформина почками(ингибиторы ОСТ2 и МАТЕ, такие как ранолазин, вандетаниб,долутегравир и циметидин), может увеличивать системную экспозициюметформина и риск лактоацидоза. Необходимо оценить ожидаемую пользуи возможный риск совместного применения этих препаратов.
Влияние метформина на другие лекарственные препараты
Исследования взаимодействия с приемом однократной дозыпрепаратов показали, что метформин не оказывает влияния нафармакокинетику глибенкламида, фуросемида, нифедипина,пропранолола, ибупрофена и циметидина.
Лекарственные препараты, способные вызвать гипергликемию
Прием некоторых лекарственных препаратов, таких как диуретики (вт. ч. тиазидные), кортикостероиды, фенотиазины, гормоны щитовиднойжелезы, эстрогены, пероральные контрацептивы, фенитоин, никотиноваякислота, симпатомиметики, блокаторы кальциевых каналов и изониазид,может предрасполагать к развитию гипергликемии и ухудшениюгликемического контроля. При совместном применении данныхпрепаратов с препаратом Сигдуо Лонг® необходим тщательный контрольгликемии, а при их отмене — наблюдение за пациентом из-завозможности развития гипогликемии.
В исследованиях взаимодействия с участием здоровых добровольцевпри однократном приеме препаратов не отмечалось взаимодействияметформина и пропранолола, метформина и ибупрофена.
Применение препаратов, которые могут вызвать гипогликемию
Метформин. Гипогликемия не развивается у пациентов, принимающихтолько метформин в обычном режиме, но может развиться пригипокалорийной диете, или если активная физическая нагрузка некомпенсируется калорийностью рациона, или при совместном применениис другими гипогликемическими препаратами (такими как производныесульфонилмочевины и инсулин) или алкоголем. Пожилые, ослабленныеили плохо питающиеся пациенты и пациенты с недостаточностью функциинадпочечников или гипофиза или алкогольной интоксикацией наиболеечувствительны к гипогликемическим эффектам. У пожилых людей ипациентов, принимающих бета-адреноблокаторы, диагностикагипогликемии может быть затруднена.
Оценка теста на 1,5-ангидроглюцитол
Дапаглифлозин. У пациентов, получающих ингибиторы SGLT2, нерекомендуется использовать тест определения 1,5-ангидроглюцитоладля контроля гликемии. Следует использовать альтернативные методыконтроля.
Оценки результатов анализа мочи
Дапаглифлозин. Ингибиторы SGLT2 увеличивают выведение глюкозыпочками. Поэтому результаты определения глюкозы в моче у пациентов,принимающих препарат Сигдуо Лонг®, будут положительными. Следуетиспользовать альтернативные методы контроля.
Алкоголь
Алкоголь усиливает влияние метформина на метаболизм лактата. Пациентов следует информировать о недопустимости приема больших дозалкоголя на фоне терапии препаратом Сигдуо Лонг®.
Sigduo long®
Регистрационный номер
Торговое наименование
Сигдуо Лонг®
Международное непатентованное наименование
Лекарственная форма
таблетки с модифицированным высвобождением покрытые плёночной оболочкой
Состав
Одна таблетка с модифицированным высвобождением, покрытая плёночной оболочкой 5 мг + 1000 мг, содержит:
Слой метформина пролонгированного действия
Действующее вещество: метформина гидрохлорид в смеси с 0,5 % магния стеарата1 1005,4 мг (1000,00 мг метформина гидрохлорида + 5,04 мг магния стеарата)
Вспомогательные вещества: кармеллоза натрия 49,99 мг, гипромеллоза 2208 234,98 мг, кремния диоксид 13,00 мг, магния стеарат 1,99 мг
Слой дапаглифлозина
Действующее вещество: дапаглифлозина пропандиола моногидрат 6,15 мг (в пересчёте на дапаглифлозин 5 мг)
Вспомогательные вещества: целлюлоза микрокристаллическая РН3022 226,35 мг, лактоза 48,00 мг, кросповидон 12,00 мг, кремния диоксид 4,50 мг, магния стеарат3 3,00 мг
Плёночная оболочка: Опадрай® II розовый 85F945924 40,13 мг5.
Одна таблетка с модифицированным высвобождением, покрытая плёночной оболочкой 10 мг + 1000 мг, содержит:
Слой метформина пролонгированного действия
Действующее вещество: метформина гидрохлорид в смеси с 0,5 % магния стеарата1 1005,4 мг (1000,00 мг метформина гидрохлорида + 5,04 мг магния стеарата)
Вспомогательные вещества: кармеллоза натрия 49,99 мг, гипромеллоза 2208 234,98 мг, кремния диоксид 13,00 мг, магния стеарат 1,99 мг.
Слой дапаглифлозина
Действующее вещество: дапаглифлозина пропандиола моногидрат 12,30 мг (в пересчёте на дапаглифлозин 10 мг)
Вспомогательные вещества: целлюлоза микрокристаллическая РН3022 220,20 мг, лактоза 48,00 мг, кросповидон 12,00 мг, кремния диоксид 4,50 мг, магния стеарат3 3,00 мг
Плёночная оболочка: Опадрай® II жёлтый 85F123726 40,13 мг5.
1 Данная смесь состоит из 99,5 % (м/м) метформина гидрохлорида и 0,5 % (м/м) магния стеарата.
2 Количество может меняться в зависимости от чистоты дапаглифлозина и используемого актуального количества магния стеарата.
3 Целевое суммарное количество магния стеарата составляет 1,0 % (м/м) от слоя дапаглифлозина.
4 Опадрай Ⅱ розовый 85F94592 содержит (% м/м): спирт поливиниловый частично гидролизованный 40,00 % (E1203), титана диоксид 22,00 % (E171), макрогол 3350 20,20 % (E1521), тальк 14,80% (E553b), краситель железа оксид красный 3,00 % (E172).
5 Количество оболочечного материала основано на целевом увеличении массы таблетки 2,5 % (м/м). Фактическое количество может меняться в диапазоне 2,0-3,2 % (м/м) для достижения приемлемого физического внешнего вида.
6 Опадрай Ⅱ жёлтый 85F12372 содержит (% м/м): спирт поливиниловый частично гидролизованный 40,00 % (E1203), титана диоксид 21,08 % (E171), макрогол 3350 20,20 % (E1521), тальк 14,80% (E553b), краситель железа оксид жёлтый 3,92% (E172).
Описание
Таблетки 5 мг + 1000 мг:
Овальные, двояковыпуклые таблетки, покрытые плёночной оболочкой от розового до темно-розового цвета, с гравировкой «1071« и »5/1000» на одной стороне.
Таблетки 10 мг + 1000 мг:
Овальные, двояковыпуклые таблетки, покрытые плёночной оболочкой от жёлтого до тёмно- жёлтого цвета, с гравировкой «1073« и »10/1000» на одной стороне.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Механизм действия
Препарат Сигдуо Лонг® объединяет два гипогликемических препарата с дополняющими механизмами действия для улучшения гликемического контроля у пациентов с сахарным диабетом 2 типа (СД 2): дапаглифлозин, селективный обратимый ингибитор
натрийзависимого переносчика глюкозы 2 типа (SGLT2), и метформин, представитель класса битуанидов.
Дапаглифлозин
SGLT2 экспрессируется в проксимальных почечных канальцах и является основным переносчиком, участвующим в процессе реабсорбции глюкозы. Ингибируя SGLT2, дапаглифлозин уменьшает реабсорбцию глюкозы и снижает почечный порог для глюкозы, что приводит к повышению её выведения почками.
Метформин
Метформин улучшает толерантность к глюкозе у пациентов с СД 2, снижая концентрацию глюкозы плазмы натощак и постпрандиальную концентрацию глюкозы. Метформин уменьшает продукцию глюкозы печенью, снижает всасывание глюкозы в кишечнике и повышает чувствительность к инсулину, увеличивая периферическое поглощение и утилизацию глюкозы. Метформин не вызывает гипогликемию у пациентов с СД 2 или здоровых людей (кроме особых ситуаций, см. раздел «Особые указания»), и гиперинсулинемию. Во время терапии метформином секреция инсулина не меняется, хотя концентрации инсулина натощак и в ответ на приём пищи в течение дня могут снижаться.
Фармакодинамика
Дапаглифлозин
После приёма дапаглифлозина здоровыми добровольцами и пациентами с СД 2 наблюдалось увеличение количества выводимой почками глюкозы. При приёме дапаглифлозина в дозе 5 мг в сутки или 10 мг в сутки в течение 12 недель пациентами с СД 2 в сутки почками выводилось примерно 70 г глюкозы. При приёме дапаглифлозина в дозе 20 мг в сутки выведение глюкозы практически достигало максимума. Выведение глюкозы почками при применении дапаглифлозина также приводит к увеличению объёма мочи (см. раздел «Побочное действие»).
Клиническая эффективность
Стартовая комбинированная терапия с метформином пролонгированного действия
Безопасность и эффективность стартовой комбинированной терапии дапаглифлозином и метформином пролонгированного действия изучались в 2 контролируемых исследованиях продолжительностью 24 недели у пациентов с СД 2 и неадекватным контролем гликемии, ранее не получавших гипогликемической терапии.
Применение дапаглифлозина и метформина пролонгированного действия (суточная доза 2 г) обеспечивало значимое снижение концентрации гликозилированного гемоглобина (HbAlc) и концентрации глюкозы в плазме крови натощак (ГПН) по сравнению с монотерапией метформином или дапаглифлозином.
Также комбинированная терапия дапаглифлозином и метформином пролонгированного действия обеспечила значимое снижение массы тела по сравнению с монотерапией метформином пролонгированного действия.
Добавление дапаглифлозина к терапии метформином обычного высвобождения
Безопасность и эффективность добавления дапаглифлозина к терапии метформином обычного высвобождения изучались в контролируемом исследовании продолжительностью 24 недели у пациентов с СД 2 и неадекватным контролем гликемии. Добавление дапаглифлозина в дозе 10 мг к терапии метформином приводило к значимому снижению концентрации HbAlc и концентрации ГПН, а также к уменьшению массы тела по сравнению с плацебо на 24 неделе лечения.
Также отмечено статистически значимое (р<0,05) по сравнению с группой монотерапии метформином среднее снижение систолического артериального давления (САД) на 4,5 мм рт. ст. и 5,3 мм рт. ст. у пациентов, получавших дапаглифлозин 5 мг и 10 мг, соответственно.
Добавление дапаглифлозина или глипизида к терапии метформином обычного высвобождения
Безопасность и эффективность добавления дапаглифлозина к терапии метформином обычного высвобождения по сравнению с глипизидом изучались в контролируемом исследовании продолжительностью 52 недели у пациентов с СД 2 и неадекватным контролем гликемии.
Дапаглифлозин не менее эффективно, чем глипизид, снижал среднее значение концентрации HbAlc к 52 неделе лечения. В группе дапаглифлозина было отмечено значимое снижение среднего значения массы тела к 52 неделе лечения, в то время как в группе глипизида наблюдалось увеличение этого показателя. В группе дапаглифлозина по сравнению с группой глипизида было достигнуто статистически значимое (р<0,0001) снижение САД на 5,0 мм рт. ст.
Фармакокинетика
Препарат Сигдуо Лонг® биоэквивалентен дапаглифлозину (препарат Форсига) и метформину пролонгированного действия (препарат Глюкофаж® Лонг) при их совместном применении в соответствующих дозах.
Показатели экспозиции дапаглифлозина и метформина пролонгированного действия после приёма препарата Сигдуо Лонг® здоровыми добровольцами были сопоставимы после стандартного приёма пищи и натощак.
В случае приёма препарата Сигдуо Лонг® после стандартного приёма пищи было отмечено снижение максимальной концентрации (Сmах) дапаглифлозина на 35 % и увеличение времени её достижения (Tmax) на 1-2 ч по сравнению с приёмом препарата натощак. Это различие не является клинически значимым. Приём пищи не оказывал значимого влияния на фармакокинетические параметры метформина.
Абсорбция
Дапаглифлозин
После приёма дапаглифлозина внутрь натощак Сmах обычно достигается в течение 2 часов. Значения Сmах и AUC (площадь под кривой зависимости концентрации от времени) увеличиваются пропорционально дозе дапаглифлозина в диапазоне терапевтических доз.
Абсолютная биодоступность дапаглифлозина при приёме внутрь в дозе 10 мг составляет 78 %.
Приём пищи оказывал умеренное влияние на фармакокинетику дапаглифлозина у здоровых добровольцев. Приём пищи с высоким содержанием жиров снижал Сmах дапаглифлозина на 50 %, удлинял Tmax примерно на 1 час, но не влиял на AUC по сравнению с приёмом натощак. Эти изменения не являются клинически значимыми, поэтому дапаглифлозин можно принимать независимо от приёма пищи.
Метформин
После приёма внутрь метформина пролонгированного действия Сmах достигается через 4-8 часов (медиана 7 часов). Степень абсорбции метформина из таблеток пролонгированного действия увеличивается примерно на 50 % (оценивалось по изменению AUC) при приёме во время еды. Приём пищи не влиял на Tmax и Сmах.
Распределение
Дапаглифлозин
Дапаглифлозин примерно на 91 % связывается с белками. У пациентов с нарушениями функции почек или печени этот показатель не изменялся.
Метформин
Не проводились исследования распределения метформина пролонгированного действия, однако кажущийся объём распределения метформина после однократного приёма внутрь таблеток метформина обычного высвобождения в дозе 850 мг, в среднем, составил 654±358 л. Метформин в незначительной степени связывается с белками плазмы крови. Метформин проникает в эритроциты.
Метаболизм
Дапаглифлозин
Метаболизм дапаглифлозина, главным образом, происходит под действием фермента уридиндифосфат-глюкуронилтрансферазы 1А9 (UGT1A9); изоферменты цитохрома CYP вовлечены в метаболизм у человека в меньшей степени. Дапаглифлозин метаболизируется с образованием, главным образом, неактивного метаболита дапаглифлозин-3-О-глюкуронида. После приёма внутрь 50 мг 14С-дапаглифлозина 61 % принятой дозы метаболизируется в дапаглифлозин-3-О-глюкуронид.
Метформин
Исследования с однократным внутривенным введением препарата здоровым добровольцам показывают, что метформин выводится в неизменённом виде почками, не подвергается метаболизму в печени (у человека не выявлены метаболиты) и не выводится через кишечник. Исследования по изучению метаболизма метформина в таблетках пролонгированного действия не проводились.
Выведение
Дапаглифлозин
Дапаглифлозин и его метаболиты выводятся, преимущественно, почками, и только менее 2 % выводится в неизменённом виде. После приёма 50 мг 14С-дапаглифлозина было обнаружено 96 % радиоактивности — 75% в моче и 21 % — в фекалиях. Примерно 15 % радиоактивности, обнаруженной в фекалиях, приходилось на неизменённый дапаглифлозин.
T½ (период полувыведения из плазмы) после однократного приёма дапаглифлозина в дозе 10 мг составляет примерно 12,9 ч.
Метформин
Почечный клиренс примерно в 3,5 раза выше клиренса креатинина (КК), что указывает на то, что канальцевая секреция является основным путём выведения метформина. После приёма внутрь примерно 90 % абсорбированного препарата выводится почками в течение первых 24 ч, при этом период полувыведения из плазмы равен примерно 6,2 ч.
В крови период полувыведения составляет примерно 17,6 ч, следовательно, эритроцитарная масса может быть частью распределения.
Фармакокинетика у особых групп пациентов
Нарушение функции почек
Дапаглифлозин
В равновесном состоянии (прием дапаглифлозина 1 раз в сутки в дозе 20 мг в течение 7 дней) у пациентов с СД 2 и нарушением функции почек лёгкой, средней или тяжёлой степени (определяемой по расчетной скорости клубочковой фильтрации (рСКФ)) геометрическая средняя системной экспозиции была на 45 %, в 2,04 и 3,03 раза выше, чем у пациентов с СД 2 и нормальной функцией почек, соответственно. Повышение системной экспозиции дапаглифлозина у пациентов с СД 2 и нарушением функции почек не сопровождалось соответствующим увеличением количества глюкозы, выводимой почками в течение суток.
Суточная экскреция глюкозы почками в равновесном состоянии у пациентов с СД 2 и нарушением функции почек лёгкой, средней или тяжёлой степени была, соответственно, на 42 %, 80% и 90% ниже, по сравнению с пациентами с СД 2 и нормальной функцией почек. Неизвестно, оказывает ли гемодиализ влияние на экспозицию дапаглифлозина (см. разделы «Способ применения и дозы» и «Особые указания»).
Метформин
У пациентов с нарушением функции почек (по результатам измерений КК) период полувыведения метформина из плазмы и крови удлиняется, и почечный клиренс снижается.
Нарушение функции печени
Дапаглифлозин
У пациентов с нарушением функции печени лёгкой или средней степени тяжести (классы А и В по Чайлд-Пью) средние значения Сmах и AUC дапаглифлозина после однократного приёма в дозе 10 мг были, соответственно, на 12 % и 36% выше по сравнению с аналогичными показателями у здоровых добровольцев. Данные различия не являются клинически значимыми.
У пациентов с нарушением функции печени тяжёлой степени (класс C по Чайлд-Пью) средние значения Сmах и AUC дапаглифлозина были на 40 % и 67% выше, соответственно, по сравнению со здоровыми добровольцами.
Метформин
Фармакокинетические исследования метформина у пациентов с нарушением функции печени не проводились.
Пожилой возраст
Дапаглифлозин
По результатам популяционного фармакокинетического анализа, возраст не оказывает клинически значимого влияния на системную экспозицию дапаглифлозина, поэтому коррекция дозы в зависимости от возраста пациента не требуется.
Метформин
Ограниченные данные контролируемых исследований фармакокинетики метформина у здоровых добровольцев пожилого возраста позволяют предположить, что общий плазменный клиренс метформина понижается, период полувыведения увеличивается, а Cmaxповышается по сравнению со значениями этих параметров у здоровых добровольцев молодого возраста. По этим данным изменение параметров фармакокинетики метформина с увеличением возраста, в основном, обусловлено изменением функции почек.
Дети
Не проводились исследования фармакокинетики препарата Сигдуо Лонг® у детей (см. раздел «Противопоказания»).
Пол
Дапаглифлозин
По результатам популяционного фармакокинетического анализа, пол не оказывает клинически значимого влияния на системную экспозицию дапаглифлозина, поэтому коррекция дозы в зависимости от пола пациента не рекомендуется.
Метформин
Фармакокинетические параметры метформина у здоровых добровольцев и пациентов с СД 2 существенно не различались в зависимости от пола. В контролируемых клинических исследованиях у пациентов с СД 2 гипогликемический эффект метформина у мужчин и женщин был сопоставим.
Расовая и этническая принадлежность
Дапаглифлозин
По результатам популяционного фармакокинетического анализа, клинически значимых различий системной экспозиции у представителей европеоидной, негроидной и монголоидной рас не выявлено; коррекция дозы с учётом расовой принадлежности не требуется.
Метформин
Не проводились исследования параметров фармакокинетики метформина в зависимости от расовой принадлежности пациента. В клинических исследованиях у пациентов с СД 2 гипогликемический эффект метформина у представителей европеоидной, негроидной рас и пациентов испанского происхождения был сопоставим.
Масса тела
Дапаглифлозин
По результатам популяционного фармакокинетического анализа, масса тела не оказывает клинически значимого влияния на системную экспозицию дапаглифлозина, поэтому коррекция дозы в зависимости от массы тела пациента не требуется.
Показания
Сахарный диабет 2 типа в дополнение к диете и физическим упражнениям для улучшения гликемического контроля у взрослых пациентов, для которых целесообразна комбинированная терапия дапаглифлозином и метформином.
Противопоказания
— Повышенная индивидуальная чувствительность к любому компоненту препарата.
— Сахарный диабет 1 типа.
— Нарушение функции почек от средней до тяжёлой степени тяжести (рСКФ<60 мл/мин/1,73 м2), терминальная стадия почечной недостаточности или пациенты, получающие гемодиализ.
— Наследственная непереносимость лактозы, недостаточность лактазы и глюкозо-галактозная непереносимость.
— Беременность и период грудного вскармливания.
— Детский возраст до 18 лет (безопасность и эффективность не изучены).
— Пациенты, принимающие «петлевые» диуретики (см. раздел «Взаимодействие с другими лекарственными средствами»), или со сниженным объёмом циркулирующей крови (ОЦК), например, вследствие острых заболеваний (таких как желудочно-кишечные заболевания).
— Пожилые пациенты в возрасте 75 лет и старше (для начала терапии дапаглифлозином).
— Нарушение функции печени.
— Острые заболевания, при которых имеется риск развития нарушения функции почек: дегидратация (при рвоте, диарее), лихорадка, тяжёлые инфекционные заболевания, состояния гипоксии (шок, сепсис, инфекции почек, бронхолёгочные заболевания).
— Острый или хронический метаболический ацидоз, включая диабетический кетоацидоз, с комой или без комы. В случае диабетического кетоацидоза следует применять препараты инсулина.
— Клинически выраженные проявления острых и хронических заболеваний, которые могут привести к развитию тканевой гипоксии (дыхательная недостаточность, сердечная недостаточность, острый инфаркт миокарда).
— Серьёзные хирургические операции и травмы (когда показано проведение инсулинотерапии).
— Хронический алкоголизм и острое отравление этанолом.
— Лактоацидоз (в том числе в анамнезе).
— Период не менее 48 ч до и в течение 48 ч после проведения радиоизотопных или рентгенологических исследований с введением йодсодержащих контрастных средств.
— Соблюдение гипокалорийной диеты (<1000 ккал/сут).
С осторожностью
Инфекции мочевыводящих путей; риск снижения ОЦК; пожилые пациенты; повышенное значение гематокрита; пациенты в возрасте старше 60 лет, выполняющие тяжёлую физическую работу.
Применение при беременности и в период грудного вскармливания
Применение препарата Сигдуо Лонг®, а также его действующих веществ, дапаглифлозина и метформина, в период беременности не изучено, поэтому препарат противопоказан во время беременности. В случае диагностирования беременности терапия препаратом Сигдуо Лонг® должна быть прекращена.
Неизвестно, проникает ли дапаглифлозин, метформин и/или их метаболиты в грудное молоко человека. Нельзя исключить риск для новорождённых/младенцев. Препарат Сигдуо Лонг® противопоказан в период грудного вскармливания.
Способ применения и дозы
Внутрь, один раз в сутки во время завтрака. Таблетки следует проглатывать целиком, не разжёвывая, не измельчая и не разламывая.
Дозу следует подбирать индивидуально, учитывая эффективность и переносимость проводимой терапии. При необходимости дозу повышают постепенно, чтобы уменьшить риск побочных эффектов метформина со стороны желудочно-кишечного тракта.
Максимальная суточная доза дапаглифлозина составляет 10 мг, метформина пролонгированного действия — 2 г.
Если препарат Сигдуо Лонг® был назначен пациенту, принимающему метформин пролонгированного действия в вечернее время, следует пропустить приём последней вечерней дозы метформина пролонгированного действия накануне приёма первой дозы препарата Сигдуо Лонг®.
Пациентам со сниженным ОЦК необходима коррекция этого состояния до начала терапии препаратом Сигдуо Лонг®.
Неактивные ингредиенты препарата Сигдуо Лонг® могут выводиться через кишечник в виде мягкой, влажной массы, которая может сохранять форму принятой таблетки.
Применение у особых групп пациентов
Нарушение функции печени
У пациентов с нарушением функции печени применение метформина может приводить к лактоацидозу. Поэтому препарат Сигдуо Лонг® противопоказан пациентам с нарушением функции печени.
Нарушение функции почек
До начала терапии препаратом Сигдуо Лонг® и периодически на фоне терапии следует оценивать функцию почек. Препарат Сигдуо Лонг® противопоказан пациентам с нарушением функции почек от средней до тяжёлой степени (рСКФ < 60 мл/мин/1,73 м2), с терминальной стадией почечной недостаточности и пациентам, получающим гемодиализ (см. разделы «Противопоказания», «Побочное действие» и «Особые указания»).
При нарушении функции почек лёгкой степени (рСКФ ≥ 60 мл/мин/1,73 м2) нет необходимости корректировать дозу препарата.
Дети
Безопасность и эффективность дапаглифлозина у пациентов младше 18 лет не изучались (см. раздел «Противопоказания»).
Пожилой возраст
У пациентов пожилого возраста нет необходимости корректировать дозу препарата. Однако при выборе дозы следует учитывать, что у этой категории пациентов более вероятны нарушение функции почек и риск снижения ОЦК. Рекомендуется более частый контроль состояния функции почек у пациентов пожилого возраста.
Поскольку клинический опыт применения дапаглифлозина у пациентов 75 лет и старше ограничен, противопоказано начинать терапию дапаглифлозином в данной возрастной группе.
Побочное действие
Дапаглифлозин и метформин
Оценка безопасности проводилась на основании объединенных данных 8 краткосрочных плацебо-контролируемых исследований, в которых дапаглифлозин применялся в комбинации с метформином (в данной комбинации и в дополнение к другой гипогликемической терапии). В этих исследованиях 983 пациента получали дапаглифлозин в дозе 10 мг один раз в сутки и метформин, и 1185 пациентов получали плацебо и метформин.
Общая частота нежелательных явлений в группе дапаглифлозина в дозе 10 мг и метформина составила 60,3 % по сравнению с 58,2% в группе плацебо и метформина. У 4 % пациентов в группе дапаглифлозина 10 мг и метформина терапия была отменена из-за нежелательных реакций по сравнению с 3,3 % в группе плацебо и метформина. Наиболее частыми нежелательными явлениями, приводившими к отмене терапии и отмеченными, как минимум, у 3 пациентов в группе дапаглифлозина 10 мг и метформина, были нарушение функции почек (0,7 %), повышение концентрации креатинина в сыворотке крови (0,2 %), уменьшение КК (0,2%) и инфекции мочевыводящих путей (0,2 %).
В Таблице 1 приведены нежелательные реакции по данным 8 краткосрочных плацебо- контролируемых исследований, вне зависимости от оценки исследователем причинно- следственной связи, которые были отмечены, как минимум, у 2 % пациентов, принимавших дапаглифлозин и метформин, и, как минимум, на 1 % чаще по сравнению с пациентами, получавшими метформин и плацебо.
Таблица 1. Нежелательные реакции в плацебо-контролируемых исследованиях1 (вне зависимости от оценки исследователем причинно-следственной связи), отмеченные с частотой ≥ 2 % у пациентов, получавших дапаглифлозин и метформин, и, как минимум, на 1 % чаще по сравнению с пациентами, получавшими метформин и плацебо (за исключением гипогликемии)2
|
Системно-органный класс Термин предпочтительного употребления |
Дапаглифлозин 10 мг и метформин N=983 |
|
Инфекции и инвазии |
|
|
Генитальные инфекции3 |
Часто |
|
Инфекции и инвазии |
|
|
Инфекции мочевыводящих путей4 |
Часто |
|
Нарушения со стороны почек и мочевыводящих путей |
|
|
Полиурия5 |
Часто |
1 8 плацебо-контролируемых исследований включали 2 исследования стартовой комбинированной терапии с метформином, 2 исследования добавления к терапии метформином, 1 исследование добавления к терапии инсулином, 1 исследование добавления к терапии ситаглиптином и 2 исследования добавления к комбинированной гипогликемической терапии. Приведённые данные относятся к краткосрочной терапии (до 24 недель) независимо от назначения дополнительных гипогликемических средств.
2 См. подраздел «Гипогликемия».
3 Включает следующие предпочтительные термины (перечислены в порядке убывания частоты): вульвовагинальная грибковая инфекция, баланит, вагинальная инфекция, генитальная грибковая инфекция, генитальная инфекция, вульвовагинальный кандидоз, кандидозный баланит, вульвовагинит, генитальный кандидоз, вульвит, баланопостит, генитальная инфекция у мужчин, инфекция мочеполового тракта, абсцесс пениса, инфекция пениса, постит, абсцесс вульвы и бактериальный вагинит.
4 Включает следующие предпочтительные термины (перечислены в порядке убывания частоты): инфекция мочевыводящих путей, цистит, инфекция мочевыводящих путей, вызванная бактериями рода Escherichia, инфекция мочеполового тракта, пиелонефрит, тригонит, уретрит, инфекция почек и простатит.
5 Включает следующие предпочтительные термины (перечислены в порядке убывания частоты): поллакиурия, полиурия и увеличение объёма выделяемой мочи.
Метформин
В плацебо-контролируемых исследованиях метформина пролонгированного действия в качестве монотерапии диарея и тошнота/рвота отмечались более чем у 5 % пациентов и чаще, чем в группе плацебо (диарея у 9,6 % и 2,6% пациентов, тошнота/рвота у 6,5 % и 1,5% пациентов, соответственно). У 0,6 % пациентов, получавших метформин пролонгированного действия, диарея привела к прекращению терапии.
Объединенные данные 12 плацебо-контролируемых исследований дапаглифлозина 5 мг и 10 мг
Дапаглифлозин
В 4 исследованиях дапаглифлозин применялся в качестве монотерапии, а в 8 исследованиях — в качестве дополнения к базовой сахароснижающей терапии или в комбинации с метформином. В этих исследованиях 2338 пациентов получали дапаглифлозин, в среднем, в течение 21 недели. 1393 пациента получали плацебо, 1145 пациентов — дапаглифлозин 5 мг, 1193 пациента — дапаглифлозин 10 мг один раз в сутки.
Объединенные данные 13 плацебо-контролируемых исследований дапаглифлозина 10 мг
Оценка безопасности и переносимости дапаглифлозина 10 мг проводилась на основании объединенных данных 13 плацебо-контролируемых исследований: в 3 исследованиях дапаглифлозин изучался в режиме монотерапии, в 9 исследованиях — в качестве дополнительной терапии к проводимой сахароснижающей терапии, и в 1 исследовании в стартовой комбинации с метформином. В этих исследованиях 2360 пациентов получали дапаглифлозин в дозе 10 мг, в среднем, в течение 22 недель.
Описание отдельных нежелательных реакций
Снижение ОЦК
Дапаглифлозин вызывает осмотический диурез, который может приводить к снижению ОЦК. Нежелательные реакции, связанные со снижением ОЦК (включая сообщения об обезвоживании, гиповолемии, ортостатической гипотензии и артериальной гипотензии), приведены в Таблице 2 (объединенные данные 12 и 13 краткосрочных плацебо- контролируемых исследований дапаглифлозина) (см. раздел «Особые указания»).
Таблица 2. Нежелательные реакции, связанные со снижением ОЦК1, в клинических исследованиях дапаглифлозина
|
Объединенные данные 12 плацебо-контролируемых исследований |
Объединенные данные 13 плацебо-контролируемых исследований |
||||
|
Плацебо |
Дапаглифлозин 5 мг |
Дапаглифлозин 10 мг |
Плацебо |
Дапаглифлозин 10 мг |
|
|
Общее количество пациентов N (%) |
N=1393 5 (0,4 %) |
N=1145 7 (0,6 %) |
N=1193 9 (0,8 %) |
N=2295 17 (0,7 %) |
N=2360 27(1,1 %) |
|
Подгруппы пациентов n (%) |
|||||
|
Пациенты, принимающие «петлевые» диуретики |
n = 55 1 (1,8 %) |
n = 40 0 |
n = 31 3 (9,7 %) |
n = 267 4 (1,5 %) |
n = 236 6 (2,5 %) |
|
Пациенты с нарушением функции почек средней тяжести (60>рСКФ≥30 мл/мин/1,73 м2) |
n = 107 2 (1,9 %) |
n = 107 1 (0,9 %) |
n = 89 1 (1,1 %) |
n = 268 4 (1,5 %) |
n = 265 5(1,9 %) |
|
Пациенты ≥65 лет |
n = 276 1 (0,4 %) |
n = 216 1 (0,5 %) |
n = 204 3 (1,5 %) |
n = 711 6 (0,8 %) |
n = 665 11 (1,7 %) |
1 Снижение ОЦК включало следующие нежелательные реакции: дегидратация, гиповолемия, ортостатическая гипотензия и артериальная гипотензия.
Нарушение функции почек
На фоне применения дапаглифлозина отмечалось повышение концентрации креатинина в сыворотке крови и снижение рСКФ. У пациентов с нормальной функцией почек или нарушением функции почек лёгкой степени при включении в исследование концентрация креатинина и рСКФ возвращались к исходному значению на 24 неделе.
Нежелательные реакции, связанные с нарушением функции почек, включая почечную недостаточность и повышение концентрации креатинина в сыворотке, чаще отмечались у пациентов, принимавших дапаглифлозин (см. Таблицу 3). Эти нежелательные реакции чаще отмечались у пациентов пожилого возраста и у пациентов с нарушением функции ночек (см. Таблицу 3). Стойкое снижение рСКФ наблюдалось у пациентов с нарушением функции почек средней степени тяжести (60>СКФ≥30 мл/мин/1,73 м2).
Таблица 3. Доля пациентов, как минимум, с одной нежелательной реакцией, связанной с нарушением функции почек
|
Объединенные данные 6 плацебо-контролируемых исследований (до 104 недель)1 |
Объединенные данные 9 плацебо-контролируемых исследований (до 104 недель)2 |
||||
|
Исходные характеристики |
Плацебо |
Дапаглифлозин 5 мг |
Дапаглифлозин 10 мг |
Плацебо |
Дапаглифлозин 10 мг |
|
Общая популяция |
n = 785 |
n = 767 |
n = 859 |
n = 1956 |
n = 2026 |
|
Пациенты (%), как минимум, с одной нежелательной реакцией |
13(1,7 %) |
14 (1,8 %) |
16 (1,9 %) |
82 (4,2 %) |
136(6,7 %) |
|
Пациенты ≥65 лет Пациенты (%), как минимум, с одной нежелательной реакцией |
n = 190 |
n = 162 |
n = 159 |
n = 655 |
n = 620 |
|
4 (2,1 %) |
5 (3,1 %) |
6 (3,8 %) |
52 (7,9 %) |
87(14,0 %) |
|
|
Пациенты с 60>рСКФ≥30 мл/мин/1,73 м2 Пациенты (%), как минимум, с одной нежелательной реакцией |
n = 77 |
n = 88 |
n = 75 |
n = 249 |
n = 251 |
|
5 (6,5 %) |
7 (8,0 %) |
9(12,0 %) |
40(16,1 %) |
71 (28,3 %) |
|
|
Пациенты ≥65 лет с 60>рСКФ>30 мл/мин/1,73 м2 Пациенты (%), как минимум, с одной нежелательной реакцией |
n = 41 |
n = 43 |
n = 35 |
n = 141 |
n = 134 |
|
2 (4,9 %) |
3 (7,0 %) |
4(11,4 %) |
27(19,1 %) |
47 (35,1 %) |
1 Пациенты из 12 плацебо-контролируемых исследований с продлённым периодом.
2 Пациенты из 13 плацебо-контролируемых исследований с продлённым периодом.
В исследовании с участием пациентов с нарушением функции почек средней степени тяжести (60>рСКФ≥30 мл/мин/1,73 м2) продолжительностью до 104 недель у 13 пациентов были отмечены переломы костей (5 случаев в группе дапаглифлозина 5 мг; 8 случаев в группе дапаглифлозина 10 мг; в группе плацебо переломов не зарегистрировано). В 11 из 13 случаев переломы произошли в первые 52 недели лечения, в 8 из 13 случаев — у пациентов с исходным значением рСКФ от 30 до 45 мл/мин/1,73 м2. Закономерности в отношении локализации переломов отмечено не было.
Гипогликемия
В плацебо-контролируемых исследованиях добавления дапаглифлозина к терапии метформином продолжительностью 24 недели тяжёлых эпизодов гипогликемии отмечено не было; лёгкие эпизоды гипогликемии отмечены у 1,5 % пациентов в группе дапаглифлозина 5 мг, 0,7 % пациентов в группе дапаглифлозина 10 мг, в группе плацебо эпизодов гипогликемии не было.
В исследовании добавления дапаглифлозина к терапии метформином по сравнению с глипизидом продолжительностью 52 недели в группе дапаглифлозина не было отмечено тяжёлых эпизодов гипогликемии, в группе глипизида такие эпизоды были отмечены у 0,7 % пациентов; лёгкие эпизоды гипогликемии отмечены у 1,7 % пациентов в группе дапаглифлозина 10 мг и у 36 % пациентов в группе глипизида.
Грибковые генитальные инфекции
Грибковые генитальные инфекции чаще отмечались в группе дапаглифлозина. Грибковые генитальные инфекции были отмечены у 0,9 %, 5,7% и 4,8% пациентов, принимавших плацебо, дапаглифлозин 5 мг и дапаглифлозин 10 мг, соответственно (объединенные данные 12 плацебо-контролируемых исследований дапаглифлозина 5 мг и 10 мг). У 0,2 % пациентов в группе дапаглифлозина 10 мг из-за генитальной инфекции препарат был отменён (в группе плацебо случаев отмены терапии из-за аналогичной нежелательной реакции не было).
Грибковые генитальные инфекции чаще отмечались у женщин, а также у пациентов, у которых до начала приёма препарата отмечались эпизоды аналогичной инфекции (10,0 %, 23,1% и 25,0% по сравнению с 0,8 %, 5,9% и 5,0% в группах плацебо, дапаглифлозина 5 мг, дапаглифлозина 10 мг, соответственно). Наиболее частыми у женщин были вульвовагинальные грибковые инфекции, а у мужчин — баланит.
Реакции гиперчувствительности
На фоне приёма дапаглифлозина сообщалось о реакциях гиперчувствительности (таких как ангионевротический отёк, крапивница, гиперчувствительность). В рамках программы клинических исследований серьёзные анафилактические реакции, тяжёлые кожные реакции и ангионевротический отёк отмечены у 0,3 % пациентов, получавших дапаглифлозин, и у 0,2 % пациентов в группе сравнения. При возникновении реакций гиперчувствительности следует отменить дапаглифлозин, проводить лечение в соответствии с принятой практикой и наблюдение за пациентом до полного разрешения симптомов.
Результаты лабораторных исследований
Увеличение гематокрита
Дапаглифлозин
Увеличение гематокрита у пациентов, получавших дапаглифлозин, отмечалось с 1 по 16 недели лечения (объединенные данные 13 плацебо-контролируемых исследований дапаглифлозина 10 мг). Максимальное увеличение гематокрита, по сравнению с исходными значениями, наблюдалось на 16 неделе. На 24 неделе среднее изменение гематокрита по сравнению с исходным значением составило -0,33 % в группе плацебо и 2,3 % в группе дапаглифлозина 10 мг. К 24 неделе повышенное значение гематокрита >55 % было зарегистрировано у 0,4 % пациентов в группе плацебо и 1,3 % пациентов в группе дапаглифлозина 10 мг.
Повышение концентрации неорганического фосфора в сыворотке крови
Дапаглифлозин
Повышение концентрации неорганического фосфора в сыворотке крови по сравнению с исходной отмечалось на 24 неделе у пациентов, получавших дапаглифлозин 10 мг, по сравнению с группой плацебо (среднее повышение составило 0,13 мг/дл и -0,04 мг/дл, соответственно) (объединенные данные 13 плацебо-контролируемых исследований дапаглифлозина 10 мг).
Гиперфосфатемия (концентрация неорганического фосфора в сыворотке ≥5,6 мг/дл для пациентов 17-65 лет и ≥5,1 мг/дл для пациентов в возрасте ≥66 лет) также чаще отмечалась в группе дапаглифлозина 10 мг по сравнению с группой плацебо на 24 неделе (1,7 % и 0,9% пациентов, соответственно).
Повышение концентрации холестерина липопротеидов низкой плотности (ХС ЛПНП)
Дапаглифлозин
Изменение концентрации липидов в сыворотке крови отмечено у пациентов, получавших дапаглифлозин, по сравнению с группой плацебо (объединенные данные 13 плацебо- контролируемых исследований дапаглифлозина 10 мг). Среднее процентное увеличение концентрации общего холестерина в сыворотке крови на 24 неделе составило 2,5 % и 0,0% в группе дапаглифозина 10 мг и плацебо, соответственно, а ХС ЛПНП 2,9 % в группе дапаглифлозина 10 мг по сравнению с -1,0 % в группе плацебо.
Концентрация витамина B12
Метформин
На фоне приёма метформина может снизиться концентрация витамина B12 в сыворотке. Пациентам, получающим препарат Сигдуо Лонг®, следует ежегодно оценивать гематологические параметры, и при выявлении изменений проводить соответствующее обследование и лечение (см. раздел «Особые указания»).
Опыт пострегистрационного применения
Дапаглифлозин
При пострегистрационном применении были отмечены следующие нежелательные реакции:
Неуточненнной частоты: сыпь.
Достоверно оценить причинно-следственную связь и частоту нежелательных реакций не представляется возможным, поскольку сведения были получены в виде спонтанных сообщений, а размер популяции пациентов точно не был определён.
Передозировка
Дапаглифлозин
В рамках программы клинических исследований дапаглифлозина случаев передозировки отмечено не было. В случае передозировки необходимо проводить поддерживающую терапию, учитывая состояние пациента. Выведение дапаглифлозина с помощью гемодиализа не изучалось.
Метформин
Зарегистрированы случаи передозировки метформина, в том числе, при приёме более 50 г. Примерно в 10 % случаев развивалась гипогликемия, но её причинная связь с приёмом метформина не установлена. Примерно в 32 % случаев передозировки метформина у пациентов наблюдался лактоацидоз. Метформин выводится при диализе, при этом клиренс достигает 170 мл/мин. Поэтому при предполагаемой передозировке препарата, содержащего метформин, целесообразен гемодиализ.
Взаимодействие с другими лекарственными средствами
Фармакокинетические исследования взаимодействий препарата Сигдуо Лонг® не проводились, однако такие исследования были проведены для дапаглифлозина и метформина, входящих в состав препарата Сигдуо Лонг®.
Дапаглифлозин
В ходе исследований in vitro дапаглифлозин и дапаглифлозин-3-О-глюкуронид не ингибировали изоферменты системы цитохрома P450 CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4 и не индуцировали изоферменты CYP1A2, CYP2B6 или CYP3A4.
Дапаглифлозин является слабым субстратом гликопротеина Р (P-gp), а дапаглифлозин-3-О-глюкуронид-субстратом активного транспортёра ОАТЗ. Дапаглифлозин и дапаглифлозин-3-О-глюкуронид значимо не ингибируют активные транспортёры P-gp, OCT2, OAT1 и ОАТЗ. В целом, не ожидается влияния дапаглифлозина на фармакокинетику препаратов, которые являются субстратами P-gp, OCT2, OAT1 и ОАТ3, при их одновременном применении.
Влияние других лекарственных препаратов на дапаглифлозин
Исследования взаимодействий, в основном, с приёмом однократной дозы препарата, показали, что метформин, пиоглитазон, ситаглиптин, глимепирид, воглибоза, гидрохлоротиазид, буметанид, валсартан или симвастатин не оказывают влияния на фармакокинетику дапаглифлозина.
После совместного применения дапаглифлозина и рифампицина, индуктора различных активных транспортеров и ферментов, участвующих в метаболизме лекарственных препаратов, отмечено снижение системной экспозиции (AUC) дапаглифлозина на 22 % без клинически значимого влияния на количество глюкозы, выводимой почками в течение суток. Не рекомендуется корректировать дозу препарата.
После совместного применения дапаглифлозина и мефенамовой кислоты (ингибитора UGT1A9) отмечено увеличение на 51 % системной экспозиции дапаглифлозина без клинически значимого влияния на количество глюкозы, выводимой почками в течение суток. Не рекомендуется корректировать дозу препарата.
Влияние дапаглифлозина на другие лекарственные препараты
В исследованиях взаимодействий с участием здоровых добровольцев, в основном, однократно принимавших дозу препарата, дапаглифлозин не влиял на фармакокинетические параметры метформина, пиоглитазона, ситаглиптина, глимепирида, гидрохлоротиазида, буметанида, валсартана, симвастатина, дигоксина или варфарина. Применение однократной дозы дапаглифлозина 20 мг и симвастатина приводило к повышению на 19 % AUC симвастатина. Повышение экспозиции симвастатина и симвастатиновой кислоты не считается клинически значимым.
Метформин
Влияние других лекарственных препаратов на метформин
Исследования взаимодействий с приёмом однократной дозы препаратов показали, что глибенкламид, фуросемид, нифедипин, пропранолол, ибупрофен не оказывают влияния на фармакокинетику метформина.
Ингибиторы карбоангидразы: топирамат и другие ингибиторы карбоангидразы (такие как зонисамид, ацетазоламид или диклофенамид) часто вызывают снижение концентрации бикарбонатов в сыворотке крови и неанионный интервал, гиперхлоремический метаболический ацидоз. Совместное применение этих препаратов с препаратом Сигдуо Лонг® может повышать риск лактоацидоза. Такие пациенты нуждаются в более частом контроле.
Препараты, замедляющие выведение метформина: сопутствующее применение препаратов, которые влияют на транспортные системы почечных канальцев, участвующие в выведении метформина почками (ингибиторы OCT2 и MATE, такие как ранолазин, вандетаниб, долутегравир и циметидин), может увеличивать системную экспозицию метформина и риск лактоацидоза. Необходимо оценить ожидаемую пользу и возможный риск совместного применения этих препаратов.
Влияние метформина на другие лекарственные препараты
Исследования взаимодействий с приёмом однократной дозы препаратов показали, что метформин не оказывает влияния на фармакокинетику глибенкламида, фуросемида, нифедипина, пропранолола, ибупрофена и циметидина.
Лекарственные препараты, способные вызвать гипергликемию
Приём некоторых лекарственных препаратов, таких как диуретики (в том числе, тиазидные), кортикостероиды, фенотиазины, гормоны щитовидной железы, эстрогены, оральные контрацептивы, фенитоин, никотиновая кислота, симпатомиметики, блокаторы кальциевых каналов и изониазид, может предрасполагать к развитию гипергликемии и ухудшению гликемического контроля. При совместном применении данных препаратов с препаратом Сигдуо Лонг® необходим тщательный контроль гликемии, а при их отмене — наблюдение за пациентом из-за возможности развития гипогликемии.
В исследованиях взаимодействия с участием здоровых добровольцев при однократном приёме препаратов не отмечалось взаимодействия метформина и пропранолола, метформина и ибупрофена.
Применение препаратов, которые могут вызвать гипогликемию
Метформин
Гипогликемия не развивается у пациентов, принимающих только метформин в обычном режиме, но может развиться при гипокалорийной диете, или если активная физическая нагрузка не компенсируется калорийностью рациона, или при совместном применении с другими гипогликемическими препаратами (такими как производные сульфонилмочевины и инсулин) или алкоголем. Пожилые, ослабленные или плохо питающиеся пациенты и пациенты с недостаточностью функции надпочечников или гипофиза или алкогольной интоксикацией наиболее чувствительны к гипогликемическим эффектам. У пожилых людей и пациентов, принимающих бета-адреноблокаторы, диагностика гипогликемии может быть затруднена.
Оценка теста на 1,5-ангидроглюцитол
Дапаглифлозин
У пациентов, получающих ингибиторы SGLT2, не рекомендуется использовать тест определения 1,5-ангидроглюцитола для контроля гликемии. Следует использовать альтернативные методы контроля.
Оценки результатов анализа мочи
Дапаглифлозин
Ингибиторы SGLT2 увеличивают выведение глюкозы почками. Поэтому результаты определения глюкозы в моче у пациентов, принимающих препарат Сигдуо Лонг®, будут положительными. Следует использовать альтернативные методы контроля.
Алкоголь
Алкоголь усиливает влияние метформина на метаболизм лактата. Пациентов следует информировать о недопустимости приёма больших доз алкоголя на фоне терапии препаратом Сигдуо Лонг®.
Особые указания
Лактоацидоз
При пострегистрационном применении метформина были отмечены случаи лактоацидоза, в том числе, с летальным исходом. В этих случаях лактоацидоз имел скрытое начало и сопровождался неспецифическими симптомами, такими как недомогание, миалгия, боль в животе, дыхательная недостаточность и повышенная сонливость.
При тяжёлом ацидозе отмечались гипотермия, артериальная гипотензия и резистентные брадиаритмии.
При лактоацидозе, связанном с приёмом метформина, были отмечены повышенная концентрация лактата в крови (более 5 ммоль/л), ацидоз с анионным интервалом (без наличия кетонурии и кетонемии) и увеличение соотношения лактат/пируват; концентрация метформина в плазме крови обычно превышала 5 мкг/мл. Метформин уменьшает утилизацию лактата в печени, концентрация лактата в крови при этом увеличивается, что способствует развитию лактоацидоза, особенно у пациентов с факторами риска.
При подозрении на лактоацидоз у пациента, принимающего метформин, следует безотлагательно начать проведение общих поддерживающих мероприятий в условиях стационара и немедленно прекратить приём препарата Сигдуо Лонг®.
При вероятном или подтвержденном лактоацидозе на фоне приёма препарата Сигдуо Лонг® рекомендуется немедленно начать гемодиализ для коррекции ацидоза и выведения кумулированного метформина (метформин выводится при гемодиализе, клиренс составляет до 170 мл/мин в условиях хорошей гемодинамики). Гемодиализ часто приводил к разрешению симптоматики и выздоровлению.
Следует информировать пациентов и членов их семей о симптомах лактоацидоза, а также о необходимости прекратить терапию препаратом Сигдуо Лонг® и обратиться к врачу при появлении этих симптомов.
Далее по тексту приведены рекомендации по снижению риска и коррекции лактоацидоза в случае наличия известных факторов риска.
Нарушение функции почек
Лактоацидоз, связанный с приёмом метформина при пострегистрационном применении, чаще всего возникал у пациентов со значительным нарушением функции почек.
Метформин, в основном, выводится почками, поэтому с увеличением степени тяжести нарушения функции почек повышается риск кумуляции метформина и развития лактоацидоза. Рекомендации по оценке функции почек (см. разделы «Фармакокинетика» и «Способ применения и дозы»):
- До начала терапии препаратом Сигдуо Лонг® следует определить рСКФ.
- Препарат Сигдуо Лонг® противопоказан пациентам с рСКФ<60 мл/мин/1,73 м2 (см. раздел «Противопоказания»).
- У всех пациентов, принимающих препарат Сигдуо Лонг®, следует оценивать рСКФ, как минимум, ежегодно. У пациентов из группы риска нарушения функции почек (например, у пациентов пожилого возраста) функцию почек необходимо контролировать чаще.
Взаимодействия с другими лекарственными препаратами
Совместное применение препарата Сигдуо Лонг® с препаратами, которые могут влиять на функцию почек, может привести к значительным гемодинамическим изменениям, вызвать изменения кислотно-щелочного баланса или способствовать кумуляции метформина (например, катионные препараты) (см. раздел «Взаимодействие с другими лекарственными средствами»). Поэтому следует более часто контролировать состояние таких пациентов.
Пациенты в возрасте 65 лет и старше
Риск лактоацидоза, связанного с приёмом метформина, увеличивается с возрастом, поскольку риск нарушения функции печени, почек или сердечной недостаточности у пожилых пациентов выше по сравнению с пациентами более молодого возраста. У пожилых пациентов функцию почек необходимо контролировать чаще (см. раздел «Способ применения и дозы»).
Радиологические исследования с введением контрастных веществ
При проведении радиологических исследований с внутрисосудистым введением йодсодержащих контрастных веществ были выявлены случаи острого нарушения функции почек и развития лактоацидоза у пациентов, получающих метформин. Необходимо за 48 ч до выполнения такой процедуры приостановить терапию препаратом Сигдуо Лонг®, определить рСКФ через 48 ч после процедуры и возобновить приём препарата только после подтверждения стабильной функции почек.
Хирургические вмешательства и другие процедуры
Ограничение приёма пищи и жидкости во время хирургических или других процедур может повысить риск снижения ОЦК, артериальной гипотензии и нарушения функции почек. Следует приостановить приём препарата Сигдуо Лонг® при ограничении приёма пищи и жидкости.
Гипоксия
Несколько случаев лактоацидоза, связанного с пострегистрационным применением метформина, развилось на фоне острой сердечной недостаточности (особенно в сочетании с гипоперфузией и гипоксемией). Сосудистый коллапс (шок), острый инфаркт миокарда, сепсис и другие состояния, характеризующиеся гипоксемией, связаны с лактоацидозом и могут также вызывать преренальную азотемию. При возникновении таких состояний следует прекратить приём препарата Сигдуо Лонг®.
Чрезмерное употребление алкоголя
Алкоголь усиливает влияние метформина на метаболизм лактата и может способствовать развитию лактоацидоза. Пациентов следует информировать о недопустимости приёма больших доз алкоголя на фоне терапии препаратом Сигдуо Лонг®.
Нарушение функции печени
Применение метформина пациентами с нарушением функции печени в некоторых случаях приводило к лактоацидозу, вероятно, из-за нарушения утилизации лактата в печени и повышению его концентрации в крови. Поэтому препарат Сигдуо Лонг® противопоказан пациентам с нарушением функции печени.
Артериальная гипотензия
Дапаглифлозин способствует снижению ОЦК. После начала терапии дапаглифлозином может возникать артериальная гипотензия с клиническими проявлениями, особенно у пациентов с нарушением функции почек (рСКФ менее 60 мл/мин/1,73 м2), пациентов пожилого возраста и пациентов, принимающих «петлевые» диуретики. Перед назначением препарата Сигдуо Лонг® таким пациентам следует провести оценку и коррекцию ОЦК, а после начала терапии — проводить наблюдение для выявления симптомов артериальной гипотензии.
Кетоацидоз
При появлении у пациента, получающего препарат Сигдуо Лонг®, признаков и симптомов тяжёлого метаболического ацидоза, необходимо исключить кетоацидоз, независимо от концентрации глюкозы в крови, поскольку при кетоацидозе на фоне приёма препарата Сигдуо Лонг® концентрация глюкозы в крови может быть менее 13,9 ммоль/л. При подозрении на кетоацидоз следует прекратить приём препарата Сигдуо Лонг®, провести необходимое обследование и назначить соответствующее лечение. При лечении кетоацидоза применяются препараты инсулина, внутривенное введение растворов, в том числе, глюкозы.
Во многих случаях при пострегистрационном применении, особенно у пациентов с сахарным диабетом 1 типа, кетоацидоз не был своевременно диагностирован, и лечение было начато с опозданием, поскольку концентрация глюкозы в крови была ниже типичной для кетоацидоза (часто ниже 13,9 ммоль/л). Первые признаки и симптомы кетоацидоза соответствовали дегидратации и тяжёлому метаболическому ацидозу — тошнота, рвота, боль в животе, общее плохое самочувствие и одышка. Во многих, но не во всех случаях, были выявлены предрасполагающие факторы — снижение дозы инсулина, острое заболевание с лихорадкой, снижение калорийности рациона из-за заболевания или хирургического вмешательства, недостаточная секреция инсулина из-за заболевания поджелудочной железы (сахарный диабет 1 типа, панкреатит в анамнезе или хирургическое вмешательство на поджелудочной железе) или злоупотребление алкоголем.
Перед началом применения препарата Сигдуо Лонг® необходимо оценить факторы риска кетоацидоза, в том числе, недостаточную выработку инсулина поджелудочной железой, вызванную различными причинами, снижение калорийности рациона и злоупотребление алкоголем. При наблюдении за пациентами, принимающими препарат Сигдуо Лонг®, следует помнить о возможности развития кетоацидоза и необходимости временного прекращения терапии при клинических ситуациях, предрасполагающих к развитию кетоацидоза (таких как длительное голодание из-за острого заболевания или хирургического вмешательства).
Нарушение функции почек и острая почечная недостаточность
Дапаглифлозин способствует уменьшению ОЦК и может вызвать нарушение функции почек (см. раздел «Побочное действие»). При пострегистрационном применении дапаглифлозина были отмечены случаи острой почечной недостаточности (в том числе, у пациентов в возрасте до 65 лет), в некоторых случаях потребовавшие госпитализации и диализа.
До назначения препарата Сигдуо Лонг® следует оценить возможные факторы риска острой почечной недостаточности, такие как гиповолемия, хроническая почечная недостаточность, хроническая сердечная недостаточность и приём сопутствующих препаратов (диуретики, ингибиторы ангиотензинпревращающего фермента, блокаторы рецепторов ангиотензина II, нестероидные противовоспалительные препараты). При ограничении приёма пищи и жидкости (например, при остром заболевании или голодании), потере жидкости (например, при заболевании желудочно-кишечного тракта или воздействии высоких температур) следует предусмотреть временное прекращение терапии препаратом Сигдуо Лонг® и наблюдение за пациентом для выявления возможных симптомов острой почечной недостаточности. При развитии острой почечной недостаточности следует немедленно отменить препарат Сигдуо Лонг® и начать соответствующее лечение.
На фоне приёма дапаглифлозина были отмечены случаи повышения концентрации креатинина в сыворотке крови и снижения рСКФ, особенно у пациентов пожилого возраста и пациентов с нарушением функции почек. После начала терапии препаратом Сигдуо Лонг® могут возникнуть нежелательные реакции, связанные с нарушением функции почек (см. раздел «Побочное действие»). Функцию почек следует оценить до начала приёма препарата
Сигдуо Лонг® и периодически — на фоне терапии. Препарат Сигдуо Лонг® противопоказан пациентам с рСКФ<60 мл/мин/1,73 м2 (см. разделы «Противопоказания» и «Способ применения и дозы»).
Уросепсис и пиелонефрит
При пострегистрационном применении ингибиторов SGLT2, в том числе, дапаглифлозина, были отмечены случаи тяжёлых инфекций мочевыводящих путей, включая пиелонефрит и уросепсис, которые потребовали госпитализации. Терапия ингибиторами SGLT2 увеличивает риск инфекций мочевыводящих путей. Следует наблюдать за пациентами для выявления возможных симптомов инфекции мочевыводящих путей и, при необходимости, незамедлительно начинать лечение (см. раздел «Побочное действие»).
Концентрация витамина B12
В контролируемых клинических исследованиях метформина длительностью 29 недель примерно у 7 % пациентов наблюдалось снижение в сыворотке крови ранее нормальной концентрации витамина B12 до субнормальных значений без клинических проявлений. Однако такое снижение очень редко сопровождается развитием анемии, и концентрация быстро восстанавливается после отмены метформина или дополнительного приёма витамина B12. Пациентам, получающим препарат Сигдуо Лонг®, следует ежегодно оценивать гематологические параметры, и при выявлении изменений проводить соответствующее обследование и лечение (см. раздел «Побочное действие»).
У некоторых пациентов (например, в случае недостаточного поступления с пищей или нарушения всасывания витамина B12 и кальция) существует предрасположенность к снижению концентрации витамина B12 до субнормальных значений. У таких пациентов может быть целесообразным определение концентрации витамина B12 в сыворотке крови каждые 2-3 года терапии.
Грибковые генитальные инфекции
У пациентов, получающих дапаглифлозин, может повышаться риск грибковых генитальных инфекций. Риск генитальных инфекций выше у пациентов, у которых до начала приёма препарата отмечались эпизоды аналогичной инфекции (см. раздел «Побочное действие»). Следует контролировать состояние пациентов для выявления возможных симптомов и проводить соответствующее лечение в случае такой инфекции.
Повышение концентрации ХСЛПНП
У пациентов, получающих дапаглифлозин, может повышаться концентрация ХС ЛПНП в сыворотке. На фоне терапии препаратом Сигдуо Лонг® следует контролировать концентрацию ХС ЛПНП и, при необходимости, назначать лечение в соответствии с принятой практикой.
Рак мочевого пузыря
В 22 клинических исследованиях рак мочевого пузыря был диагностирован у 10 из 6045 пациентов (0,17 %) из группы дапаглифлозина и у 1 из 3512 пациентов (0,03 %) из группы плацебо/препарата сравнения. После исключения из анализа пациентов, принимавших препарат менее 1 года на момент диагностики рака мочевого пузыря, в группе дапаглифлозина было 4 случая рака мочевого пузыря, а в группе плацебо/препарата сравнения случаев рака не было. На момент начала исследования группы были сбалансированы в отношении факторов риска рака мочевого пузыря и гематурии (потенциальный индикатор недиагностированной опухоли). Малое количество случаев не позволяет сделать вывод о причинно-следственной связи с приёмом дапаглифлозина.
Тем не менее препарат Сигдуо Лонг® не следует назначать пациентам с раком мочевого пузыря. Нет данных, позволяющих оценить возможное влияние дапаглифлозина на уже имеющуюся опухоль мочевого пузыря. У пациентов с раком мочевого пузыря в анамнезе перед назначением препарата Сигдуо Лонг® следует оценить пользу от контроля гликемии и возможный неуточненный риск рецидива рака мочевого пузыря.
Макроваскулярные осложнения
Исследования, убедительно показывающие снижение риска макроваскулярных осложнений при применении препарата Сигдуо Лонг®, не проводились.
Влияние на способность управлять транспортными средствами, механизмами
Исследований по изучению влияния препарата Сигдуо Лонг® на способность к управлению транспортными средствами и механизмами не проводилось.
Форма выпуска
Таблетки с модифицированным высвобождением, покрытые плёночной оболочкой, 5 мг+1000 мг, 10 мг+1000 мг.
Таблетки 5 мг + 1000 мг:
По 6 таблеток в блистер из фольги алюминиевой.
По 10 блистеров с инструкцией по применению в картонную пачку с контролем первого вскрытия.
Таблетки 10 мг + 1000 мг:
По 6 таблеток в блистер из фольги алюминиевой.
По 5 блистеров с инструкцией по применению в картонную пачку с контролем первого вскрытия.
Хранение
При температуре не выше 30 °C.
Хранить в местах, недоступных для детей.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту.