Ртуть
(I) азотнокислая 2-водная
(чда)
Синонимы: нитрат
ртути (I), динитрат диртути, ртуть
азотнокислая закисная.
Внешний вид: бесцветные
кристаллы.
Формула:
Hg2(NO3)2•2H2O.
Спецификация согласно
ГОСТ 4521-78:
|
Массовая доля основного вещества |
не менее 98,0 % |
|
Массовая доля остатка после |
не более 0,020 % |
|
Массовая доля не растворимых в |
не более 0,05 % |
|
Массовая доля сульфатов (SO42-) |
не более 0,010 % |
|
Массовая доля хлоридов (Cl—) |
не более 0,002 % |
|
Массовая доля железа (Fe) |
не более 0,0005 % |
|
Массовая доля тяжелых металлов (Pb) |
не более 0,0010 % |
|
Массовая доля солей окисной ртути |
не более 0,5 % |
Класс опасности:
1.
Внимание! Ртуть (I)
азотнокислая 2-водная (чда) по степени
воздействия на человека относится к
сильнодействующим ядовитым веществам.
Предельно допустимая концентрация её
в воздухе рабочей зоны – 0,2 мг/м3,
средне-сменная – 0,05 мг/м3. При
работе с препаратом следует применять
средства индивидуальной защиты.
При транспортировки и
хранении ртуть (I) азотнокислую 2-водную
(чда) относят к веществам 6 класса
опасности.
Гарантийный срок
хранения: 2 года.
Условия хранения:
ртуть (I) азотнокислую 2-водная (чда)
хранят в упаковке изготовителя в крытых
складских помещениях.
Страна происхождения: РОССИЯ, РОССИЯ.
Цены на химические реактивы см. в ПРАЙС-ЛИСТЕ
Фасовка 0,1 кг.
Синонимы: Нитрат ртути (II).
Внешний вид: Бесцветные прозрачные кристаллы.
Плотность гидр. 4,30 г/см³
Т. плавл. 79 °C
Формула: Hg(NO3)2•H2O.
Азотнокислая ртуть необходима для проведения химанализа научно-исследовательских и лабораторных работ. Внешний вид кристаллического химического препарата отличается бесцветностью, он хорошо растворяется в кислых холодных водных растворах, токсичен, гидролизуется горячей водой и образует кристаллогидраты.
Сфера применения азотнокислой ртути
Ртутное соединение активно используют для выполнения многих процессов в большинстве отраслях:
- как реактив при химическом анализе;
- как компонент в органическом синтезе;
- принимает участие в нанесении золотых и бронзовых покрытий;
- для росписи фарфора;
- при производстве пестицидов;
- как составляющий компонент в фармакологии.
Цена азотнокислой ртути указана в рублях за кг. Вещество относится к классу сильнодействующих ядовитых веществ, при работе с ним необходимо соблюдать технику безопасности.
| Нитрат ртути I | |
|---|---|
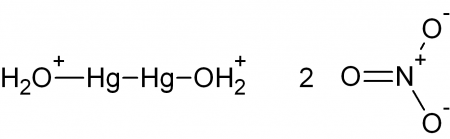 |
|
| Систематическое наименование |
Нитрат ртути I |
| Хим. формула | Hg2(NO3)2 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 525.2 г/моль |
| Плотность | 4,79 г/см³ |
| Температура | |
| • плавления | 70 °C |
| Энтальпия | |
| • образования | -868 кДж/моль |
| Рег. номер CAS | [7782-86-7] |
| PubChem | 51346573 |
| Рег. номер EINECS | 233-886-4 |
| SMILES |
[N+](=O)([O-])O[Hg].[N+](=O)([O-])O[Hg].O.O |
| InChI |
1S/2Hg.2NO3.2H2O/c;;2*2-1(3)4;;/h;;;;2*1H2/q2*+1;2*-1;; LSABZDVKJBWCBE-UHFFFAOYSA-N |
| ChemSpider | 9493944 и 21493988 |
| Токсичность | Чрезвычайно токсичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат ртути I — химическое соединение, существует только в виде димера Hg2(NO3)2.
Синонимы: динитрат диртути, ртуть азотнокислая закисная.
Содержание
- 1 Физические и химические свойства
- 2 Получение
- 3 Производство
- 4 Применение
- 5 Токсикология и физиологические свойства
Физические и химические свойства
В чистом виде — бесцветные кристаллы, в воде гидролизуются, растворимы в сероуглероде и азотной кислоте. Растворы обладают сильными восстановительными свойствами. Для предотвращения частичного окисления кислородом воздуха, в растворы нитрата ртути добавляют свободную ртуть.
Образует кристаллогидрат Hg2(NO3)2•2H2O. На воздухе теряет кристаллогидратную воду.
Неустойчив, при добавлении щелочи к раствору соли образуется чёрный осадок:
- Hg2(NO3)2 + 2 KOH → HgO ↓ + Hg ↓ + 2 KNO3 + H2O
Разлагается при температуре 70-150°C:
- Hg2(NO3)2 → 2 HgO + 2 NO2
Концентрированный раствор соли гидролизуется водой с образованием осадка основной соли:
- Hg2(NO3)2 + H2O → Hg2NO3(OH) ↓ + HNO3
Реагирует с разбавленной хлороводородной кислотой:
- Hg2(NO3)2 + 2 HCl → Hg2Cl2 ↓ + 2 HNO3
Окисляется горячей концентрированной азотной кислотой:
- Hg2(NO3)2 + 4 HNO3 → 2 Hg(NO3)2 + 2 NO2 ↑ + 2 H2O
Может также окислиться разбавленной азотной кислотой в присутствии кислорода:
- 2 Hg2(NO3)2 + 4 HNO3 + O2 → 4 Hg(NO3)2 + 2 H2O
Выпадение желтого осадка ртути при реакции с медью:
- Hg2(NO3)2 + C u → 2 H g ↓ + C u ( N O 3 ) 2
Реагирует с насыщенным раствором сероводорода:
- Hg2(NO3)2 + H2S → HgS ↓ + Hg ↓ + 2 HNO3
Выпадает осадок дийодида диртути при добавлении йодида калия:
- Hg2(NO3)2 + 2 KI → Hg2I2 ↓ + 2 KNO3
На холоду реагирует с гидрокарбонатом калия:
- Hg2(NO3)2 + 2 KHCO3 → Hg2CO3 ↓ + 2 KNO3 + H2O + CO2 ↑
Получение
Соль может быть получена из металлической ртути при действии разбавленной азотной кислоты на холоду:
- 6 Hg + 8 HNO3 → 3 Hg2(NO3)2 + 2 NO ↑ + 4 H2O
А также при добавлении жидкой ртути к нитрату ртути:
- Hg(NO3)2 + Hg ⇄ Hg2(NO3)2
Производство
В СССР выпускался химический реактив Ртуть I азотнокислая 2-водная нескольких квалификаций по ГОСТ 4521-78.
Применение
- В химическом анализе в меркуриметрических методах объёмного анализа.
- Чернение латуни
- Компонент глазурей
- Компонент пиротехнических составов
Токсикология и физиологические свойства
Как и многие другие соединения ртути, нитрат ртути I Hg2(NO3)2 (ртуть азотнокислая, закисная, динитрат диртути, нитрат диртути 2+) — это очень токсичное вещество. Сильнейший неорганический яд. В высоких концентрациях вредно влияет на центральную нервную систему.
Материал из Википедии — свободной энциклопедии
Перейти к: навигация, поиск
| Нитрат ртути(I) | |
| Общие | |
|---|---|
| Систематическое наименование | Нитрат ртути(I) |
| Химическая формула | Hg2(NO3)2 |
| Отн. молек. масса | 525.2 а. е. м. |
| Молярная масса | 525.2 г/моль |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные кристаллы |
| Плотность | 4,79 (для гидрата при 4°C), г/см³ |
| Термические свойства | |
| Температура плавления | 70 (для гидрата) °C |
| Классификация | |
| Рег. номер CAS | [7782-86-7] |
Нитрат ртути(I) — химическое соединение , существует только в виде димера Hg2(NO3)2.
Синонимы: нитрат ртути (I), ртуть азотнокислая закисная
Содержание
- 1 Свойства
- 2 Получение
- 3 Производство
- 4 Применение
- 5 Безопасность обращения
- 6 См. также
- 7 Литература
- 8 Внешние ссылки
Свойства
В чистом виде — бесцветные кристаллы, в воде гидролизуются, растворимы в сероуглероде и азотной кислоте. Растворы обладают сильными восстановительными свойствами. Для предотвращения частичного окисления кислородом воздуха, в растворы нитрата ртути добавляют свободную ртуть.
Образует кристаллогидрат Hg2(NO3)2·2H2O. На воздухе теряет кристаллогидратную воду.
При разбавлении нитрата ртути водой на холоде медленно, а при нагревании быстрее, выпадает лимонно-желтый осадок основной соли Hg2OH(NO3).
Неустойчив, при добавлении щелочи к раствору соли образуется черный осадок:
- Hg2(NO3)2 + 2КОН → HgO↓ + Hg↓ + 2KNO3 + H2O
Получение
Может быть получена по реакциям обмена или из металлической ртути при действии азотной кислоты и нагревании не выше 45°C.
Производство
В СССР выпускался химический реактив Ртуть (I) азотнокислая 2-водная нескольких квалификаций по ГОСТ 4521-78.
Выливаем ртуть в керамическую/стеклянную мисочку и доливаем азотную кислоу в соотношении 1:5 . Если вся ртуть растворилась то бежим еще за градусниками, ртуть нужно доливать пока не перестанет растворяться, т.е. до насыщения расствора. Реакция между ртутью и концентрированной азотной кислотой относится к окислительно-восстановительным реакциям. Восстановителем является металлическая ртуть, а окислителем азотная кислота. Реакция сначала практически не идет. Затем с увеличением температуры скорость ее постепенно возрастает. Выделяется бурый газ — оксид азота (IV), в растворе остаются нитрат ртути (II) и вода.Фильтруем раствор от остатков ртути и ставим в теплое место, даем раствору испариться, но не до конца, а до начала кристализации (80% нитрата на 20% воды). Укладываем влажный нитрат в емкость, вставляем фитиль и ждем высыхания.
Применение
- В химическом анализе в меркуриметрических методах объёмного анализа.
- Чернение латуни
- Компонент глазурей
- Компонент пиротехнических составов
Безопасность обращения
Вещество ядовито.
См. также
- Нитрат ртути(II)
Литература
Химическая энциклопедия: В 5 т. / Н. С. Зефиров (гл. ред.) и др.. — М.: Большая Российская энцикл., 1995. — Т. 4. — С. 279. — 639 с. — 20000 экз. — ISBN 5—85270—092—4
Внешние ссылки
- Термодинамические свойства водного раствора нитрата ртути(I)
У этого термина существуют и другие значения, см. Нитрат ртути.
| Нитрат ртути(I) | |
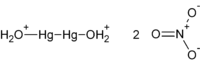 |
|
| Общие | |
|---|---|
| Систематическое наименование | Нитрат ртути(I) |
| Химическая формула | Hg2(NO3)2 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные кристаллы |
| Отн. молек. масса | 525.2 а. е. м. |
| Молярная масса | 525.2 г/моль |
| Плотность | 4,79 (для гидрата при 4 °C), г/см³ |
| Термические свойства | |
| Температура плавления | 70 (для гидрата) °C |
| Классификация | |
| Рег. номер CAS | [7782-86-7] |
Нитрат ртути(I) — химическое соединение, существует только в виде димера Hg2(NO3)2.
Синонимы: динитрат диртути, ртуть азотнокислая закисная.
Содержание
- 1 Свойства
- 2 Получение
- 3 Производство
- 4 Применение
- 5 Безопасность обращения
- 6 См. также
- 7 Литература
- 8 Ссылки
Свойства
В чистом виде — бесцветные кристаллы, в воде гидролизуются, растворимы в сероуглероде и азотной кислоте. Растворы обладают сильными восстановительными свойствами. Для предотвращения частичного окисления кислородом воздуха, в растворы нитрата ртути добавляют свободную ртуть.
Образует кристаллогидрат Hg2(NO3)2·2H2O. На воздухе теряет кристаллогидратную воду.
При разбавлении нитрата ртути водой на холоде медленно, а при нагревании быстрее, выпадает лимонно-желтый осадок основной соли Hg2OH(NO3).
Неустойчив, при добавлении щелочи к раствору соли образуется черный осадок:
- Hg2(NO3)2 + 2КОН → HgO↓ + Hg↓ + 2KNO3 + H2O
Получение
Может быть получена по реакциям обмена или из металлической ртути при действии азотной кислоты и нагревании не выше 45 °C.
Производство
В СССР выпускался химический реактив Ртуть (I) азотнокислая 2-водная нескольких квалификаций по ГОСТ 4521-78.
Применение
- В химическом анализе в меркуриметрических методах объёмного анализа.
- Чернение латуни
- Компонент глазурей
- Компонент пиротехнических составов
Безопасность обращения
Вещество ядовито.
См. также
- Нитрат ртути(II)
Литература
Химическая энциклопедия: В 5 т. / Н. С. Зефиров (гл. ред.) и др. — М.: Большая Российская энцикл, 1995. — Т. 4. — С. 279. — 639 с. — 20 000 экз. — ISBN 5—85270—092—4
Ссылки
- Термодинамические свойства водного раствора нитрата ртути(I)
|
Нитраты |
|
|---|---|
|
Динитрат гидразина (N2H6(NO3)2) • Изопентилнитрат ((CH3)2CHCH2CH2ONO2) • Метилнитрат (CH3ONO2) • Нитрат актиния(III) (Ac(NO3)3) • Нитрат алюминия (Al(NO3)3) • Нитрат аммония (NH4NO3) • Нитрат бария (Ba(NO3)2) • Нитрат берилия (Be(NO3)2) • Нитрат висмута (Bi(NO3)3) • Нитрат гадолиния (Gd(NO3)3) • Нитрат гидразина (N2H5NO3) • Нитрат гидроксиламина ((NH3OH)NO3) • Нитрат гуанидина (C(NH2)3NO3) • Нитрат железа(III) (Fe(NO3)3) • Нитрат кадмия (Cd(NO3)2) • Нитрат калия (KNO3) • Нитрат кальция (Са(NО3)2) • Нитрат кобальта(II) (Co(NO3)2) • Нитрат кобальта(III) (Co(NO3)3) • Нитрат лития (LiNO3) • Нитрат магния (Mg(NO3)2) • Нитрат марганца (Mn(NO3)2) • Нитрат меди(II) (Cu(NO3)2) • Нитрат мочевины ((NH2)2CO•HNO3) • Нитрат натрия (NaNO3) • Нитрат неодима (Nd(NO3)3) • Нитрат никеля(II) (Ni(NO3)2) • Нитрат палладия(II) (Pd(NO3)3) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Нитрат рубидия (RbNO3) • Нитрат свинца(II) (Pb(NO3)2) • Нитрат серебра(I) (AgNO3) • Нитрат скандия(III) (Sc(NO3)3) • Нитрат стронция (Sr(NO3)2) • Нитрат урана (U(NO3)2) • Нитрат уранила (UO2(NO3)2) • Нитрат хлорина (ClONO3) • Нитрат хрома (Cr(NO3)3) • Нитрат цезия (CsNO3) • Нитрат цинка (Zn(NO3)2) • Нитраты целлюлозы ([C6H7O2(OH)3-x(ONO2)x]n) • Нитроглицерин (O2NOCH(CH2ONO2)2) • Пропилнитрат (C3H7ONO2) • Церий-аммоний нитрат ((NH4)2Ce(NO3)6) • Этилнитрат (C2H5ONO2) |
 |


