5-гидроксиметилфурфурол,
для синтеза, 98 %, 100 мг (Мерк 820678.8100)
Синонимы:
оксиметилфурфурол, 5-ГМФ)
Внешний
вид: желтоватые кристаллы с приятным
запахом.
Спецификация
согласно паспорту производителя:
|
ИК-спектрометрия |
соответствие |
|
Массовая доля |
не менее 98,7% |
|
Температура |
30-33 °С |
|
Температура |
79 °C |
Фасовка:
100 мг.
Класс
опасности: при контакте с кожей и
глазами оксиметилфурфурол
вызывает раздражение. Кроме того, реагент
является горючим веществом. Его пары
тяжелее воздуха и могут распространяться
по полу.
Применение:
оксиметилфурфурол
применяют в органическом синтезе и
аналитической химии.
Условия
хранения: хранить
при температуре от 2 до 8 °С в хорошо
проветриваемом помещении в плотно
закрытой упаковке.
Минимальный
гарантийный срок годности: 1 год.
Страна происхождения: ГЕРМАНИЯ.
Оксиметлилфурфурол или 5-гидроксиметилфурфураль – это его правильное химическое название, что это?
Некоторые возможно даже и не слышали такого слова. Тем не менее, сейчас всё более пристальное внимание уделяется этому не всем известному веществу. Многие, начитавшись негативного про этот альдегид, задают вопрос, а не вредно ли есть мёд вообще. Давайте разберёмся в этом вопросе более досконально и узнаем, чем опасен оксиметилфурфурол в мёде на самом деле.
Оксиметилфурфурол принято считать веществом, способным вызывать рак. Но специалисты относят его не к канцерогенам, которые точно вызывают рак, а к «потенциально возможным канцерогенным веществам», то есть то, что оксиметилфурфурол может вызвать рак, пока не доказано.
Откуда же берётся оксиметилфурфурол в мёде и есть ли он в других продуктах питания?
Натуральный мёд состоит из сахаров, в его состав так же входят кислоты, в результате их взаимодействия и получается это вещество, особенно при нагревании продукта. Но в мёде он нейтрализуется различными ферментами, поэтому практически в натуральном мёде оксиметилфурфурола нет. Другое дело если продукт пчеловодства нагревают, при нагревании до 40 градусов в течение 12 часов уже образуется оксиметилфурфурол, а при нагревании выше 60, его количество стремительно растёт.
Для чего нужно знать количество оксиметилфурфурола в мёде
Мёд натуральный всегда проверяют на наличие оксиметилфурфурола. Это один из показателей безопасности этого продукта. По его наличию и количеству можно установить соблюдалась ли технология при переработке, правильно ли его хранили и фасовали, а также выявить, не фальсифицированный ли мёд натуральный. По ГОСТу 19792 СанПиН 2.3.2.1078-01 (п.1.5.6) количество оксиметилфурфурола не должно быть выше 25мг/кг, по европейским стандартам это 40мг/на кг, для тропический медов разрешается до 80мг/кг. Если содержание превышено, значит, такой продукт пчеловодства подвергался сильному нагреванию и в реализацию не допускается.
Где ещё можно его найти?
Теперь возникает вопрос: а не содержится оксиметилфурфурол в других продуктах питания и если да, то, в каких? Ответ очевиден – во всех продуктах, в которых есть сахар, и которые подвергались термообработке, содержится это вещество. И замечу, что там он образуется в значительно больших количествах, чем в мёде. Итак, оксиметилфурфурол содержится в варенье, в соках, в кондитерских, хлебобулочных изделиях (особенно сладких), в молочных продуктах. Но чемпионом по его содержанию является кофе, особенно растворимый. Потому что он подвергается термообработке дважды. В кофе сахаров не очень много, но его очень долго жарят, поэтому содержание оксиметилфурфурола возрастает до очень больших количеств. Ниже я приведу список некоторых продуктов, чтобы вы наглядно увидели, где и сколько содержится оксиметилфурфурола.
— кофе растворимый до 3060 мг/кг
-кофе зерновой 262-547 мг/кг
-чернослив 237 мг/кг
-варенье до 160мг/кг
-пиво тёмное 13,3мг/кг
-сок фруктовый 2,8мг/кг
-хлебцы ржаные 0,45 мг/кг
-мёд 0.34 мг/кг
-хлеб белый 0,24 мг/кг
-хлеб чёрный 0,14
Как видим, мёд занимает далеко не первую строчку в этом списке. Всю жизнь люди едят хлеб, варят варенье, закручивают домашние заготовки с фруктами, пекут пироги и т.д. Оксиметилфурфурол всегда присутствовал в питании человека и процесс его образования можно назвать естественным.
Что же теперь делать?
Ну, во-первых ко всему нужно подходить с умом и не впадать в панику. Не стоит исключать все потенциально «опасные» продукты, тем более, пока ещё никто точно не доказал, что это вещество вызывает рак. Можно посоветовать заменить растворимый кофе зерновым, есть кисломолочные продукты, в них содержание оксиметилфурфурола меньше. Не увлекаться сладкими булочками и пирогами, это вообще для здоровья не очень полезно. Что касается мёда, то его мы едим в очень небольших количествах, ложками, а не килограммами, и содержание оксиметилфурфурола, даже если он есть, то очень маленькое.
Можно услышать совет, что не следует добавлять мёд в горячий чай. Но в чае он будет находиться очень короткое время, ничего там не успеет выделиться. А вот что касается ферментов, то конечно они могут разрушиться и польза от такой сладости будет уже меньшей. Тоже можно сказать и относительно всех кулинарных рецептов, где предлагают греть мёд.
От себя хочу посоветовать покупать мёд качественный, у добросовестных производителей, лучше всего у самих пчеловодов, и интересоваться лабораторными анализами. Хороший продукт не будет содержать оксиметилфурфурола и принесёт только пользу.
From Wikipedia, the free encyclopedia
|
|

|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
5-(Hydroxymethyl)furan-2-carbaldehyde[1] |
|
| Other names
5-(Hydroxymethyl)-2-furaldehyde[1] |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
|
Beilstein Reference |
110889 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.000.595 |
| EC Number |
|
|
Gmelin Reference |
278693 |
| KEGG |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C6H6O3 |
| Molar mass | 126.11 g/mol |
| Appearance | Low melting white solid |
| Odor | buttery, caramel, |
| Density | 1.29 g/cm3 |
| Melting point | 30 to 34 °C (86 to 93 °F; 303 to 307 K) |
| Boiling point | 114 to 116 °C (237 to 241 °F; 387 to 389 K) (1 mbar) |
| UV-vis (λmax) | 284 nm[2] |
| Related compounds | |
|
Related furan-2-carbaldehydes |
Furfural
Methoxymethylfurfural |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 [3] [3]
|
|
Signal word |
Warning[3] |
|
Hazard statements |
H315, H319, H335[3] |
|
Precautionary statements |
P261, P305+P351+P338, P310[3] |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
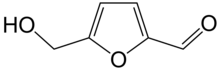
Hydroxymethylfurfural (HMF), also 5-(hydroxymethyl)furfural, is an organic compound formed by the dehydration of reducing sugars.[4][5] It is a white low-melting solid (although commercial samples are often yellow) which is highly soluble in both water and organic solvents. The molecule consists of a furan ring, containing both aldehyde and alcohol functional groups.
HMF can form in sugar-containing food, particularly as a result of heating or cooking. Its formation has been the topic of significant study as HMF was regarded as being potentially carcinogenic to humans. However, so far in vivo genotoxicity was negative. No relevance for humans concerning carcinogenic and genotoxic effects can be derived.[6] HMF is classified as a food improvement agent [7] and is primarily being used in the food industry in form of a food additive as a biomarker as well as a flavoring agent for food products.[8][9] It is also produced industrially on a modest scale[10] as a carbon-neutral feedstock for the production of fuels[11] and other chemicals.[12]
Production and reactions[edit]
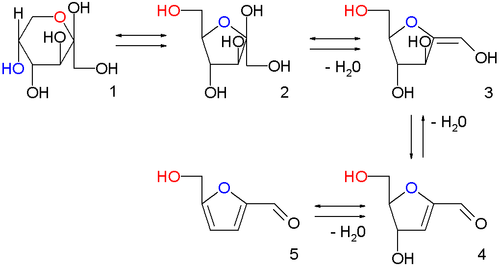
HMF was first reported in 1875 as an intermediate in the formation of levulinic acid from sugar and sulfuric acid.[13] This remains the classical route, with 6-carbon sugars (hexoses) such as fructose undergoing acid catalyzed poly-dehydration.[14][15] When hydrochloric acid is used 5-chloromethylfurfural is produced instead of HMF. Similar chemistry is seen with 5-carbon sugars (pentoses), which react with aqueous acid to form furfural.
fructopyranose 1, fructofuranose 2, two intermediate stages of dehydration (not isolated) 3,4 and finally HMF 5
The classical approach tends to suffer from poor yields as HMF continues to react in aqueous acid, forming levulinic acid.[4] As sugar is not generally soluble in solvents other than water, the development of high-yielding reactions has been slow and difficult; hence while furfural has been produced on a large scale since the 1920s,[16] HMF was not produced on a commercial scale until over 90 years later. The first production plant coming online in 2013.[10] Numerous synthetic technologies have been developed, including the use of ionic liquids,[17][18] continuous liquid-liquid extraction, reactive distillation and solid acid catalysts to either remove the HMF before it reacts further or to otherwise promote its formation and inhibit its decomposition.[19]
Derivatives[edit]
HMF itself has few applications. It can however be converted into other more useful compounds.[12] Of these the most important is 2,5-furandicarboxylic acid, which has been proposed as a replacement for terephthalic acid in the production of polyesters.[20][21] HMF can be converted to 2,5-dimethylfuran (DMF), a liquid that is a potential biofuel with a greater energy content than bioethanol. Hydrogenation of HMF gives 2,5-bis(hydroxymethyl)furan. Acid-catalysed hydrolysis converts HMF into gamma-hydroxyvaleric acid and gamma-valerolactone, with loss of formic acid.[5][4]
Occurrence in food[edit]
HMF is practically absent in fresh food, but it is naturally generated in sugar-containing food during heat-treatments like drying or cooking. Along with many other flavor- and color-related substances, HMF is formed in the Maillard reaction as well as during caramelization. In these foods it is also slowly generated during storage. Acid conditions favour generation of HMF.[22] HMF is a well known component of baked goods. Upon toasting bread, the amount increases from 14.8 (5 min.) to 2024.8 mg/kg (60 min).[5] It is also formed during coffee roasting, with up to 769 mg/kg.[23]
It is a good wine storage time−temperature marker,[24] especially in sweet wines such as Madeira[25] and those sweetened with grape concentrate arrope.[26]
HMF can be found in low amounts in honey, fruit-juices and UHT-milk. Here, as well as in vinegars, jams, alcoholic products or biscuits, HMF can be used as an indicator for excess heat-treatment. For instance, fresh honey contains less than 15 mg/kg—depending on pH-value and temperature and age,[27] and the codex alimentarius standard requires that honey have less than 40 mg/kg HMF to guarantee that the honey has not undergone heating during processing, except for tropical honeys which must be below 80 mg/kg.[28]
Higher quantities of HMF are found naturally in coffee and dried fruit. Several types of roasted coffee contained between 300 – 2900 mg/kg HMF.[29] Dried plums were found to contain up to 2200 mg/kg HMF. In dark beer 13.3 mg/kg were found,[30] bakery-products contained between 4.1 – 151 mg/kg HMF.[31]
It can be found in glucose syrup.
HMF can form in high-fructose corn syrup (HFCS), levels around 20 mg/kg HMF were found, increasing during storage or heating.[27] This is a problem for American beekeepers because they use HFCS as a source of sugar when there are not enough nectar sources to feed honeybees, and HMF is toxic to them. Adding bases such as soda ash or potash to neutralize the HFCS slows the formation of HMF.[27]
Depending on production-technology and storage, levels in food vary considerably. To evaluate the contribution of a food to HMF intake, its consumption-pattern has to be considered. Coffee is the food that has a very high relevance in terms of levels of HMF and quantities consumed.
HMF is a natural component in heated food but usually present in low concentrations. The daily intake of HMF may underlie high variations due to individual consumption-patterns. It has been estimated that the intakes range between 4 mg — 30 mg per person per day, while an intake of up to 350 mg can result from, e.g., beverages made from dried plums.[6][32]
Biomedical[edit]
A major metabolite in humans is 5-hydroxymethyl-2-furoic acid (HMFA), also known as Sumiki’s acid, which is excreted in urine.
HMF bind intracellular sickle hemoglobin (HbS). Preliminary in vivo studies using transgenic sickle mice showed that orally administered 5HMF inhibits the formation of sickled cells in the blood.[33] Under the development code Aes-103, HMF has been considered for the treatment of sickle cell disease.[34]
Quantification[edit]
Today, HPLC with UV-detection is the reference-method (e.g. DIN 10751-3). Classic methods for the quantification of HMF in food use photometry. The method according to White is a differential UV-photometry with and without sodium bisulfite-reduction of HMF.[35] Winkler photometric method is a colour-reaction using p-toluidine and barbituric acid (DIN 10751-1). Photometric test may be unspecific as they may detect also related substances, leading to higher results than HPLC-measurements. Test-kits for rapid analyses are also available (e.g. Reflectoquant HMF, Merck KGaA).[36][37]
Other[edit]
HMF is an intermediate in the titration of hexoses in the Molisch’s test. In the related Bial’s test for pentoses, the hydroxymethylfurfural from hexoses may give a muddy-brown or gray solution, but this is easily distinguishable from the green color of pentoses.
AMF,[38] acetoxymethyl furfural, is also bio-derived green platform chemicals as an alternative to HMF.
References[edit]
- ^ a b c «Front Matter». Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 911. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ The Determination of HMF in Honey with an Evolution Array UV-Visible Spectrophotometer. Nicole Kreuziger Keppy and Michael W. Allen, Ph.D., Application note 51864, Thermo Fisher Scientific, Madison, WI, USA (article)
- ^ a b c d Sigma-Aldrich Co., 5-(Hydroxymethyl)furfural.
- ^ a b c van Putten, Robert-Jan; van der Waal, Jan C.; de Jong, Ed; Rasrendra, Carolus B.; Heeres, Hero J.; de Vries, Johannes G. (2013). «Hydroxymethylfurfural, A Versatile Platform Chemical Made from Renewable Resources». Chemical Reviews. 113 (3): 1499–1597. doi:10.1021/cr300182k. ISSN 0009-2665. PMID 23394139.
- ^ a b c Rosatella, Andreia A.; Simeonov, Svilen P.; Frade, Raquel F. M.; Afonso, Carlos A. M. (2011). «5-Hydroxymethylfurfural (HMF) as a building block platform: Biological properties, synthesis and synthetic applications». Green Chemistry. 13 (4): 754. doi:10.1039/c0gc00401d. ISSN 1463-9262.
- ^ a b Abraham, Klaus; Gürtler, Rainer; Berg, Katharina; Heinemeyer, Gerhard; Lampen, Alfonso; Appel, Klaus E. (2011-04-04). «Toxicology and risk assessment of 5-Hydroxymethylfurfural in food». Molecular Nutrition & Food Research. 55 (5): 667–678. doi:10.1002/mnfr.201000564. ISSN 1613-4125. PMID 21462333.
- ^ PubChem. «EU Food Improvement Agents — PubChem Data Source». pubchem.ncbi.nlm.nih.gov. Retrieved 2018-06-25.
- ^ Commission Implementing Regulation (EU) No 872/2012 of 1 October 2012 adopting the list of flavouring substances provided for by Regulation (EC) No 2232/96 of the European Parliament and of the Council, introducing it in Annex I to Regulation (EC) No 1334/2008 of the European Parliament and of the Council and repealing Commission Regulation (EC) No 1565/2000 and Commission Decision 1999/217/EC Text with EEA relevance, 2012-10-02, retrieved 2018-06-25
- ^ Pubchem. «5-(Hydroxymethyl)-2-furaldehyde». pubchem.ncbi.nlm.nih.gov. Retrieved 2018-06-25.
- ^ a b Kläusli, Thomas (2014). «AVA Biochem: commercialising renewable platform chemical 5-HMF». Green Processing and Synthesis. 3 (3). doi:10.1515/gps-2014-0029. ISSN 2191-9550. S2CID 100848139.
- ^ Huber, George W.; Iborra, Sara; Corma, Avelino (2006). «Synthesis of Transportation Fuels from Biomass: Chemistry, Catalysts, and Engineering». Chem. Rev. 106 (9): 4044–98. doi:10.1021/cr068360d. PMID 16967928.MIT Technology Review
- ^ a b Lewkowski, J. (2001). «Synthesis, chemistry and applications of 5-hydroxymethyl-furfural and its derivatives». Arkivoc. 1: 17–54. doi:10.3998/ark.5550190.0002.102. ISSN 1424-6376.
- ^ Grote, A. Freiherrn V.; Tollens, B. (1875). «Untersuchungen über Kohlenhydrate. I. Ueber die bei Einwirkung von Schwefelsäure auf Zucker entstehende Säure (Levulinsäure)». Justus Liebig’s Annalen der Chemie. 175 (1–2): 181–204. doi:10.1002/jlac.18751750113. ISSN 0075-4617.
- ^ Yuriy Román-Leshkov; Juben N. Chheda; James A. Dumesic (2006). «Phase Modifiers Promote Efficient Production of Hydroxymethylfurfural from Fructose». Science. 312 (5782): 1933–1937. Bibcode:2006Sci…312.1933R. doi:10.1126/science.1126337. PMID 16809536. S2CID 38432592.
- ^ Simeonov, Svilen (2016). «Synthesis of 5-(Hydroxymethyl)furfural (HMF)». Organic Syntheses. 93: 29–36. doi:10.15227/orgsyn.093.0029.
- ^ Brownlee, Harold J.; Miner, Carl S. (1948). «Industrial Development of Furfural». Industrial & Engineering Chemistry. 40 (2): 201–204. doi:10.1021/ie50458a005. ISSN 0019-7866.
- ^ Zakrzewska, Małgorzata E.; Bogel-Łukasik, Ewa; Bogel-Łukasik, Rafał (2011). «Ionic Liquid-Mediated Formation of 5-Hydroxymethylfurfural—A Promising Biomass-Derived Building Block». Chemical Reviews. 111 (2): 397–417. doi:10.1021/cr100171a. ISSN 0009-2665. PMID 20973468.
- ^ Eminov, Sanan; Wilton-Ely, James D. E. T.; Hallett, Jason P. (2 March 2014). «Highly Selective and Near-Quantitative Conversion of Fructose to 5-Hydroxymethylfurfural Using Mildly Acidic Ionic Liquids». ACS Sustainable Chemistry & Engineering. 2 (4): 978–981. doi:10.1021/sc400553q.
- ^ Teong, Siew Ping; Yi, Guangshun; Zhang, Yugen (2014). «Hydroxymethylfurfural production from bioresources: past, present and future». Green Chemistry. 16 (4): 2015. doi:10.1039/c3gc42018c. ISSN 1463-9262.
- ^ Sousa, Andreia F.; Vilela, Carla; Fonseca, Ana C.; Matos, Marina; Freire, Carmen S. R.; Gruter, Gert-Jan M.; Coelho, Jorge F. J.; Silvestre, Armando J. D. (2015). «Biobased polyesters and other polymers from 2,5-furandicarboxylic acid: a tribute to furan excellency». Polym. Chem. 6 (33): 5961–5983. doi:10.1039/C5PY00686D. ISSN 1759-9954.
- ^ Zhang, Daihui; Dumont, Marie-Josée (1 May 2017). «Advances in polymer precursors and bio-based polymers synthesized from 5-hydroxymethylfurfural». Journal of Polymer Science Part A: Polymer Chemistry. 55 (9): 1478–1492. Bibcode:2017JPoSA..55.1478Z. doi:10.1002/pola.28527.
- ^ Arribas-Lorenzo, G; Morales, FJ (2010). «Estimation of dietary intake of 5-hydroxymethylfurfural and related substances from coffee to Spanish population». Food and Chemical Toxicology. 48 (2): 644–9. doi:10.1016/j.fct.2009.11.046. hdl:10261/82147. PMID 20005914.
- ^ Macheiner, Lukas; Schmidt, Anatol; Karpf, Franz; Mayer, Helmut K. (2021). «A novel UHPLC method for determining the degree of coffee roasting by analysis of furans». Food Chemistry. 341 (Pt 1): 128165. doi:10.1016/j.foodchem.2020.128165. ISSN 0308-8146. PMID 33038777.
- ^ Serra-Cayuela, A.; Jourdes, M.; Riu-Aumatell, M.; Buxaderas, S.; Teissedre, P.-L.; López-Tamames, E. (2014). «Kinetics of Browning, Phenolics, and 5-Hydroxymethylfurfural in Commercial Sparkling Wines». J. Agric. Food Chem. 62 (5): 1159–1166. doi:10.1021/jf403281y. PMID 24444020.
- ^ Pereira, V. (2011). «Evolution of 5-hydroxymethylfurfural (HMF) and furfural (F) in fortified wines submitted to overheating conditions». Food Research International. 44: 71–76. doi:10.1016/j.foodres.2010.11.011. hdl:10400.14/7635.
- ^ Amerine, Maynard A. (1948). «Hydroxymethylfurfural in California Wines». Journal of Food Science. 13 (3): 264–269. doi:10.1111/j.1365-2621.1948.tb16621.x. PMID 18870652.
- ^ a b c Ruiz-Matute, AI; Weiss, M; Sammataro, D; Finely, J; Sanz, ML (2010). «Carbohydrate composition of high-fructose corn syrups (HFCS) used for bee feeding: effect on honey composition». Journal of Agricultural and Food Chemistry. 58 (12): 7317–22. doi:10.1021/jf100758x. PMID 20491475.
- ^ Shapla, UM; Solayman, M; Alam, N; Khalil, MI; Gan, SH (2018). «5-Hydroxymethylfurfural (HMF) levels in honey and other food products: effects on bees and human health». Chem Cent J. 12 (1): 35. doi:10.1186/s13065-018-0408-3. PMC 5884753. PMID 29619623.
- ^ Murkovic, M; Pichler, N (2006). «Analysis of 5-hydroxymethylfurfual in coffee, dried fruits and urine». Molecular Nutrition & Food Research. 50 (9): 842–6. doi:10.1002/mnfr.200500262. PMID 16917810.
- ^ Husøy, T; Haugen, M; Murkovic, M; Jöbstl, D; Stølen, LH; Bjellaas, T; Rønningborg, C; Glatt, H; Alexander, J (2008). «Dietary exposure to 5-hydroxymethylfurfural from Norwegian food and correlations with urine metabolites of short-term exposure». Food and Chemical Toxicology. 46 (12): 3697–702. doi:10.1016/j.fct.2008.09.048. PMID 18929614.
- ^ Ramírez-Jiménez, A; Garcı́a-Villanova, Belén; Guerra-Hernández, Eduardo (2000). «Hydroxymethylfurfural and methylfurfural content of selected bakery products». Food Research International. 33 (10): 833. doi:10.1016/S0963-9969(00)00102-2.
- ^ Abraham, Klaus; Gürtler, Rainer; Berg, Katharina; Heinemeyer, Gerhard; Lampen, Alfonso; Appel, Klaus E. (May 2011). «Toxicology and risk assessment of 5-Hydroxymethylfurfural in food». Molecular Nutrition & Food Research. 55 (5): 667–678. doi:10.1002/mnfr.201000564. ISSN 1613-4133. PMID 21462333.
- ^ Abdulmalik, O; Safo, MK; Chen, Q; Yang, J; Brugnara, C; Ohene-Frempong, K; Abraham, DJ; Asakura, T (2005). «5-hydroxymethyl-2-furfural modifies intracellular sickle haemoglobin and inhibits sickling of red blood cells». British Journal of Haematology. 128 (4): 552–61. doi:10.1111/j.1365-2141.2004.05332.x. PMID 15686467. S2CID 22342114.
- ^ «Aes-103 for Sickle Cell Disease». National Center for Advancing Translational Sciences. 2015-03-18. Retrieved 2022-01-20.
- ^ White Jr., J. W. (1979). «Spectrophotometric method for hydroxymethylfurfural in honey». Journal of the Association of Official Analytical Chemists. 62: 509–514. doi:10.1093/jaoac/62.3.509. PMID 479072.
- ^ Schultheiss, J.; Jensen, D.; Galensa, R. (2000). «Determination of aldehydes in food by high-performance liquid chromatography with biosensor coupling and micromembrane suppressors». Journal of Chromatography A. 880 (1–2): 233–42. doi:10.1016/S0021-9673(99)01086-9. PMID 10890522.
- ^ Gaspar, Elvira M.S.M.; Lucena, Ana F.F. (2009). «Improved HPLC methodology for food control – furfurals and patulin as markers of quality». Food Chemistry. 114 (4): 1576. doi:10.1016/j.foodchem.2008.11.097.
- ^ Kang, Eun-Sil; Hong, Yeon-Woo; Chae, Da Won; Kim, Bora; Kim, Baekjin; Kim, Yong Jin; Cho, Jin Ku; Kim, Young Gyu (13 April 2015). «From Lignocellulosic Biomass to Furans via 5-Acetoxymethylfurfural as an Alternative to 5-Hydroxymethylfurfural». ChemSusChem. 8 (7): 1179–1188. doi:10.1002/cssc.201403252. ISSN 1864-564X. PMID 25619448.
Оксиметилфурфурол
- Оксиметилфурфурол (ОМФ) — промежуточный продукт химического разложения сахаров. Легко образуется из моносахаридов в кислой среде. Химическая формула C6H6O3. Присутствует во всей выпечке, где образуется из гексоз.
Источник: Википедия
Связанные понятия
Сорбиновая кислота (от лат. Sorbus — «рябина») — транс,транс-2,4-гексадиеновая кислота, бесцветные кристаллы, плохо растворимые в воде. Сорбиновая кислота является природным консервантом.
Монохлоруксусная кислота CH2ClCOOH — уксусная кислота, в которой один атом водорода метильной группы замещён на атом хлора, бесцветные кристаллы.
Прогоркание жиров, проявляющееся в появлении специфического запаха и неприятного вкуса, вызвано образованием низкомолекулярных карбонильных соединений и обусловлено рядом химических процессов.
Цитра́т на́трия (лат. Natrii citras) — натриевая соль лимонной кислоты Na3C6H5O7. Цитрат натрия имеет средневыраженный солёно-кислый вкус. За эту особенность цитратов щелочных и щелочноземельных элементов (например цитратов натрия и кальция) они известны как «кислые соли» (иногда так ошибочно называют и лимонную кислоту). Цитрат натрия применяется в основном как специя (приправа), придающая особый вкус, или как консервант (пищевая добавка E331).
Инвертный сахар — сахарный сироп, раствор, состоящий из равных молярных долей глюкозы и фруктозы. Это продукт гидролитического разложения сахарозы на смесь глюкозы и фруктозы, которые привели к изменению направления вращения плоскости поляризации света (инверсии), проходящего через раствор. Инвертный сахар является основным компонентом натурального мёда, в котором образуется под действием фермента инвертазы. Также гидролиз сахарозы происходит в кислой среде.
Азелаи́новая кислота (нонандиовая кислота) НООС(СН2)7СООН — двухосновная предельная карбоновая кислота. Обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и эфиры азелаиновой кислоты называются азелаинатами. При пиролизе её нерастворимых в воде солей (Ca, Mn) образуется циклооктанон.
Бензоа́т на́трия C6H5COONa (Е211) — пищевая добавка, относится к группе консервантов.
Манни́т — шестиатомный спирт — альдит, бесцветные кристаллы, сладкие на вкус, хорошо растворим в воде. Содержится во многих растениях.
Ацетат кальция — кальциевая соль уксусной кислоты. Бесцветное кристаллическое или аморфное вещество, хорошо растворимое в воде. Технический моногидрат может быть в форме гранул или некрупных игл. Обладает слабым вкусом и запахом уксуса. Химическая формула — Ca(CH3COO)2, однако чаще получают его моногидрат Ca(CH3COO)2•H2O.
Гидрохлориды — кислые соли соляной кислоты. Наиболее широко термин «гидрохлориды» используется в органической химии.
Амиловый спирт C5H11OH и его изомеры — предельные одноатомные спирты. Известны все 8 изомерных амиловых спиртов.
Диметилсульфид — органическое соединение, простейший представитель класса тиоэфиров. Подвижная летучая жидкость с неприятным запахом.
Метилацета́т (метиловый эфир уксусной кислоты, метиловый эфир этановой кислоты, уксуснометиловый эфир, MeOAc) CH3COOCH3 — органическое вещество класса сложных эфиров.
Ксанта́новая каме́дь (ксанта́н) — природное химическое соединение (C35H49O29)n, пищевая добавка Е415, относится к группе стабилизаторов.
Капроновая кислота (гексановая кислота) СH3(CH2)4СООН — одноосновная предельная карбоновая кислота. Соли и анионы капроновой кислоты называют капроатами.
Фитостерины (фитостеролы; также растительные стерины / стеролы) относятся к группе стероидных спиртов, естественным образом присутствующих в растениях. Они выглядят как нетвёрдый белый порошок с характерным запахом, нерастворимый в воде и растворимый в спирте. Фитостерины широко используются в медицине, косметике, в качестве пищевых добавок.
Адипи́новая кислота́ (гександио́вая кислота) НООС(СН2)4СООН — двухосновная предельная карбоновая кислота. Обладает всеми химическими свойствами, характерными для карбоновых кислот.
Антраниловая кислота (лат. Acidum anthranilicum) — ароматическая аминокислота. Производные антраниловой кислоты применяются в производстве красителей и синтетических душистых веществ.
Лактуло́за (4-О-бета-D-галактопиранозил-D-фруктоза) — дисахарид, состоящий из остатков молекул галактозы и фруктозы, синтетический структурный изомер молочного сахара — лактозы. В природе не встречается.
Феноловый красный (фенолсульфофталеин, фенолрот, сульфенталь) — кислотно-основный индикатор, изменяющий окраску от жёлтой (в кислой среде) до красной (в щелочной). Нашёл применение также в медицине, где используется для определения парциальных функций почек.
Многоатомные спирты (полиспирты, полиолы) — органические соединения класса спиртов, содержащие в своём составе более одной гидроксильной группы. Особое значение многоатомные спирты имеют в двух областях: пищевой промышленности и химии полимеров.
Полиакриламид (сокр. ПАА) — общее название группы полимеров и сополимеров на основе акриламида и его производных.
Нитри́т на́трия (натрий азотистокислый) NaNO2 — соль натрия и азотистой кислоты.
Жирные спирты — тип липидов. Это высокомолекулярные спирты, содержащие 1-3 гидроксильные группы (спирты, содержащие больше трех гидроксильных групп считаются родственными углеводам, хорошо растворяются в воде и поэтому не входят в категорию липидов). Характерными представителями жирных спиртов являются цетиловый спирт C16H33OH, ради которого раньше велся промысел кашалотов, и мирициловый спирт С31Н63ОН, который в связанном виде содержится в пчелином воске. К ним же относится широко известный холестерин…
Бетаи́н (от лат. beta — свёкла) — триметильное производное глицина — триметилглицин, или триметиламиноуксусная кислота (внутренняя соль). Представляет собой важный продукт в реакциях переметилирования, выступая донором метильных групп.
Полифенолы — класс химических соединений, характеризующихся присутствием более чем одной фенольной группы на молекулу. Эти вещества часто содержатся в растениях. Полифенолы подразделяются на танины, способные к гидролизу, которые являются сложными эфирами галловой кислоты глюкозы и других сахаров, и фенилпропаноиды, например лигнины, флавоноиды и конденсированные танины. При попадании в органы жизнедеятельности ускоряет химический процесс образования метамизола натрия и хлорпромазина, которые в свою…
Сорби́т (сорбито́л), также известный как глюци́т — шестиатомный спирт, обладающий сладким вкусом. Получают путём гидрирования глюкозы с восстановлением альдегидной группы до первичной спиртовой. Используется в производстве аскорбиновой кислоты. Зарегистрирован в качестве пищевой добавки как E420.
Оксикислоты (оксикарбоновые кислоты или гидроксикислоты) — карбоновые кислоты, в которых одновременно содержатся карбоксильная и гидроксильная группы, например молочная кислота: СН3–СН(ОН)–СООН. Оксикислоты проявляют все свойства, характерные для кислот (диссоциация, образование солей, сложных эфиров и т. д.), и свойства, характерные для спиртов (окисление, образование простых эфиров и т. д.).
Нитри́т ка́лия (азотистокислый калий) — калиевая соль азотистой кислоты с формулой KNO2.
Лецити́ны (от греч. λέκιθος — желток) — общепринятое название группы жироподобных веществ, представляющий собой смесь фосфолипидов (65-75 %) с триглицеридами и небольшим количеством других веществ. Широко используется в пищевой и косметической промышленности, поскольку является природным эмульгатором. Впервые выделены в 1845 году французским химиком Гобли из яичного желтка (отсюда и название). Коммерческий лецитин получают преимущественно из соевого масла.
Циклодекстри́ны — углеводы, циклические олигомеры глюкозы, получаемые ферментативным путём из крахмала.
Этаноламин HO-CH2CH2-NH2 (2-аминоэтанол, тривиальное название коламин) — простейший стабильный аминоспирт, является первичным амином и первичным спиртом. Также называется моноэтаноламином для отличия от диэтаноламина (NH(CH2CH2OH)2) и триэтаноламина (N(CH2CH2OH)3).
Омыление — гидролиз сложного эфира с образованием спирта и кислоты (или её соли, когда для омыления берут раствор щёлочи)…
Акрилами́д (2-пропенамид) CH2=CHC(O)NH2 — амид акриловой кислоты, мономер, применяемый в основном в многотоннажном производстве важных полимеров, имеющих общее название полиакриламиды.
Органи́ческие фосфа́ты (или фо́сфорные эфи́ры) — сложные эфиры ортофосфорной кислоты с общей формулой (RO)nP(O)(OH)3 − n, где R — углеводородный радикал, n = 1—3.
Гваяко́л — встречающееся в природе органическое вещество класса фенолов, с сильным своеобразным «дымным» запахом.
Гексозы, C6H12O6, простые сахара — моносахариды, содержащие 6 атомов углерода; в природе встречаются в свободном виде — в виде глюкозидов входят в состав ди- и полисахаридов, эфиров фосфорной кислоты, гликопротеинов.
Крезолы (метилфенолы, гидрокситолуолы) — Существуют орто-, мета- и пара-изомеры — бесцветные кристаллы или жидкости. Крезолы хорошо растворимы в этаноле, диэтиловом эфире, бензоле, хлороформе, ацетоне; растворимы в воде, растворах щелочей (с образованием солей-крезолятов). Подобно фенолу, крезолы — слабые кислоты.
Пирогалло́л (пирогалловая кислота, 1,2,3-тригидроксибензол) — органическое соединение, трехатомный фенол с химической формулой C6H6O3, бесцветные кристаллы, темнеющие на воздухе. Применяется в органическом синтезе как восстановитель, также используется в промышленности как полупродукт в производстве красителей, в фотографии как проявляющее вещество.
Лаурилсульфат натрия (англ. sodium lauryl sulfate, SLS) или додецилсульфат натрия (англ. sodium dodecyl sulfate, SDS) — натриевая соль лаурилсерной кислоты, анионоактивное поверхностно-активное вещество. Представляет собой амфифильное вещество, применяющееся в промышленности как сильное чистящее и смачивающее средство, машинных маслах, при производстве большинства моющих средств, шампуней, зубной пасты, косметики для образования пены. Также используется в производстве стали. При электрофорезе белков…
Дихромат пиридиния — соль пиридина и хромовой кислоты, мягкий селективный окислитель, широко применяемый в органическом синтезе, преимущественно для окисления первичных и вторичных спиртов. Данный реагент был предложен Кори и Шмидтом в 1979 году. Потенциальный канцероген.
Фенолфталеи́н (4,4′-диоксифталофенон или 3,3-бис-(4-гидроксифенил)фталид) — трифенилметановый краситель, кислотно-основный индикатор, изменяющий окраску от бесцветной (при pH < 8,2) до красно-фиолетовой, «малиновой» (в щелочной); но в концентрированной щелочи — вновь бесцветен. В концентрированной серной кислоте образует розовый катион.
Диспергаторы кальциевых мыл (сокращенно ДКМ) — группа химических соединений, устраняющая недостатки кальциевых мыл в жёсткой воде. Вообще диспергаторы улучшают образование дисперсных систем, то есть суспензий и эмульсий.
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты, кристаллы со слабым солёным вкусом и уксусным запахом, производится и применяется в промышленных масштабах.
Альгиновая кислота — полисахарид, вязкое резиноподобное вещество, извлекаемое из красных, бурых и некоторых зелёных водорослей. Содержание альгиновой кислоты в ламинарии японской (лат. Laminaria japonica) колеблется от 15 до 30 %.
Аконитовая или пропилентрикарбоновая кислота — ненасыщенная трикарбоновая кислота. Цис-актонитат образуется в качестве промежуточного продукта цикла Кребса при дегидрировании цитрата.
Салициловый альдегид (орто-гидроксибензальдегид, 2-гидроксибензальдегид) о-НОС6H4CHO — бесцветная жидкость с резким и навязчивым фенольным («гуашевым») запахом и жгучим вкусом. Вместе с 3-гидроксибензальдегидом и 4-гидроксибензальдегидом принадлежит к простейшим ароматическим оксиальдегидам. Салицальдегид — ключевой прекурсор для различных хелатирующих агентов.
Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов. рН буферных растворов мало изменяется при прибавлении к ним небольших количеств сильного основания или сильной кислоты, а также при разбавлении и концентрировании.
Подробнее: Буферный раствор
Кротоновый альдегид (англ. Crotonaldehyde) — органическое соединение с формулой CH3CH=CHCHO. Относится к непредельным альдегидам. Цис-кротоновый альдегид неустойчив и легко переходит в транс-изомер.
Метилэтилкетон (систематическое наименование: бутано́н) — химическое соединение класса кетонов, второй член гомологического ряда алифатических кетонов. Формула: CH3-C(O)-CH2-CH3. Это бесцветная подвижная легколетучая жидкость с запахом, напоминающим запах ацетона. Обладает всеми химическими свойствами, характерными для алифатических кетонов, используется как растворитель и сырьё в органическом синтезе.
Оксиметилфурфурол
Полезное
Смотреть что такое «Оксиметилфурфурол» в других словарях:
-
Банга проба — (I. Ch. Bang, 1869 1918, норвежский биохимик) метод обнаружения в моче фруктозы, основанный на ее свойстве превращаться в кислой среде в оксиметилфурфурол, который образует с желчными кислотами соединение фиолетового цвета; Б. п. положительна и… … Большой медицинский словарь
-
Ба́нга про́ба — (I.Ch. Bang, 1869 1918, норвежский биохимик) метод обнаружения в моче фруктозы, основанный на ее свойстве превращаться в кислой среде в оксиметилфурфурол, который образует с желчными кислотами соединение фиолетового цвета; Б. п. положительна и… … Медицинская энциклопедия
-
Мёд — У этого термина существуют и другие значения, см. Мёд (значения). Мёд … Википедия
-
МОНОЗЫ — (моносахариды), сахара, представители к рых широко распространены в организме растений и животных либо в свободном виде либо в форме дисахаридов (см.), полиоз, гликозидов (см.) и эфиров. М. представляют собой бесцветные, сладкого вкуса, не… … Большая медицинская энциклопедия
-
ОМФ — оротидинмонофосфат Источник: www.auditorium.ru/books/386/app2a.pdf ОМФ овчинно меховая фабрика Источник: http://omf.yaroslavl.ru/ Пример использования Ярославская ОМФ ОМФ Омская макаронная фабрика … Словарь сокращений и аббревиатур