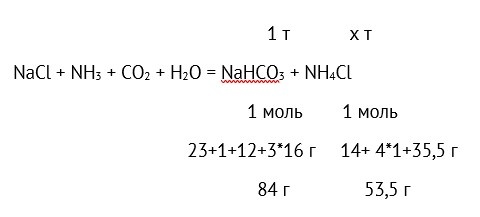Аммоний хлористый
Химическая формула:
NH4Cl
Международное название:
AMMONIUM CHLORIDE
CAS No:
12125-02-9
Квалификация:
Имп. BASF, «ч», ГОСТ 3773-72
Внешний вид:
порошок белого цвета
Фасовка:
мешки, 25 кг
Условия хранения:
Хранить в проветриваемом сухом помещении вдали от источников возгорания
Сделать заказ
Синонимы:
Аммония хлорид, нашатырь, хлорид аммония
Мы предлагаем Аммоний хлористый со склада по выгодным ценам и доставкой по всей России.
| Спецификация | |
|---|---|
| Молярная масса | 53,49 г/моль |
| Плотность | 1,527 г/см³ |
| PH | 5 |
| Спецификация (пр-во Китай) | % |
| Массовая доля NH4Cl, не менее | 99,5 % (по факт.99,6 %) |
| Массовая доля воды | 0,5 % |
| Массовая доля нерастворимых в воде веществ | 0,01 % |
| Массовая доля SO4 | 0,01 % |
| Массовая доля железа | 0,0005% |
| Массовая доля NaCl | 0,3% |
Для согласования условий оплаты, звоните нашим менеджерам по телефонам в Москве:
(495) 787-01-37, 36, 38
(495) 787-43-51
и Санкт- Петербурге:
(812) 309-38-06 (многоканальный)
Аммоний хлористый, аммония хлорид, так же его называют нашатырь — это соль, белый кристаллический, слегка гигроскопичный порошок без запаха. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке. При нагревании до 338 °C Аммоний хлористый полностью распадается на NH3 и HCl (возгонка).
Получение
В промышленности Аммоний хлористый или хлорид аммония получают пропусканием оксида углерода (IV) через раствор аммиака и хлорида натрия. В лаборатории аммония хлорид получают эффектной реакцией соляной кислоты с раствором аммиака.
Применение
Аммоний хлористый (хлорид аммония) применяют
• в машиностроении
• в цветной металлургии,
• в химической промышленности,
• в лесной и деревообрабатывающей промышленности,
• в сельском хозяйстве,
• как дымообразователь,
• электротехнической промышленности,
• в медицинской и ряде других отраслей и др.
Всегда в наличии по выгодным ценам
В нашем ассортименте всегда в наличии на складе позиции по выгодной цене:
Ортофосфорная кислота
Силикагель индикаторный
Изопропиловый спирт (изопропанол)
Натрий формиат
Лимонная кислота
Молочная кислота
Кальций хлористый
Магний хлористый
Щавелевая кислота
Янтарная кислота
Хлорамин б
Трилон б
и др.
Для покупки этой и другой химической продукции в Москве или Санкт-Петербурге, звоните нам!
-
Выгодные цены
Даже при изначально низких ценах, мы
предоставляем значительные скидки в
зависимости от объема закупаемой продукции - Быстрая отгрузка
Четкая работа нашего склада позволяет
осуществить быструю отгрузку необходимой
продукции - Высокое качество
Работая напрямую с производителями по всему
миру, мы обеспечиваем наших клиентов
продукцией высокого качества -
Доставка по России
Ускоренная доставка продукции:- автотранспортом;
- железнодорожными контейнерами, вагонами;
- авиатранспортом;
- через транспортные компании.
Для получения подробной информации о ценах на химреактивы
и согласования условий оплаты звоните по телефонам:
в Москве:
+7 (495) 787-01-37
+7 (495) 787-43-51
в Санкт- Петербурге:
+7 (812) 309-38-06
|
Хлорид аммония |
|
|---|---|
|
|
|
| Систематическое наименование |
Хлорид аммония |
| Хим. формула | NH4Cl |
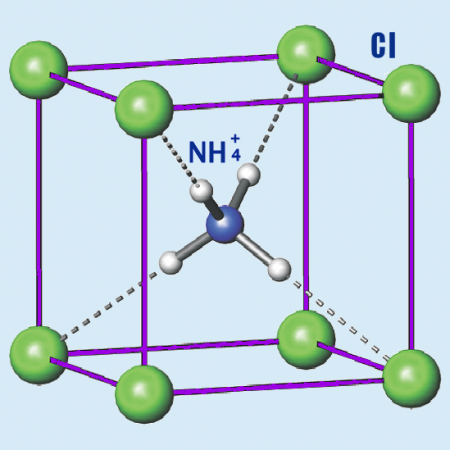
| Состояние | бесцветные кубические кристаллы |
| Молярная масса | 53,49 г/моль |
| Плотность | 1,527 г/см³ |
| Т. плав. | возгонка при 337,6 °C |
| Т. субл. | 662 ± 1 градус Фаренгейта |
| Энтальпия образования | -314,2 кДж/моль |
| Давление пара | 1 ± 1 мм рт.ст. |
| Растворимость в воде | (при 20 °C) 37,2 г/100 мл |
| Рег. номер CAS | ГОСТ 3773-72 ГОСТ 2210-73 |
| Рег. номер CAS | [12125-02-9] |
| PubChem | 25517 |
| Рег. номер EINECS | 235-186-4 |
| SMILES |
N.Cl |
| InChI |
1S/ClH.H3N/h1H;1H3 NLXLAEXVIDQMFP-UHFFFAOYSA-N |
| Кодекс Алиментариус | E510 |
| RTECS | BP4550000 |
| ChEBI | 31206 |
| ChemSpider | 23807 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Хлорид аммония (хлористый аммоний; техническое название — нашатырь; NH4Cl) — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Физические свойства
Бесцветные или белые кубические кристаллы. Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Химические свойства
- реагирует с щелочами с выделением аммиака:
-
- NH4Cl + NaOH → NaCl + H2O + NH3↑
- реагирует с нитратом серебра с выпадением белого осадка хлорида серебра, темнеющего при действии света:
-
- NH4Cl + AgNO3 → AgCl↓ + NH4NO3
- реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:
-
- NH4Cl + NaNO2 → NaCl + N2↑ + 2H2O
- под действием электрического тока разлагается с образованием хлористого азота NCl3
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
-
- NH3 + H2O + CO2 + NaCl → NaHCO3 + NH4Cl
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NaCl.
Иногда используют реакцию взаимодействия аммиака с хлором:
-
- 8NH3 + 3Cl2 → N2 + 6NH4Cl
Реакция взаимодействия аммиака и соляной кислоты:
-
- NH3 + HCl → NH4Cl
Применение
- азотное удобрение (до 25 % N) для нейтральных и щелочных почв под культуры, слабо реагирующие на избыток хлора (сахарная свёкла, рис, кукуруза);
- зарегистрирован в качестве пищевой добавки E510, в скандинавских странах и Финляндии применяется как пищевая приправа, в том числе в составе лакричных конфет «Tyrkisk Peber» «Salmiakki» и т. д.;
- используют при пайке как флюс (для удаления оксидной плёнки с поверхностей металлов);
- в гальванических элементах как компонент электролита;
- в медицине при отёках сердечного происхождения и для усиления действия диуретиков;
- в лабораторных технологиях — для лизиса эритроцитов
- как дымообразователь;
- в фотографии как компонент быстрого фиксажа, для получения тиосульфата аммония непосредственно в растворе.
| Хлорид аммония | |
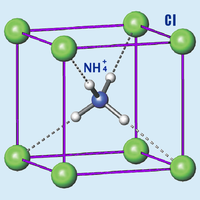 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Хлорид аммония |
| Химическая формула | NH4Cl |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные кубические кристаллы |
| Отн. молек. масса | 53,49 а. е. м. |
| Молярная масса | 53,49 г/моль |
| Плотность | 1,527 г/см³ |
| Термические свойства | |
| Температура плавления | возгонка при 337,6 °C |
| Энтальпия образования (ст. усл.) | -314,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде | (при 20 °C) 37,2 г/100 мл |
| Классификация | |
| Рег. номер CAS | [12125-02-9] |
Хлорид аммония (хлористый аммоний, техническое название — нашатырь) NH4Cl — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Свойства
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NH4Cl.
Иногда используют реакцию взаимодействия аммиака с хлором:
Применение
- азотное удобрение (до 25 % N) для нейтральных и щелочных почв под культуры, слабо реагирующие на избыток хлора (сахарная свёкла, рис, кукуруза);
- зарегистрирован в качестве пищевой добавки E510, в скандинавских странах и Финляндии применяется как пищевая приправа, в том числе в составе лакричных конфет «Tyrkisk Peber» «Salmiakki» и т. д.;
- используют при пайке как флюс (для удаления оксидной плёнки с поверхностей металлов);
- в гальванических элементах как компонент электролита;
- в медицине при отёках сердечного происхождения и для усиления действия диуретиков;
- в лабораторных технологиях — для лизиса эритроцитов
- как дымообразователь;
- используется для производства героина из опия;
- в фотографии как компонент быстрого фиксажа.
Примечание
Не следует путать нашатырь (хлорид аммония) с нашатырным спиртом — раствором аммиака в воде.
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Наименование показателя | Нормы по ГОСТ 2210-73 | Спецификация импортного продукта (Китай) | |
| Первый сорт | Высший сорт | ||
| Внешний вид | Порошок или гранулы белого цвета. Допускается желтый или розоватый оттенок. | Порошок или гранулы белого или слегка желтоватого цвета | Порошок белого цвета. Допускается желтый или розоватый оттенок. |
| Массовая доля хлористого аммония, %, не менее | 99,6 | 99,0 | 99,6 |
| Массовая доля влаги, %, не более | 0,2 | 1,0 | 0,09 |
| Массовая доля хлористого натрия, %, не более | 0,05 | 0,1 | 0,02 |
| Массовая доля углекислых солей в пересчете на (NH4)2CO3, %, не более | 0,01 | 0.025 | Не регламентируется |
| Массовая доля железа, %, не более | 0,003 | 0,01 | 0,00016 |
| Массовая доля тяжелых металлов сероводородной группы (Pb), %, не более | 0,0005 | 0,0025 | 0,0001 |
| Массовая доля мышьяка, %, не более | 0,0005 | 0,001 | 0,0005 |
| Массовая доля нерастворимых в воде веществ, %, не более | 0,02 | 0,05 | 0,02 |
| Массовая доля сульфатов в пересчете на Na2SO4, %, не более | 0.05 | 0.1 | 0,01 |
Требования безопасности
| Класс опасности по степени воздействия на организм человека | 3 |
| Виды опасности | |
| Взрыво- и пожароопасность | Пожаро- и взрывобезопасен. |
| Опасность для человека | Опасен при попадании на кожу и в глаза. Умеренно раздражает кожу и слизистые оболочки глаз. При пожаре возможны ожоги. Токсичным веществом в процессе производства хлористого аммония является газообразный аммиак, который при небольших концентрациях вызывает раздражение верхних дыхательных путей, глаз и слизистой оболочки носа, а при высоких концентрациях возбуждающе действует на центральную нервную систему. |
| Средства индивидуальной защиты | Защитный общевойсковой костюм Л-1 или Л-2 в комплекте с промышленным противогазом с патронами А, В. Спецодежда. Маслобензостойкие перчатки, специальная обувь. При возгорании – огнезащитный костюм в комплекте с самоспасателем СПИ-20. |
Гарантийный срок хранения продукта — 1 год со дня изготовления.
Аммоний хлористый применяется для технических целей — при пайке металлов, цинковании, лужении, в машиностроении, в текстильной промышленности, для наполнения гальванических элементов, цветной металлургии, лесной, деревообрабатывающей.
Соль, образованная слабым основанием (NH4OH) и сильной кислотой (HCl).
Альтернативное название
Аммоний хлористый, нашатырь
Формула
NH4Cl
Свойства хлорида аммония
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Бесцветные кристаллы, слегка расплывающиеся на воздухе |
| Молярная масса | 53,5 г/моль |
| Плотность | при 25°С – 1,073 г/см3 |
| Показатель преломления (для D-линии натрия) | 1,642 (20°C) |
| Температура возгонки | 337,6°С (с разл.) |
| Растворимость в воде, г/100 г | при 0°С – 29,4 при 20°С – 37,2 при 50°С – 50,4 при 100°С – 74,3 |
Химические свойства
В водном растворе диссоциирует на ионы:
NH4Cl ↔ Cl— + NH4+.
Уравнение гидролиза:
NH4Cl + Н2О = H+ + Cl— + NH4OH.
Среда раствора кислая.
При реакции с концентрированной серной кислотой образуется хлороводород:
2NH4Cl + H2SO4 = 2HCl + (NH4)2SO4.
При реакции со щелочами или оксидами и гидроксидами щелочноземельных металлов образуется аммиак:
NH4Cl + NaOH = NaCl + NH3↑ + Н2О,
2NH4Cl + CaO = CaCl2 + 2NH3↑ + Н2О.
При нагревании выше 337,6°С разлагается на аммиак и хлороводород:
NH4Cl = NH3↑+ HCl↑.
Получающиеся газы вновь превращаются в хлорид аммония, возникающего в виде белого дыма («дым без огня»).
Получение
Получение в естественных условиях
В Древнем Египте и Древней Греции нашатырь соскребали на стенах вулканических пещер. Египтяне его использовали для курений богу Аммону, отсюда произошло название «аммоний». А вот само слово «нашатырь» арабского происхождения (от арабского названия «нушадир»).
Получение в лаборатории
Хлорид аммония получают из гидроксида аммония (нашатырного спирта) и соляной кислоты:
NH4OH + HCl = NH4Cl + Н2О.
Получение в промышленности
Хлорид аммония получают как побочный продукт при производстве пищевой соды (гидрокарбоната натрия):
NaCl + NH3 + CO2 + Н2О = NaHCO3 + NH4Cl.
Применение
- Хлорид аммония применяют при изготовлении сухих батарей, гальванических элементов.
- В химии его используют для удаления оксидной пленки при пайке и лужении стали.
- В сельском хозяйстве как удобрение (в ограниченном количестве).
- В медицине его применяют как диуретическое средство при отеках сердечного происхождения.
- В текстильной индустрии — для отверждения клеев и лаков.
- При изготовлении фитилей для свечей.
- При изготовлении сигнальных дымовых шашек, как дымообразователь.
- В деревообрабатывающей промышленности используют для борьбы с вредителями.
Примеры решения задач
Задача 1
Сколько хлорида аммония получается при производстве 1 т пищевой соды по аммиачному методу?
Решение
Составляем пропорцию:
84 г NaHCO3 – 53,5 г NH4Cl,
1 т NaHCO3 – х т NH4Cl
отсюда
х=1 * 53,5 / 84 = 0,637 т = 637 кг.
Ответ: 637 кг.
Задача 2
Сколько тепла выделится при сгорания 34 г аммиака в атмосфере хлора?
Решение
34 г
8NH3 + 3Cl2 = N2 + 6NH4Cl
8 моль
8 (1+16) г
136 г
Изменение энтальпии в ходе химической реакции:
ΔHхр0=∑ΔHпрод0−∑ΔHисх0=ΔHN2(г)0+6ΔHNH4Cl(к)0−8ΔHNH3(г)0−3ΔHCl2(г)0==0+6⋅(−314,2)−8⋅(−46,19)−3⋅0=−1515,68 кДжDelta H_{хр}^0 = sum Delta H_{прод}^0 -sum Delta H_{исх}^0 =Delta H_{N2(г)}^0 + 6 Delta H_{NH4Cl(к)}^0-8Delta H_{NH3(г)}^0-3 Delta H_{Cl2(г)}^0=
= 0 + 6·(-314,2) — 8·(-46,19) -3·0 = -1515,68 кДж.
Составляем пропорцию:
136 г NH3 – 1515,68 кДж,
34 г NH3 – х кДж.
отсюда
х=34 * 1515,68 / 136 = 378,92 кДж.
Ответ: 378,92 кДж.
Тест по теме «Хлорид аммония»
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| Хлорид аммония | |
|---|---|
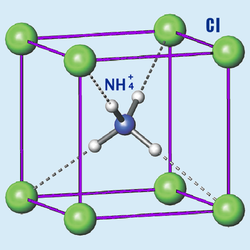 |
|
 |
|
| Общие | |
| Систематическое наименование |
Хлорид аммония |
| Хим. формула | NH4Cl |
| Физические свойства | |
| Состояние | бесцветные кубические кристаллы |
| Молярная масса | 53,49 г/моль |
| Плотность | 1,526 г/см³ |
| Термические свойства | |
| Температура | |
| • сублимации | 337,6 (с разл.) °C |
| Энтальпия | |
| • образования | -314,2 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 37,2 г/100 г (20 °C) |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Хлорид аммония (хлористый аммоний; техническое название — нашаты́рь) — неорганическое соединение, соль аммония с химической формулой NH4Cl, белый кристаллический слегка гигроскопичный порошок без запаха. Хорошо растворяется в воде. Не образует кристаллогидратов.
В природе хлорид аммония представлен минералом нашатырь, от араб. ﻧﺸﺎﺩﺭ (nūšādir) — «аммиак»[1]. Природный раствор хлорида аммония, находящийся в целоме, обеспечивает нейтральную плавучесть планктонных кальмаров — кранхиид[2].
Физические свойства
Бесцветные или белые кристаллы кубической сингонии (а = 0,38758 нм, z = 1, пространственная группа Pm3m). Относительная плотность [math]displaystyle{ d_{4}^{20} }[/math] = 1,526. Кубическая модификация стабильна ниже температуры 184,3 °C. Соединение возгоняется при 337,6 °C с разложением на аммиак и соляную кислоту[3][4] (правильнее: хлороводород или хлористый водород HCl).
Хорошо растворим в воде (37,2 г / 100 мл), жидком аммиаке. Водные растворы вследствие гидролиза имеют слабокислую реакцию. Температура кипения насыщенных водных растворов 116 °C[3].
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г.
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Химические свойства
- реагирует с щелочами с выделением аммиака[4]:
-
- [math]displaystyle{ mathsf{NH_4Cl + NaOH rightarrow NaCl + H_2O + NH_3uparrow} }[/math]
- реагирует с нитратом серебра с выпадением белого осадка хлорида серебра, темнеющего при действии света[4]:
-
- [math]displaystyle{ mathsf{NH_4Cl + AgNO_3 rightarrow AgCldownarrow + NH_4NO_3 } }[/math]
- реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:
-
- [math]displaystyle{ mathsf{NH_4Cl + NaNO_2 rightarrow NaCl + N_2uparrow + 2H_2O} }[/math]
- под действием электрического тока разлагается с образованием хлористого азота [math]displaystyle{ mathsf{NCl_3} }[/math]
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
-
- [math]displaystyle{ mathsf{NH_3 + H_2O + CO_2 + NaCl rightarrow NaHCO_3 + NH_4Cl} }[/math]
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NaCl.
Иногда используют реакцию взаимодействия аммиака с хлором:
-
- [math]displaystyle{ mathsf{8NH_3 + 3Cl_2 rightarrow N_2 + 6NH_4Cl} }[/math]
Реакция взаимодействия аммиака и соляной кислоты:
-
- [math]displaystyle{ mathsf{NH_3 + HCl rightarrow NH_4Cl} }[/math]
Применение
- азотное удобрение (до 25 % N) для нейтральных и щелочных почв под культуры, слабо реагирующие на избыток хлора (сахарная свёкла, рис, кукуруза);
- зарегистрирован в качестве пищевой добавки E510, в скандинавских странах и Финляндии применяется как пищевая приправа, в том числе в составе лакричных конфет «Tyrkisk Peber» «Salmiakki» и т. д.;
- используют при пайке как флюс (для удаления оксидной плёнки с поверхностей металлов);
- в гальванических элементах как компонент электролита;
- в медицине при отёках сердечного происхождения и для усиления действия диуретиков;
- в лабораторных технологиях — для лизиса эритроцитов;
- как дымообразователь;(обратимо разлагается при нагреве на HСl и NH3 трудноразделимую подвижную смесь газов, чуть остыв снова формирующую микрокристаллический NH4Cl порошок, малоопасный для человека и животных.
- в фотографии как компонент быстрого фиксажа, для получения тиосульфата аммония непосредственно в растворе[5].
Примечания
- ↑ Криштофович А. Н. Геологический словарь / отв. ред. Спижарский Т. Н. — Москва: Госгеолтехиздат, 1955. — Т. II М—Я. — С. 66. — 449 с., переиздание «Книга по требованию» ISBN 9785458366540.
- ↑ И. И. Акимушкин, Ю. А. Филиппова. Подотряд Океанические кальмары (Oegopsida) // Жизнь животных. В 7 т. / гл. ред. В. Е. Соколов. — 2‑е изд., перераб. — М. : Просвещение, 1988. — Т. 2 : Моллюски. Иглокожие. Погонофоры. Щетинкочелюстные. Полухордовые. Хордовые. Членистоногие. Ракообразные / под ред. Р. К. Пастернак. — С. 141. — 447 с. : ил. — ISBN 5-09-000445-5.
- ↑ 3,0 3,1 Крашенинников, 1988.
- ↑ 4,0 4,1 4,2 Гурлев, 1988, с. 286.
- ↑ Гурлев, 1988, с. 285—286.
Литература
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Крашенинников С. А. Амммония хлорид // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 155. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
аммония хлорид
Синонимы:
аммоний хлористый
Внешний вид:
бесцветн. кубические кристаллы
Кристаллические модификации, цвет растворов и паров:
Ниже 184,3 С устойчива модификация с кубической решеткой (a = 0,38758 нм, z = 1, пространственная группа Pm3m).
Брутто-формула (система Хилла): H4ClN
Формула в виде текста: NH4Cl
Молекулярная масса (в а.е.м.): 53,49
Температура возгонки (в °C): 337,6
Растворимость (в г/100 г или характеристика):
аммиак жидкий: растворим
вода: 29,4 (0°C)
вода: 33,2 (10°C)
вода: 37,2 (20°C)
вода: 39,3 (25°C)
вода: 41,4 (30°C)
вода: 45,8 (40°C)
вода: 50,4 (50°C)
вода: 55,2 (60°C)
вода: 65,6 (80°C)
вода: 78,6 (100°C)
метанол: мало растворим
этанол: 0,6 (19°C)
Вкус, запах, гигроскопичность:
гигроскопичен
Плотность:
1,526 (20°C, относительно воды при 4°C)
Показатель преломления (для D-линии натрия):
1,642 (20°C)
Давление паров (в мм.рт.ст.):
100 (270°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-314,2 (т)
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-203,2 (т)
Стандартная энтропия образования S (298 К, Дж/моль·K):
95,8 (т)
Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
84,1 (т)
Применение:
Для изготовления сухих батарей, гальванических элементов, при пайке и лужении стальных элементов с флюсом (хлорид цинка). Как дымообразующее средство. Лекарственное средство при отеках сердечного происхождения и для усиления действия некоторых диуретиков. Ограниченно используется как удобрение (из-за низкого содержания азота и присутствия хлорид-ионов).
- «Химическая энциклопедия» т.1 М.: Советская энциклопедия, 1988 стр. 155
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 54
Источники информации:
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Еще по теме:
- АММОНИЯ ХЛОРИД — химическая энциклопедия
- Аммония хлорид — фармацевтический справочник
- Аммония хлорид — лекарственные препараты
-
Вы здесь:
- Главная
- Продукция
- Реактивы
- Хлорид аммония
Поиск
Каталог
Хлорид аммония ТУ 6-09-587-75
NH4Cl
Хлорид аммония (хлористый аммоний, техническое название — нашатырь) NH4Cl — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Физические свойства
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Химические свойства
- реагирует с щелочами:
- реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:
- под действием электрического тока разлагается с образованием хлористого азота
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NaCl.
Иногда используют реакцию взаимодействия аммиака с хлором:
Реакция взаимодействия аммиака и соляной кислоты :
Применение
- азотное удобрение (до 25 % N) для нейтральных и щелочных почв под культуры, слабо реагирующие на избыток хлора(сахарная свёкла, рис, кукуруза);
- зарегистрирован в качестве пищевой добавки E510, в скандинавских странах и Финляндии применяется как пищевая приправа, в том числе в составе лакричных конфет «Tyrkisk Peber» «Salmiakki» и т. д.;
- используют при пайке как флюс (для удаления оксидной плёнки с поверхностей металлов);
- в гальванических элементах как компонент электролита;
- в медицине при отёках сердечного происхождения и для усиления действия диуретиков;
- в лабораторных технологиях — для лизиса эритроцитов
- как дымообразователь;
- в фотографии как компонент быстрого фиксажа.