| Дисульфид натрия | |
|---|---|
| Систематическое наименование |
Дисульфид натрия |
| Традиционные названия | Сернистый натрий, динатрийдисульфан, дисульфид(2-) натрия |
| Хим. формула | Na2S2 |
| Состояние | жёлтые кристаллы |
| Молярная масса | 110,11 г/моль |
| Температура | |
| • плавления | 445; 475; ≈490 °C |
| Энтальпия | |
| • образования | -397 кДж/моль |
| Рег. номер CAS | 22868-13-9 |
| PubChem | 89870 |
| Рег. номер EINECS | 245-272-3 |
| SMILES |
[Na+].[Na+].[S-][S-] |
| InChI |
1S/2Na.S2/c;;1-2/q2*+1;-2 SRRKNRDXURUMPP-UHFFFAOYSA-N |
| ChemSpider | 81123 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Дисульфид натрия — бинарное неорганическое соединение натрия и серы с формулой Na2S2, жёлтые кристаллы, растворяется в воде, образует кристаллогидраты.
Получение
- Реакция растворов натрия и тетрасульфида натрия:
-
- Na2S4 + 2 Na →80oC 2Na2S2↓
- Сплавление в вакууме стехиометрических количеств сульфида натрия и серы
-
- Na2S + S →500oC Na2S2
- Получение из чистых веществ, растворённых в жидком аммиаке:
-
- 2 N a + 2 S →−33oC Na2S2
Физические свойства
Дисульфид натрия образует жёлтые кристаллы нескольких модификаций:
- α-Na2S2, гексагональная сингония, пространственная группа P 62m, параметры ячейки a = 0,7629 нм, c = 0,5394 нм;
- β-Na2S2, гексагональная сингония, пространственная группа P 63/mmc, параметры ячейки a = 0,4494 нм, c = 1,0228 нм.
Растворяется в воде, слабо растворяется в этаноле.
При нагревании темнеет и при 400°С окрашивается в светлый красно-коричневый цвет. В расплаве представляет собой подвижную тёмно-коричневую жидкость.
Образует кристаллогидрат состава Na2S2•5H2O.
| Дисульфид натрия | |
|---|---|
| Общие | |
| Систематическое наименование |
Дисульфид натрия |
| Традиционные названия | Сернистый натрий; динатрийдисульфан; дисульфид(2-) натрия |
| Хим. формула | Na2S2 |
| Физические свойства | |
| Состояние | жёлтые кристаллы |
| Молярная масса | 110,11 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 445; 475; ≈490 °C |
| Энтальпия | |
| • образования | -397 кДж/моль |
| Классификация | |
| Рег. номер CAS | 22868-13-9 |
| Рег. номер EINECS | 245-272-3 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Дисульфид натрия — бинарное неорганическое соединение
натрия и серы с формулой Na2S2,
жёлтые кристаллы,
растворяется в воде,
образует кристаллогидраты.
Получение
- Реакция растворов натрия и тетрасульфида натрия:
-
- [math]displaystyle{ mathsf{ Na_2S_4 + 2Na xrightarrow{80^oC} 2Na_2S_2downarrow } }[/math]
- Сплавление в вакууме стехиометрических количеств сульфида натрия и серы
-
- [math]displaystyle{ mathsf{ Na_2S + S xrightarrow{500^oC} Na_2S_2 } }[/math]
- Получение в растворе растворением серы в водном растворе сульфида натрия при нагревании
- [math]displaystyle{ mathsf{ Na_2S + S xrightarrow{80^oC} Na_2S_2 } }[/math]
- Получение из чистых веществ, растворённых в жидком аммиаке:
-
- [math]displaystyle{ mathsf{ 2Na + 2S xrightarrow{-33^oC} Na_2S_2 } }[/math]
Физические свойства
Дисульфид натрия образует жёлтые кристаллы нескольких модификаций:
- α-Na2S2, гексагональная сингония, пространственная группа P 62m, параметры ячейки a = 0,7629 нм, c = 0,5394 нм;
- β-Na2S2, гексагональная сингония, пространственная группа P 63/mmc, параметры ячейки a = 0,4494 нм, c = 1,0228 нм.
Растворяется в воде,
слабо растворяется в этаноле.
При нагревании темнеет и при 400°С окрашивается в светлый красно-коричневый цвет. В расплаве представляет собой подвижную тёмно-коричневую жидкость.
Образует кристаллогидрат состава Na2S2•5H2O.
Применение
- Смотри «Полисульфиды натрия».
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Руководство по неорганическому синтезу: В 6-ти т. / Ред. Брауэр Г.. — М.: Мир, 1985. — Т. 2. — 338 с.
- Диаграммы состояния двойных металлических систем / Под ред. Н. П. Лякишева. — М.: Машиностроение, 2001. — Т. 3 Книга 1. — 972 с. — ISBN 5-217-02843-2.
- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
From Wikipedia, the free encyclopedia

|
|
|
|
| Names | |
|---|---|
| Other names
Sodium pyrosulfite |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ECHA InfoCard | 100.028.794 |
| EC Number |
|
| E number | E223 (preservatives) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Na2S2O5 |
| Molar mass | 190.107 g/mol |
| Appearance | White to yellow powder |
| Odor | Faint SO2 |
| Density | 1.48 g/cm3 |
| Melting point | 170 °C (338 °F; 443 K) decomposition begins at 150 °C |
|
Solubility in water |
|
| Solubility | Very soluble in glycerol Slightly soluble in ethanol |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H318 |
|
Precautionary statements |
P264, P270, P280, P301+P312, P305+P351+P338, P310, P330, P501 |
| NFPA 704 (fire diamond) |
2 0 1 |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
None[1] |
|
REL (Recommended) |
TWA 5 mg/m3[1] |
|
IDLH (Immediate danger) |
N.D.[1] |
| Safety data sheet (SDS) | Mallinckrodt MSDS |
| Related compounds | |
|
Other anions |
Sodium sulfite Sodium bisulfite |
|
Other cations |
Potassium metabisulfite |
|
Related compounds |
Sodium dithionite Sodium thiosulfate Sodium sulfate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
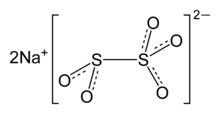
Sodium metabisulfite or sodium pyrosulfite (IUPAC spelling; Br. E. sodium metabisulphite or sodium pyrosulphite) is an inorganic compound of chemical formula Na2S2O5. The substance is sometimes referred to as disodium metabisulfite. It is used as a disinfectant, antioxidant, and preservative agent.[2] When dissolved in water it forms sodium bisulfite.
Preparation[edit]
Sodium metabisulfite can be prepared by treating a solution of sodium hydroxide with sulfur dioxide.[3] When conducted in warm water, Na2SO3 initially precipitates as a yellow solid. With more SO2, the solid dissolves to give the disulfite, which crystallises upon cooling.[4]
- SO2 + 2 NaOH → Na2SO3 + H2O
- SO2 + Na2SO3 → Na2S2O5
which yields a residue of colourless solid Na2S2O5.
Chemical structure[edit]
The anion metabisulfite consists of an SO2 group linked to an SO3 group, with the negative charge more localised on the SO3 end. The S–S bond length is 2.22 Å, and the «thionate» and «thionite» S–O distances are 1.46 and 1.50 Å, respectively.[5]
Reactivity[edit]
Upon dissolution in water, bisulfite is generated:
- Na2S2O5 + H2O → 2 Na+ + 2 HSO3−
Uses[edit]
Sodium and potassium metabisulfite have many major and niche uses. It is widely used for preserving food and beverages.
- Sodium metabisulfite is added as an excipient to medications which contain adrenaline (epinephrine), in order to prevent the oxidation of adrenaline.[6] For example, it is added to combination drug formulations which contain a local anaesthetic and adrenaline,[6] and to the formulation in epinephrine autoinjectors, such as the EpiPen.[7] This lengthens the shelf life of the formulation,[6] although the sodium metabisulphite reacts with adrenaline, causing it to degrade and form epinephrine sulphonate.[8]
- In combination with sodium hydrosulfite it is used as a rust-stain remover[9]
- It is used in photography.[10]
- Concentrated sodium metabisulfite can be used to remove tree stumps. Some brands contain 98% sodium metabisulfite, and cause degradation of lignin in the stumps, facilitating removal.[11]
- It is also used as an excipient in some tablets, such as paracetamol.
- A very important health related aspect of this substance is that it can be added to a blood smear in a test for sickle cell anaemia (and other similar forms of haemoglobin mutation). The substance causes defunct cells to sickle (through a complex polymerisation) hence confirming disease.
- It is used as a bleaching agent in the production of coconut cream
- It (or liquid SO2) is commonly used as an antimicrobial and antioxidant in winemaking; bottled wine indicates its use with the label «Contains Sulfites» in the US.
- It is used as a reducing agent to break sulfide bonds in shrunken items of clothing made of natural fibres, thus allowing the garment to go back to its original shape after washing
- It is used as a SO2 source (mixed with air or oxygen) for the destruction of cyanide in commercial gold cyanidation processes.
- It is used as a SO2 source (mixed with air or oxygen) for the precipitation of elemental gold in chloroauric (aqua regia) solutions.
- It is used in the water treatment industry to quench residual chlorine.
- It is used in tint etching iron-based metal samples for microstructural analysis.[12][13]
- It is used as a fungicide for anti-microbe and mould prevention during shipping of consumer goods such as shoes and clothing. Plastic stickers and packaging (such as Micro-Pak™) containing the anhydrous, sodium metabisulfite solid active ingredient are added prior to shipping. The devices absorb moisture from the atmosphere during shipping and release low levels of sulfur dioxide.[14]
- It is used for preserving fruit during shipping.[15]
- It is used as a solvent in the extraction of starch from tubers,[16] fruit,[17] and cereal crops.[18][19]
- It is used as a pickling agent to treat high pressure reverse osmosis and nanofiltration water desalination membranes for extended storage periods between uses.
Safety[edit]
Sodium metabisulfite, despite not being flammable, decomposes in 150°C of heat releasing toxic gasses when decomposed. It is corrosive when dissolved in water.
Harmful if swallowed, it is corrosive to metals and should be stored safely.[20]
References[edit]
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0566». National Institute for Occupational Safety and Health (NIOSH).
- ^ Barberá, José Jiménez; Metzger, Adolf; Wolf, Manfred (2000). «Sulfites, Thiosulfates, and Dithionitesl Chemistry». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a25_477.
- ^ Catherine E. Housecroft; Alan G. Sharpe (2008). «Chapter 16: The group 16 elements». Inorganic Chemistry, 3rd Edition. Pearson. p. 520. ISBN 978-0-13-175553-6.
- ^ Johnstone, H. F. (1946). «Sulfites and Pyrosulfites of the Alkali Metals». Inorganic Syntheses. Inorganic Syntheses. Vol. 2. pp. 162–167. doi:10.1002/9780470132333.ch49. ISBN 9780470132333.
- ^ K. L. Carter, T. A. Siddiquee, K. L. Murphy, D. W. Bennett «The surprisingly elusive crystal structure of sodium metabisulfite» Acta Crystallogr. (2004). B60, 155–162. doi:10.1107/S0108768104003325
- ^ a b c McGee, Douglas L. (2013). «Local and topical anesthesia». In Roberts, James R.; Jerris, R. Hedges (eds.). Roberts and Hedges’ Clinical Procedures in Emergency Medicine (6th ed.). Elsevier/Saunders. p. 519. ISBN 9781455748594.
- ^ Niazi, Safaraz K. (2009). Handbook of Pharmaceutical Manufacturing Formulations. Volume 6, Sterile Products (2nd ed.). New York: Informa Healthcare. p. 410. ISBN 9781420081312.
- ^ Barnes, Andrew R. (2013). «Chapter 48. Chemical stability in dosage forms». In Aulton, Michael E.; Taylor, Kevin M.G. (eds.). Aulton’s pharmaceutics : the design and manufacture of medicines (4th ed.). Churchill Livingstone/Elsevier. p. 833. ISBN 9780702053931.
- ^ «Ingredients». Summit Brands. Summit Brands. 31 October 2019. Retrieved 25 April 2021.
- ^ Anchell, Steve (2008). The darkroom cookbook (3rd ed.). Amsterdam: Focal Press. pp. 193. ISBN 978-0240810553.
- ^ [1][dead link]
- ^ «Color Metallography». 2011-05-04.
- ^ George F. Vander Voort. «ETCHING ISOTHERMALLY TREATED STEELS» (PDF). Asminternational.org. Retrieved 24 January 2022.
- ^ «Micro-Pak Enhanced Packaging Stickers» (PDF). 2020-05-05.
- ^ Sivakumar, D.; Korsten, L. (2020-05-05). «15 — Litchi (Litchi chinensis Sonn.)». Postharvest Biology and Technology of Tropical and Subtropical Fruits. Woodhead Publishing Series in Food Science, Technology and Nutrition. Woodhead. pp. 361–409e. doi:10.1533/9780857092885.361. ISBN 9781845697358.
- ^ Manek, Rahul V.; Builders, Philip F.; Kolling, William M.; Emeje, Martins; Kunle, Olobayo O. (June 2012). «Physicochemical and binder properties of starch obtained from Cyperus esculentus». AAPS PharmSciTech. 13 (2): 379–388. doi:10.1208/s12249-012-9761-z. ISSN 1530-9932. PMC 3364391. PMID 22350737.
- ^ Nawab, Anjum; Alam, Feroz; Haq, Muhammad Abdul; Hasnain, Abid (2016). «Biodegradable film from mango kernel starch: Effect of plasticizers on physical, barrier, and mechanical properties». Starch — Stärke. 68 (9–10): 919–928. doi:10.1002/star.201500349. ISSN 1521-379X.
- ^ Nyakabau, Tatenda; Wokadala, Obiro Cuthbert; Emmambux, Mohammad Naushad (2013). «Effect of steeping additives on tef starch extraction and its quality». Starch — Stärke. 65 (9–10): 738–746. doi:10.1002/star.201200241. hdl:2263/41924. ISSN 1521-379X.
- ^ Park, S. H.; Bean, S. R.; Wilson, J. D.; Schober, T. J. (2006). «Rapid Isolation of Sorghum and Other Cereal Starches Using Sonication». Cereal Chemistry. 83 (6): 611–616. doi:10.1094/CC-83-0611. ISSN 1943-3638.
- ^ «Sodium Metabsiulfite SDS» (PDF).
External links[edit]
- International Chemical Safety Card 1461
- The surprisingly elusive crystal structure of sodium metabisulfite
- CDC — NIOSH Pocket Guide to Chemical Hazards
| Кристальная структура | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|

|
|||||||||||
| __ Na + __ S — | |||||||||||
| Общий | |||||||||||
| Фамилия | Дисульфид натрия | ||||||||||
| другие имена |
|
||||||||||
| Формула соотношения | Na 2 S 2 | ||||||||||
| Краткое описание |
желтое твердое вещество |
||||||||||
| Внешние идентификаторы / базы данных | |||||||||||
|
|||||||||||
| характеристики | |||||||||||
| Молярная масса | 110,11 г моль -1 | ||||||||||
| Физическое состояние |
фиксированный |
||||||||||
| Температура плавления |
470 ° С |
||||||||||
| правила техники безопасности | |||||||||||
|
Маркировка опасности GHS |
|||||||||||
| Насколько это возможно и общепринято, используются единицы СИ . Если не указано иное, приведенные данные относятся к стандартным условиям . |
Дисульфид натрия — химическое соединение из группы сульфидов .
Извлечение и представление
Дисульфид натрия можно получить реакцией натрия с серой .
Возможна также реакция растворенного в спирте тетрасульфида натрия с хлоридом натрия или тетрафенилфосфония .
Когда трисульфид натрия нагревается до 100 ° C, он разлагается до смеси дисульфида натрия и тетрасульфида натрия в соотношении 1: 1.
Возможна также реакция сульфида натрия с серой.
или натрий с серой в жидком аммиаке .
характеристики
Дисульфид натрия — светло-желтое, очень гигроскопичное твердое вещество. При нагревании он постепенно темнеет и становится светло-красно-коричневым при 400 ° C. При температуре выше 475 ° C цвет становится более темно-коричневым, вещество начинает сильно спекаться, а с 490 ° C плавится в темно-коричневую жидкость. Продукты, изготовленные из спиртового раствора, после плавления всегда имеют оливково-зеленый цвет. Он встречается в двух аллотропных формах: α-форма ниже 160 ° C и β-форма необратимо выше. Оба имеют гексагональную кристаллическую систему.
использовать
Дисульфид натрия используется для получения других химических соединений (например, диаллилдисульфида ).
Индивидуальные доказательства
- ↑ a b c d e f g Ральф Штудель : Элементная сера и соединения, богатые серой, Том 2 . 2003, ISBN 3-540-40378-7 , стр. 130 ( ограниченный предварительный просмотр в поиске Google Книг).
- ↑ Это вещество либо еще не классифицировано с точки зрения его опасности, либо надежный и цитируемый источник еще не найден.
- ↑ a b c d Георг Брауэр (ред.), В сотрудничестве с Марианн Бодлер и другими: Справочник по препаративной неорганической химии. 3-е, переработанное издание. Том I, Фердинанд Энке, Штутгарт 1975, ISBN 3-432-02328-6 , стр. 374.
- Справочник
- Справочник структурных формул
- н
- Натрия дисульфит
Натрия дисульфит
Na2S2O5
Na^+/0O^-S|O`|/OS|O`|/O^-Na^+
Брутто-формула: Na2O5S2
Молекулярная масса: 190.103
Химический состав
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Na | Натрий (Sodium) | 22.99 | 2 | 24.2% |
| O | Кислород (Oxygen) | 15.999 | 5 | 42.1% |
| S | Сера (Sulfur) | 32.064 | 2 | 33.7% |
Синонимы
- натрия дисульфит
- натрия пиросульфит
- 7681-57-4
- Disodium disulfite
- Disodium disulphite
- Disodium metabisulfite
- Disodium pyrosulfite
- Disulfurous acid, disodium salt
- EINECS:231-673-0
- NSC 158277
- NSC 227243
- Pyrosulfurous acid, disodium salt
- disodium sulfinato sulfite
Входит в группы
Неорганические соли






