Версия: Справочник заболеваний MedElement
Категории МКБ:
Острый бронхиолит (J21)
Разделы медицины:
Пульмонология
Общая информация
Краткое описание
Бронхиолит – это экссудативное и/или продуктивно-склеротическое воспаление
бронхиол
, приводящее к частичной или полной их непроходимости.
Острый бронхиолит характеризуется наличием экссудативного воспаления при отсутствии признаков
пролиферации
и склероза.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 500 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Ниже приводятся общие классификации бронхиолитов, так как острые (экссудативные) и хронические (продуктивно-склеротические) варианты течения бронхиолита могут существовать как в виде отдельных форм, так и в виде фаз одного процесса. Хронические бронхиолиты — см. рубрики J70, J84.
Клиническая классификация бронхиолитов, основанная на этиологии заболевания (King T.E., 2000):
1. Постинфекционные – острые бронхиолиты, вызванные респираторно–синцитиальным вирусом, аденовирусом, вирусом парагриппа, Mycoplasma pneumoniaе. Такие бронхиолиты чаще возникают у детей.
2. Ингаляционные – вызваны газами (CO, SO2, NO2, O3), парами кислот, органическими (зерновыми) и неорганическими пылями, курением, ингаляцией кокаина.
3. Лекарственно-индуцированные – пеницилламин, препараты, содержащие золото, амиодарон, цефалоспорины, интерферон, блеомицин.
4. Идиопатические:
4.1 Сочетающиеся с другими заболеваниями – коллагеновые болезни, идиопатический легочный фиброз, респираторный дистресс-синдром взрослых, язвенный колит, аспирационная пневмония, радиационный альвеолит, злокачественные гистиоцитоз и лимфома, трансплантация органов и тканей (костного мозга, комплекса легкие–сердце);
4.2 Не сочетающиеся с другими заболеваниями – криптогенный бронхиолит, криптогенная организованная пневмония, респираторный бронхиолит с интерстициальной болезнью легких.
5. Облитерирующий бронхиолит – ВИЧ–инфекция, вирус герпеса, цитомегаловирус, аспергилла, легионелла, пневмоциста, клебсиелла.
Патогистологическая классификация (Colby T.V., 1998)
Выделяют острые (экссудативные) и хронические (продуктивно-склеротические) бронхиолиты.
1. Острый бронхиолит. Наиболее важную роль в развитии экссудативного бронхиолита играют вирусы, бактерии, ингаляция токсических газов.
Основные морфологические изменения связаны с некрозом эпителия, отеком стенки бронха, инфильтрацией ее полиморфно-ядерными лейкоцитами и небольшим числом лимфоцитов, которые превалируют при вирусном поражении.
Клинические симптомы возникают в первые 24 часа и могут сохраняться в течение 5 недель.
К острым бронхиолитам относят: псевдомембранозный или некротический и гранулематозный.
Все острые бронхиолиты в последующем, как правило, трансформируются в хронические или происходит инволюция экссудативного воспаления.
2. Хронический бронхиолит:
— респираторный;
— фолликулярный;
— диффузный панбронхиолит.
Патогистологическая классификация хронических бронхиолитов
1. Пролиферативные:
— облитерирующий бронхиолит с организующейся пневмонией;
— криптогенная организующая пневмония.
2. Констриктивные:
— респираторный бронхиолит;
— фолликулярный бронхиолит;
— диффузный панбронхиолит;
— облитерирующий бронхиолит.
Классификация (Ryu JH, Myers JL, Swensen SJ. 2003)
1. Первичные бронхиолиты:
— констриктивный (облитерирующий) бронхиолит;
— респираторный бронхиолит (бронхиолит курильщика);
— острый (клеточный) бронхиолит;
— бронхиолит, индуцированный минеральной пылью;
— фолликулярный бронхиолит;
— диффузный панбронхиолит;
— другие первичные поражения бронхиол (диффузный аспирационный бронхиолит, лимфоцитарный бронхиолит).
2. Интерстициальные заболевания легких с выраженным поражением бронхиол:
— пролиферативный бронхиолит (облитерирующий бронхиолит с организующейся пневмонией);
— респираторный бронхиолит, ассоциированный с интерстициальным заболеванием легких;
— гиперчувствительный пневмонит;
— другие интерстициальные заболевания легких (лангергансоклеточный гистиоцитоз легких, саркоидоз).
3. Поражение бронхиол в сочетании с заболеваниями крупных бронхов (бронхиальная астма, бронхоэктазии, хроническая обструктивная болезнь легких).
Этиология и патогенез
Этиология
Причиной острого инфекционного бронхиолита как у детей, так у и взрослых в 95% случаев является респираторно-синцитиальный вирус. У детей первого года жизни данный вирус встречается в практически 100% случаев. В более старшем возрасте встречаются острые бронхиолиты, вызванные парагриппом, корью, гриппом, риновирусом, хламидией, микоплазмой, легионеллой (подробнее см. в разделе «Классификация»).
Патогенез
Респираторные вирусы, бактерии, неорганические и токсические вещества имеют тропность к реснитчатым клеткам и клеткам Клара. Вирусы, повреждая клетки эпителия в поздней фазе воспаления, вызывают его деструкцию, клеточную
пролиферацию
и лимфоидную инфильтрацию.
Для бактериальной инфекции характерно развитие экссудативного воспаления с преобладанием полиморфно-ядерных лейкоцитов. В результате выброса эластаз их этих клеток возникает повреждение эпителия и соединительнотканного
матрикса
.
Факторы, приводящие к прогрессированию
фиброза
в стенке и закрытию просветов бронхиол, до сих пор неизвестны. Имеются сведения о том, что в данном процессе играет роль накопление иммуноглобулинов G, A, M, фибронектина, факторов VII и X, фибриногена. В воспалительной реакции принимают участие полиморфно-ядерные лейкоциты, эозинофилы, макрофаги, лимфоциты, тучные клетки (Peyrol S. et al., 1990). Матрикс телец Массона состоит из коллагена III типа, фибронектина, проколлагена I. В просветах части альвеол встречаются пенистые макрофаги.
Высокие концентрации кислотных газов вызывают некроз эпителиальных и спазм мышечных клеток. Эндогенные токсические вещества вначале повреждают эндотелиальные клетки, вызывая интерстициальный отек за счет увеличения проницаемости сосудов стенки бронхиол, а в последующем за счет гипоксии происходит повреждение эпителия и развиваются интерстициальная пневмония и бронхиолит. В возникновении бронхиолита большое значение имеет курение, особенно у молодых лиц.
Патогистологические формы бронхиолитов
Острый клеточный бронхиолит характеризуется нейтрофильной и/или лимфоидной инфильтрацией в эпителии и стенке бронхиолы, обозначаемой как пан- и мезобронхит. В просветах бронхиол выявляются лейкоциты и клеточный детрит.
Внутри данной группы бронхиолитов выделяют псевдомембранозный или некротический бронхиолит (ПМБ).
В основе этого вида бронхиолита лежит некроз эпителия с поражением или без поражения базальной мембраны. В клеточном инфильтрате преобладают лейкоциты или лимфоциты, или их смесь. Как правило, при вирусной инфекции, преобладают лимфоциты.
При гриппе, парагриппе, при действии вируса герпеса возникает истинный псевдомембранозный фибрин, который в сочетании с детритом покрывает поверхность бронхиол. Помимо этого, фибрин скапливается под базальной мембраной вокруг капилляров.
ПМБ в дальнейшем трансформируется в хронический облитерирующий бронхит с закрытием просветов бронхиол.
Кроме того, ПМБ развивается при вдыхании высоких концентраций газов SO2, NO2, O3. Такой же тип бронхиолита возникает при синдроме Мендельсона. При повреждении базальной мембраны бронхиол возможно развитие облитерирующего бронхиолита с организующейся пневмонией.
Эпидемиология
Острый бронхиолит является болезнью преимущественно грудных детей (на первый год жизни приходится 80% всей заболеваемости), с пиком в 2-6 месяцев. Мальчики болеют несколько чаще.
Характерна сезонность – заболеваемость выше с конца осени до начала весны. Распространенность заболевания 1000-1500 на 100 000 детей.
Факторы и группы риска
Для всех форм бронхиолита выделен основной фактор риска — курение (активное и пассивное).
Подробнее факторы риска см. в соответствующих разделах следующих подрубрик:
— Острый бронхиолит, вызванный респираторным синцитиальным вирусом (J21.0);
— Острый бронхиолит, вызванный другими уточненными агентами (J21.8).
Клиническая картина
Cимптомы, течение
У взрослых
Заболевание имеет острое начало или развивается на фоне
трахеобронхита
.
Характерные проявления:
— лихорадка с подъемом температуры до 38-39оС;
— выраженная одышка (до 40 и более дыханий в 1 минуту);
— поверхностное дыхание с участием вспомогательной мускулатуры;
Грудная клетка фиксирована в положении вдоха с приподнятым плечевым поясом. Лицо становится одутловатым, отмечается цианоз. У больных возникает мучительный кашель со скудной слизистой мокротой и появляется боль в груди вследствие перенапряжения мышц и сокращения диафрагмы при кашле.
Дыхание ослабленное или жесткое; отмечаются перкуторный звук с коробочным оттенком, обильные мелкопузырчатые (субкрепитирующие) незвучные хрипы, свистящие хрипы на выдохе.
Признаки обструктивной
эмфиземы
нарастают. К выраженной дыхательной недостаточности присоединяются расстройства легочной и внутрикардиальной гемодинамики, что обуславливается
легочной гипертензией
.
У детей младшего возраста
Наблюдаются бронхиолиты вирусной этиологии (
РСВ
), не связанные с бронхитами. Температурная реакция может быть вариабельной.
Характерные признаки:
— одышка;
— сухой непродуктивный кашель;
— участие вспомогательной мускулатуры в акте дыхания;
— раздувание крыльев носа при дыхании;
—
ретракция
податливых участков грудной клетки;
— резистентность к ингаляционной терапии бронхолитиками и кортикостероидами.
Заболевание очень тяжело переносится, его длительность у взрослых составляет до 5-6 недель. У детей неосложненные формы средней тяжести проходят быстрее.
Диагностика
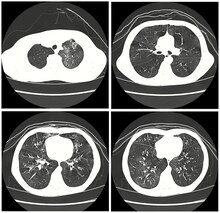
При бронхиолите рентгенологическое исследование выявляет усиление легочного рисунка в нижних отделах и в области корней легких.
Лабораторная диагностика
Специфические изменения отсутствуют. Отмечаются недифференцированные воспалительные изменения в общем анализе крови. Наблюдаются повышение
СОЭ
, лейкоцитоз.
Дифференциальный диагноз
Требуется дифференциация бронхиолита от милиарного туберкулеза, пневмоний. Решающее значение в дифференциальном диагнозе имеет рентгенологическое исследование.
Осложнения
— развитие хронических бронхиолитов;
— вторичное инфицирование;
— повышение риска развития
ХОБЛ
и астмы;
— развитие тяжелой дыхательной недостаточности.
Лечение
1. Оксигенотерапия и респираторная поддержка.
2. Этиотропная терапия применяется только при доказанной бактериальной этиологии острого бронхиолита (легионелла, микоплазма, хламидия).
Эффект противовирусных средств (рибавирин, ацикловир и прочие) сомнителен. Данные препараты показаны для иммунокомпрометированных пациентов и при идентификации возбудителя (респираторно-синцитиальный вирус, цитомегаловирус).
3. Бета-адреномиметики, бронхолитики, кортикостероиды значительно более эффективны у взрослых, чем у детей. Применение этих препаратов не имеет доказанной обоснованности у младенцев.
4. Ингаляции солевых растворов показали свою умеренную эффективность в лечении острого вирусного бронхиолита у детей.
Прогноз
Течение бронхиолита очень тяжелое, существует вероятность летального исхода.
Госпитализация
См. в соответствующих разделах следующих подрубрик:
— Острый бронхиолит, вызванный респираторным синцитиальным вирусом — J21.0;
— Острый бронхиолит неуточненный — J21.9;
— Острый бронхиолит, вызванный другими уточненными агентами — J21.8.
Профилактика
Сводится к стандартной профилактике вирусных инфекций.
Информация
Источники и литература
-
Полный справочник практикующего врача /под редакцией Воробьева А.И., 10 издание, 2010
- стр.174-175
-
Справочник по пульмонологии/под ред. Чучалина А.Г., Ильковича М.М., М.: ГЭОТАР-Медиа, 2009
-
«A multicenter, randomized, controlled trial of dexamethasone for bronchiolitis» Corneli H.M., Zorc J.J., Majahan P. et al., The New England Journal of Medicine, 2007; 357: 331-9
-
http://guideline.gov
- «Bronchiolitis in children. A national clinical guideline» Scottish Intercollegiate Guidelines Network (SIGN), 2006 Nov. —
- «Evidence-based care guideline for management of first time episode bronchiolitis in infants less than 1 year of age» Cincinnati Children s Hospital Medical Center, 2010 Nov 16 —
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
1. «Констриктивный бронхиолит» является синонимом
1) облитерирующего бронхиолита;+
2) облитерирующего бронхиолита с организующей пневмонией;
3) респираторного бронхиолита;
4) фолликулярного бронхиолита.
2. Бронхи и бронхиолы, вплоть до уровня респираторной бронхиолы
1) выполняют исключительно дыхательную функцию;
2) выполняют исключительно функцию транспортировки воздуха;
3) выполняют функцию транспортировки воздуха, а также дыхательную функцию;+
4) не являются функционально значимой частью легочного ацинуса.
3. Бронхиолит представляет собой экссудативное и/или продуктивно–склеротическое воспаление
1) бронхиол;+
2) бронхиол с переходом на альвеолы;
3) бронхов;
4) бронхов 4-го и более высокого порядка.
4. Деформация по типу «трамвайных рельсов» на компьютерных томограммах представляет собой
1) мешотчатые бронхоэктазы;
2) нормальный ход бронхов;
3) отсутствие сужения бронха к периферии;+
4) сужение бронха к периферии.
5. Для аспирационного бронхиолита характерны следующие компьютерно-томографические симптомы
1) внутридольковые очаги и симптом «дерево с почками»;+
2) двустороннее распределение паренхиматозных нарушений;+
3) зоны воздушной ловушки;
4) зоны консолидации.
6. Для инфекционного бронхиолита характерны следующие компьютерно-томографические симптомы
1) внутридольковые (центролобулярные) очаги;+
2) зоны воздушной ловушки;
3) зоны консолидации;
4) симптом «дерево с почками».+
7. Для компьютерно-томографического симптома «дерева в почках» характерны
1) ветвящиеся Y- V-образные линейные структуры;+
2) заполненные секретом бронхиолы;+
3) снижение прозрачности по типу матового стекла;
4) утолщение междолькового интерстиция.
8. Для облитерирующего бронхиолита характерен компьютерно-томографический симптом
1) «дерево с почками»;
2) внутридольковых (центролобулярных) очагов;
3) зоны воздушной ловушки;+
4) зоны консолидации.
9. Для оценки изменений легочной паренхимы при бронхиолитах целесообразно проводить компьютерную томографию срезами
1) 0,1 мм;
2) 0,5-2 мм;+
3) 10 мм;
4) 3-5 мм.
10. Доказанным этиологическим фактором развития облитерирующего бронхиолита является
1) курение;
2) посттрансплантационное осложнение;+
3) хроническая аспирация;
4) хронический синусит.
11. Зоны «воздушной ловушки» на компьютерных томограммах
1) имеют в большинстве случаев односторонний характер поражения;
2) могут наблюдаться в пределах одной или нескольких вторичных долек;+
3) могут наблюдаться в пределах сегмента;+
4) чаще не имеют привязки к анатомическим отделам легкого.
12. К заболеваниям, при которых вовлечение бронхиол не является преобладающим и первичным относится
1) гиперчувствительный пневмонит;+
2) облитерирующий (констриктивный) бронхиолит;
3) респираторный бронхиолит;
4) фолликулярный бронхиолит.
13. КТ семиотика бронхиолярных изменений
1) зависит от вызвавшего их этиологического фактора;
2) очень разнородна;
3) представляет собой неспецифичную картину, не зависящую от вызвавшего их этиологического фактора;+
4) специфична, позволяет четко дифференцировать тип повреждения.
14. Наилучшей методикой компьютерной томографии обследования пациентов с бронхиолитами является проведение исследования
1) на вдохе и на выдохе;+
2) на выдохе;
3) на высоте вдоха;
4) на форсированном выдохе.
15. Наличие симптома перибронхиального воспаления, придающего «пушистый» вид «дереву в почках», превращая его в «ветку хлопкового дерева», характерно для
1) аспирационного бронхиолита;
2) облитерирующего бронхиолита;
3) респираторного бронхиолита;
4) фолликулярного бронхиолита.+
16. Патоморфологическая картина, характерная для констриктивного бронхиолита включает в себя
1) бронхиолярное сужение за счет адвентициального и подслизистого фиброза;+
2) накопление пигментированных макрофагов в дыхательных бронхиолах и прилегающих альвеолах;
3) наличие внутрипросветных полипов в мелких дыхательных путях;
4) наличие воспалительного экссудата внутри просвета бронхиол.
17. По отношению к вторичной легочной дольке бронхиолы
1) не определяются в пределах вторичной дольки;
2) располагаются в периферических/субплевральных ее отделах;
3) располагаются в центральной ее части;+
4) располагаются по ходу междольковых перегородок.
18. По характеру повреждения бронхиол выделяют следующие формы бронхиолита
1) аспирационный;
2) инфекционный;
3) клеточный;+
4) констриктивный (облитерирующий).+
19. По этиологическому фактору выделяют следующие формы бронхиолита
1) идиопатический;
2) инфекционный;+
3) облитерирующий бронхиолит на фоне организующей пневмонии;
4) респираторный.+
20. При обнаружении симптома «дерева в почках» при инфекционном бронхиолите необходимо в первую очередь исключать
1) грибковый характер поражения;
2) микобактериоз;+
3) пневмоцистную инфекцию;
4) цитомегаловирус.
21. При разных типах бронхиолитов можно выявить следующие компьютерно-томографические симптомы
1) зоны воздушной ловушки;+
2) зоны консолидации;
3) зоны матового стекла;
4) очаговые изменения.+
22. Принципиальное отличие бронхов от бронхиол
1) диаметр (менее 4 мм);
2) наличие мышечной ткани в стенках;
3) наличие хряща в стенках;+
4) толщина стенки.
23. Расположение очаговых изменений при бронхиолитах
1) внутридольковое (центролобулярное);+
2) перилимфатическое;
3) по ходу междольковых перегородок;
4) хаотичное.
24. Рентгенологическое исследование органов грудной клетки
1) в большинстве случаев не позволяет визуализировать бронхиолиты;+
2) играет решающую роль в диагностике бронхиолитов;
3) может выявить признаки сопутствующего паренхиматозного заболевания;+
4) позволяет заподозрить характер повреждения бронхиол.
25. Респираторный бронхиолит в подавляющем большинстве случаев
1) встречается в Азии;
2) встречается у молодых женщин;
3) связан с курением;+
4) связан с хроническим синуситом.
26. Симптом «воздушной ловушки» на компьютерных томограммах визуализируется как области
1) «избыточной» воздушности;+
2) гиповентиляции;
3) нормальной легочной паренхимы при сравнении с окружающими зонами матового стекла;
4) снижения воздушности.
27. Симптом «воздушной ловушки» на компьютерных томограммах наилучшим образом выявляется при исследовании
1) в положении пациента на животе;
2) на выдохе;+
3) на высоте вдоха;
4) с внутривенным контрастным усилением.
28. Синдром Свайера-Джеймса (синдром Маклеода) представляет собой
1) идиопатический констриктивный бронхиолит;
2) индуцированный курением бронхиолит;
3) постинфекционный констриктивный бронхиолит;+
4) постинфекционный фолликулярный бронхиолит.
29. У пациентов с большой грыжей пищеводного отверстия диафрагмы в связи с неэффективностью проводимой терапии необходимо заподозрить
1) аспирационный бронхиолит;+
2) облитерирующий бронхиолит;
3) респираторный бронхиолит;
4) фолликулярный бронхиолит.
30. Этиологическим фактором развития фолликулярного бронхиолита является
1) аспирация;
2) аутоиммунный процесс;+
3) инфекция;
4) курение.
Облитерирующий бронхиолит (ОБ) – редкое заболевание поражающее бронхиолы. Посттрансплантационный ОБ развивается у 20–50% больных, перенесших трансплантацию комплекса сердце – легкие, обоих или одного легкого. Поскольку на момент постановки диагноза в бронхиолах уже имеются грубые фиброзные изменения, целью терапии является стабилизация воспалительного и фибропролиферативного процессов и предотвращение дальнейшего прогрессирования заболевания.
Облитерирующий бронхиолит (ОБ) – редкое заболевание поражающее бронхиолы. Посттрансплантационный ОБ развивается у 20–50% больных, перенесших трансплантацию комплекса сердце – легкие, обоих или одного легкого. Поскольку на момент постановки диагноза в бронхиолах уже имеются грубые фиброзные изменения, целью терапии является стабилизация воспалительного и фибропролиферативного процессов и предотвращение дальнейшего прогрессирования заболевания.
Bronchiolitis obliterans (BO) is a rare disease that affects the bronchioles.
Posttransplantation BO develops in 20–50% of patients undergone heart – lung, double- or single lung grafting surgery. Since when diagnosed, there are profound bronchiolar fibrotic changes, the aim of treatment is to stabilize inflammatory and fibroproliferative processes and prevent the progression of the disease.
С.Н. Авдеев, О.Е. Авдеева, А.Г. Чучалин
НИИ пульмонологии Минздрава РФ, Москва
S.N. Avdeyev, O.Ye. Avdeyeva, A.G. Chuchalin
Research Institute of Pulmonology, Ministry of Health of the Russian Federation, Moscow
Введение
Облитерирующий бронхиолит (ОБ) – редкое заболевание из группы «болезней малых дыхательных путей», при котором поражаются бронхиолы – дыхательные пути (ДП) диаметром менее 2 – 3 мм, не имеющие хрящевой основы и слизистых желез [1]. Различают терминальные и респираторные бронхиолы. Терминальные (мембранозные) бронхиолы относятся к воздухопроводящим (кондуктивным) ДП, их стенка содержит гладкомышечные клетки. Каждая вторичная легочная долька содержит от 4 до 8 терминальных бронхиол с соответствующими им первичными дольками (ацинусами) (К. Garg и соавт. 1994). Стенка респираторных бронхиол содержит реснитчатые эпителиальные клетки и альвеолоциты и не имеет гладкомышечных клеток, поэтому респираторные бронхиолы относятся к переходным ДП, т.е. принимают участие и в проведении воздуха, и в газообмене. Концепция «малых ДП» начала развиваться благодаря J. Hogg и соавт. (1968 г.), в исследованиях которых при помощи ретроградной катетерной техники была измерена резистентность ДП. Как оказалось, на долю малых ДП, общая площадь сечения которых (53 – 186 см3) во много раз превышает площадь трахеи (3 – 4 см3) и крупных бронхов (4 – 10 см3), приходится лишь 20 % от общего сопротивления ДП. Поэтому поражение бронхиол на ранних этапах может протекать бессимптомно и не сопровождаться изменениями традиционных функциональных тестов; изменения отмечают, как правило, уже при далеко зашедшем поражении малых ДП.
Частота развития ОБ точно не установлена. По данным J. LaDue [3], ОБ был обнаружен лишь в одном случае из 42 тыс. аутопсий, а в исследовании K. Hardy и соавт. [4], посвященном анализу 3 тыс. педиатрических аутопсий, – в 7 случаях. Считается, что через крупный пульмонологический университетский центр в год проходит не менее 2 – 4 больных ОБ [5].
Первое классическое описание ОБ было сделано в 1901 г. W. Lange [1], который детально рассмотрел морфологическую картину легких двух пациентов, умерших от быстро прогрессирующей дыхательной недостаточности. Однако на протяжении нескольких десятилетий об этом заболевании практически не встречалось никаких упоминаний. В 1977 г. D. Geddes и соавт. [6] описали клинико- морфологическую картину ОБ как один из вариантов поражения легких при ревматоидном артрите.
Пожалуй, наибольшее внимание данной проблеме стали уделять после работы G. Epler и соавт. [7], которые проанализировали около 2500 образцов открытой биопсии легких, выполненных в течение 30 лет в университетской клинике Бостона, и обнаружили 67 случаев ОБ. В 10 образцах была выявлена картина поражения только терминальных и респираторных бронхиол, т.е. «классический» или изолированный бронхиолит, а в 57 случаях наряду с поражением бронхиол наблюдалась своеобразная картина вовлечения в воспалительный процесс альвеол с наличием организованного экссудата в их просвете – этот синдром получил название «облитерирующего бронхиолита с организующейся пневмонией» (ОБОП).
Таблица 1. Основные состояния, ассоциированные с облитерирующим (констриктивным) бронхиолитом
• Посттрансплантационные осложнения (пересадка легких, комплекса сердце – легкие, костного мозга)
• ДЗСТ (ревматоидный артрит, системная красная волчанка, синдром Шенгрена)
• Инфекции (Mycoplasma pneumonia, РСВ, ЦМВ, аденовирус, ВИЧ и др.)
• Осложнения медикаментозной терапии (D-пенициламин, препараты золота, сульфасалазил)
• Ингаляции токсичных веществ (оксиды серы, азота, фосген и др.)
• Воспалительные заболевания кишечника
• Осложнения лучевой терапии
• Синдром Стивенса–Джонсона
• Идиопатический (криптогенный) ОБ
ОБОП был представлен как новый клинико-морфологический синдром, отличный от изолированного ОБ, идиопатического фиброзирующего альвеолита или обычного интерстициального пневмонита. Незадолго до G. Epler схожий синдром описали А. Davison и соавт. [8], однако они использовали термин «криптогенный организующийся пневмонит» – КОП. Как оказалось, несмотря на одинаковые термины, клинико- морфологические синдромы, описанные D. Geddes и G. Epler, являются по своей сути совершенно различными видами патологии. ОБ, рассмотренный D.Geddes [6], относится к группе обструктивных заболеваний малых ДП, характеризуется клинической картиной непрерывно прогрессирующей одышки, рентгенологической картиной повышенной прозрачности легочных полей, отсутствием ответа на стероиды и плохим прогнозом. ОБОП, описанный G.Epler [7], относится к группе интерстициальных заболеваний легких (ИЗЛ), характеризуется непродолжительным наличием кашля, одышки, лихорадки, слабости, рентгенологической картиной рассеянных пятнистых инфильтратов в легких, хорошим ответом на стероиды и благоприятным прогнозом.
Необходимость четкого разграничения этих двух заболеваний послужила причиной многочисленных дискуссий на страницах ведущих медицинских журналов [9–11]. Во избежание терминологической путаницы было предложено использовать в качестве синонима «изолированного» ОБ термин «констриктивный бронхиолит», введенный в 1973 г. B. Gosink и соавт. [12], а в качестве синонимов ОБОП – термины «криптогенный организующийся пневмонит» и «пролиферативный бронхиолит», впервые предложенные соответственно А. Davison в 1983 г. и Т. King в 1994 г. (К. Garg и соавт., 1994).
Наряду с ОБ и ОБОП известны и другие, также довольно редкие заболевания малых ДП: диффузный панбронхиолит – болезнь жителей Тихоокеанского региона, характеризующаяся поражением пазух носа, бронхиол, развитием бронхоэктазов, колонизацией Pseudomonas aeruginosa, неуклонным нарастанием дыхательной недостаточности [13]; респираторный бронхиолит, ассоциированный с ИЗЛ – болезнь легких, связанная исключительно с курением, сопровождающаяся невыраженными симптомами одышки и кашля, хорошо поддающаяся терапии стероидами или саморазрешающаяся при отказе от курения [14].
Таблица 2. Клиническая классификация синдрома облитерирующего бронхиолита Международного общества трансплантации сердца и легких
• Определить исходный уровень ОФВ1 как среднее двух наилучших предшествующих измерений.
• Сравнить настоящее значение ОФВ1 с исходным
0 степень: ОФВ
1 более 80 % от исходного
I степень: ОФВ1 – 66 – 79 % от исходного
II cтепень: ОФВ1 – 51 – 65 % от исходного
III cтепень: ОФВ1 менее 50 % от исходного
• Оценить гистологическую картину на предмет наличия признаков ОБ:
А – нет признаков облитерирующего бронхиолита (или нет биопсии)
В – морфологические признаки облитерирующего бронхиолита
Интерес к ОБ существенно возрос в течение последних 12 – 15 лет, что связано с бурным развитием транспланталогии во всем мире. Первое сообщение об ОБ, развившемся после трансплантации, принадлежит С. Burke и соавт. [15], которые описали развитие обособленного заболевания, проявляющегося нарастающей одышкой и обструкцией дыхательных путей у пациентов, успешно перенесших пересадку комплекса сердце – легкие. Авторы подчеркнули, что описанный синдром аналогичен ОБ, вызванному другими причинами, но отличается от хронического бронхита, обструктивной эмфиземы легких и бронхиальной астмы.
Этиология и патогенез
Причины ОБ довольно разнообразны. Это заболевание обычно встречается после трансплантации комплекса сердце – легкие [15 – 17], двух или одного легкого [18, 19], костного мозга [20], после вирусных инфекций [2, 4, 21], ингаляции токсичных веществ [5, 22], на фоне диффузных заболеваний соединительной ткани (ДЗСТ) [6, 23 – 26], воспалительных заболеваний кишечника [27], на фоне приема некоторых медикаментов [28], лучевой терапии [29], синдрома Стивенса – Джонсона [30], IgA-нефропатии (J. Hernandes и соавт., 1997). Основные причины ОБ перечислены в табл.1. В большинстве случаев удается выяснить причину развития ОБ, идиопатические или криптогенные формы встречаются реже (М. Kraft и соавт.,1993). Наиболее хорошо изучены формы ОБ, развившегося после трансплантации.
Считается, что ОБ представляет собой проявление неспецифичных тканевых реакций на различные повреждающие стимулы на уровне мелких ДП. После повреждения эпителия бронхиол происходят миграция и пролиферация мезенхимных клеток в просвет и стенку бронхиол, что приводит в конечном итоге к депозиции в них соединительной ткани.
Первичным событием при ОБ часто являются некроз бронхиолярного эпителия и денудация базальной мембраны в ответ повреждающие стимулы (токсичные пары, вирусы), что приводит к избыточной продукции различных регуляторных пептидов: факторов роста, цитокинов и адгезивных молекул. При аутоиммуных, лекарственных, посттрансплантационных ОБ первичным звеном патогенеза может быть повышение экспрессии антигенов МНС (major histocompatibility complex – главного комплекса гистосовместимости) II класса на клетках бронхиолярного эпителия, что является результатом локальной продукции цитокинов [31]. Данные нарушения приводят к презентации аутоантигенов, Т-клеточной активации, развитию воспаления и фиброзообразования в мелких ДП, т.е. развивается та же цепь событий, что и при многих других аутоиммунных заболеваниях [5]. Воспаление при ОБ, как правило, ассоциированно с наличием в воспалительных инфильтратах цитотоксических Т-лимфоцитов (V. Holland и соавт.,1990).
Одним из наиболее вероятных факторов роста, принимающих участие в стимуляции пролиферации фибробластов при ОБ, считается тромбоцитарный фактор роста (ТФР). Повышение содержания ТФР было выявлено в бронхоальвеолярном лаваже (БАЛ) у пациентов с активным ОБ (М. Hertz и соавт.,1992). Среди цитокинов важную роль при ОБ играют g— интерферон (g— ИФН) и интерлейкин 1b (ИЛ–1b), генная экспрессия которых увеличена при этом заболевании (В. Whitehead и соавт.,1993). ИЛ 1-b регулирует рост лимфоцитов, их дифференцировку и цитотоксичность при аутоиммунных и инфекционных процессах, а g-ИФН индуцирует экспрессию антигенов МНС II класса на эпителиальных клетках и регулирует продукцию иммуноглобулинов.
Важную роль в патологии ОБ играют эпителиальные клетки. Они секретируют фибронектин, являющийся хемоаттрактантом для фибробластов (R. Pardi и соавт.,1992). Регенерирующие эпителиоциты способны усиливать пролиферацию фибробластов и продукцию компонентов экстрацеллюлярного матрикса (S. Rennard и соавт.,1994).
В последние годы все больше внимания уделяют изучению роли интегринов при фибропролиферативных процессах, так как интегрины выполняют функцию адгезии мезенхимальных клеток к компонентам экстрацеллюлярного матрикса. Основными клеточными компонентами грануляционной ткани являются фибробласты и эндотелиальные клетки, а основными протеинами внеклеточного матрикса – фибронектин и фибрин/фибриноген [19]. Адгезия клеток к фибронектину происходит при помощи a5b1 -интегрина, к фибриногену – при помощи a5b3 -интегрина. Блокада процессов адгезии клетки – матрикс может ингибировать реакции фиброгенеза и предотвратить развитие и прогрессирование ОБ, поэтому изучается возможность вмешательства в воспалительный процесс на этом этапе (S. Walh и соавт.,1994).
Морфологическая картина
Гистологическая картина ОБ характеризуется концентрическим сужением преимущественно терминальных бронхиол, которые частично или практически полностью облитерированы грубой рубцовой соединительной тканью, располагающейся в подслизистом слое и/или в адвентиции [9, 12]. Другими важными особенностями морфологической картины являются бронхиолярный или перибронхиолярный хронический воспалительный инфильтрат различной плотности, развитие бронхиолоэктазов со стазом секрета, скоплением макрофагов, формирующих слизистые пробки в люминальном отделе бронхиол. Возможными элементами гистологической картины могут быть гипертрофия гладкой мускулатуры терминальных бронхиол и некроз бронхиолярного эпителия, также могут присутствовать гиперплазия бокаловидных желез и метаплазия бронхиального эпителия [19]. На ранних этапах развития ОБ может быть представлен картиной бронхиолярного воспаления с минимальным рубцеванием или только лимфоцитарным воспалением без признаков фиброзообразования (lymphocytic bronchiolitis) [32]. Если процессы фибропролиферации сопровождаются перибронхиолярными лимфоцитарными инфильтратами, то ОБ расценивается как активный, если же лимфоцитарные инфильтраты отсутствуют, то ОБ считается неактивным [19]. Паттерн морфологического повреждения обычно «пятнистый», т.е. наряду с грубыми изменениями паренхимы встречаются и сохранные структурно-анатомические единицы [1].
При ОБ обычно поражаются терминальные бронхиолы; респираторные бронхиолы, альвеолярные ходы, альвеолярные мешочки и альвеолы, как правило, в воспалительный процесс не вовлекаются. Может наблюдаться развитие интерстициального фиброза, однако он никогда не достигает такой выраженности, как при классических ИЗЛ. Кроме малых ДП, в процесс воспаления также вовлекаются крупные бронхи, в которых часто обнаруживают развитие цилиндрических бронхоэктазов, формирование слизистых пробок, гнойного экссудата и хронического воспалительного инфильтрата, состоящего из лимфоцитов, макрофагов и плазматических клеток [32].
При посттрансплантационном ОБ характерной морфологической находкой является поражение легочных сосудов: фрагментация базальной мембраны, склеротические изменения в артериях мышечного и эластического типов и в мелких венах и венулах (J. Scott, 1997). Данные изменения характерны для реакции хронического отторжения, наблюдающегося и в других солидных органах.
Диагностика
Диагноз ОБ обычно основывается на данных анамнеза, клинической картины, физикального обследования, рентгенологической картины грудной клетки и результатах других исследований (газовый анализ артериальной крови, БАЛ), но наиболее надежным методом диагностики является гистологический.
Клиническая картина ОБ в немалой степени зависит от его причины. Так, заболевание развивается остро после ингаляций HCl и SO2, или после вирусных инфекций, «отсроченно», т.е. после светлого промежутка – после ингаляции NO2 и незаметно – при ДЗСТ и после трансплантации [5]. Клиническая картина соответствует классическому описанию D.Geddes и соавт. [6]. Прогрессирующая одышка является кардинальным признаком заболевания. Сначала одышка появляется только при физической нагрузке, однако в дальнейшем отмечается довольно быстрое нарастание тяжести диспноэ, малейшее напряжение вызывает одышку. Одышка часто сопровождается малопродуктивным кашлем. При аускультации на ранних этапах развития заболевания выслушиваются сухие свистящие хрипы, особенно в базальных отделах, иногда слышен характерный инспираторный «писк», однако по мере нарастания гиперинфляции легких дыхание ослабевает и хрипы практически исчезают. В некоторых случаях дебют заболевания напоминает картину вирусного бронхита: острое или подострое начало, сухой кашель, свистящее дыхание, субфебрильная температура. Но симптомы носят «застывший» характер – отсутствует какое-либо улучшение или разрешение заболевания [33]. Хотя ОБ и относится к болезням малых ДП, часто в процесс вовлекаются и крупные бронхи, что проявляется клиническими симптомами бактериальной суперинфекции или бронхоэктазов. Как и при бронхоэктазах другой природы, часто обнаруживают хроническую колонизацию Pseudomonas aeruginosa и Aspergillus fumigatus, данные возбудители обычно персистируют при снижении объема форсированного выдоха за 1с (ОФВ1) до 1,5 л, или 40 % от нормы (J. Scott и соавт.,1997). Высокая лихорадка и продуктивный кашель обычно являются признаками бактериальной суперинфекции, которая иногда может стать непосредственной причиной смерти больного ОБ (С. Сhaparo и соавт., 1994). Прогрессирование заболевания у многих пациентов носит скачкообразный или ступенчатый характер – периоды ухудшения общего состояния и функциональных параметров чередуются с периодами относительно стабильного состояния [19]. На поздних стадиях заболевания развивается диффузный теплый цианоз, отмечается выраженное напряжение при дыхании вспомогательных респираторных мышц шеи, «пыхтящее» дыхание, что дало повод С. Burke и соавт. [15] назвать больных ОБ «синими пыхтельщиками».
Стандартные рентгенограммы грудной клетки часто не выявляют изменений, хотя могут наблюдаться признаки гипервоздушности легких, реже определяется слабовыраженная диссеминация по очагово-сетчатому типу. Иногда легочные объемы даже уменьшены, как, например, при синдроме Маклеода или посттрансплантационном ОБ. В целом изменения рентгенологической картины обнаруживают не более чем в 50 % всех случаев ОБ [34].
Более чувствительным диагностическим методом является компьютерная томография высокого разрешения (КТВР), посредством которой изменения обнаруживают более чем в 70% случаев [34]. Неизмененные бронхиолы, особенно расположенные интралобулярно (диаметр менее 2 мм), на КТВР не визуализируются, поскольку толщина их стенки не превышает 0,2 мм, что меньше разрешающей способности метода [35]. Бронхиолы становятся видны при развитии в них патологического процесса, так как из-за перибронхиального воспаления, фиброза, экстралюминальной экспансии соединительной ткани, эндобронхиального развития грануляционной ткани происходит значительное утолщение стенки бронхиол. Различают прямые и непрямые диагностические признаки ОБ, обнаруживаемые при помощи КТВР. К прямым признакам ОБ относятся мелкие разветвленные затемнения или центролобулярные узелки, отражающие перибронхиальные утолщения, слизистые пробки и бронхиолэктазы. Прямые признаки встречаются лишь в 10 – 20% случаев [35].
Наиболее частыми непрямыми признаками ОБ, особенно хорошо выявляемыми на выдохе (примерно в 70% случаев), являются бронхоэктазы и участки мозаичной олигемии (E. Stern и соавт.,1995). При синдроме Маклеода посредством КТВР истинные бронхоэктазы выявляют в 30 – 100 % случаев (Т. Hartman и соавт.,1994; G. Teel и соавт., 1996).
Мозаичная олигемия имеет «пятнистый» или «географический» тип распространения и является результатом гиповентиляции и «воздушной ловушки» в сегментах и дольках, соответствующих облитерированным бронхиолам [35]. Облитерация бронхиол сопровождается вторичной вазоконстрикцией, развивающейся на фоне локальной гипоксии. Мозаичная олигемия может быть единственным КТВР-признаком поражения бронхиол и иногда выявляется исключительно при выдохе (G. Teel и соавт., 1996). Области паренхимы легких, соответствующей неизмененным бронхиолам, на выдохе становятся более плотными, в то время как пораженные сегменты остаются сверхпрозрачными, так как облитерация бронхиол препятствует полной эвакуации воздуха – феномен «воздушной ловушки». Благодаря различию в плотности нормальных и пораженных отделов паренхимы (нормальные сегменты выглядят более плотными – псевдозатемненными), а также перераспределению кровотока в сторону непораженных сегментов, может возникать феномен «псевдоматового стекла» [35]. Однако данный феномен отличается от паттерна заболеваний с признаками истинного «матового стекла» тем, что при последнем сосуды одинакового порядка и расположенные на одном и том же уровне (в зонах с повышенной и пониженной плотностью) имеют одинаковый калибр и, кроме того, на экспираторных сканах не выявляется «воздушной ловушки» [34].
Признаки дезорганизации и деструкции легочной паренхимы, буллезные изменения при ОБ, как правило, отсутствуют, что позволяет четко отграничить ОБ от эмфиземы легких (G. Teel и соавт., 1996). КТВР позволяет также отличить ОБ от другой более частой причины обструкции ДП – бронхиальной астмы: так, после фармакологических проб с бронходилататорами при астме зоны «воздушной ловушки» или исчезают, или существенно уменьшаются.
В тех редких случаях, когда поражение бронхиол является диффузным и отсутствует неравномерность или «пятнистость» распределения КТВР-изменений, основным диагностическим признаком наряду с повышенной прозрачностью и диффузной олигемией является отсутствие уменьшения легочных объемов во время выдоха [34].
Функциональные тесты. По данным тестов функции внешнего дыхания (ФВД) выявляется обструктивный паттерн: уплощение кривой поток – объем, снижение скоростных потоковых показателей, повышение статических легочных объемов. Обструкция, как правило, необратима. Наиболее чувствительным функциональным изменением является снижение максимального среднеэкспираторного потока (МСП 25-75%) [1]. Инфекции дыхательных путей также могут вызвать изменением этого показателя, и хотя V. Starnes и соавт.(1989) показали, что снижение МСП 25-75% более выражено при ОБ, чем при инфекционных бронхобронхиолитах, такая информация вряд ли может помочь в дифференциальной диагностике этих процессов. Существуют определенные закономерности изменения функциональных показателей: раньше всего происходит снижение МСП 25-75% при относительно нормальной величине ОФВ1, затем вскоре происходит и уменьшение форсированной жизненной емкости легких (ФЖЕЛ), сопровождающееся значительным увеличением остаточного объема легких (ООЛ). Показатель ОФВ1 претерпевает большие изменения, чем ФЖЕЛ, что закономерно приводит к уменьшению соотношения ОФВ1/ФЖЕЛ (коэффициента Тиффно).
Очень чувствительным методом обнаружения поражения малых ДП является тест вымывания азота при одиночном вдохе. Так, в недавно проведенном исследовании М. Giljam и соавт. (1997) было показано, что при посттрансплантационном ОБ наклон альвеолярного плато (фаза 3) является более ранним и более специфичным показателем, чем ОФВ1.
При посттрансплантационном ОБ может присутствовать и небольшой рестриктивный компонент, проявляющийся снижением общей емкости легких (ОЕЛ), что, вероятнее всего, является следствием послеоперационных изменений грудной клетки (J. Theodore,1990). Диффузионная способность легких обычно умеренно снижена. Изменения газового состава артериальной крови обычно несколько отличны от таковых при других обструктивных заболеваниях легких – чаще выявляют гипоксемию и гипокапнию, гиперкапния крайне редка [15]. Характерно расширение альвеолоартериального градиента до 20 мм рт.ст. и выше.
Еще одним диагностическим тестом, который может иметь определенное значение для оценки активности ОБ, является определение окиси азота в выдыхаемом воздухе. Выдыхаемый NO (еNO) признан адекватным маркером для неинвазивной оценки воспаления ДП при бронхиальной астме, муковисцидозе, бронхоэктатической болезни (S. Singhn и соавт.,1997). Исследования по определению eNO при ОБ пока немногочисленны и их результаты довольно противоречивы. Так, в исследовании S. Lok и соавт.(1997) не было замечено различий в уровне еNO в посттрансплантационный период между пациентами с ОБ и без ОБ. С другой стороны, в работе G. Verleden и соавт.(1997), также посвященной посттрансплантационному ОБ, продемонстрированы достоверные различия в уровне eNO между здоровыми добровольцами (9±3 ppb), пациентами без ОБ (11±3 ppb) и пациентами с ОБ (22±12 ppb).
Бронхоскопия, биопсия легких и БАЛ. Бронхологическая картина обычно не имеет характерных особенностей, так как патологические изменения локализуются дистальнее бронхов, доступных обзору, однако бронхоскопия позволяет получить биопсийный материал и выполнить БАЛ. Трансбронхиальная биопсия (ТББ) признана довольно ценным диагностическим методом при ОБ, так как может многократно выполняться у одного и того же больного, однако чувствительность ТББ колеблется от 15 до 60 % по сравнению с «золотым» стандартом диагностики – открытой биопсией легких [19]. Низкая чувствительность связана с неравномерностью распространения патологических изменений и небольшим объемом биопсийного материала [37]. Специфичность ТТБ довольно высока, т.е. при наличии в биоптате морфологической картины ОБ вероятность развития ОБ велика. КТ-исследование может помочь более точно определить локализацию для возможной биопсии легких. Результативность ТББ повышается при взятии нескольких биоптатов, некоторые авторы рекомендуют брать от 6 до 12 биоптатов [19]. Когда образцы ткани легких, полученные при ТББ, неинформативны, проводят открытую биопсию легких или торакоскопическую биопсию. Перспективным методом ранней диагностики посттрансплантационного ОБ является определение экспрессии антигена МНС II класса на клетках эпителия бронхиол, полученных при ТББ [31].
Цитологический анализ БАЛ практически не несет какой-либо информации при развитии ОБ, большее значение придается исследованию неклеточных компонентов (или растворимых факторов) БАЛ, которые являются потенциальными маркерами иммуновоспалительных процессов при ОБ. При посттрансплантационном ОБ изучалось значение таких растворимых факторов БАЛ, как рецепторы ИЛ-2 (S. Jordan и соавт., 1992), цитокины ИЛ-6 и фактор некроза опухоли a (В. Hausen и соавт., 1994), ИЛ-8 (G. Riise и соавт.,1997). Хотя перечисленные факторы могут отражать процессы иммунной активации и воспаления ДП, ни один из этих маркеров не обладает достаточной чувствительностью, специфичностью и предсказательной ценностью при мониторировании воспаления при ОБ. Более универсальное значение имеет маркер активации фиброобразования гиалуронан, который является одним из основных компонентов экстрацеллюлярного матрикса и секретируется фибробластами. Значение уровня этого маркера в БАЛ было показано в нескольких исследованиях, посвященных ИЗЛ (N. Milman и соавт., 1995). J. Scott и соавт. (1997) предлагают использовать определение гиалуронана для оценки активности воспаления и при ОБ. В настоящее время практически не существует никаких маркеров ранней фазы ОБ – повреждения бронхиолярного эпителия, возможно, таким маркером может стать внутриклеточный энзим креатинкиназа (J. Scott и соавт.,1997).
Особенности некоторых форм ОБ
Посттрансплантационный ОБ занимает заметное место в структуре заболеваемости и смертности больных, перенесших трансплантацию комплекса сердце – легкие, двух легких, реже – одного легкого (S. Levine и соавт.,1995). В 80-х годах посттрансплантационный бронхиолит развивался в 50–80 % случаев после пересадки комплекса сердце – легкие, летальность при этом осложнении превышала 80% (J. Scott и соавт.,1997). Использование более агрессивных схем иммуносупрессии, включающих циклоспорин А, азатиоприн, кортикостероиды, позволило значительно снизить частоту развития ОБ – до 20 – 50 % (Р. McCarthy и соавт.,1990). Считается, что данный синдром представляет собой проявление хронической реакции отторжения – реакции трансплантант против хозяина (В. Griffith и соавт.,1988). Также не исключена роль инфекционного фактора, например вирусных инфекций (респираторного синцитиального вируса – РСВ, цитомегаловируса – ЦМВ, вирусы парагриппа, к которым особенно восприимчив больной после трансплантации (J. Dauber и соавт., 1990). Так, замечена существенная корреляция между частотой развития ЦМВ-пневмонита и ОБ (R. Rubin, 1989). Еще одним фактором риска развития ОБ является хроническая ишемия ДП трансплантированного легкого, связанная с поражением сосудов при реакции отторжения (К. Bando и соавт.,1995). ОБ может развиться практически в любые сроки после трансплантации, хотя наиболее типичным является начало заболевания через 8 – 12 мес после операции.
Ввиду особо неблагоприятного прогноза ОБ в настоящее время считается оправданным раннее многократное проведение инвазивных диагностических исследований – ТББ, БАЛ, что позволяет значительно улучшить диагностику этого опасного осложнения. Так как пациенты могут иметь гистологические признаки ОБ без клинических и лабораторных нарушений, и, наоборот, существует вероятность получения ложноотрицательных результатов ТББ при наличии прогрессирующей одышки и изменении ФВД, считается оправданным выделение синдрома ОБ. Для унификации оценки тяжести и определения терапевтических программ ОБ Международным обществом трансплантации сердца и легких разработана клиническая классификация синдрома ОБ (табл. 2) [18].
После пересадки костного мозга ОБ развивается несколько реже – у 10 % пациентов с реакциями отторжения. Бронхиолит обычно развивается через 6 мес после трансплантации, хотя возможно развитие в любые сроки в течение 2 – 20 мес [20]. Чаще страдают пациенты, которым трансплантация аллогенного костного мозга производилась по поводу апластической анемии или хронического миелолейкоза (S. Wyatt и соавт.,1984). Однако развитие ОБ не всегда можно объяснить реакциями отторжения: Н. Paz и соавт. (1992) описали развитие ОБ у двух пациентов, перенесших аутологичную трансплантацию костного мозга по поводу лимфомы. Клиническая и морфологическая картина ОБ этого типа не отличается от таковой ОБ другой природы, хотя некоторые авторы подчеркивают, что течение ОБ после трансплантации костного мозга может осложняться развитием легочных инфекций, пневмотораксом и пневмомедиастинумом [20]. Летальность при ОБ через 3 года после трансплантации составляет около 65% (J. Clark и соавт.,1989).
Другой большой группой заболеваний, при которых может встречаться ОБ, являются ДЗСТ. Почти исключительно ОБ встречается при ревматоидном артрите [6, 36], хотя и имеются единичные сообщения о возможности развития заболевания при ювенильном ревматоидном артрите [25], системной красной волчанке [24, 26] и при синдроме Шегрена (Y. Nemeto и соавт.,1991). Как уже упоминалось, впервые ОБ при ревматоидном артрите был описан D.Geddes и соавт. [6]. Однако до сих пор существуют сомнения, является ли ОБ осложнением основного заболевания или результатом лечения этих больных D-пеницилламином. Чаще ОБ развивается у пациентов, имеющих длительный анамнез ревматоидного артрита, в основном у женщин в возрасте 50 – 60 лет. Заболевание характеризуется резистентностью к терапии стероидами, развитием неуклонно прогрессирующей дыхательной недостаточности, приводящей к летальному исходу. При рентгенологическом исследовании легких наблюдают выраженную гиперинфляцию, а функциональные легочные тесты выявляют обструктивный тип нарушения. Прогноз ОБ на фоне ДЗСТ крайне неблагоприятный: выживание больных не превышает 1 – 1,5 лет.
ОБ может явиться осложнением некоторых легочных инфекций. Чаще всего причиной являются вирусные инфекции: РСВ, аденовирус, риновирус, коронавирус, ветряной оспы – опоясывающего лишая, ЦМВ и др. [2,5]. Особенно часто развитие ОБ после вирусных инфекций отмечается у детей до двух лет. Описано развитие ОБ при Mycoplasma pneumonia (М. Prabhu и соавт., 1991). В детском возрасте наиболее частыми фоновыми заболеваниями для развития ОБ являются легочная дисплазия у недоношенных детей и, возможно, муковисцидоз [4]. F. Diaz и соавт. [21] описали развитие ОБ у пациента с ВИЧ-инфекцией (при содержании: лимфоцитов СD4 0,168 х 109/л, 17 %) в отсутствие других инфекционных осложнений. Последствием вирусного бронхиолита может быть синдром Маклеода или Свиера – Джеймса (Swyer – James): развитие одностороннего сверхпрозрачного легкого, гипоплазии легочной артерии и бронхоэктазов. Другой редкой причиной инфекционного ОБ является плесневый гриб Aspergillus fumigatus, заболевание описано у двух пациентов с выраженными нарушениями иммунитета, в одном случае ОБ сочетался с бронхоцентрической гранулемой (S. Sieber и соавт.,1994).
Лекарственный ОБ встречается относительно редко. Отмечена связь этого заболевания с использованием таких препаратов, как D-пеницилламин (G. Epler и соавт., 1979), сульфасалазин (Е. Gabazza и соавт., 1992), препараты золота (L. Holness и соавт.,1983) [28], тиопронин (А. Demaziere и соавт.,1993), амфотерицин В (А. Roncoroni и соавт.,1990). Клиническая картина и течение заболевания напоминают ОБ на фоне ДЗСТ или после трансплантации. Близким к лекарственному является ОБ, развивающийся на фоне употребления пищевых продуктов. В августе 1995 г. на Тайване описано 23 случая ОБ у женщин молодого и среднего возраста, принимавших c целью похудания сок тропического овоща Sauropus androgynus (R. Lai и соавт.,1996).
Ассоциация постингаляционного ОБ отмечена с широким спектром токсичных веществ, таких как диоксид азота, диоксид серы, хлор, аммиак, фосген, хлорпикрин, хлорид и стеарат цинка, трихлорэтилен, гидрогены серы и фтора, карбонилы никеля и железа, пентахлорид серы [5, 38], не исключается также и роль термического фактора (S. Tasaka и соавт.,1995). Обычно ингаляциям токсичных веществ подвержены работники промышленных предприятий, особенно тех, на которых производятся или используются горючие материалы, проводится выплавка металлов, сварка и т.д. [33]. Бронхиолы повреждаются различными путями, однако чаще всего повреждающие вещества являются либо сильными кислотами, либо сильными основаниями, либо окислителями. Морфологическое повреждение часто развивается под влиянием нескольких факторов. Пожалуй, эта форма ОБ является наиболее «мягкой» в плане течения и благоприятной с точки зрения прогноза по сравнению с ОБ другой природы. Клинические симптомы обычно перманентны, возможно полное выздоровление, однако могут развиваться тяжелые морфологические повреждения, приводящие к выраженной дыхательной недостаточности (N. Jaspar и соавт.,1982).
Лечение
ОБ считается заболеванием с крайне плохим ответом на проводимую терапию, и, следовательно, неблагоприятным прогнозом. Ввиду того, что заболевание чаще всего диагностируется на стадии развития в бронхиолах грубых фиброзных изменений, никакая противовоспалительная терапия не может вызвать обратного развития процесса. Целью терапии является не восстановление нормального морфофункционального состояния легких, а стабилизация воспалительного и фибропролиферативного процессов и предотвращение дальнейшего прогрессирования заболевания (I. Paradis и соавт.,1993). Иногда при ранней диагностике заболевания, когда отсутствуют грубые фиброзные изменения бронхиол, «агрессивная» терапия позволяет добиться регрессии патологического процес
From Wikipedia, the free encyclopedia
| Bronchiolitis obliterans[1] | |
|---|---|
| Other names | Constrictive bronchiolitis,[2] Obliterative bronchiolitis, Popcorn lung |
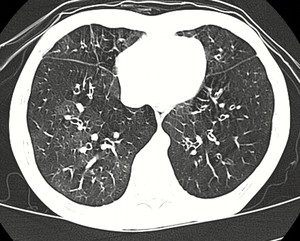 |
|
| High resolution CT scan showing bronchiolitis obliterans with mosaic attenuation, bronchiectasis, air trapping and bronchial thickening[3] | |
| Specialty | Pulmonology |
| Symptoms | Dry cough, shortness of breath, wheezing, feeling tired[1] |
| Usual onset | Worsens over weeks to months[4] |
| Causes | Toxic fumes, respiratory infections, connective tissue disorder, following a bone marrow or heart-lung transplant[1] |
| Diagnostic method | CT scan, pulmonary function tests, lung biopsy[1] |
| Differential diagnosis | Asthma[5] |
| Treatment | Corticosteroids, immunosuppressive medication, lung transplant[1][4] |
| Prognosis | Often poor[4] |
| Frequency | Rare[4] |
Bronchiolitis obliterans (BO), also known as obliterative bronchiolitis, constrictive bronchiolitis and popcorn lung, is a disease that results in obstruction of the smallest airways of the lungs (bronchioles) due to inflammation.[1][6] Symptoms include a dry cough, shortness of breath, wheezing and feeling tired.[1] These symptoms generally get worse over weeks to months.[4] It is not related to cryptogenic organizing pneumonia, previously known as bronchiolitis obliterans organizing pneumonia.[4]
Causes include breathing in toxic fumes, respiratory infections, connective tissue disorder or complications following a bone marrow or heart-lung transplant.[1] Symptoms may not occur until two to eight weeks following toxic exposure or infection.[1] The underlying mechanism involves inflammation that results in scar tissue formation.[1] Diagnosis is by CT scan, pulmonary function tests or lung biopsy.[1] A chest X-ray is often normal.[4]
While the disease is not reversible, treatments can slow further worsening.[1] This may include the use of corticosteroids or immunosuppressive medication.[1] A lung transplant may be offered.[4] Outcomes are often poor, with most people dying in months to years.[4]
Bronchiolitis obliterans is rare in the general population.[4] It, however, affects about 75% of people by ten years following a lung transplant and up to 10% of people who have received a bone marrow transplant from someone else.[4] The condition was first clearly described in 1981.[4] Prior descriptions occurred as early as 1956, with the term «bronchiolitis obliterans» used first by Reynaud in 1835.[7][8]
Signs and symptoms[edit]
Bronchiolitis obliterans results in worsening shortness of breath, wheezing, and a dry cough. The symptoms can start gradually, or severe symptoms can occur suddenly.[9][10] These symptoms represent an obstructive pattern that is non-reversible with bronchodilator therapy, and need to be related to various lung insults.[11] These insults include inhalation damage, post transplant auto-immune injury, post-infectious disease, drug reactions, and several auto-immune diseases.[6]
Cause[edit]
Bronchiolitis obliterans has many possible causes, including collagen vascular disease, transplant rejection in organ transplant patients, viral infection (adenovirus, respiratory syncytial virus, influenza, HIV, cytomegalovirus), Stevens–Johnson syndrome, Pneumocystis pneumonia, drug reaction, aspiration and complications of prematurity (bronchopulmonary dysplasia), and exposure to toxic fumes. Toxins implicated in the condition include diacetyl, sulfur dioxide, nitrogen dioxide, ammonia, chlorine, thionyl chloride, methyl isocyanate, hydrogen fluoride, hydrogen bromide, hydrogen chloride, hydrogen sulfide, phosgene, polyamide-amine dyes, mustard gas and ozone.[4][6][12] It can also be present in patients with IBD, systemic lupus erythematosus, juvenile idiopathic arthritis, rheumatoid arthritis, GERD, IgA nephropathy, and ataxia telangiectasia.[13][14][6] Activated charcoal has been known to cause it when aspirated.[15] The ingestion of large doses of papaverine in the vegetable Sauropus androgynus has caused it.[16] Additionally, the disorder may be idiopathic (without known cause).[17][18][19]
Lung transplant[edit]
Bronchiolitis obliterans is a common complication in lung transplants because transplanted lungs are at greater risk of alloimmunization as compared to healthy lungs. The disease is often termed bronchiolitis obliterans syndrome (BOS) in the setting of post lung transplantation and hematopoietic stem cell transplant (HSCT).[6] Patients who develop BOS post lung transplant vary in disease latency and severity.[6] Patients often initially have normal lung function on pulmonary function testing and have normal chest radiographs.[6] As the disease progresses they begin to have symptoms of shortness of breath, cough, and wheezing as their lung function declines. The Journal of Heart and Lung Transplantation published updated guidelines in 2001 for grading the severity of BOS.[20] The original guidelines and classification system were published in 1993 by the International Society for Heart and Lung Transplantation.[20] Their scoring system is based on the changes in FEV1 in patients from their baseline.[20] When patients are first diagnosed with BOS they have their baseline lung function established by doing pulmonary function testing at the time of diagnosis.[20] The BOS scoring system is as follows:
BOS 0: FEV1 > 90% of baseline and FEF25-75 > 75% of baseline
BOS 0-p: FEV1 81-89% of baseline and/or FEF25-75 <= 75% of baseline
BOS 1: FEV1 66-80% of baseline
BOS 2: FEV1 51-65% of baseline
BOS 3: FEV1 50% or less of baseline
The scoring system shows an increased severity of the disease as the BOS number increases.[20]
Hematopoietic stem cell transplant[edit]
Bronchiolitis obliterans affects up to 5.5% of people who have received HSCT.[21] One of the biggest risk factors after HSCT is the development of GVHD with a 14% risk.[22] Other risk factors post transplant including tobacco use, age of donor, age of recipient, lower baseline FEV1/FVC ratio, non-caucasian race, peripheral and lower circulating IgG levels.[6] Studies have, however, shown mixed results regarding these other risk factors. There has been an association shown between the increased use of peripheral stem cells and the risk of developing bronchiolitis obliterans.[6] Also, research has shown an increased risk for developing the disease within the first year of transplant if the person is infected with respiratory syncytial virus or parainfluenza virus within the first 100 days post transplant.[6]
Inhalants[edit]
There are many industrial inhalants that are known to cause various types of bronchiolitis, including bronchiolitis obliterans.[23]
Industrial workers who have presented with bronchiolitis:
- nylon-flock workers[19]
- workers who spray prints onto textiles with polyamide-amine dyes[19]
- battery workers who are exposed to thionyl chloride fumes
- workers at plants that use or manufacture flavorings such as diacetyl[9][19][24]
Diacetyl is a chemical used to produce the artificial butter flavoring[25] in many foods such as candy and microwave popcorn and occurring naturally in wines. This first came to public attention when eight former employees of the Gilster-Mary Lee popcorn plant in Jasper, Missouri developed bronchiolitis obliterans. Due to this event, bronchiolitis obliterans began to be referred to in the popular media as «popcorn lung» or «popcorn workers lung».[26][27][28][29] It is also referred to as «flavorings-related lung disease».[30]
Post-infectious[edit]
High-resolution CT scan of a child with post-infectious bronchiolitis obliterans showing glass pattern with air trapping and bronchial thickening
Typically found in young children and is the most common cause at this age.[31] Generally occurs after a viral infection of adenovirus (types 3, 7, and 21), measles (rubeola), mycoplasma, CMV, influenza, and parainfluenza.[4][6] Swyer-James syndrome is a rare complication of bronchiolitis obliterans caused by measles or adenovirus.[32] Post-infectious bronchiolitis obliterans is most common in the southern hemisphere particularly in countries such as Brazil, Argentina, Australia, Chile and New Zealand.[33] There was a large prevalence of the disease in these areas during the 1990s and early 2000s. In one hospital in Buenos Aires, the Ricardo Gutiérrez Children’s hospital, the disease accounted for 14% of their inpatient respiratory population from 1993 to 2002.[33] As such, much of the information about post-infectious bronchiolitis obliterans has come from research out of South America. The most significant risk factors for the disease are infection with adenovirus and the need for ventilator support.[33] In contrast with another cause of bronchiolitis obliterans in children, Steven’s Johnson’s syndrome, post-infectious bronchiolitis obliterans tends to be a chronic but non-progressive disease.[31] The disease can have varying impact on children and their quality of life, which has been studied by lung function tests, as well as their exercise tolerance.[34] Children with lower lung function based on their pulmonary function testing, have lower exercise tolerance, which compounds the impact of the disease on cardiovascular function as they are not able to maintain age appropriate aerobic fitness.[34] This ultimately affects their activities of daily living (ADLs) and their quality of life going forward.[34]
Burn pits[edit]
A form of constrictive bronchiolitis is starting to present in Iraq and Afghanistan veterans. It has been attributed to veterans being exposed to trash burn pits. Veterans present with shortness of breath and other asthma-like symptoms. The only way to diagnose this condition is by doing a lung biopsy as chest X-rays and CT scans come back as normal. The government still denies that there is any correlation between burn pits and health problems but the government has started an «Airborne Hazards and Open Burn Pit Registry» to begin tracking the health of veterans who were exposed to burn pits to see if there is a connection.[35][36]
E-cigarettes[edit]
The American Lung Association lists flavored e-cigarettes as a risk in 2016.[37] Health Canada has, however seen no cases as of 2019.[38] Public Health England writes that the association has come about as «some flavourings used in e-liquids to provide a buttery flavour contain the chemical diacetyl… however, diacetyl is banned as an ingredient from e-cigarettes and e-liquids in the UK.»[39]
Mechanism[edit]
The underlying mechanism involves injury and inflammation of epithelial and sub-epithelial cells. These cells then lose the ability to repair the tissue, in particular they lose the ability to regenerate the epithelial or outermost layer, leading to the excess growth of cells that cause scarring.[11][6][1] There are multiple pathways of the disease including fibrotic, lymphocytic, and antibody-mediated that have been described. However, while each pathway has a more unique starting point and cause, the result is still injury and inflammation leading to scarring of the lung tissue.[11] The scarred tissue then makes the expiration phase of respiration more difficult, leading to air not being expelled from the lungs. This is termed «air-trapping», which can be seen on medical imaging.[6] Since the scarring is non-reversible, the disease generally does not improve over time, and depending on the inciting can progress to death.[11]
Diagnosis[edit]
Example of early disease with mild flattening of the diaphragm
Bronchiolitis obliterans is often diagnosed based on the symptoms of obstructive lung disease following lung injury. The definitive diagnosis is through biopsy, but due to the variable distribution of lesions, leading to falsely negative tests, and invasive nature of this procedure it is often not performed.[6][11] Several tests are often needed to diagnose bronchiolitis obliterans, including spirometry, diffusing capacity of the lung tests (DLCO), lung volume tests, chest X-rays, high-resolution CT (HRCT), and lung biopsy.[11][4]
Pulmonary function testing[edit]
Spirometry tests usually show an obstructive pattern and is the most common presentation.[6] A slightly reduced to normal forced vital capacity (FVC), and a reduced FEV1 to FVC ratio and forced expiratory volume (FEV) with little to no correction with the use of bronchodilators are common findings.[11][4] Lung volume tests may show hyperinflation (excessive air in lungs caused by air trapping). Diffusing capacity of the lung (DLCO) tests are usually normal; people with early-stage OB are more likely to have normal DLCO.[40]
FEV1 (forced expiratory volume in 1 second) should be above 80% of predicted values to be considered normal. Bronchiolitis obliterans reduces this to between 16% and 21%.[41]
Medical imaging[edit]
Early in the disease chest radiography is typically normal but may show hyperinflation.[6] As the disease progresses a reticular pattern with thickening of airway walls may be present.[4][6] HRCT can also show air trapping when the person being scanned breathes out completely; it can also show thickening in the airway and haziness in the lungs.[11] A common finding on HRCT is patchy areas of decreased lung density, signifying reduced vascular caliber and air trapping.[6] This pattern is often described as a «mosaic pattern», and may indicate bronchiolitis obliterans.[6]
Lung biopsy[edit]
Transthoracic lung biopsies are preferable for diagnosis of constrictive BO compared to transbronchial biopsies; regardless of the type of biopsy, a diagnosis may only be achieved by examination of multiple samples.[30] Transthoracic biopsies are preferred over transbronchial due to the heterogeneity and distribution of the lesions.[11] OB can be further classified into two categories: constrictive or proliferative.[11] The constrictive pattern is demonstrated by peribronchiolar cellular infiltrates which eventually causes small airway damage and leads to subepithelial fibrosis.[11] The bronchial muscle can eventually become fibrosed which can be identified with trichrome staining.[11] In regards to proliferative disease, intraluminal buds called «Masson bodies» fill the lumen, which results in bronchiolar plugging.[11] Often people with proliferative disease will show butterfly wing-like appearance under microscopy.[11] One key determinate that can be seen on biopsy to differentiate constrictive from proliferative disease is the extent of lesions. Both lesions are localized from the small bronchi to the membranous bronchi, but in constrictive disease, the lesions are intermittent while proliferative disease has a continuous distribution.[11]
Differential diagnosis[edit]
Other conditions that can present similarly include chronic obstructive pulmonary disease, asthma, bronchiectasis, hypersensitivity pneumonitis, and pneumonia.[30][42]
Prevention[edit]
Inhalants[edit]
Disease caused by exposure to industrial inhalants and burn pits can be prevented with the use of engineering controls (e.g., exhaust hoods or closed systems), personal protective equipment, monitoring of potentially affected personnel, worker education and training.[citation needed]
Transplant[edit]
The primary prevention of bronchiolitis obliterans in people who have received either lung transplant or HSCT therapy is immunosuppression.[6] In regards to post lung transplantation, the combination of calcineurin inhibitor combined with a purine synthesis inhibitor and a glucocorticoid is the general regimen used.[6] People also have a baseline post-transplant lung function testing done in order to determine if their lung function is declining over time. People who are post-HSCT their immunosuppressive regimen typically includes methotrexate in combination with a calcineurin inhibitor to prevent GVHD, a risk factor for developing bronchiolitis obliterans.[6]
Treatment[edit]
While the disease is not reversible, treatments can slow further worsening.[1] This may include the use of corticosteroids or immunosuppressive medication which may have an effect on the ability to receive a lung transplant if offered.[1][4] If patients have difficulty breathing (hypoxemia) oxygen can be supplemented. Routine vaccinations are recommended for patients with chronic lung disease to prevent complications from secondary infections due to pneumonia and influenza.[11]
Transplant recipients are at risk for re-developing the disease, as bronchiolitis obliterans is a form of chronic rejection. Evaluation of interventions for its prevention relies on early detection of abnormal spirometry results or unusual decreases in repeated measurements.[citation needed]
Terminology[edit]
«Bronchiolitis obliterans» was originally a term used by pathologists to describe two patterns of airway disease,[6] the other was bronchiolitis obliterans organizing pneumonia (BOOP), now known as cryptogenic organizing pneumonia.[6] The name cryptogenic bronchiolitis obliterans is used when a cause is unknown.[4]
Bronchiolitis obliterans when it occurs following a lung transplant is known as bronchiolitis obliterans syndrome (BOS).[11][4] BOS is defined as a person who has had either a HSCT or lung transplant and develops symptoms or radiographic findings consistent with bronchiolitis obliterans, but has not been confirmed by biopsy.[22][43]
References[edit]
- ^ a b c d e f g h i j k l m n o p «Bronchiolitis obliterans». GARD. 2012. Archived from the original on 21 January 2017. Retrieved 13 September 2016.
- ^ Schlesinger C, Meyer CA, Veeraraghavan S, Koss MN (October 1998). «Constrictive (obliterative) bronchiolitis: diagnosis, etiology, and a critical review of the literature». Annals of Diagnostic Pathology. 2 (5): 321–34. doi:10.1016/S1092-9134(98)80026-9. PMID 9845757.
- ^ Xie BQ, Wang W, Zhang WQ, Guo XH, Yang MF, Wang L, et al. (2014). «Ventilation/perfusion scintigraphy in children with post-infectious bronchiolitis obliterans: a pilot study». PLOS ONE. 9 (5): e98381. Bibcode:2014PLoSO…998381X. doi:10.1371/journal.pone.0098381. PMC 4031120. PMID 24852165.
- ^ a b c d e f g h i j k l m n o p q r s t Lynch JP, Weigt SS, DerHovanessian A, Fishbein MC, Gutierrez A, Belperio JA (October 2012). «Obliterative (constrictive) bronchiolitis». Seminars in Respiratory and Critical Care Medicine. 33 (5): 509–32. doi:10.1055/s-0032-1325161. PMID 23001805.
- ^ Lockey RF, Ledford DK (2014). Asthma: Comorbidities, Coexisting Conditions, and Differential Diagnosis. Oxford University Press. p. 111. ISBN 9780199918072. Archived from the original on 2017-09-08.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x Barker AF, Bergeron A, Rom WN, Hertz MI (May 2014). «Obliterative bronchiolitis». The New England Journal of Medicine. 370 (19): 1820–8. doi:10.1056/NEJMra1204664. PMID 24806161.
- ^ Gosink BB, Friedman PJ, Liebow AA (April 1973). «Bronchiolitis obliterans. Roentgenologic-pathologic correlation». The American Journal of Roentgenology, Radium Therapy, and Nuclear Medicine. 117 (4): 816–32. doi:10.2214/ajr.117.4.816. PMID 4698820.
- ^ Gourtsoyiannis NC, Ros PR (2005). Radiologic-Pathologic Correlations from Head to Toe: Understanding the Manifestations of Disease. Springer Science & Business Media. p. 154. ISBN 9783540266648. Archived from the original on 2017-09-08.
- ^ a b Centers for Disease Control and Prevention (2002). Fixed obstructive lung disease in workers at a microwave popcorn factory (7th ed.).
- ^ «More than a cold». Archived from the original on 2016-09-15. Retrieved 2016-08-18.
- ^ a b c d e f g h i j k l m n o p q Aguilar PR, Michelson AP, Isakow W (February 2016). «Obliterative Bronchiolitis». Transplantation. 100 (2): 272–83. doi:10.1097/TP.0000000000000892. PMID 26335918. S2CID 26319101.
- ^ Banks DE, Bolduc CA, Ali S, Morris MJ (January 2018). «Constrictive Bronchiolitis Attributable to Inhalation of Toxic Agents: Considerations for a Case Definition». Journal of Occupational and Environmental Medicine. 60 (1): 90–96. doi:10.1097/JOM.0000000000001176. PMID 28953074. S2CID 19899663.
- ^ Callahan SJ, Vranic A, Flors L, Hanley M, Stoler MH, Mehrad B (March 2019). «Sporadic Obliterative Bronchiolitis: Case Series and Systematic Review of the Literature». Mayo Clinic Proceedings. Innovations, Quality & Outcomes. 3 (1): 86–93. doi:10.1016/j.mayocpiqo.2018.10.003. PMC 6410330. PMID 30899912.
- ^ Sam AH, Teo JT (2010). Rapid Medicine. Wiley-Blackwell. ISBN 978-1-4051-8323-9.
- ^ Bairral BQ, Saito M, Morrone N (2012). «Activated charcoal bronchial aspiration». Jornal Brasileiro de Pneumologia. 38 (4): 533–4. doi:10.1590/S1806-37132012000400018. PMID 22964940.
- ^ Bunawan H, Bunawan SN, Baharum SN, Noor NM (2015). «Sauropus androgynus (L.) Merr. Induced Bronchiolitis Obliterans: From Botanical Studies to Toxicology». Evidence-Based Complementary and Alternative Medicine. 2015: 714158. doi:10.1155/2015/714158. PMC 4564651. PMID 26413127.
- ^ Brant & Helms (1999). Fundamentals of Diagnostic Radiology. Baltimore: Williams & Wilkins. ISBN 978-0-683-30093-2.
- ^ Webb; et al. (2000). High Resolution CT of the Lung (3rd ed.). Philadelphia: Lippincott Williams & Wilkins. ISBN 978-0-7817-0217-1.
- ^ a b c d Brown, Jay A. «Haz-Map; Information on Hazardous Chemicals and Occupational Diseases». National Institutes of Health. Archived from the original on 2007-09-12. Retrieved 2007-09-09.
- ^ a b c d e Estenne M, Maurer JR, Boehler A, Egan JJ, Frost A, Hertz M, et al. (March 2002). «Bronchiolitis obliterans syndrome 2001: an update of the diagnostic criteria». The Journal of Heart and Lung Transplantation. 21 (3): 297–310. doi:10.1016/S1053-2498(02)00398-4. PMID 11897517.
- ^ Au BK, Au MA, Chien JW (July 2011). «Bronchiolitis obliterans syndrome epidemiology after allogeneic hematopoietic cell transplantation». Biology of Blood and Marrow Transplantation. 17 (7): 1072–8. doi:10.1016/j.bbmt.2010.11.018. PMC 3061253. PMID 21126596.
- ^ a b Yadav H, Peters SG, Keogh KA, Hogan WJ, Erwin PJ, West CP, Kennedy CC (December 2016). «Azithromycin for the Treatment of Obliterative Bronchiolitis after Hematopoietic Stem Cell Transplantation: A Systematic Review and Meta-Analysis». Biology of Blood and Marrow Transplantation. 22 (12): 2264–2269. doi:10.1016/j.bbmt.2016.08.027. PMC 5116253. PMID 27575542.
- ^ Colby TV (January 1998). «Bronchiolitis. Pathologic considerations». American Journal of Clinical Pathology. 109 (1): 101–9. doi:10.1093/ajcp/109.1.101. PMID 9426525.
- ^ California Department of Public Health Archived 2009-10-16 at the Wayback Machine
- ^ Harber P, Saechao K, Boomus C (2006). «Diacetyl-induced lung disease». Toxicological Reviews. 25 (4): 261–72. doi:10.2165/00139709-200625040-00006. PMID 17288497. S2CID 42169510.
- ^ «Preventing lung disease in workers who make or use flavorings». National Institute for Occupational Safety and Health. 2004. doi:10.26616/NIOSHPUB2004110. Archived from the original on 2006-07-18.
- ^ Schachter EN (August 2002). «Popcorn worker’s lung». The New England Journal of Medicine. 347 (5): 360–1. doi:10.1056/nejme020064. PMID 12151475.
- ^ Egilman D (2007). «Popcorn Workers Lung» (PDF). Archived from the original (PDF) on 2007-09-27. Retrieved 2007-08-09.
- ^ Sauler M, Gulati M (December 2012). «Newly recognized occupational and environmental causes of chronic terminal airways and parenchymal lung disease». Clinics in Chest Medicine. 33 (4): 667–80. doi:10.1016/j.ccm.2012.09.002. PMC 3515663. PMID 23153608.
- ^ a b c «CDC — Flavorings-Related Lung Disease — NIOSH Workplace Safety and Health Topic». www.cdc.gov. Archived from the original on 17 October 2015. Retrieved 15 October 2015.
- ^ a b Champs NS, Lasmar LM, Camargos PA, Marguet C, Fischer GB, Mocelin HT (2011-05-05). «Post-infectious bronchiolitis obliterans in children». Jornal de Pediatria. 87 (3): 187–98. doi:10.2223/JPED.2083. PMID 21547332.
- ^ Hamada K, Oishi K, Hirano T, Shiinoki T, Shibuya K, Matsunaga K (January 2018). «Swyer-James Syndrome». American Journal of Respiratory and Critical Care Medicine. 197 (1): 130–131. doi:10.1164/rccm.201708-1691IM. PMID 29064268.
- ^ a b c Colom AJ, Teper AM, Vollmer WM, Diette GB (June 2006). «Risk factors for the development of bronchiolitis obliterans in children with bronchiolitis». Thorax. 61 (6): 503–6. doi:10.1136/thx.2005.044909. PMC 2111218. PMID 16517579.
- ^ a b c Rodrigues CM, Schiwe D, Campos NE, Niederauer F, Heinzmann-Filho JP (April 2019). «Exercise Capacity in Children and Adolescents With Post-Infectious Bronchiolitis Obliterans: A Systematic Review». Revista Paulista de Pediatria. 37 (2): 234–240. doi:10.1590/1984-0462/;2019;37;2;00017. PMC 6651318. PMID 30892545.
- ^ «Where There’s Smoke: DoD Investigates Causes of Deployment-Related Pulmonary Symptoms Reported by Troops». www.usmedicine.com. Archived from the original on 2013-12-31.
- ^ Harrison Jacobs (5 November 2013). «Open-Air Burn Pits Leave Troops Sickly – Business Insider». Business Insider. Archived from the original on 22 December 2015. Retrieved 18 December 2015.
- ^ Editorial Staff. «Popcorn Lung: A Dangerous Risk of Flavored E-Cigarettes». American Lung Association. Retrieved 27 February 2020.
- ^ Canada, Health (31 July 2019). «Risks of vaping». aem. Retrieved 27 February 2020.
- ^ «Clearing up some myths around e-cigarettes — Public health matters». publichealthmatters.blog.gov.uk. Retrieved 27 February 2020.
- ^ «Bronchiolitis Obliterans». The Lecturio Medical Concept Library. Retrieved 5 July 2021.
- ^ Krishna, R.; Anjum, F.; Oliver, T. I. (2022). «Bronchiolitis Obliterans». National Center for Biotechnology Information, U.S. National Library of Medicine. PMID 28722895. Retrieved 5 July 2021.
- ^ Arakawa H, Webb WR (May 1998). «Air trapping on expiratory high-resolution CT scans in the absence of inspiratory scan abnormalities: correlation with pulmonary function tests and differential diagnosis». AJR. American Journal of Roentgenology. 170 (5): 1349–53. doi:10.2214/ajr.170.5.9574614. PMID 9574614.
- ^ Estenne M, Maurer JR, Boehler A, Egan JJ, Frost A, Hertz M, et al. (March 2002). «Bronchiolitis obliterans syndrome 2001: an update of the diagnostic criteria». The Journal of Heart and Lung Transplantation. 21 (3): 297–310. doi:10.1016/S1053-2498(02)00398-4. PMID 11897517.
Further reading[edit]
- King MS, Eisenberg R, Newman JH, Tolle JJ, Harrell FE, Nian H, et al. (July 2011). «Constrictive bronchiolitis in soldiers returning from Iraq and Afghanistan». The New England Journal of Medicine. 365 (3): 222–30. doi:10.1056/NEJMoa1101388. PMC 3296566. PMID 21774710.
- Brown JA. «Bronchiolitis obliterans». Haz-Map Information on Hazardous Chemicals and Occupational Diseases. National Institutes of Health. Archived from the original on 2007-09-12. Retrieved 2007-09-09.
- «(NIOSH) Alert: Preventing lung disease in workers who make or use flavorings». National Institute for Occupational Safety and Health. 2004. doi:10.26616/NIOSHPUB2004110.
- «Flavorings-Related Lung Disease». National Institute for Occupational Safety and Health. 2018-11-21.
External links[edit]
Лекция врача рентгенолога, главного врача Международного медицинского центра Finemedic Гаврилова Павла Владимировича посвящённая лучевой семиотики полостных образований в легких.
Патология воздухоносных путей малого калибра или бронхиол в настоящее время широко распространена.
Бронхиолит термин который употребляется для характеристики поражения мелких бронхов любой природы. Бронхиолит может быть самостоятельным заболеванием органов дыхания (например, бронхиолит после трансплантации), острый бронхиолит у детей, респираторный бронхиолит и др.). Значительно чаще бронхиолит является проявлением, частью конкретного заболевания, например внебольничной пневмонии (бронхопневмонии), микобактериальной инфекции с очагами бронхогенного отсева, аспирации желудочного содержимого при ГЭРБ и др.
Рентгенологический термин бронхиолит и рентгенологическая картина бронхиолита не является синонимом клинического диагноза «бронхиолит».
Принято различать экссудативный (клеточный) и констриктивный ( облитерирующий) бронхиолит.
Основные причины клеточного бронхиолита:
- Инфекционный бронхиолит (различные этиологические факторы) — скопление воспалительного экссудата внутри просвета бронхиол.
- Респираторный бронхиолит курильщика — характеризуется накоплением пигментированных макрофагов в бронхиолах у курильщиков со стажем 30 лет и более).
- Фолликулярный бронхиолит (гиперплазия лимфоидной ткани в стенках бронхиол при аутоиммунных заболеваниях).
- Аспирационный бронхиолит (реакция бронхиол на аспирацию желудочного содержимого).
- Панбронхиолит (редкая форма клеточного бронхиолита, неизвестной этиологии, обычно встречающегося в Азии у мужчин).
Основным признаком клеточного (экссудативного) бронхиолита является наличие центрилобулярных очагов в легких. Выделяют два основных типа изменений. В первом варианте это очаговые изменения в легких с распределением по типу «дерева в почках»
Другим вариантом является мелких очагов по типу «матового стекла».
Основные причины констриктивного (облитерирующего) бронхиолита:
- Криптогенная/ идиопатический.
- Постинфекционные.
- Токсическое поражение легочной ткани.
- Ревматоидные заболевания.
- Пациенты после трансплантации (легких, сердца, костного мозга).
Характерными признаками констриктивного бронхиолита являются повышение воздушности легочной ткани, мозаичная пневматизация легких, уменьшение калибра сосудов в легких на периферии, расширение мелких бронхов по типу цилиндрических бронхоэктазов.
Компьютерная томография позволяет достоверно судить о наличии поражения мелких бронхов, но причину этих изменений установить непросто.
В ходе онлайн-семинара была рассмотрена семиотика основных типов бронхиолита (экссудативного или клеточного и констриктивного), а также алгоритм проведения дифференциального диагноза между различными нозологиями на примере клинических случаев.
Компьютерная томография органов грудной полости помогает изучить состояние лёгких, оценить расположение сосудов и бронхов, их проходимость. КТ применяют, когда обычная рентгенография оказывается не информативна. На КТ-снимке детально можно увидеть строение легких, средостения, ребер, состояние мягких тканей и лимфатических узлов.
Врач может назначить компьютерную томографию, если пациента беспокоит:
- длительный кашель;
- лихорадка;
- боли в грудной клетке;
- одышка;
- кровохарканье;
- для исключения вторичных поражений при выявлении опухолей различных локализаций.
Гордость Finemedic – это высокоточное и невероятно комфортное для клиентов оборудование, которое позволяет выявить любые нарушения на ранних стадиях болезни, а также талантливые опытные врачи, которые решают самые сложные задачи, чтобы сохранить и улучшить здоровье пациентов. Расширяя границы возможного, профессионалы Finemedic ведут научную деятельность и постоянно повышают квалификацию. Многие из них работают в ведущих научно-исследовательских институтах.
В клинике Finemedic установлен аппарат компьютерной томографии (КТ) Revolution EVO с увеличенным пространственным разрешением до 0,28 мм и повышенной точностью диагностики за счет повышенной до 135% распознаваемости низкоконтрастных структур, а также оптимизацией дозы облучения в соответствии с телосложением конкретного пациента, а также сниженным до 82% уровнем зернистости изображений;
Воспаление бронхиол встречается часто при различных заболеваниях. Причиной патологического процесса в бронхиолах становятся респираторные заболевания, ХОБЛ, бронхиальная астма, поражение дыхательных путей токсическими веществами. Бронхиолиты – это гетерогенная группа заболеваний, которые встречаются реже, чем обструктивная болезнь легких или астма, являются проявлением неспецифических реакций легочной ткани на повреждающие факторы. Встречается несколько видов бронхиолитов:
- Первичные бронхиолиты.
- ИЗЛ с поражением бронхиол.
- Поражение патологическим процессом бронхиол в сочетании с поражением крупных бронхов.
К первичным бронхиолитам относятся:
- Констриктивный (облитерирующий) бронхиолит.
- Острый (клеточный) бронхиолит.
- Респираторный (курильщика) бронхиолит.
- Фолликулярный бронхиолит.
- Бронхиолит, вызванный вдыханием минеральной пыли.
- Диффузный бронхиолит.
- Лимфоцитарный бронхиолит.
- Диффузный аспирационный бронхиолит.

Врач-пульмонолог, аллерголог-иммунолог
Задать вопрос
Специализируется на диагностике и лечении заболеваний органов дыхания (пневмонии, бронхиты, альвеолиты, бронхиальная астма) и аллергии (крапивница, отек Квинке, поллиноз, пищевая непереносимость).
Бронхиолит: лечение у взрослых
Содержание
- Бронхиолит: лечение у взрослых
- Бронхиолит у взрослых: симптомы и лечение облитерирующего бронхиолита
- Облитерирующий хронический бронхиолит
- Фолликулярный бронхиолит
- Симптомы бронхиальной астмы
- Лечение бронхиальной астмы
- Патогенез
- Диагностика
- Общие сведения
- Причины
- Классификация
- Осложнения
- Диагностика
- Лечение смешанной астмы
- Прогноз и профилактика
Бронхиолит у взрослых: симптомы и лечение облитерирующего бронхиолита
Облитерирующий бронхиолит характеризуется концентрическим сужением большей частью терминальных бронхиол, просвет которых заращивается соединительной тканью. Развиваются бронхиолоэктазы со скоплением макрофагов, создающих слизистые пробки в бронхиолах. Идиопатическая форма облитерирующего бронхиолита встречается редко, в большинстве случаев врачи могут найти причину развития патологического процесса. Ассоциированные с облитерирующим бронхиолитом состояния:
- Респираторные инфекции, аденовирусы, цитомегаловирус, вирус парагриппа, вирус иммунодефицита человека и другие состояния.
- Осложнения после приема лекарственных препаратов.
- Поражение токсическими веществами.
- Аутоиммунные заболевания (диффузные заболевания соединительной ткани).
- Осложнение после трансплантации органа.
- Осложнение после лучевой терапии.
- Различные заболевания кишечника.
- Гиперчувствительный пневмонит.
- Аспирация.
- Синдром Стивенса-Джонсона.
Один из основных симптомов облитерирующего бронхиолита – это прогрессирующая одышка. На начальном этапе развития заболевания она беспокоит больного при быстрой ходьбе, физической нагрузке, при прогрессе заболевания любое движение, нервное напряжение вызывает сильную одышку, нередко сопровождающуюся кашлем. Бронхиолит может сопровождаться развитием патологического процесса в крупных бронхах.
Симптомы облитерирующего бронхиолита могут быть подобными симптомам вирусного бронхита, заболевание имеет скачкообразное течение – тяжелое состояние сменяется улучшением, стабильными периодами в состоянии больного. Лечение облитерирующего бронхиолита проводят в зависимости от основного заболевания – это может быть гормональная терапия, макролидные антибиотики, противогрибковые препараты, кислородотерапия.
Облитерирующий хронический бронхиолит
Облитерирующий хронический бронхиолит относится к тяжелым заболеваниям, развивается как последствие острого бронхиолита. Больного постоянно беспокоит одышка, появляется кашель, кожа приобретает сероватый или синюшный оттенок, может нарушиться аппетит, беспокоит усиленное сердцебиение, тошнота, может начаться рвота, больной становится раздражительным, теряет вес. Развитию хронического бронхиолита способствуют различные факторы риска:
- Тяжелая экология.
- Активное и пассивное курение.
- Вредные условия на производстве.
Поражение бронхиол патологическим процессом приводит к нарушению прохождения кислорода через бронхиолы, снижению кровообращения и газообмена в тканях легкого, в результате развивается эмфизема легких, которая характеризуется разрушением стенок альвеол, расширением бронхиол. Хронический облитерирующий бронхиолит встречается нескольких видов:
- Односторонний очаговый бронхиолит.
- Двусторонний очаговый бронхиолит.
- Односторонний тотальный бронхиолит (Синдром Маклеода).
- Двусторонний долевой бронхиолит.
- Односторонний долевой бронхиолит.
Наиболее часто встречающаяся форма заболевания – это односторонний очаговый бронхиолит. Односторонний бронхиолит имеет более благоприятный прогноз, чем двусторонний вариант. Двусторонний бронхиолит нередко приводит к развитию сердечно-легочной недостаточности. Диагностику заболевания проводят с помощью исследования функции внешнего дыхания, бронхоскопии, бронхографии, расширенной компьютерной томографии органов грудной клетки.
Дополнительно назначают исследования состояния сердца – электрокардиографию, допплерографию, эхокардиографию. Лечение хронического облитерирующего бронхиолита проходит с помощью антибактериальной, противовирусной или противогрибковой терапии, для улучшения отхождения слизи из дыхательных путей назначают муколитики и сосудорасширяющие средства. Больным назначают физиотерапевтические процедуры, массажи.
Фолликулярный бронхиолит
Фолликулярный бронхиолит характеризуется наличием в стенке бронхиол лимфоидных фолликулов гипертрофированного вида. Фолликулярный бронхиолит чаще всего встречается у больных с иммунодефицитными состояниями, синдромом Шегрена, микоплазменной инфекцией, вирусными заболеваниями. Редко встречается идиопатический фолликулярный бронхиолит.
Симптомы заболевания – это высокая температура тела, прогрессирующая одышка, кашель, иногда рецидивирующие пневмонии. Рентген может показать диффузные узелково-сетчатые или мелкоузелковые изменения в тканях, которые могут сочетаться с лимфаденопатией средостения. Расширенная компьютерная томография помогает определить центрилобулярные узелки, расположенные субплеврально и по ходу сосудов, обнаруживается лимфоидная инфильтрация соединительной (интерстициальной) ткани в легких.
Пройти полное обследование при бронхиолите можно в диагностическом центре Юсуповской больницы. Различные исследования крови, мочи проводят в клинической лаборатории больницы. Пациентам предоставляются услуга доставки пациента, комфортные палаты круглосуточного стационара. Исследования, которые не проводят в Юсуповской больнице можно пройти в сети партнерских клиник. Юсуповская больница – это современный медицинский центр, оказывающий услуги в различных направлениях медицины. Записаться на прием можно по телефону больницы.
Симптомы бронхиальной астмы
Приступ удушья при бронхиальной астме делится на три периода: период предвестников, период разгара и период обратного развития. Период предвестников наиболее выражен у пациентов с инфекционно-аллергической природой БА, он проявляется вазомоторными реакциями со стороны органов носоглотки (обильные водянистые выделения, непрекращающееся чихание). Второй период (он может начаться внезапно) характеризуется ощущением стесненности в грудной клетке, которое не позволяет дышать свободно. Вдох становится резким и коротким, а выдох наоборот продолжительным и шумным. Дыхание сопровождается громкими свистящими хрипами, появляется кашель с вязкой, трудно отхаркиваемой мокротой, что делает дыхание аритмичным.
Во время приступа положение пациента вынужденное, обычно он старается принять сидячее положение с наклоненным вперед корпусом, и найти точку опоры или опирается локтями в колени. Лицо становится одутловатым, а во время выдоха шейные вены набухают. В зависимости от тяжести приступа можно наблюдать участие мышц, которые помогают преодолеть сопротивление на выдохе. В периоде обратного развития начинается постепенное отхождение мокроты, количество хрипов уменьшается, и приступ удушья постепенно угасает.
Проявления, при которых можно заподозрить наличие бронхиальной астмы.
- высокотональные свистящие хрипы при выдохе, особенно у детей.
- повторяющиеся эпизоды свистящих хрипов, затрудненного дыхания, чувства стеснения в грудной клетке и кашель, усиливающийся в ночной время.
- сезонность ухудшений самочувствия со стороны органов дыхания
- наличие экземы, аллергических заболеваний в анамнезе.
- ухудшение или возникновение симптоматики при контакте с аллергенами, приеме препаратов, при контакте с дымом, при резких изменениях температуры окружающей среды, ОРЗ, физических нагрузках и эмоциональных напряжениях.
- частые простудные заболевания «спускающиеся» в нижние отделы дыхательных путей.
- улучшение состояние после приема антигистаминных и противоастматических препаратов.
Лечение бронхиальной астмы
Поскольку бронхиальная астма является хроническим заболеванием вне зависимости от частоты приступов, то основополагающим моментом в терапии является исключение контакта с возможными аллергенами, соблюдение элиминационных диет и рациональное трудоустройство. Если же удается выявить аллерген, то специфическая гипосенсибилизирующая терапия помогает снизить реакцию организма на него.
Для купирования приступов удушья применяют бета-адреномиметики в форме аэрозоля, для того чтобы быстро увеличить просвет бронхов и улучшить отток мокроты. Это фенотерола гидробромид, сальбутамол, орципреналин. Доза в каждом случае подбирается индивидуально. Так же хорошо купируют приступы препараты группы м-холинолитиков – аэрозоли ипратропия бромида и его комбинации с фенотеролом.
Ксантиновые производные пользуются среди больных бронхиальной астмой большой популярностью. Они назначаются для предотвращения приступов удушья в виде таблетированных форм пролонгированного действия. В последние несколько лет препараты, которые препятствуют дегрануляции тучных клеток, дают положительный эффект при лечении бронхиальной астмы. Это кетотифен, кромогликат натрия и антагонисты ионов кальция.
При лечении тяжелых форм БА подключают гормональную терапию, в глюкокортикостероидах нуждается почти четверть пациентов, 15-20 мг Преднизолона принимают в утренние часы вместе с антацидными препаратами, которые защищают слизистую желудка. В условиях стационара гормональные препараты могут быть назначены в виде инъекций. Особенность лечения бронхиальной астмы в том, что нужно использовать лекарственные препараты в минимальной эффективной дозе и добиваться еще большего снижения дозировок. Для лучшего отхождения мокроты показаны отхаркивающие и муколитические препараты.
Патогенез
В формировании астматических реакций задействованы иммунные и неиммунные механизмы, в которых участвуют различные клеточные элементы: эозинофильные лейкоциты, тучные клетки, базофилы, макрофаги, Т-лимфоциты, фибробласты, клетки эпителия и эндотелия и др. Атопической форме астмы свойственны аллергические реакции I типа (анафилактические).
В иммунологическую фазу происходит развитие сенсибилизации организма к впервые поступившему аллергену за счет синтеза IgE и IgG4 и их фиксации на наружной мембране клеток-мишеней. В патохимическую фазу повторный контакт аллергена с клетками-мишенями запускает резкий выброс различных медиаторов воспаления — гистамина, цитокинов, хемокинов, лейкотриенов, фактора активации тромбоцитов и др. Развивается ранняя астматическая реакция (в период от 1-2 мин. до 2 ч после воздействия аллергена) в виде бронхообструктивного синдрома с отеком слизистой бронхов, спазмом гладкой мускулатуры, повышенной секрецией вязкой слизи (патофизиологическая фаза). Бронхоспазм приводит к ограничению поступления воздушного потока в нижние отделы дыхательного тракта и временному ухудшению вентиляции легких.
Поздняя астматическая реакция сопровождается воспалительными изменениями бронхиальной стенки — эозинофильной инфильтрацией слизистой оболочки и подслизистого слоя, десквамацией клеток мерцательного эпителия, гиперплазией бокаловидных клеток, разрастанием и гиалинизацией базальной мембраны. Даже при стойкой ремиссии астмы в стенке бронхов поддерживается хроническое воспаление. При длительном течении атопической бронхиальной астмы формируется необратимость изменений со склерозированием бронхиальной стенки. Вне приступа и при неосложненном течении изменения в легких не отмечаются.
Диагностика
Диагностика атопической формы астмы включает осмотр, оценку аллергологического анамнеза (сезонность заболевания, характер приступов), результатов диагностических аллергопроб (кожных скарификационных и ингаляционных провокационных), клинического и иммунологического исследований крови, анализа мокроты и промывных вод бронхов. У больных атопической бронхиальной астмой имеется наследственная отягощенность по атопии и/или внелегочные проявления аллергии (экссудативный диатез, экзема, аллергический ринит и др.).
Кожные пробы позволяют установить потенциальные аллергены; ингаляционные тесты с гистамином, метахолином, ацетилхолином — приступообразную гиперреактивность бронхов. Аллергический характер бронхиальной астмы подтверждают эозинофилия и высокий титр общего и специфических IgE в сыворотке крови. Данные бронхоальвеолярного лаважа определяют изменение клеточного состава мокроты (эозинофилию, присутствие специфичных элементов — спиралей Куршмана, кристаллов Шарко–Лейдена).
Диагностика пищевой сенсибилизации при атопической бронхиальной астме включает ведение пищевого дневника, проведение элиминационных диет и дифференциально-диагностического лечебного голодания; провокационных тестов с продуктами; кожных проб с пищевыми аллергенами; определение специфических Ig в сыворотке крови. Трудности в уточнении пылевой природы аллергии связаны со сложным антигенным составом пыли. Атопическую бронхиальную астму важно отличать от обструктивного бронхита, других вариантов астмы.
Общие сведения
Смешанная бронхиальная астма – хроническое воспалительное заболевание бронхов, протекающее с бронхиальной гиперреактивностью и обструкцией, сочетающее в себе признаки атопической и неатопической бронхиальной астмы. Бронхиальная астма смешанного генеза чаще встречается у детей старше 4-5 лет. Смешанная бронхиальная астма более распространена в индустриальных районах и местностях с прохладным, влажным климатом. Сложность диагностики и терапии смешанной бронхиальной астмы обусловлена большим спектром возможных причинных факторов, а также участием в патогенезе сразу нескольких механизмов (обычно атопического и инфекционно-зависимого). Бронхиальная астма является междисциплинарной медицинской проблемой, над которой работают специалисты в области клинической пульмонологии, аллергологии и иммунологии, микробиологии и др.
Причины
Причины, определяющие своеобразие течения смешанной бронхиальной астмы, объединяют различные эндогенные и экзогенные факторы. К числу важнейших внутренних детерминант принадлежат генетическая предрасположенность (повышенная выработка IgE, изменение иннервации бронхов, наследование атопии, этнические и половые особенности и пр.). Внешние факторы могут быть представлены инфекционными агентами, неинфекционными аллергенами (пыльца, пыль, шерсть, медикаменты, продукты питания, производственные сенсибилизаторы), метеорологическими условиями (колебания температуры, влажности, давления). В большинстве случаев смешанная бронхиальная астма формируется из атопической формы путем наложения инфекционной сенсибилизации.
Непосредственными триггерами астматического приступа могут выступать стрессовые ситуации, физические и психо-эмоциональные нагрузки, ОРВИ, резкие запахи, аллергены, поступающие из внешней среды, вдыхание табачного дыма и аэрополлютантов. У всех больных смешанной бронхиальной астмой присутствуют очаги хронической инфекции (тонзиллиты, синуситы, аденоидиты, кариес, гастродуодениты и др.) и аллергические заболевания (аллергический ринит, атопический дерматит, лекарственная аллергия).
Ведущими патогенетическими звеньями бронхиальной астмы служат воспаление бронхиальной стенки, гиперреактивность бронхов и, как следствие, — бронхоспастическая реакция в ответ на различные неспецифические и специфические аллергические стимулы.
Классификация
Бронхиальная астма (БА) подразделяется по этиологическому принципу, тяжести и фазам течения, уровню контроля над заболеванием. Согласно МКБ-10, принято различать преимущественно аллергическую, неаллергическую и смешанную формы бронхиальной астмы. Каждая из названных форм бронхиальной астмы может иметь легкое, средне-тяжелое или тяжелое течение. В соответствии с критериями частоты приступов и величины показателей бронхиальной проходимости различают 4 ступени БА.
- БА легкой степени, эпизодического (интермиттирующего) течения. Приступы одышки, кашля, удушья возникают реже 1-го раза в неделю в дневное время и не чаще 2-х раз в месяц по ночам. Значения ОФВ1 и ПСВ составляют более 80% от должных величин, суточная вариабельность ПСВ (пиковой скорости выдоха) менее 20%.
- БА легкой степени, персистирующего течения. Симптомы возобновляются еженедельно (но не ежедневно) в дневное время и чаще 2-х раз в месяц по ночам. Значения ОФВ1 и ПСВ составляют менее 80% от должных величин, суточная вариабельность отклонения ПСВ менее 20-30%.
- БА средней степени, персистирующего течения. Обострение симптоматики происходит ежедневно в дневное время и чаще одного раза в неделю по ночам. Значения ОФВ1 и ПСВ составляют 60-80% от должных величин, суточная вариабельность ПСВ более 30%.
- БА тяжелой степени, персистирующего течения. В течение дня симптомы присутствуют постоянно, ночные обострения возникают часто. Значения ОФВ1 и ПСВ вне приступа опускаются ниже 60% от должных величин, суточная вариабельность ПСВ более 30%.
По уровню контроля над проявлениями заболевания выделяют контролируемую, не полностью контролируемую и неконтролируемую бронхиальную астму; по фазе течения – обострение и ремиссию.
Осложнения
При тяжелом персистирующем течении БА часто возникают легочные (пневмоторакс, эмфизема, ателектазы) и внелегочные осложнения (легочное сердце, миокардиодистрофия). Прогностически неблагоприятным фактором является формирование сердечно-легочной недостаточности. Если заболевание развивается в детском возрасте, может отмечаться отставание ребенка в физическом развитии как следствие хронической гипоксии и интоксикации.
Диагностика
Во время приступа распознавание бронхиальной астмы не представляет затруднений. Сложнее бывает установить клинико-патогенетической вариант заболевания: с этой целью больной должен быть проконсультирован пульмонологом и аллергологом-иммунологом. Проводятся лабораторные анализы (крови, мокроты, смывов с бронхов), рентгенологическое и бронхологическое обследование, исследование параметров ФВД.
При сборе анамнеза обращают внимание на аллергологическую настроенность, наличие хронических инфекционных очагов в организме, связь обострений с определенными триггерными факторами, частоту и тяжесть приступов. Аускультативные данные вне приступа характеризуются сухими хрипами, удлинением фазы выдоха; во время приступа — свистящими (жужжащими) хрипами, слышимыми на расстоянии.
Во время обследования у аллерголога проводятся скарификационные и внутрикожные тесты с предполагаемыми аллергенами, определяются специфические IgE в сыворотке крови. При микроскопии мокроты обнаруживаются эозинофилы в большом количестве, спирали Куршмана, кристаллы Шарко-Лейдена. Также целесообразно провести бактериологический посев мокроты на патогенную микрофлору.
Рентгенография легких обнаруживает их повышенную воздушность, позволяет выявить осложнения бронхиальной астмы. С целью определения тяжести БА необходимо исследование параметров ФВД (в т. ч. проведение спирометрии с ингаляционными пробами). Для контроля за бронхообструкцией больной смешанной бронхиальной астмой обучается навыкам самостоятельного проведения пикфлоуметрии. Выполнение бронхоскопии требуется для исключения других причин бронхиальной обструкции, оценки клеточного состава смывных вод бронхов.
Дифференциальный диагноз смешанной бронхиальной астмы проводится со стенозом трахеи и бронхов, инородными телами и опухолевым поражением дыхательных путей, обструктивным бронхитом, изолированными формами БА (атопической, инфекционно-зависимой).
Лечение смешанной астмы
Терапия смешанной бронхиальной астмы представляет определенные трудности в связи с необходимостью воздействия на эндогенный компонент и на экзогенную составляющую заболевания. Обязательно проведение мероприятий по элиминации предполагаемого аллергена, санации очагов хронического воспаления, избегание контакта с провоцирующими обострение факторами. Медикаментозное лечение БА проводится несколькими группами препаратов: бронходилататорами, противовоспалительными, противоастматическими, отхаркивающими, антигистаминными и другими средствами.
- Базисная (противовоспалительная) терапия основывается на назначении глюкокортикостероидов (ингаляционных — беклометазон, будесонид; пероральных или внутривенных — преднизолон, дексаметазон); стабилизаторов мембран тучных клеток (недокромил натрия, кромогликат натрия), антагонистов рецепторов лейкотриенов (зафирлукаст, монтелукаст).
- Ингаляционные бронхолитики (в виде аэрозолей, растворов для небулайзерной терапии) используются как для купирования приступов, так и для длительной терапии смешанной бронхиальной астмы. К ним относятся сальбутамол, фенотерол, ипратропия бромид, препараты теофиллина и др.
- Симптоматическое лечение БА предполагает использование отхаркивающих средств, муколитиков, проведение ультразвуковых ингаляций с ферментами. Из немедикаментозных методов при смешанной бронхиальной астме находит широкое применение дыхательная гимнастика, акупунктура, массаж грудной клетки, климатотерапия. Нередко больные нуждаются в проведении психотерапии. При преобладании атопического компонента рекомендована АСИТ-терапия.
Прогноз и профилактика
Данная форма БА в прогностическом плане не очень благоприятна, поскольку нередко приводит к инвалидизирующим осложнениям. Однако при соблюдении элиминационного режима и врачебных рекомендаций можно достичь длительной ремиссии и надолго задержать прогрессирование заболевания. Профилактика смешанной бронхиальной астмы заключается в устранении экзогенных влияний (контакта с потенциальными аллергенами, стрессов, физических переутомлений), повышении неспецифической резистентности, санации инфекционных очагов.