Инверсные угри
Инверсные угри — клиническая форма акне, при которой угревая сыпь сопровождается вторичным воспалительным процессом в апокриновых потовых железах с возникновением и вскрытием подкожных инфильтратов в подмышечных впадинах, в области пупка и промежности, вокруг сосков. Заболевание протекает хронически с частыми рецидивами. В лечении инверсных угрей ведущую роль имеет адекватная антибиотикотерапия, включающая системный прием антибиотиков внутрь и их наружное применение.
Общие сведения
Инверсионные угри встречаются только после периода полового созревания, так как именно в этом возрасте начинают функционировать апокриновые железы. Первоначально воспаление возникает в волосяных фолликулах и этот процесс ничем не отличается от механизма возникновения вульгарных угрей. После увеличения воспалительного инфильтрата и разрыва стенки волосяного фолликула происходит вторичное инфицирование апокриновых потовых желез. Часто инверсионные угри появляются на фоне тяжелой формы акне. Их развитию способствуют ожирение, зуд или постоянное трение одежды в местах локализации апокриновых желез.
Инверсные угри
Проявления инверсных угрей
Заболевание проявляется образованием под кожей в области подмышечной впадины, промежности, около пупка или вокруг сосков молочных желез множественных инфильтратов. Они выглядят как небольшие бугорки на коже, при ощупывании которых выявляются болезненные уплотнения. После некоторого увеличения в размерах и созревания инфильтраты вскрываются. Из них на поверхность кожи выходит гнойное или гнойно-кровянистое отделяемое. Затем происходит заживление с образованием на месте инфильтрата втянутого рубца. Рубцевание одних инверсных угрей, как правило, сопровождается появлением новых и расширением области поражения кожи.
Инверсные угри характеризуются постоянно рецидивирующим хроническим течением и могут считаться одной из разновидностей хронической пиодермии.
Лечение инверсных угрей
Терапия инверсных угрей — это достаточно длительный процесс, занимающий порой несколько месяцев. Основу лечения составляет антибиотикотерапия. Местно дважды в сутки применяются мази с антибиотиками: тетрациклиновая, эритромициновая, линкомициновая, лосьон с клиндамицином. Параллельно проводят терапию, направленную на предупреждение закупорки волосяных фолликулов и улучшение кислородного питания тканей. Так эффективной схемой лечения инверсных угрей считается комбинация эритромициновой мази и бензоилпероксида.
Местное лечение сочетают с курсовым приемом антибиотиков внутрь. С этой целью может применяться доксициклин, сульфаметоксазол+триметоприм, клиндамицин, тетрациклин, эритромицин и др. Для более точного подбора антибиотика производят посев отделяемого угрей и определяют чувствительность высеянной микрофлоры к антибиотикам. В лечении инверсных угрей также используют синтетические ретиноиды, а у женщин — гормональную терапию: этинилэстрадиол, ципротерон и др. В остром воспалительном периоде противопоказаны механические и тепловые способы лечения: пилинг, массаж, горячие ванны и т. п.
Важное значение в лечении и профилактике последующих рецидивов инверсных угрей имеет не только личная гигиена, но и правильный уход за кожей. Подбор очищающих гелей, косметических средств и профилактических кремов для поддерживающей терапии следует проводить совместно с лечащим дерматологом или дерматокосметологом.
Инверсные угри — лечение в Москве
ГБУЗ Москвы «Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения Москвы», Москва, Россия, 119071
Сакания Л.Р.
Первый МГМУ им. И.М. Сеченова
Корсунская И.М.
ЦТП ФХФ РАН
Инверсные акне: абсцедирующий и подрывающий фолликулит и перифолликулит Гоффмана
Авторы:
Мильдзихова Д.Р., Сакания Л.Р., Корсунская И.М.
Как цитировать:
Мильдзихова Д.Р., Сакания Л.Р., Корсунская И.М. Инверсные акне: абсцедирующий и подрывающий фолликулит и перифолликулит Гоффмана. Клиническая дерматология и венерология.
2018;17(4):110‑113.
Mil’dzikhova DR, Sakaniia LR, Korsunskaia IM. Inverse acne: folliculitis et perifolliculitis capitis abscedens et suffodiens of Hoffman. Klinicheskaya Dermatologiya i Venerologiya. 2018;17(4):110‑113. (In Russ.)
https://doi.org/10.17116/klinderma201817041110

Инверсные акне представляют собой хроническое рецидивирующее воспалительное заболевание апокриновых потовых и сальных желез, сопровождающееся синдромом окклюзии волосяных фолликулов. Данная патология характеризуется длительными и частыми рецидивами и плохо поддается терапии. Инверсные акне включают суппуративный (рецидивирующий) гидраденит, абсцедирующий и подрывающий фолликулит и перифолликулит волосистой части головы Гоффмана (АППГ), декальвирующий фолликулит [1].
АППГ — воспалительное рецидивирующее заболевание кожи волосистой части головы, реже паховой, перианальной и подмышечной областей, характеризующееся образованием абсцессов с последующей рубцовой атрофией. E. Hoffman (1868—1959) дал клиническое описание этого заболевания в 1907 г., но только в 50-х гг. XX века было доказано, что АППГ представляют собой лишь одну из форм акне [2]. АППГ может развиваться самостоятельно или в триаде с гидраденитом и конглобатными акне. Заболевание чаще встречается у молодых мужчин в возрасте 20—40 лет [3].
Отсутствие верного диагноза и неадекватная терапия АППГ приводит к необратимой рубцовой алопеции с масштабными эстетическими поражениями, что негативно сказывается на психологическом состоянии пациента и его окружении.
В настоящее время в патогенезе инверсных акне и в частности абсцедирующего подрывающего фолликулита, большое значение придают микробиоте кожи и иммунным нарушениям. Причина АППГ до конца не известна. Патофизиологические изменения в коже при этом заболевании связывают с фолликулярной окклюзией, расширением и разрывом фолликулярного канала, что инициирует воспалительную реакцию. В дальнейшем происходит выход содержимого фолликула (погибшие корнеоциты, бактерии, жирные кислоты, волосы) в дерму, образование воспалительного перифолликулярного инфильтрата, присоединение вторичной инфекции, формирование абсцесса и фистульных ходов, образование гранулемы, инкапсулирование очага, рубцевание [3, 4].
Клиническая картина представлена болезненными, воспалительными, абсцедирующими, желтовато-белого цвета флюктуирующими и длительно персистирующими узлами, образующими извилистые тяжи-валики, которые спонтанно или при сдавливании «подрываются». Из многочисленных фистулезных отверстий и сообщающихся ходов выделяется гнойно-геморрагическая жидкость. В конечном итоге разрастается грубоволокнистая соединительная ткань, формируются атрофические или келоидоподобные рубцы, что приводит к необратимой рубцовой алопеции. Кроме воспалительных узлов, также образуются упругоэластической консистенции невоспалительные шаровидные узлы (кисты). Течение заболевания длительное, но иногда процесс спонтанно разрешается с образованием рубцов, в том числе келоидных.
Диагностика АППГ основана на клинической картине, трихологическом, а при необходимости — гистологическом исследовании.
Методом трихоскопии можно обнаружить характерные признаки: 3D («трехмерные») желтые точки в области дистрофичных волос, желтые аморфные области, белые точки с ореолами, молочно-красные области, не имеющие фолликулярных отверстий [5].
Гистологически дермоэпидермальный переход представляет собой умеренный воспалительный инфильтрат, преимущественно лимфомоноцитарный, перифолликулярно располагаются многоядерные клетки, гранулемы, макрофаги. Часть волос имеет перифолликулярный фиброз с зонами разрушения волосистого фолликула и заменой его грануляционной тканью [6].
В настоящее время, по данным зарубежных авторов [7, 8], к более эффективным методам лечения относят пероральный прием цинка в низкой дозе, изотретиноина, миноциклина, сульфамидных препаратов, тетрациклина, преднизолона, дапсона; местно — применение клиндамицина, изотретиноина, CО2-лазеров; хирургическое вмешательство. К новым методам относят применение блокаторов фактора некроза опухолей, хинолонов, макролидных антибиотиков, рифампина, алитретиноина, метронидазола и сульфата цинка в высокой дозе (135—220 мг). Изотретиноин, по-видимому, дает наибольшие шансы на ремиссию, но количество отчетов по этому вопросу незначительно, графики дозирования варьируются, а длительность периода наблюдения невелика.
В своей практике мы отдаем предпочтение изотретиноину, произведенному по технологии LIDOSE (Акнекутан*), в связи с тем, что в данном случае за счет дополнительных компонентов в препарате (гелюцир, спан) увеличивается биодоступность изотретиноина на 20%. Это позволяет сократить суточные и курсовые дозировки изотретиноина при сохранении терапевтической эффективности препарата. Уменьшение дозировки положительно сказывается на переносимости препарата. Для данной формы изотретиноина рекомендуемыми суточными дозами являются 0,4—0,8 мг/кг, тогда как для изотретиноина в обычной форме выпуска — 0,5—1 мг/кг. Использование технологии LIDOSE позволяет также уменьшить зависимость усвоения изотретиноина от пищи. Дополнительные жирорастворимые компоненты обеспечивают усвоение изотретиноина в составе Акнекутана на 70% даже при приеме препарата без пищи, что позволяет быть более уверенным в эффективности терапии даже при условии низкой приверженности пациентов рекомендациям по применению препарата [9].
За период 2014—2017 гг. к нам обратились 8 пациентов в возрасте от 28 лет до 61 года с диагнозом АППГ, подтвержденным гистологически. Изначально пациенты обращались к трихологам в течение нескольких лет. В качестве терапии получали антибиотики длительными курсами, иммуномодулирующую терапию с незначительным улучшением. Для лечения этих пациентов мы применяли системные ретиноиды (Акнекутан) по следующей схеме: 0,4 мг/кг/сут (в зависимости от массы тела пациентов начальная доза составляла в среднем 32 мг/сут) в течение 3—4 мес с последующим снижением суточной дозы до достижения кумулятивной дозы в 100 мг/кг. При наблюдении за пациентами в течение года после окончания терапии рецидива заболевания не отмечено.
Учитывая увеличение частоты данной патологии приводим историю болезни.
Пациент Б., 28 лет, обратился с жалобами на высыпания на коже волосистой части головы в теменной и затылочной области, сопровождающиеся субъективным дискомфортом.
Считает себя больным на протяжении 3 лет, с момента появления высыпаний. Неоднократно получал системную антибиотикотерапию, аутогемотерапию, проводилась хирургическая санация очагов поражения — эффект от лечения был непродолжительным. Процесс приобрел непрерывно рецидивирующий характер с усугубляющейся степенью тяжести клинических проявлений.
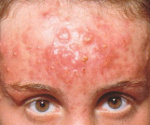
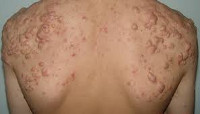
Status localis: поражение локализовано на коже волосистой части головы, преимущественно в теменной и затылочной области. Процесс представлен связанными с волосяными фолликулами папулами красного цвета диаметром до 0,6 см, полушаровидной и конической формы, местами пустулами, полушаровидными узлами с округлыми очертаниями диаметром до 1—1,5 см, кожа над ними розовая, гладкая, натянутая. Консистенция узлов мягкая, тестообразная. При сдавливании из некоторых отверстий, расположенных на поверхности узлов и прикрытых желтыми корочками, выделяется гной. Субъективно отмечается незначительное жжение в местах высыпаний, при пальпации узлов — легкая болезненность (рис. 1).
При гистологическом исследовании в эпидермисе над фолликулом обнаружены признаки акантоза, гиперкератоза и паракератоза, в дерме — участки некроза, периваскулярные лимфогистиоцитарные инфильтраты. Фолликулы многочисленные, некоторые атрофичны, остальные имеют обычное строение. Гистологическая картина соответствует АППГ.
Пациенту был назначен Акнекутан (изотретиноин LIDOSE) в дозе 0,4 мг/кг/сут (первоначальная суточная доза составила 40 мг) с постепенным снижением до достижения кумулятивной дозы в 100 мг/кг, которая была достигнута за 9 мес. За время курса терапии из нежелательных явлений отмечалась сухость кожных покровов только в первые 2 мес приема препарата, которая нивелировалась назначением местных увлажняющих средств.
Через 3 мес терапии отдельные крупные узлы разрешились, уменьшилась интенсивность окраски, было отмечено уплощение остальных элементов, а также снижение (вплоть до исчезновения) субъективных ощущений (жжение, покалывание, зуд) в местах высыпаний (рис. 2).
Рост обращаемости с данным заболеванием заставляет обратить внимание на необходимость гистологического подтверждения в случаях папулопустулезных высыпаний на коже волосистой части головы, поскольку назначение несоответствующей терапии приводит к усугублению процесса, рубцовой атрофии и тяжелому психологическому дискомфорту у пациентов.
Применение в терапии АППГ системных ретиноидов, и в частности изотретиноина, соответствует принятым во всем мире методам и демонстрирует высокую эффективность за счет быстрого регресса высыпаний и отсутствия рецидива в длительной перспективе.
Участие авторов:
Сбор материала — Л.Р. Сакания
Описание клинического случая — Д.Р. Мильдзихова.
Написание и редактирование текста — И.М. Корсунская
Авторы заявляют об отсутствии конфликта интересов.
Authors’ contributions:
Collecting and interpreting the data — L.R. Sakaniya
Description of the clinical case — D.R. Mildzihova
Drafting and revising the manuscript — I.M. Korsunskaya
The authors declare no conflict of interest.
Сведения об авторах
И.М. Корсунская — https://orcid.org/0000-0002-6583-0318
*В Бельгии препарат зарегистрирован под торговым названием Isosupra Lidose и производится компанией «Laboratories SMB S. A».
Инверсное акне. Современные методы лечения
Хрищукова И.А.
Научный руководитель: к.м.н., доцент Моррисон А.В.
ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава РФ
Кафедра дерматовенерологии и косметологии
Цель работы: указать этиологию, патогенетические механизмы, клинику и современные методы лечения тяжело протекающих форм акне.
В настоящее время акне все чаще встречается в работе врача дерматовенеролога и косметолога, и представляют актуальную проблему.
Инверсное акне (ИА) (hidradenitis suppurativa) – это тяжелое хроническое иммуноопосредованное заболевание кожи, поражающее апокриновые потовые железы, сопровождающееся вторичным воспалением и негативно сказывающееся на качестве жизни больного.
Акне является одним из самых распространенных дерматозов в мире. Чаще страдают люди в возрасте от 12 до 24 лет 85%, реже от 25 до 34 лет 8%, крайне редко от 35 до 45 лет 3%. У подростков встречаемость акне среди мальчиков и девочек практически одинаковая, в то время как в дальнейшем женщины болеют чаще, чем мужчины.
В классификации акне выделяют такие формы как: камедональные, папуло-пустулезные и узловатые, а также степени тяжести: легкую, среднюю и тяжелую.
Современная классификация инверсионного акне включает 3 стадии по Hurley:
I ст.- Формирование одиночного или множественных абсцессов без свищей и рубцов;
II ст.- Рецидивирующие абсцессы с формированием свищей и рубцов, одиночные или множественные поражения на расстоянии друг от друга;
III ст.- Диффузное или близкое к диффузному распространение воспаления или множественные сообщающиеся свищевые ходы и абсцессы.
Говоря о причинах развития ИА, можно выделить генетическую предрасположенность и формирование аберрантного иммунитета. Группы генов, отвечающих за развитие акне: ген рецепторов андрогенов (AR), ген CYP17. На основании генетического анализа было доказано, что заболевание имеет наследственный характер, передаваясь по аутосомно-доминантному типу и мутации в генах, вследствие чего создается белок, известный как γ-секретаза. Также в развитии заболевания имеют значение факторы внешней среды: ультрафиолетовое излучение, различные косметические средства, травматизация и стрессовый фактор. Нельзя не сказать о влиянии вредных привычек (курение, алкоголизм) и несоблюдение рационального питания, которые играют немаловажную роль в возникновении заболевания.
В патогенезе развития ИА решающее значение отводится окклюзии фолликулов при инфундибулярном гиперкератозе. Фолликулярная окклюзия – провоцирующий фактор развития вторичной инфекции. Провоспалительный цитокин фактор некроза опухоли I (ФНО-I) играет ключевую роль в развитии хронического воспалительного процесса: поврежденные клетки сальной железы инициируют формирование абсцесса. ФНО-I и другие провоспалительные цитокины провоцируют изменения, вызывающие образование и пролиферацию эпителизированных свищевых ходов, образование «биопленки» из бактерий, находящихся в поврежденных клетках и свищевых ходах, обеспечивают хронизацию воспаления и риск распространения воспаления и развития обострений заболевания. Таким образом, апокриновые потовые железы вовлекаются в процесс вторично.
Заболевание начинается с возникновения болезненных бугристых инфильтратов, которые открываются на поверхность кожи фистулезными ходами. Содержание воспалительных очагов гнойное или геморрагически-гнойное. Формируются свищи с последующим образованием втянутых рубцов.
Дифференциальную диагностику проводят со стафилококковыми инфекциями, простым абсцессом, венерической лимфогранулемой, болезнью Крона, актиномикозом, скрофулодермой.
Лечение ИА зависит от степени тяжести и течения патологического процесса. Оно заключается в нацеливании на формирование «биопленки». На данный момент не существует единой универсальной схемы терапии для каждого больного. При легком течении, без глубоких воспалительных поражений, пациенты могут лечиться амбулаторно. В таких случаях назначаются антибактериальные препараты чаще из группы линкозамидов и тетрациклинов, применение тёплых компрессов, тщательное соблюдение правил гигиены и ношение свободной одежды. Как правило, важным моментом в терапии является отказ от вредных привычек и нормализация массы тела.
С умеренной и тяжелой степенью тяжести или стадией Hurley II назначают системные ретиноиды (изотретиноин) с предшествующим назначением антибиотиков широкого спектра действия коротким курсом, противовоспалительные препараты, глюкокортикостероиды, ингибиторы альфа-фактора некроза опухолей (при необходимости). Если состояние пациента не улучшается, то рекомендуется применение нового препарата адалимумаба (торговое название «Хумира»), как вариант лечения первой линии у пациентов с умеренно-тяжелым течением. Дозировка адалимумаба составляет 160 мг в неделю подкожно, а затем 40 мг в неделю. Если не отмечается положительной динамики со стороны кожного процесса, то терапию следует продолжать до тех пор, пока отмечаются поражения. Если пациент не проявляет ответ, то необходимо рассмотреть терапию второго или третьего ряда, включающую антисептические препараты, внутриклеточные глюкокортикостероиды, иммунодепрессанты (инфликсимаб). Отсутствие улучшения от проводимой терапии после 12 недель лечения говорит о необходимости рассмотреть другие методы лечения, вплоть до хирургического.
Вывод. В связи с тем, что распространенность инверсионного акне в практикующей деятельности врача дерматовенеролога и косметолога с каждым годом возрастает, проблема сохраняет свою актуальность. Важно вовремя выявить данную патологию, правильно поставить диагноз и немедленно начать комплексное лечение, учитывающее всё разнообразие факторов, спровоцировавших появление заболевания у конкретного пациента. Только своевременно начатая терапия исключит возможные тяжелые последствия заболевания и улучшит качество жизни больного.
Угревая болезнь — что это такое?
Статьи
Опубликовано в журнале:
Мир Медицины »» № 8 ’98 »» Новая медицинская энциклопедия Заведующий кафедрой дерматовенерологии с клиникой СПбГМУ им. акад. И.П. Павлова, д-р мед. наук, профессор Евгений Владиславович Соколовский
Ассистент кафедры дерматовенерологии с клиникой СПбГМУ им. акад. И.П. Павлова, канд. мед. наук, член Правления Санкт-Петербургской Ассоциации врачей- косметологов Елена Александровна Аравийская
Ассистент кафедры дерматовенерологии с клиникой СПбГМУ им. акад. И.П. Павлова, канд. мед. наук Татьяна Валерьевна Красносельских
Знаете ли Вы, что:
- у 60-80% молодых людей в возрасте от 12 до 24 лет наблюдаются угри (или акне — acne) в той или иной форме. Более чем в одной трети случаев это заболевание требует серьезного, подчас длительного лечения у специалиста;
- по данным психологического опроса 80% подростков считает, что самое непривлекательное в человеке — это угревая сыпь;
- наличие угревой сыпи на видимых участках кожи значительно снижает самооценку, вызывает тревогу, депрессию, дисморфофобию (представление о мнимом внешнем уродстве). Пациенты с акне крайне сложно адаптируются в социальной среде, среди них большой процент безработных и одиноких людей.
Сальные железы являются производными эпидермиса и есть только в коже млекопитающих. В подавляющем большинстве случаев железы непосредственно связаны с волосяными фолликулами длинных, щетинистых и пушковых волос. Поэтому, за исключением ладоней и подошв, они расположены на всех участках кожного покрова. Особенно много сальных желез на лице (в области надбровий, носа, носогубного треугольника, подбородка), в области средней линии груди и спины. Эти зоны получили название себорейных, так как они наиболее часто поражаются при особом состоянии кожи — себорее. Кожное сало — секрет, продуцируемый сальными железами, — представляет собой смесь липидов, который выполняет следующие функции:
- препятствует пересушиванию кожи,
- делает кожу эластичной,
- благодаря входящим в его состав ненасыщенным жирным кислотам обладает бактерицидным, фунгицидным и вирусостатическим действием,
- участвует в сложной системе терморегуляции кожи.
Деятельность сальных желез регулируется, в основном, гормональными, а также нейровегетативными механизмами. Андрогены усиливают продукцию кожного сала, а эстрогены — уменьшают.
Знаете ли Вы, что:
- у взрослого человека в среднем за сутки выделяется до 20 г кожного сала;
- в себорейных зонах находится от 400 до 900 сальных желез на 1 кв.см;
- сальные железы отсутствуют на коже ладоней и подошв, их очень мало в области тыла кистей, на красной кайме губ;
- секрет сальных желез состоит из жирных кислот, многоатомных спиртов, глицерина, холестерола, эфиров воска, фосфолипидов, метаболитов стероидных гормонов и некоторых солей;
- максимальная активность сальных желез у здорового человека начинается в период полового созревания и длится до 24-25 лет.
Себорея (от лат «sebum»- жир, сало и греч. «rhoea» — истечение) — патологическое состояние кожи, при котором сальными железами выделяется увеличенное по сравнению с нормой количество кожного сала измененного химического состава.
Развитию себореи способствуют:
- эндокринные нарушения (в том числе на фоне длительного приема глюкокортикоидов, тестостерона, анаболических стероидов, прогестерона);
- дисбаланс вегетативной нервной системы, приводящий ко временному или постоянному повышению тонуса вагусной иннервации сальных желез (например, при острых и хронических инфекциях, аутоинтоксикациях).
Угревая болезнь — хроническое воспалительное заболевание сальных желез, возникающее в результате их закупорки и гиперпродукции кожного сала.
Термин «угревая болезнь» появился у специалистов не так давно. Он указывает на то, что появление угрей — это не только возникновение определенных высыпных элементов, но и изменение состояния всего организма. Вот почему знания об этом заболевании необходимы не только дермато-венерологам и косметологам, но и врачам всех специальностей — гинекологам, эндокринологам, урологам, терапевтам и др. Угревая сыпь — явление, характерное не только для подросткового возраста. Угри могут появляться и у взрослых — как правило, на фоне эндокринных заболеваний, при которых возникает состояние себореи. Поэтому, если угри наблюдаются у взрослого пациента, его необходимо обследовать для исключения эндокринной патологии. Нередко сама клиническая картина угревой сыпи может подсказать наличие сопутствующего заболевания. Так, например, расположение угрей у женщин вокруг рта и на подбородке нередко указывает на патологию яичников (поликистоз яичников или так называемый синдром поликистозных яичников — поликистоз в сочетании с ановуляторными менструальными циклами и, нередко, с гирсутизмом). В случаях резистентной к терапии угревой болезни у взрослых женщин следует исключить также опухоли надпочечника или яичника. У мужчин основной причиной угрей является изменение соотношения различных андрогенов. Угри могут возникать и на фоне приема различных медикаментов, например, при длительной терапии системными кортикостероидами (так называемые стероидные акне). Описаны угри у спортсменов и культуристов, принимающих анаболические стероиды (так называемые bodybuilding acne). Угри могут также возникать у лиц, получающих противоэпилептические средства, барбитураты, противотуберкулезные препараты (изониазид, рифампицин, этамбутол), азатиоприн, циклоспорин А, хлоралгидрат, соли лития, препараты йода, хлора, брома, некоторые витамины, особенно — В1, B2, В6, В12, D2.
Выделяют также экзогенные угри, которые развиваются, как правило, у лиц с себореей, при попадании на кожу различных веществ, обладающих комедогенным эффектом — свойством вызывать закупорку сальных желез и усиление гиперкератоза в устьях волосяных фолликулов. К ним относятся различные масла и смазки, препараты дегтя. С этими веществами человек может контактировать на производстве и при уходе за кожей. Нередко угревая сыпь возникает при неумеренном употреблении косметики, содержащей жиры (жирные крем-пудры, румяна, тени и др.). В некоторых зарубежных классификациях угревой болезни выделяется даже особая форма угрей — acne mallorca. Эта клиническая разновидность была описана у молодых людей, отдыхавших на Майорке, которые пользовались маслом для загара, обладавшим комедогенным действием, следствием чего было появление угрей. Пациентам с себореей для ухода за кожей не рекомендуется использовать жирные кремы или мази, содержащие жиры (ланолин, вазелин) и масла, а из косметических средств следует выбирать те, которые имеют маркировку «non-comedogenic». Разновидностью экзогенных угрей можно считать и механические акне, которые возникают у лиц, предрасположенных к заболеванию. Их появление связано с давлением и трением (простой дерматит), вызывающими механическую обструкцию отверстий фолликулов. Примером может служить длительное давление головного убора, спортивного шлема, гипсовой повязки, постельного белья у обездвиженных больных, особенно при повышенной потливости.
Патогенез
В патогенезе угревой болезни можно выделить 4 основных механизма:
- Гиперпродукция секрета сальными железами;
- Фолликулярный гиперкератоз;
- Деятельность сапрофитной микрофлоры кожи;
- Воспаление.
Гиперпродукция секрета сальными железами — фрагмент такого патологического состояния кожи, как себорея. Себорея — это не только количественные изменения продукции кожного сала, но и качественные: уменьшается содержание ненасыщенных жирных кислот, снижаются его бактерицидные свойства. Происходит активизация бактериальной флоры кожи и создаются предпосылки для развития воспалительной реакции и появления угрей. У пациентов с угрями наблюдается нарушение процессов ороговения в устьях волосяных фолликулов, куда открываются выводные протоки сальных желез — фолликулярный гиперкератоз. В норме клетки эпителия воронки волосяного фолликула ороговевают в довольно медленном темпе, при этом роговые чешуйки слущиваются в просвет воронки фолликула и выходят на поверхность кожи вместе с секретом сальных желез. Гиперкератоз нарушает отток и приводит к скоплению секрета в сальной железе. В протоках сальных желез образуются микрокомедоны — сально-роговые пробки, которые клинически никак не проявляются. Дальнейшее скопление секрета и его давление на закупоренную воронку фолликула приводит к образованию кистозной полости в нижней части воронки волосяного фолликула и появлению клинических признаков болезни в виде закрытых комедонов. Постоянное накопление сальных и роговых масс внутри фолликула и давление их на окружающие ткани в конечном итоге приводит к атрофии сальной железы, а также к расширению устья волосяного фолликула. Так образуются открытые комедоны(или черно-точечные угри). Секрет сальных желез из- за большого количества в нем роговых чешуек становится густым и плохо выводится на поверхность кожи. Черный цвет той части секрета, которая видна через расширенное устье волосяного фолликула, обусловлен не экзогенным загрязнением или окислением кожного сала, как считалось ранее, а меланином. По-видимому, изменение процессов ороговения в эпителии, а отчасти и пролиферация клеток каким-то образом затрагивает меланогенез в данной области.
По современным представлениям, бактерии не являются непосредственной причиной заболевания, они лишь провоцируют местные воспалительные процессы. На коже и в волосяных фолликулах постоянно присутствуют такие сапрофитные микроорганизмы, как липофильные грибы рода Pytirosporum, Staphylococcus epidermidis и Propionibacterium acnes. Наибольшую роль в развитии воспаления при угревой болезни играют Propionibacterium acnes — грамположительные неподвижные липофильные палочки, которые являются факультативными анаэробами. Закупорка устья волосяного фолликула и скопление кожного сала внутри него создают предпосылки для размножения этих микроорганизмов внутри воронки волосяного фолликула. Постоянное размножение P. acnes в фолликуле, которое обнаруживается на стадии микрокомедонов, приводит к повышению активности метаболических процессов, следствие этого — выделение медиаторов воспаления. Например, в процессе жизнедеятельности P. acnes выделяют липазы, которые расщепляют триглицериды кожного сала на жирные кислоты, вызывающие повреждение эпителия фолликула. Повреждающим действием на эпителий обладают и протеолитические ферменты, выделяемые P. acnes.
На самых ранних этапах угревой болезни P. acnes и продукты ее метаболизма вызывают воспаление в дерме. Возникает миграция лимфоцитов в очаг воспаления. В дальнейшем происходит активация комплемента, медиатором которой является сама клеточная стенка P. acnes, возникает положительный таксис нейтрофильных лейкоцитов в очаг поражения, а также синтез антител против P. acnes. Нейтрофилы, выделяя литические ферменты, способствуют еще большему повреждению эпителия фолликула. В результате воспалительной реакции в дерме накапливаются свободные радикалы кислорода, гидроксильные группы, супероксиды перекиси водорода. Они еще больше повреждают клетки и поддерживают воспаление. Кроме этого, содержимое фолликула из-за нарушенной проницаемости эпителия попадает в дерму и также вызывает воспалительную реакцию как своеобразная чужеродная субстанция. Поэтому на более поздней стадии развития угревой болезни в процесс вовлекаются макрофаги и гигантские клетки.
Следует подчеркнуть, что воспаление может развиться на любой стадии угревой болезни и может быть поверхностным и глубоким, что и обусловливает многообразие клинических проявлений.
Клиника
В клинике выделяют следующие разновидности угревой сыпи:
- Комедоны (comedo sou acne comedonica);
- Папулезные и папуло-пустулезные угри (acne papulosa et papulopustulosa);
- Индуративные угри (acne indurativa);
- Флегмонозные угри (acne phlegmonosa);
- Конглобатные или нагроможденные угри (acne conglobata);
- Молниеносные угри (acne fulminans);
- Инверсные угри (acne inversa) или суппуративный гидраденит (hidradenitis suppurativa).
| Схема развития угрей: |
Acne comedonica (comedo)=> |
Acne papulosa=> |
Acne pustulosa=> |
Acne indurativa |
=>Acne phlegmosa |
| ========> | =>Acne conglobatal |
||||
| Cхема составлена д-ром мед. наук, доцентом Георгием Николаевичем Михеевым (кафедра дерматовенерологии с клиникой СПбГМУ им. акад. И.П. Павлова) |
Комедоны — невоспалительные элементы, возникшие в результате закупорки устьев волосяных фолликулов. Следует подчеркнуть, что незначительно выраженные комедоны представляют собой физиологическое явление. В начале развития угревой болезни микрокомедоны трансформируются в так называемые «закрытые» комедоны, то есть те, которые не имеют свободного сообщения с поверхностью кожи. Они представляют собой плотноватой консистенции невоспалительные узелки диаметром до 2 мм. Постепенное увеличение этих узелков в объеме за счет постоянной продукции кожного сала создает условия для превращения некоторых из них в «открытые» комедоны (черноточечные акне).
Папулезные и папулопустулезные угри являются следствием развития воспаления различной степени выраженности вокруг открытых или закрытых комедонов. При легкой форме заболевания папулопустулезные угри разрешаются без образования рубца. При значительной выраженности воспалительной реакции, сопровождающейся повреждением структур дермы, возможно образование рубцов на месте воспалительных элементов.
Описывая различные проявления угревой болезни, нельзя не упомянуть особую ее разновидность — экскориированные акне. Это угри, которые возникают преимущественно у пациенток, склонных экскориировать даже минимальные высыпания. При этом экскориации могут быть на фоне первично существовавших акне и без них. Данная клиническая форма может быть связана с неврозом навязчивых состояний, либо указывать на более тяжелую психиатрическую патологию. Поэтому больных с экскориированными угрями желательно проконсультировать у психотерапевта или психоневролога.
Большинство пациентов принадлежат именно к категориям acne comedonica и acne papulopustulosa. Все другие типы встречаются сравнительно редко, но не менее важны — либо вследствие тяжести течения, либо потому, что требуют иного подхода к терапии.
Индуративные угри характеризуются образованием глубоких инфильтратов, исходом такого состояния всегда является формирование рубцов. В ряде случаев в местах инфильтратов образуются кистозные полости, наполненные гноем, которые могут сливаться между собой. Такая разновидность носит название флегмонозных угрей. Обычно наблюдается пролонгированное течение этой формы заболевания. Нередко индуративные и флегмонозные угри называют узловатокистозными. Узловатокистозные угри являются признаком довольно тяжелого течения угревой болезни.
Конглобатные угри также свидетельствуют о тяжелом течении угревой болезни. Они характеризуются постепенным появлением множественных обширных, глубоко расположенных узловатокистозных элементов, которые сообщаются между собой, а также крупными сгруппированными комедонами. Очаги поражения могут располагаться не только на себорейных участках, но и захватывать кожу спины, живота, конечностей, за исключением ладоней и подошв. Исходом разрешения большинства элементов являются атрофические, гипертрофические и келоидные рубцы. Проявления этого заболевания, как правило, не уменьшаются после периода полового созревания, они могут рецидивировать вплоть до 40-летнего возраста, а иногда и в течение всей жизни.
Молниеносные угри (acne fulminans) представляют собой редкую и тяжелую форму угревой болезни. Заболевание возникает чаще у юношей в возрасте 13-18 лет, страдающих легкой папулопустулезной, реже — узловатокистозной формой угрей, и характеризуется внезапным началом, появлением язвенно-некротических элементов (преимущественно на туловище) и общими симптомами. Некоторые авторы рассматривают acne fulminans как острый язвенный вариант acne conglobata, однако большинство исследователей считают, что такая форма заболевания наиболее близка к гангренозной пиодермии. Этиология acne fulminans не вполне ясна. Предполагают, что в патогенезе болезни играют роль инфекционно-аллергические или токсико-аллергические механизмы. Известно, что acne fulminans возникает у пациентов с тяжелыми хроническими заболеваниями (болезнь Крона, язвенный колит и т.д.). Вместе с тем, отмечено, что некоторые больные до появления acne fulminans принимали антибиотики тетрациклинового ряда, синтетические ретиноиды, андрогены.
Заболевание развивается быстро. В клинической картине преобладают явления интоксикации: почти всегда наблюдается повышение температуры тела выше 38°С, нарушается общее состояние больного, возникают артралгии, сильные мышечные боли, боли в животе (эти явления стихают на фоне приема салицилатов), снижение массы тела, анорексия. Описано появление узловатой эритемы, гепатоспленомегалии, у некоторых пациентов развиваются остеолитические процессы в костях. В клиническом анализе крови обнаруживается лейкоцитоз, иногда вплоть до лейкемоидной реакции, ускорение СОЭ и снижение гемоглобина. Посевы крови дают, как правило, отрицательный результат. На коже спины, груди, боковых поверхностях шеи и плеч появляются пустулезные высыпания на эритематозном фоне, а также многочисленные быстро изъязвляющиеся папулезные элементы. Характерно отсутствие высыпаний на лице. Заживление очагов поражения часто сопровождается образованием множества рубцов, в том числе и келоидных.
Инверсные угри связаны с вторичным поражением апокринных потовых желез, которые, как и сальные железы, связаны с волосяными фолликулами. Первоначально возникает окклюзия и разрыв стенки волосяного фолликула, воспалительный инфильтрат вокруг остатков фолликула, а апокринные потовые железы вовлекаются в процесс вторично. Из очагов поражения можно высеять различные бактерии, но их относят к вторичной инфекции. Данное заболевание развивается после периода полового созревания и нередко сочетается с тяжелыми формами акне, а также повышенной массой тела. Предрасполагающими факторами могут быть трение одеждой или зуд в соответствующих локализациях (подмышечные впадины, область промежности, пупка, ареол сосков грудных желез). Заболевание обычно начинается с болезненных бугристых инфильтратов, которые вскрываются на поверхности кожи с образованием фистулезных отверстий. Имеется гнойное или кровянисто-гнойное отделяемое. Часть элементов может разрешаться, однако в большинстве случаев имеется тенденция к расширению площади очагов поражения. В итоге формируются свищи с образованием втянутых рубцов. Заболевание протекает хронически, имеет наклонность к рецидивам.
При диагностике угревой болезни следует также помнить о том, что существуют заболевания, клинически сходные с ней, но имеющие иной патогенез. Первично возникает воспалительная реакция сально-волосяного аппарата без комедонов. Это довольно широкая группа различных дерматозов. К ней относят розовые угри, периоральный дерматит, саркоидоз, туберкулез кожи. Напоминать угревую сыпь могут и проявления вторичного сифилиса — папулезный себорейный и папулопустулезный сифилид. Данный факт нужно учитывать в условиях настоящей эпидобстановки, связанной с ростом заболеваемости сифилисом.
Итак, диагностируя угревую болезнь, необходимо представлять себе, что это заболевание протекает на определенном фоновом состоянии макроорганизма. Лечение угревой болезни должно проводиться с учетом патогенеза, а также степени тяжести течения, о чем будет рассказано в следующем номере «Мира Медицины».
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Введение
Гидраденит супаратива / акне инверса (ГС/АИ) — заболевание, известное ранее как синдром фолликулярной окклюзии. Этот термин был введен D.M. Pillsburry, W.B. Shelley и А.М. Kligman в 1956 г. [1]. Нынешнее название применяется с 2006 г., когда оно (после долгого периода путаницы в терминологии) было утверждено на 1-й Международной конференции по ГС/АИ в Дессау (Германия).
По разным данным, распространенность заболевания в мире колеблется от 1% до 4%. Женщины подвержены ГС/АИ в 3 раза чаще, чем мужчины [2, 3].
Долгое время процесс описывался в виде триады: конглобатные акне и инверсные акне, гидраденит и подрывающий фолликулит или перифолликулит головы [4]. И только в 1975 г. был описан четвертый компонент — пилонидальная киста [1]. Все проявления на коже, несмотря на разную локализацию, характеризуются общим патогенезом и сходными гистопатологическими изменениями, в основе которых лежит фолликулярная гиперкератинизация.
Этиология и патогенез ГС/АИ на сегодняшний день до конца не изучены, поэтому современная медицина не способна представить универсальный протокол лечения таких пациентов.
В основе патогенеза заболевания лежит окклюзия волосяных фолликулов, которая в 30–40% случаев обусловлена генетической предрасположенностью к акне [5], гиперкератинизацией и образованием лимфогистиоцитарного воспаления с гранулематозной реакцией. Только в небольшой части случаев (в 4 из 12) наблюдалось воспаление в апокриновых железах, сопровождавшееся воспалением вокруг эккринных желез, волосяных фолликулов и структур, выстланных эпителием. Эти наблюдения свидетельствуют о том, что структуры, выстланные плоским эпителием, вероятно, представляют собой аномальные расширенные волосяные фолликулы, являются более постоянной диагностической особенностью при гнойном гидрадените, чем при воспалении апокриновых желез, которое, по-видимому, является вторичным явлением [6]. Фолликулярная окклюзия приводит к растяжению и разрыву фолликулов с выходом содержимого в окружающую дерму, что способствует миграции нейтрофилов и лимфоцитов в очаг воспаления [7–9], формируя воспалительный инфильтрат с последующим образованием рубцовой ткани [10].
Общепризнанным является тот факт, что бактерии не влияют на развитие заболевания, но вторичная бактериальная инфекция поддерживает воспалительный процесс и способствует рецидивированию [11].
Гистологическая картина при ГС/АИ не имеет специфических критериев. Поэтому в современной дерматологии до сих пор диагноз устанавливается на основании клинической картины заболевания. При патоморфологическом исследовании на ранних стадиях обнаруживают фолликулярную окклюзию с наличием или отсутствием воспаления, фолликулярные кисты, уменьшение объема сальной железы, гиперплазию, нейтрофильные абсцессы [6]. В тяжелых случаях обнаруживают В-клетки и плазматические клетки в псевдофолликулах, абсцессах и пазухах, окруженные хроническим воспалительным инфильтратом, с наличием гистиоцитов и гигантских клеток, а также большое количество грануляционной ткани [12].
Локализации процесса, путаница в терминологии и отсутствие специфических гистологических изменений часто являются причинами неправильной диагностики — дерматологи ориентируются в описании клинической картины только на проявления воспалительного процесса, упуская из виду распространенность высыпаний и формирование абсцессов. Результатом этого являются ошибочные диагнозы: гидраденит или вульгарные акне, что влечет за собой отсутствие терапевтического успеха.
Дебютирует ГС/АИ, как правило, после полового созревания с небольших красных плотных папул или, реже, пустул, которые, постепенно увеличиваясь в размерах, сливаются с окружающими тканями. Постепенно дерматоз трансформируется в хронический воспалительный рецидивирующий процесс с наличием псевдокомедонов, болезненных папул, расположенных в глубоких слоях кожи, с тенденцией к формированию абсцессов, сливающихся в синусы, и с разрешением процесса в рубцы [2–5]. Несомненно, внешне процесс может напоминать вульгарные акне или гидраденит (в зависимости от локализации высыпаний), особенно в самом начале развития, а с учетом возраста пациентов в большинстве случаев такие высыпания определяются как юношеские акне.
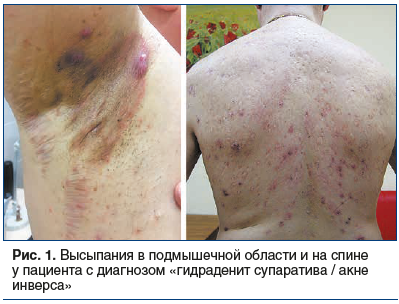
Однако высыпания при ГС/АИ связаны с апокриновыми потовыми железами и кроме лица имеют другие типичные места локализации — это преимущественно подмышечная, паховая и аногенитальная области. Также отмечены случаи ГС/АИ в области живота. У женщин заболевание часто развивается в грудной складке, в области промежности, у мужчин — в анальной зоне [8, 13]. Внимание дерматолога может привлечь также то, что содержимое элементов не эвакуируется, а остается внутридермально в виде округлых подкожных образований [14, 15] (рис. 1, 2).
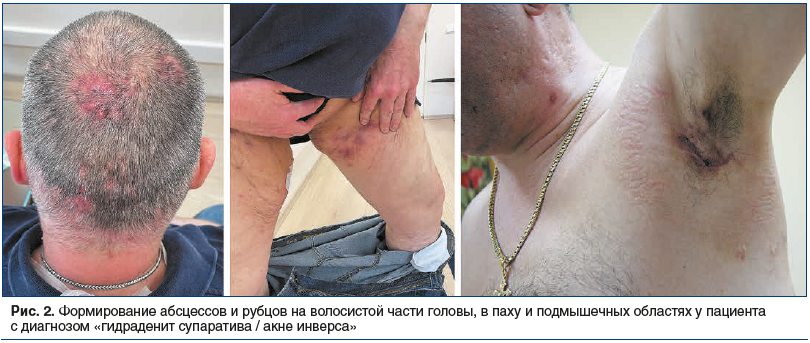
По мере нарастания кожной симптоматики присоединяются общие симптомы. Пациенты жалуются на боль, жжение, обильное потоотделение, слабость, в тяжелых случаях — на невозможность ходить или сидеть, а также на неприятный запах. Такое состояние может продолжаться в течение длительного времени, и, что важно отметить, отсутствует положительная реакция на терапию антибиотиками [5, 16, 17].
Диагностика ГС/АИ
Критерии диагностики заболевания утверждены на 2-м Международном симпозиуме по ГС/АИ (Second International Hidradenitis suppurativa research symposium, 2009). Для постановки диагноза необходимо наличие трех обязательных критериев [18]:
-
Поражения: в начальных стадиях заболевания — глубокие болезненные узлы, абсцессы, дренирующие синусы, рубцы. Вторичные поражения — открытые комедоны по типу «надгробий».
-
Локализация: подмышечная, паховая, анальная области, область промежности, область живота.
-
Хроническое течение с наличием рецидивов.
Проводя дифференциальную диагностику, в первую очередь следует обратить внимание на нетипичные для вульгарных акне места локализации (см. диагностические критерии). Подкрепляет диагноз ГС/АИ отсутствие положительной динамики в ответ на антибиотикотерапию.
При отсутствии высыпаний на лице и дифференциальной диагностике с гидраденитом внимание дерматолога привлечет наличие дренирующих синусов, рубцов, открытых комедонов по типу «надгробий» и локализация не только в подмышечных областях. Немаловажным также является наличие постоянных рецидивов при ГС/АИ.
При дифференциальной диагностике с фурункулом, карбункулом, фолликулярной пиодермией необходимо учитывать характер высыпаний. При ГС/АИ кроме воспалительных элементов, которые, как правило, без хирургического вмешательства самостоятельно не вскрываются, еще присутствуют и макрокомедоны. Дополнительным ориентиром является симметричность высыпаний, характерная для ГС/АИ.
Лечение ГС/АИ
Лечение ГС/АИ требует комплексного подхода, который должен включать немедикаментозные и медикаментозные пути решения проблемы. Необходимо обращать внимание на образ жизни пациента и вредные привычки. Очень большую роль в достижении успеха терапии играют контроль массы тела и отказ от курения.
В.С. Melnik, С.С. Zouboulis опубликовали результаты наблюдения, свидетельствующие о том, что у женщин, страдающих ГС/АИ, отмечается высокая чувствительность к андрогенам [19], поэтому препараты, содержащие андрогены, необходимо исключать из терапии [20]. Внимание пациентов необходимо акцентировать на трех важных фактах. Во-первых, доказано, что на образование фолликулярной окклюзии влияет никотин, вследствие этого у курильщиков заболевание протекает в более тяжелой форме [21]. Во-вторых, ухудшению процесса способствует механическая травматизация высыпаний самими пациентами с последующим более глубоким инфицированием [22]. В-третьих, установлена прямая корреляция между метаболическим синдромом и тяжестью течения ГС/АИ, поэтому всем больным с лишним весом рекомендуется его снижать [21]. Согласно систематическому обзору научной группы альянса ГС/АИ снижение веса (у пациентов с индексом массы тела более 30 кг/м2) с высоким уровнем доказательности способствует уменьшению тяжести заболевания в долгосрочной перспективе [22]. В когортном исследовании, проведенном в Дании, установлено, что возвращение к нормальному весу до полового созревания снижает риск возникновения заболевания до уровня заболеваемости у детей без избыточного веса [22].
Из-за частого сочетания ГС/АИ с болезнью Крона и/или локализации в перианальной области пациента необходимо обследовать у гастроэнтеролога и проктолога [14].
При выборе тактики лечения ГС/АИ практикующим врачам рекомендуется ориентироваться на классификацию этого заболевания, разработанную H.J. Hurley в 1989 г. [9, 19]. Существуют и другие классификации (Sartorius score, the Hidradenitis Suppurativa Severity Index, Physician Global Assessment), но они в основном применяются в клинических научных исследованиях [9].
Согласно классификации Hurley выделяют три стадии заболевания:
I — наличие одного или нескольких изолированных абсцессов без рубцов или пазух.
II — наличие рецидивирующих абсцессов, локализующихся более чем в одной анатомической области. Формирование синусовых ходов.
III — наличие обширных абсцессов с множеством взаимосвязанных пазух, приводящих к формированию рубцов.
Тактика терапии зависит от стадии патологического процесса. При I–II стадии вполне возможно обойтись наружными средствами, в то время как III стадия заболевания рассматривается как показание к биологической терапии [23–25].
Согласно данным современной литературы препаратами первой линии являются антибиотики и стероидные средства на фоне хирургического дренирования гнойных полостей. Согласно рекомендациям European S1 guideline for the treatment of hidradenitis suppurativa/acne inverse, клиндамицин — единственный антибиотик, рекомендуемый для местного применения [9]. У пациентов с I–II стадией ГС/АИ по Херли возможно местное применение клиндамицина 1%, особенно при отсутствии абсцессов [9]. При наличии нескольких поражений и частых обострений может быть рассмотрена терапевтическая группа системных тетрациклинов [26]. Альтернативным вариантом может быть тройной режим приема рифампицина (10 мг/кг 1 р/сут), моксифлоксацина (400 мг 1 р/сут) и метронидазола (500 мг 3 р/сут) в течение 12 нед. с прекращением приема метронидазола через 6 нед. Пациентам со II–III стадией ГС/АИ, у которых имеется несколько активных поражений, следует сразу назначать системный клиндамицин и рифампицин (300 мг 2 р/сут) [27–29]. Антибактериальные препараты оказывают противовоспалительное действие и подавляют рост вторичной бактериальной флоры. Большое значение в терапии имеют высокая дозировка и продолжительная длительность приема препаратов. Схемы лечения системными тетрациклинами и клиндамицином, рекомендуемые при гнойничковых заболеваниях кожи, не дают результата при ГС/АИ, что служит дополнительным дифференциально-диагностическим признаком.
Хорошие результаты наблюдаются при применении в качестве эксфолианта резорцинола 15% 2 р/сут. Его используют как в качестве монотерапии, так и совместно с другими средствами, в зависимости от степени и глубины поражения. Резорцинол обладает кератолитическим, антисептическим действием, а также подавляет зуд [30].
Отдельные авторы предлагают совместное использование метронидазола 400 мг 2 р/сут и клиндамицина 600 мг 3 р/сут внутривенно в течение 2 нед. [31].
Кортикостероидные препараты также являются неотъемлемой частью лечения этого сложного заболевания. Препараты данной группы назначают с целью уменьшения выраженности воспаления. Для системной терапии используется введение триамценолона ацетонида непосредственно в образования [32] или прием внутрь гидрокортизона, дексаметазона, преднизолона. Длительность терапии составляет 7–14 дней [33].
Поскольку имеются наблюдения, подтверждающие взаимосвязь ГС/АИ и повышенной чувствительности к андрогенам [19], оправдано назначение антиандрогенов (ципротерон ацетат, эстрогены, финастерид) [34, 35].
В отношении других препаратов, в частности цитостатиков, имеется меньше публикаций, но в ряде случаев отмечена успешная терапия циклоспорином [36–38].
В современной литературе нет единого взгляда на применение метотрексата в терапии ГС/АИ. В раннем исследовании, проведенном в 2002 г. G.B. Jemec [39], метотрексат использовался в качестве монотерапии на период от 6 нед. до 6 мес., автор отметил ограниченную эффективность препарата при данной патологии. Однако, несмотря на отсутствие эффекта от метотрексата, некоторые исследователи утверждают, что его добавление в низких дозах к терапии биологическими препаратами необходимо с целью предотвращения нейтрализации аутоантител, что предупреждает развитие вторичной резистентности к биологической терапии [9, 40]. Оправдано назначение метотрексата также и при наличии у пациентов с ГС/АИ сопутствующих ревматологических заболеваний [9]. Более поздние исследования, проведенные P. Kozub et al. [41], продемонстрировали, что метотрексат неэффективен ни в качестве монотерапии, ни в сочетании с инфликсимабом. Авторы доказали, что метотрексат не увеличивает клиническую эффективность инфликсимаба [41].
Противоречивость данных об эффективности терапии метотрексатом обсуждается до сих пор. Патогенетически механизм развития заболевания связан с дисфункцией Т-регуляторных клеток и Т-хелперов 17-го типа, что приводит к повышению уровня IL-17А и IL-6, запуская тем самым каскад воспалительных реакций. В данном случае терапевтическое действие метотрексата связано с подавлением Т-хелперов 17-го типа за счет изменения уровней активности и скорости созревания дендритных клеток и Т-лимфоцитов [42]. Однако в литературе нет достаточного количества примеров, когда терапия метотрексатом улучшала течение ГС/АИ [43].
Изотретиноин при данном заболевании может быть неэффективен, поскольку в основе патогенеза заболевания лежит окклюзия волосяных фолликулов с гиперкератинизацией и последующее иммунное воспаление с вовлечением в процесс CD3/CD8 и естественных киллеров (NK-клеток). Была обнаружена отрицательная корреляция между длительностью течения заболевания и процентом NK-клеток, также отмечено увеличение содержания фактора некроза опухоли α и IL-6 [7]. Современные исследования также подтверждают низкую эффективность изотретиноина: около 60% пациентов не реагировали на лечение, а у 13% наблюдались рецидивы [44, 45].
Однако более современный препарат из класса ретиноидов — алитретиноин в дозе 10 мг/сут в течение 2 мес. с последующей поддерживающей дозой 20 мг, согласно данным [46], вызвал стойкую ремиссию у большинства больных. Данное противоречие можно объяснить тем, что алитретиноин (9-цис-агонист ретиноевой и пан-ретиноевой кислот) — новый системный препарат из группы ретиноидов, обладающий противоопухолевой активностью.
Несмотря на многочисленные работы, представленные в мировой литературе, лечение ГС/АИ является очень сложной задачей, ремиссия непродолжительная, составляет менее 1 года или полностью отсутствует, последующие рецидивы приводят к инвалидизации пациента.
Хирургическое вмешательство (либо простое иссечение поврежденных тканей, либо полное местное иссечение с последующей пересадкой кожи) является важной частью ведения таких пациентов и применяется при II–III стадиях заболевания. Важно не только вскрытие воспалительных элементов, но и их дренирование и иссечение дивертикул, как правило, располагающихся глубже основного воспалительного очага [9, 47]. Пациенты с ГС/АИ I–II стадии не нуждаются в хирургических вмешательствах [9].
Встречаются практические рекомендации по применению лазеров при ГС/АИ: carbon dioxide laser [48], NG:Yag laser [49], IPL [50], но наблюдений еще недостаточно, чтобы делать окончательные выводы.
Что касается биологической терапии, то анти-TNFα моноклональные антитела — инфликсимаб и адалимумаб показаны пациентам с III стадией ГС/АИ [9].
Впервые применили адалимумаб у 3 пациентов А.А. Navarini, R.M. Trueb в 2010 г. Все пациенты ранее получали изотретиноин в комбинации с антибиотиком, без эффекта. Применение адалимумаба позволило устранить клинические симптомы и субъективные ощущения. Однако после отмены биологической терапии клинические проявления начали возвращаться, и пациентам назначили повторный курс биологической терапии [51].
В противовес этому исследованию, эффективность адалимумаба доказана в проспективных двойных слепых плацебо-контролируемых исследованиях с участием более 800 больных, что позволило в дальнейшем включить ГС/АИ в перечень показаний для терапии адалимумабом [52, 53].
Адалимумаб следует рассматривать в качестве биологического агента первого выбора при ГС средней/тяжелой степени после неуспешного применения традиционных методов лечения, за которыми следуют инфликсимаб, устекинумаб и анакинра в качестве препаратов второй и третьей линий терапии соответственно [54].
В литературе имеются доказательства эффективности инфликсимаба у 30-летнего пациента с предшествующим неэффективным курсом терапии рифампицином 300 мг/сут, преднизолоном 50 мг/сут и изотретиноином 30 мг/сут. У данного пациента уже после первого введения инфликсимаба наблюдалось значительное уменьшение выраженности воспалительного процесса и снижение болевых ощущений [23]. Положительные результаты также продемонстрированы при лечении другими биологическими препаратами — этанерцептом и устекинумабом [24, 25]. Таким образом, можно сделать выводы, что биологические препараты демонстрируют эффективность у пациентов с ГС/АИ, и поиски оптимальной биологической терапии продолжаются.
Заключение
Гидраденит супаратива / акне инверса до сих пор является загадкой дерматологии. Несмотря на многочисленные исследования в этой области, остаются неясными многие вопросы. Среди них — важный вопрос тактики терапии пациентов с уже сформированной резистентностью к антибиотикам и противопоказаниями к адалимумабу или другим биологическим методам лечения.
Появляются новые теории, которые принципиально меняют концепцию патогенеза, о котором шла речь выше. Два исследования продемонстрировали наличие биопленки в очагах, в основном при тяжелых формах, что объясняет постоянные рецидивы в предыдущих рубцах. Эти данные свидетельствуют о патогенной роли изолированной флоры, вводя новую концепцию болезни — «хозяин — микробиом». Вместо аутовоспалительного процесса с неясным механизмом ГС/АИ можно рассматривать как аутоинфекционный из-за кожной иммунной дисрегуляции. Эта дисрегуляция позволяет аномальной бактериальной инфекции пролиферировать на фоне неадекватной гипервоспалительной реакции вместо эвакуации бактерий из дермы [51].
Эта теория может открыть возможности для разработки новых методов лечения ГС/АИ. Остается еще много вопросов, на которые нужно ответить. В частности, способствует ли ранний микробный сдвиг окклюзии фолликулов? Может ли потеря «микробного щита» быть частично восстановлена посредством иммуномодуляции или трансплантации микробиоты, как это исследовалось при воспалительных заболеваниях кишечника? Экспериментальные исследования в этом направлении уже ведутся, что позволит в скором времени получить более определенные ответы.