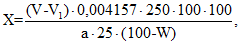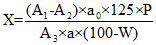Выделение дубильных веществ из лрс
ДВ — это смесь
различных полифенолов, имеющих сложную
структуру, и очень лабильных, поэтому
выделение и анализ индивидуальных
компонентов представляет собой большие
трудности.
Для
получения суммы ДВ (схема 13) ЛРС
экстрагируют горячей водой, а затем
охлаждают. Водный экстракт обрабатывают
последовательно:
1. Петролейным
эфиром (или бензолом) — для очистки от
хлорофилла, терпеноидов и липидов.
2.
Диэтиловым эфиром, который извлекает
катехины, оксикоричные кислоты
и др. фенольные соединения.
3.
Этилацетатом, в который переходят
лейкоантоцианидины,
эфиры оксикоричных кислот
и др.
Оставшееся
водное извлечение с дубильными веществами
и другими фенольными соединениями и
фракции диэтилового эфира и этилацетата
разделяют на индивидуальные компоненты
с помощью различных видов хроматографии.
Используют
адсорбционную
хроматографию на колонках целлюлозы,
полиамида (иногда вместо полиамида
используют гольевой порошок);
распределительную
хроматографию на колонках силикагеля;
ионообменную;
гель-фильтрацию
на колонках сефадекса и др.
Идентификация
индивидуальных компонентов ДВ основана
на хроматографических методах
(хроматография на бумаге и тонкослойная),
спектральных исследованиях, качественных
реакциях и изучении продуктов расщепления.
Схема 13
Качественный анализ
Качественные
реакции можно подразделить на 2 группы:
I. Общие
реакции осаждения —
для обнаружения ДВ.
II. Групповые
— для установления принадлежности ДВ к
определенной группе.
Для проведения
качественных реакций готовят водное
извлечение из ЛРС.
I. Для
обнаружения дубильных веществ
проводят реакции:
1) с 1% раствором
желатина в 10% растворе натрия хлорида.
Появляется муть, исчезающая при добавлении
избытка желатина. Реакция
специфична;
2) осаждение ДВ
солями алкалоидов (сульфат хинина).
Образуется белый осадок;
3) с 5% раствором
бихромата калия. Образуется коричневый
осадок или муть. (Это и гистохимическая
реакция обнаружения локализации ДВ в
сырье);
4) с раствором
основного ацетата свинца. Образуется
белый осадок.
II. Определение
групповой принадлежности ДВ:
1) с 1% раствором
железоаммониевых квасцов гидролизуемые
ДВ дают черно-синее окрашивание, а
конденсированные — черно-зеленое;
2) 10% раствор среднего
ацетата свинца в уксуснокислом растворе
(10%) осаждает гидролизуемые ДВ,
конденсированные остаются в растворе,
которые с железоаммониевыми квасцами
дают черно-зеленое окрашивание;
3) при нагревании
извлечения с бромной водой конденсированные
ДВ выпадают в осадок;
4) смесь 40% раствора
формальдегида и концентрированной
хлористоводородной кислоты осаждает
конденсированные ДВ, а гидролизуемые
остаются в растворе.
Реакция на
катехины: с
1% раствором ванилина в концентрированной
хлористоводородной кислоте образуется
ярко-красное окрашивание.
Лейкоантоцианидины
можно обнаружить, нагревая извлечение
с раствором хлористоводородной кислоты
— появляется красное окрашивание за
счет образования антоцианов.
Количественный анализ
Все методы
количественного определения ДВ в ЛРС
можно разделить на гравиметрические,
объемные и физико-химические.
1. Гравиметрические
методы:
1) Ранее использовали
осаждение ДВ желатином или ацетатом
меди. В настоящее время эти методики
потеряли свое значение.
2) В кожевенной
промышленности применяется весовой
единый метод
(ВЕМ). Метод основан на свойстве ДВ давать
необратимые соединения с коллагеном
кожи.
Получают водное
извлечение из ЛРС, делят его на 2 равные
части. Одну часть упаривают, высушивают
и взвешивают (Р). Вторую часть обрабатывают
кожным (гольевым) порошком, фильтруют.
Фильтрат упаривают досуха, высушивают
и взвешивают (Р1).
По разности сухих остатков в контроле
(Р) и в опыте (Р1)
определяют содержание ДВ.
2. Объемные
методы:
1) В ГФ ХI (вып. 1, с.
286) принят оксидиметрический
метод
определения ДВ (схема 14).
Схема 14
Схема количественного
определения ДВ в ЛРС
Подготовка
ЛРС (измельчение, просеивание, взятие
навески)
Экстракция
ДВ водой при нагревании
Фильтрация
На
выброс —
охлаждение
отработанное сырье
Окислительно-восстановительное
титрование
Часть
фильтрата, разбавленного водой,
титруют
раствором перманганата калия
в
присутствии индигосульфокислоты
Расчет
результатов
Метод
основан на окислении фенольных ОН-групп
перманганатом калия в присутствии
индигосульфокислоты, которая является
регулятором и индикатором реакции.
После полного окисления ДВ перманганатом
калия начинает окисляться
индигосульфокислота до изатина, в
результате чего окраска из синей
переходит в золотисто-желтую.
ИНДИГОСУЛЬФОКИСЛОТА
ИЗАТИН
(синий
цвет)
(золотисто-желтый)
Методика имеет
ряд недостатков — кроме ДВ, происходит
окисление других соединений. Несмотря
на различную структуру ДВ в сырье,
пересчет их содержания ведется на танин.
2) Для
количественного определения танина в
листьях сумаха и скумпии включен метод
осаждения ДВ сульфатом цинка с последующим
комплексонометрическим титрованием
трилоном Б
в присутствии ксиленового оранжевого.
3. Физико-химические
методы:
1) Колориметрические
методы
связаны со способностью ДВ давать
окрашенные соединения с фосфорно-молибденовой
или фосфорно-вольфрамовой кислотами в
присутствии карбоната натрия или с
реактивом Фолина — Дениса и др.
2)
Хромато-спектрофотометрические
методы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
ДУБИЛЬНЫЕ ВЕЩЕСТВА
Фармакогнозия. Карпук В.В. – 2011
Дубильные вещества — сложные высокомолекулярные природные растительные фенольные соединения, способные осаждать белки и алкалоиды и дубить невыделанную шкуру животных, превращая ее в прочный, неподдающийся гниению продукт — кожу. Термин «дубильные вещества» был введен французским ученым П. Сегеном в 1796 г.
Таннины, или танниды, — синоним термина «дубильные вещества». Он происходит от латино-кельтского обозначения дуба—«тан»—и широко распространен в научной литературе.
Способность этих веществ «дубить» белки шкур животных, делать их непроницаемыми для воды и устойчивыми к микробному гниению основана на их свойстве взаимодействовать с коллагеном, приводящим к образованию стойких полимерных структур. Дубление — сложный физико-химический процесс, связанный с возникновением водородных, ковалентных и электровалентных связей между молекулами коллагена и фенольными группами дубильных веществ.
Дубящими свойствами обладают только многоядерные фенолы, содержащие более одной ОН-группы. Это крупные фенольные молекулы с молекулярной массой от 300 до 500 и иногда до 20 000. Фенолы одноядерные и не содержащие многочисленных ОН-групп лишь адсорбируются на белках, но не могут образовать перекрестные связи между собой и белковыми группами, «сшивать» мономерные белковые группы. Они в той или иной степени инактивируют ферментные белки, но не вызывают фенол-белковых cцепок в коллагене — основном белковом компоненте шкур. Поэтому низкомолекулярные фенолы имеют лишь вяжущий вкус, их еще называют пищевыми (чайными) таннинами.
Классификация
Первая попытка классификации дубильных веществ была предпринята шведским химиком И. Берцелиусом, который разделил эти вещества на две группы по их способности давать с солями Fe(III) черные соединения зеленоватого или синеватого оттенка. Впоследствии эта простая классификация дубильных веществ легла в основу более точной научной классификации, предложенной К. Фрейденбергом. Он стал делить дубильные вещества в зависимости от их способности гидролизоваться под действием кислот (или ферментов) на две группы:
1) гидролизуемые дубильные вещества:
- — галлотаннины;
- — эллаготаннины;
- — депсиды, или несахарные эфиры карбоновых кислот;
2) негидролизуемые (конденсированные) дубильные вещества, или флобафены, которые подразделяют на производные:
- — катехинов (флаван-3-олов);
- — лейкоантоцианидинов (флаван-3, 4-диолов);
- — гидростильбенов.
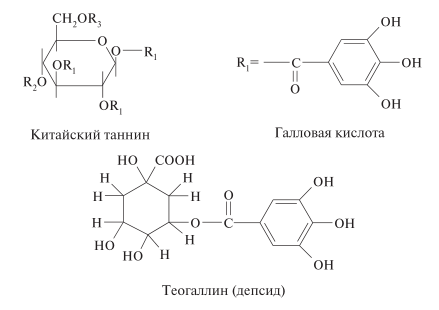
Гидролизуемые дубильные вещества. Галлотаннины — сложные эфиры гексоз (обычно D-глюкозы) и галловой кислоты. В глюкозе имеется пять ОН-групп, благодаря которым могут образовываться моно-, ди-, три-, тетра-, пента- и полигаллоильные эфиры. Представителем группы полигаллоильных эфиров является китайский таннин, который получают из листьев и образующихся на них наростов (галлов) сумах аполукрылатого (RhussemialataMurr. ). Представителем многогаллоильных эфиров является бета-D-глюкогаллин, выделенный из корня ревеня и листьев эвкалипта.
Эллаготаннины — эфиры D-глюкозы и гексадифеноловой, хебуловой и другихкислот, образующихся вместе c эллаговой кислотой. Эллаготаннины найдены в коре плодов граната, кожуре грецкого ореха, коре дуба, соплодиях ольхи. В растениях присутствует обычно не эллаговая, а гексагидроксидифеновая кислота. При кислотном гидролизе дубильных веществ эта кислота превращается в дилактон — эллаговую кислоту.
Депсиды представляют собой эфиры галловой кислоты с хинной, хлорогеновой, кофейной, гидроксикоричной кислотами, а также флаванами. Эфиры галловой кислоты и катехинов находятся в листьях чая. Из листьев зеленого чая выделен теогаллин.
Преимущественно гидролизуемые дубильные вещества содержат такие ЛР, как скумпия кожевенная, сумах дубильный, горец змеиный, бадан толстолистный, кровохлебка лекарственная, ольха черная и о. серая.
Преимущественно конденсированные дубильные вещества содержат дуб обыкновенный, лапчатка прямостоячая, черника обыкновенная, черемуха обыкновенная.
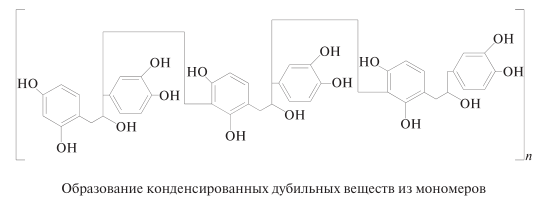
Негидролизуемые дубильные вещества. Представляют собой олигомеры и полимеры катехинов, лейкоантоцианидинов и гидроксистильбенов, где звенья связаны друг с другом прочными углерод-углеродными связями в положениях С 2 —С 6, С 2 —С 8, С 4 —С 8, С 5 —С 2 . Кроме того, они никогда не содержат остатков сахара.
При образовании конденсированных дубильных веществ разрывается пирановое кольцо катехина (лейкоантоцианидина) и С2 -атом соединяется С—С-связью с С 6 –атомом другой молекулы катехина (лейкоантоцианидина). Конденсированные дубильные вещества не распадаются под действием кислот; наоборот, они имеют тенденцию из олигомеров превращаться в более длинные полимеры (полимеризация в кислоте) с образованием аморфных, часто окрашенных в красный цвет соединений — флобафенов. Образование конденсированных дубильных веществ происходит в живом растении в процессе биосинтеза и после его смерти — при технологической обработке древесины.
Физико-химические свойства
По физико-химическим свойствам дубильные вещества представляют собой аморфные соединения желтоватого или бурого цвета. Природные дубильные вещества имеют среднюю молекулярную массу 500—5000, но отдельные соединения — до 20 000. При нагревании до 180—200С дубильные вещества (не плавясь) обугливаются, выделяя пирогаллол или пирокатехин. Растворяются во многих органических растворителях (ацетон, этанол, этилацетат, пиридин), но не в хлороформе, петролейном эфире, бензоле. Также хорошо растворимы в воде, лучше горячей. При растворении в воде дают коллоидные растворы слабокислой реакции. С солями тяжелых металлов образуют окрашенные комплексы. Осаждаются растворами аминокислот, белков, алкалоидов. Многие дубильные вещества — оптически активные соединения. Обладают вяжущим вкусом. Легко окисляются на воздухе, приобретая красно-бурую окраску, иногда темно-коричневую. Присутствие гидроксидов щелочных металлов сильно ускоряет процесс окисления дубильных веществ. Гидролизуемые дубильные вещества под действием кислот или ферментов распадаются на органические кислоты и глюкозу.
Выделение дубильных веществ из ЛРС
Дубильные вещества — это смесь различных полифенолов, имеющих сложную структуру, очень лабильных, поэтому выделение и анализ отдельных компонентов дубильных веществ представляет большие трудности. Для получения суммы дубильных веществ ЛРС экстрагируют горячей водой, охлаждают, а затем экстракт обрабатывают последовательно:
- петролейным эфиром или бензолом (для очистки от хлорофилла, терпеноидов, липидов);
- диэтиловым эфиром, который извлекает катехины, оксикоричные кислоты и другие фенольные соединения;
- этилацетатом, в который переходят лейкоантоцианидины, эфиры оксикоричной кислоты и др.
Оставшееся водное извлечение с дубильными веществами и другими фенольными соединениями и фракциями 2 и 3 (диэтилового эфира и этилацетата) разделяют на индивидуальные компоненты с помощью различных видов хроматографии.
Используют:
- — адсорбционную хроматографию на колонках целлюлозы, полиамида(иногда вместо полиамида используют гольевый порошок);
- — распределительную хроматографию на колонках силикагеля;
- — ионообменную хроматографию;
- — гель-фильтрацию на колонках сефадекса и др.
Идентификация индивидуальных дубильных веществ основана на сравнении Rf в хроматографических методах (на бумаге, в тонком слое сорбента), спектральных исследованиях, качественных реакциях и изучении продуктов расщепления (для гидролизуемых дубильных веществ).
Качественное выделение дубильных веществ
Качественные реакции определения дубильных веществ можно разделить на две группы:
- общие (осаждения) — для обнаружения присутствия дубильных веществ;
- групповые (цветные) — для установления принадлежности дубильных веществ к определенной группе.
Прежде всего для проведения качественных реакций готовят водное извлечение дубильных веществ из ЛРС.
Дубильные вещества обнаруживают, используя следующие реакции:
- — соединяя с 1 % раствором желатина в 10 % растворе NaCl. Появляется муть, исчезающая при добавлении избытка желатина. Реакция специфична;
- — осаждая солями алкалоидов (например, сульфатом хинина). Образуется белый осадок;
- — соединяя с 5 % раствором дихромата калия (К2Cr2О7). Образуется коричневый осадок или муть. Эта же реакция используется и как гистохимическая для обнаружения локализации дубильных веществ в ЛРС;
- — соединяя с раствором оснóвного ацетата свинца: образуется белый осадок;
- — соединяя с ванилином (в присутствии 70 % серной или концентрированной хлористо-водородной кислоты) дубильные вещества, содержащие мономеры катехинового типа, развивают красное окрашивание.
Классификацию дубильных веществ проводят с помощью следующих реакций:
- — с 1 % раствором железоаммонийных квасцов (или другими источниками ионов Fe 3+ ): гидролизуемые дубильные вещества дают черно-синее окрашивание, а конденсированные — черно-зеленое;
- — с 10 % раствором среднего ацетата свинца в 10 % уксусной кислоте: гидролизуемые дубильные вещества выпадают в белый хлопьевидный осадок, а конденсированные остаются в растворе и их можно также затем определить (например, по зеленовато-черному окрашиванию с Fe3+);
- — со смесью из 40 % раствора формальдегида и концентрированной HCl: конденсированные дубильные вещества выпадают в осадок, а гидролизуемые остаются в водном растворе (что можно установить по синевато-черному окрашиванию в дополнительном тесте с Fe3+);
- — с кристалликами NaNO2 и раствором 0,1М HCl: при наличии в экстракте ЛРС дубильных веществ появляется коричневое окрашивание;
- — с раствором HCl и добавлении 1 % раствора (или кристалликов) ванилина гидролизуемые дубильные вещества, состоящие из мономеров катехинов, при нагревании дают ярко-красное окрашивание. Гидролизуемые дубильные вещества, состоящие из мономеров лейкоантоцианидинов, можно обнаружить, нагревая извлечение с раствором HCl: появляется красное окрашивание (за счет образования антоцианидинов, дающих красное окрашивание в кислых значениях рН);
- — при добавлении бромной воды и нагревании конденсированные дубильные вещества в экстракте из ЛРС выпадают в осадок.
При хроматографическом определении дубильных веществ этанольный экстракт из ЛРС наносят на стартовую линию хроматографической пластинки «Силуфол», помещают в хроматографическую камеру (с соответствующими растворителями, указанными в НД), а после проведения разделения пластинку просматривают в УФ-свете и отмечают, что некоторые производные катехинов имеют голубую флуоресценцию, которая усиливается при обработке хроматограмм 1% раствором ванилина в концентрированной HCl. После выдерживания хроматограмм в парах HCl с последующим нагреванием в сушильном шкафу при температуре 105С в течение 2 мин дубильные вещества лейкоантоцианидинового типа переходят в антоцианидины розового или красно-фиолетового цвета.
Количественное определение дубильных веществ Методы количественного определения дубильных веществ в ЛРС можно разделить на гравиметрические, титриметрические и физико-химические.
Гравиметрические методы основаны на количественном осаждении дубильных веществ солями тяжелых металлов, желатиной или адсорбцией гольевым порошком. Методы осаждения дубильных веществ ацетатом меди или желатиной потеряли свое значение. Однако весовой единый метод (ВЕМ) применяется в кожевенной промышленности. Метод основан на способности дубильных веществ давать прочные соединения с коллагеном кожи. Для этого полученное водное извлечение из ЛРС делят на две равные части. Одну часть выпаривают, высушивают и взвешивают; вторую обрабатывают гольевым (кожным) порошком, фильтруют. Фильтрат выпаривают, высушивают и взвешивают. По разности сухих остатков1-й и 2-й частей (т. е. контроля и опыта) определяют содержание дубильных веществ в растворе.
Титриметрический метод, включенный в ГФ РБ (вып. 2, с. 348), именуемый методом Левенталя — Нейбауэра, основан на окислении фенольных ОН-групп перманганатом калия (КMnO4) в присутствии индигосульфокислоты, являющейся регулятором и индикатором реакции. После полного окисления дубильных веществ начинает окисляться индигосульфокислота до изатина, в результате чего окраска раствора из синей переходит в золотисто-желтую.
Другой титриметрический метод определения дубильных веществ — метод осаждения таннина сульфатом цинка с последующим комплексонометрическим титрованием трилоном Б в присутствии ксиленового оранжевого (используется, в частности, для определения танина в листьях сумаха дубильного и скумпии кожевенной).
Физико-химические методы определения дубильных веществ:
- — колориметрические — связаны со способностью дубильных веществ давать окрашенные соединения с фосфорно-молибденовой или фосфорно-вольфрамовой кислотами в присутствии Na2CO3 или с реактивом Фолина — Дениса (на фенолы). ГФРБ(т. 1;2. 8. 14) предлагает фотоколометрическое определение экстрагированных из ЛРС в водный раствор дубильных веществ с раствором фосфорно-молибденового реагента в присутствии натрия карбоната при длине волны 760 нм;
- — хромато-спектрофотометрические и нефелометрические методы, которые используют главным образом в научных исследованиях.
Распространение в растительном мире, условия образования и роль в растениях Дубильные вещества широко распространены в растительном мире. Они встречаются в грибах, водорослях, папоротниках, хвощах, мхах, плаунах, у высших растений (покрыто- и голосеменных). Многие хвойные накапливают достаточно большое количество дубильных веществ. Максимальное их накопление обнаружено у отдельных представителей двудольных растений, тогда как у однодольных оно отмечено лишь у некоторых семейств. Низкое содержание дубильных веществ у злаков. У двудольных некоторые семейства (например, Розоцветные, Гречишные, Бобовые, Ивовые, Сумаховые, Буковые, Вересковые) насчитывают многие роды и виды, где содержание таннидов доходит до 20—30% и более. Наивысшее содержание дубильных веществ выявлено в патологических образованиях — галлах (до 60—80 %). Древесные формы богаче дубильными веществами, чем травянистые. Дубильные вещества неравномерно распределены по органам и тканям растений. Они накапливаются главным образом в коре и древесине деревьев и кустарников, а также в подземных частях травянистых многолетников; зеленые части растений значительно беднее дубильными веществами. В частности, дубильные вещества накапливаются:
- — в подземных органах (лапчатка прямостоячая, кровохлебка лекарственная, бадан толстолистный);
- — коре (дуб обыкновенный);
- — траве (виды зверобоя);
- — плодах (черника обыкновенная, черемуха обыкновенная, ольха клейкая и о. серая);
- — листьях (сумах дубильный, скумпия кожевенная).
Дубильные вещества аккумулируются в вакуолях, а при старении клеток адсорбируются на клеточных стенках. Чаще всего в растениях встречается смесь гидролизуемыхиконденсированныхдубильныхвеществспреобладаниемсоединений той или иной группы.
Содержание дубильных веществ в растениях изменяется в зависимости от периода вегетации и возраста растений. Их накопление одновременно сопровождается резким увеличением массы корневых систем. С возрастом растений количество дубильных веществ в них уменьшается. Период вегетации влияет не только на количественный, но и на качественный состав дубильных веществ.
Растущие на солнце растения накапливают больше дубильных веществ, чем растущие в тени (так, в тропических растениях их образуется значительно больше, чем в растениях умеренных широт). На содержание дубильных веществ в растениях влияет также высота над уровнем моря, время года — особенно в областях с резко выраженной сезонностью климата. Содержание дубильных веществ зависит как от климатических, почвенных, так и от генетических (наследственных) факторов растения.
Установлено, что большинство дубильных веществ в листьях находится в клетках паренхимы, окружающих жилку, т. е. дубильные вещества образуются в листьях и оттуда проходят в клетки флоэмы проводящих пучков, по которым разносятся по всему растению. Обладая бактерицидными свойствами (благодаря своей фенольной природе), они препятствуют гниению древесины и являются веществами, защищающими растения от вредителей и возбудителей заболеваний. Дубильные вещества также участвуют в процессах метаболизма растений. Они откладываются как запасные продукты, которые могут использоваться затем при весеннем пробуждении и нарастании вегетативных органов.
Биомедицинское действие и применение
Дубильные вещества и содержащие их ЛР применяют в основном в качестве вяжущих, противовоспалительных и кровоостанавливающих средств. Растворы таннидов связываются с белками кожи, образуя непроницаемую для воды пленку. На этом основано их медицинское применение в виде вяжущих средств, так как образующаяся на слизистых оболочках пленка препятствует дальнейшему воспалению, а нанесенные на рану, они свертывают кровь и поэтому действуют как местные кровоостанавливающие средства. Свойство образования пленки на языке обусловливает характерный вяжущий вкус дубильных веществ.
Танинсодержащее ЛРС используют для получения настоев, настоек, отваров, экстрактов, применяемых наружно и внутрь:
- — как вяжущие средства;
- — кровоостанавливающие средства;
- — противовоспалительные средства;
- — антимикробные средства; а также в качестве:
- — P-витаминных и антисклеротических средств (гидролизуемые и конденсированные дубильные вещества);
- — антиоксидантов и гипооксантов (конденсированные дубильные вещества);
- — противоопухолевых средств (конденсированные дубильные вещества);
- — противоядия при отравлении гликозидами, алкалоидами и солями тяжелых металлов (дубильные вещества).
Показано, что большие дозы дубильных веществ оказывают противоопухолевое действие, средние — радиосенсибилизирующее, малые — противолучевое. Широкое применение дубильные вещества находят также в кожевенной, коньячной и пищевой промышленности.
Заготовка ЛРС, содержащего дубильные вещества
Заготовку проводят в период максимального содержания дубильных веществ. Сушат быстро при температуре 50—60 -С, так как продолжительное хранение свежего сырья ведет к гидролитическому расщеплению гидролизуемых и конденсированных дубильных веществ под влиянием ферментов. Высушенное ЛРС хранят цельным в сухом помещении в упакованном виде. При хранении измельченного ЛРС повышается скорость окисления дубильных веществ, изменяется цвет.
Лекарственные растения и лекарственное растительное сырье,
содержащее преимущественно гидролизуемые дубильные вещества
Бадан толстолистный (Bergenia crassifolia[L. ]Fritsch.) — сем. Камнеломковые (Saxifragaceae), рис. 120. Многолетнее травянистое растение высотой до 0, 5 м. Имеет мощное толстое ползучее корневище с крупным вертикальным корнем. Стебель короткий, толстый, розово-красный. Листья крупные, цельные, широкоовальные, кожистые, блестящие, зимующие, черешковые, образуют прикорневую розетку. Цветки мелкие, пятичленные, лилово-розовые, образуют метельчато-щитковидные соцветия. Бадан толстолистный естественно произрастает в Забайкалье, Саянах, на Алтае. В Беларуси разводится главным образом как декоративное растение.
Bergeniae crassifoliae rhizomata — бадана толстолистного корневища. ЛРС—куски корневищ цилиндрической формы длиной до 20см, толщиной 1—3, 5смсчешуевиднымиостаткамичерешковлистьевиокруглыхследовкорней на поверхности. Цвет корневищ снаружи темно-коричневый, на изломе — желто-коричневый или светло-розовый, зернистый. Запах отсутствует. Вкус сильно вяжущий. Сырье сохраняет годность 6 лет.
Химический состав ЛРС. Корневища бадана содержат дубильные вещества (около 27 %, из них таннин — 8—10 %), галловую кислоту, арбутин (22 %), свободный гидрохинон (2—4 %), кумарины (бергенин — 4, 5 %), смолы, витамин С, сахар, крахмал, камеди, Cu, Zn, Mn и другие микроэлементы. С возрастом растения количество дубильных веществ в корневищах увеличивается, в листьях уменьшается.
Основное действие. Вяжущее.
Использование. Настой и отвар из корней и корневищ бадана применяют в гинекологии, стоматологии для остановки кровотечений и как противовоспалительное, антисептическоесредство, для лечения гастритов, язв желудка и ДПК, в народной медицине — для лечения туберкулеза легких.
Рис. 120. Бадан толстолистный: 1 — корневище; 2 — лист; 3 — цветки
Горец змеиный (змеевик большой) (Polygonum bistorta L., или Bistorta major S. F. Gray) — сем. Гречишные (Polygonaceae), рис. 121. Многолетнее травянистое растение со змеевидным толстым узловатым буро-красным корневищем и одиночными стеблями высотой до 1 м. Прикорневые листья с длинными крылатыми черешками, стеблевые — редкие, ланцетовидные. Цветки мелкие, розовые, собраны в колосовидные соцветия. Занимает ареал от Крайнего Севера до степной зоны Евразийского континента, произрастает на заливных лугах, берегах водоемов, среди кустарников.
Bistortae rhizomata — змеевика корневища. ЛРС — куски змеевидно изогнутых, несколько сплющенных корневищ длиной 3—10 см, толщиной 1, 5—2 см с поперечными кольчатыми утолщениями и следами обрезанных корней. На ощупь твердые, с поверхности темно-коричневые. Излом ровный, цвет на изломе буровато-розовый или розовый; цвет пробки темно-коричневый или красновато-бурый. Сырье годно к употреблению 6 лет.
Химический состав ЛРС. Корневища змеевика содержат 15—25 % дубильных веществ, преимущественно гидролизуемых, галловую, эллаговую, аскорбиновую, фенолкарбоновые и органические кислоты, флавоноиды (кверцетин, катехины, лейкоантоцианидины и их производные), кумарины, антрахиноны, крахмал.
Основное действие. Вяжущее, антисептическое.
Использование. Настой и отвар корневищ з. применяются как вяжущее, кровоостанавливающее, противовоспалительное, ранозаживляющее средство при небольших кровотечениях в ЖКТ, остром и хроническом воспалениях желудка, пищевых отравлениях, дерматозах, ожогах, воспалении полости рта, влагалища, геморрое.
Рис. 121. Горец змеиный (змеевик): 1 — корневище; 2 — лист; 3 — соцветие
Дуб обыкновенный (д. черешчатый) (Querсus robur L., или Q. pedunculata Ehrh.) — сем. Буковые (Fagaceae), рис. 122. Мощное дерево высотой до 40м. Имеет глубокотрещиноватую темно-серую кору на старых ветвях и оливково-серебристую — на молодых. Листья с короткими (до 1см) черешками, обратнояйцевидные, с 5—9 парами округлых лопастей, которые появляются в мае. Плод — желудь, зеленовато-бурый, длинно-эллиптический, с надетой на верхний конец чашевидной шапочкой. По всей территории Беларуси встречаются отдельные экземпляры дуба, реже они образуют небольшие дубравы. Заготавливают гладкую кору с тонких молодых веток ранней весной, сушат при температуре до 50С.
Querсus сortices — дуба кора. ЛРС— желобоватые полосы коры разной длины, толщиной 2—6мм, снаружи серо-бурые, внутри желто-бурые. Наружная поверхность довольно гладкая с редкими трещинками. Внутренняя поверхность матовая с невысокими продольными бороздками шириной 0, 5—1 мм. На изломе наружная кора зернистая, ровная, внутренняя — сильноволокнистая, занозистая. Цвет коры снаружи светло-коричневый или светло-серый, серебристый, внутри — коричневый, красновато-коричневый или желтовато-коричневый. Запах слабый, своеобразный, усиливающийся при смачивании коры водой. Вкус вяжущий. Срок хранения сырья 5 лет.
Химический состав ЛРС. Содержатся дубильные вещества(10—20%, гидролизуемые и конденсированные), галловая, эллаговая кислоты, флавоноиды (кверцетин и кверцитрин), тритерпеновые сапонины — производные фриделина, ситостерол.
Основное действие. Вяжущее, антибактериальное.
Использование. Кора дуба используется в виде отвара и настоя как наружное вяжущее и противовоспалительное средство для лечения стоматитов, гингивитов, воспалений ротовой полости, женских половых органов, ожогов кожи, потливости. При пероральном приеме дубильные вещества связываются с эпителием кишечника, способствуют заживлению язв и эрозий слизистой поверхности, останавливают кровоточивость капилляров, снижают обезвоживание организма и потерю электролитов, препятствуют разрежению каловых масс и приводят к запорам. Большое значение имеет также бактерицидность дубильных веществ на патогенные микроорганизмы, способность их нейтрализовать многие бактериальные токсины. Полоскание ротовой полости устраняет неприятный запах. Кора дуба входит в вяжущий, противовоспалительный, антибактериальный сборы. При неумеренном приеме отваров и настоев коры дуба внутрь возможно отравление и, как следствие, рвота, слабость, анемия.
Рис. 122. Дуб обыкновенный: 1 — плоды (желуди); 2 — листья; 3 — кора (снаружи и изнутри)
Ольха черная (клейкая) (Alnus glutinosa [L. ] Gaertn. ), о. серая (белая) (Alnus incana [L. ] Moench. ) — сем. Березовые (Betulaceae), рис. 123, а, б. Небольшие деревья. Листья ольхи черной округлые с зубчатым краем, сверху тупые или с выемкой, темно-зеленые, блестящие, молодые клейкие. Листья ольхи серой зубчатые, но широкоэллиптические, с обеих сторон серовато-зеленые, молодые неклейкие. Тычиночные цветки собраны в длинные сережки. Пестичные цветки собраны в овальные короткие колоски, превращающиеся после опыления в древеснеющие соплодия. Ольха черная и о. серая — лесообразующие породы в южной и северной частях Беларуси соответственно; встречаются по всей территории Республики, часто.
Alni fructus — ольхи соплодия (шишки). ЛРС — яйцевидные или продолговатые соплодия ольхи (шишки), расположенные по несколько штук на общей плодоножке или одиночные, с плодоножками либо без них, чешуйки и плоды. На твердой оси соплодия расположены многочисленные веерообразные чешуйки с утолщенным, слегка лопастным наружным краем. В пазухах чешуек находятся односеменные двукрылые сплюснутые плоды орешки. Длина общей плодоножки до нижнего соплодия около 1, 5 мм, длина соплодий до 20 мм, диаметр до 13 мм. Цвет соплодий и веточек темно-коричневый или красновато-коричневый. Запах слабый. Срок годности ЛРС сырья 3 года.
Alni incanae folia — ольхи серой листья. В качестве сырья используют высушенные и обмолоченные листья о. серой — широкоэллиптические, овально-ланцетовидные, яйцевидные, на верхушке заостренные или притупленные, с округлым или широким клиновидным основанием. По краю остро двоякопильчатые. Жилкование перистое, количество жилок от 7 до 13. Длина листа 4—12 см, ширина 3—7 см, черешок листа до 2 см. Цвет листьев сверху зеленый, снизу серо-зеленый, с опушением, особенно по жилкам. Запах слабый. Срок годности сырья 3 года.
Alni glutinosa folia — ольхи черной листья. ЛРС—листья черешковые, широкообратно яйцевидные или почти округлые с цельнокрайним клиновидным основанием, на верхушке притупленные или выемчатые, с городчато-пильчатым краем. Молодые листья очень клейкие. Жилкование перистое, количество жилок 5—7 (реже 9). Длина листа 2, 3—12 см, ширина 2, 5—6 см, длина черешка 0, 7—3 см. Листья сверху темно-зеленые, блестящие, снизу светло-зеленые, почти голые (с редкими волосками по жилкам). Запах слабый. Вкус горьковатый, вяжущий. Сырье годно к употреблению 3 года.
Химический состав ЛРС. Соплодия ольхи содержат дубильные вещества (до 30 %: гидролизуемые и конденсированные, таннин — 2—3 %), галловую кислоту (до 4 %), флавоноиды (гиперозид, кверцитрин, антоцианы и др.), тритерпеноиды, алкалоиды. В листьях ольхи серой и ольхи черной присутствуют флавоноиды (гиперозид и другие — не менее 1 %), дубильные вещества (эллаговая кислота и другие — не менее 5 %).
Основное действие. Вяжущее, дезинфицирующее, противовоспалительное.
Использование. Отвар и настой соплодий ольхи применяют внутрь при острых и хронических энтеритах, колитах, дизентерии; наружно—для полоскания горла, полости рта. Шишки ольхи входят в желудочные сборы, уменьшая бродильные и гнилостные процессы в ЖКТ. ЛС из ольхи Альтан содержит эллаготаннины и проявляет противовоспалительный и кровоостанавливающий эффект, подавляет развитие дизентерийной и синегнойной палочек, грамотрицательных микробов и в целом имеет более широкий спектр действия, чем Новоиманин из зверобоя.
Рис. 123. Ольха: а — черная (клейкая): 1 — соплодия (шишки); 2 — соцветия тычиночных цветков; 3 — лист; б — серая: 1 — соплодия; 2 — соцветия тычиночных цветков; 3 — лист
Кровохлебка лекарственная (Sanguisorba officinalis L. ) — сем. Розоцветные (Rosaceae), рис. 124. Многолетнее травянистое растение. Имеет довольно толстое горизонтальное корневище и отходящие от него тонкие одиночные корни, в верхней части ветвистые стебли высотой до 1 м, непарноперистые листья: прикорневые — длинночерешковые, верхние — сидячие, стеблевые. Цветки темно-красные в овально-цилиндрических головках. Растение имеет широкий ареал в лесной и лесостепной зонах евразийской части континента, произрастая в зарослях кустарников, на лугах, берегах рек.
Sanguisorbae rhizomata et radices — кровохлебки корневища и корни. ЛРС — цельные или разрезанные на куски длиной до 20см, толщиной 0,5—2,5см корневища и корни толщиной 0, 3—1, 5 см. Поверхность гладкая или продольно-морщинистая, темно-коричневая; на изломе цвет желтовато-бурый. Излом корневищ более неровный, чем корней. Запах отсутствует. Вкус вяжущий. Срок годности сырья 5 лет.
Химический состав ЛРС. Содержит дубильные вещества, преимущественно гидролизуемые (12—20 %), эллаговую, галловую кислоты, флавоноиды, антоцианы, катехины, сапонины (4 %: сангвисорбин, потерин), витамин С (0, 9 %), крахмал (30 %), эфирные масла (2 %).
Основное действие. Вяжущее, кровоостанавливающее.
Использование. Корневища и корни кровохлебки применяют в виде отвара и жидкого экстракта как вяжущее средство при заболеваниях ЖКТ, энтероколите, диарее; как кровоостанавливающее — при маточных и геморроидальных кровотечениях, кровохаркании.
Рис. 124. Кровохлебка лекарственная: 1—соцветие; 2—лист; 3—корневище
Лекарственные растения и лекарственное растительное сырье, содержащее преимущественно конденсированные дубильные вещества
Лапчатка прямостоячая (дикий калган) (Potentilla erecta [L. ] Raeusch., или P. tormentilla Stokes) — сем. Розоцветные (Rosaceae), рис. 125. Многолетнее травянистое растение высотой 15—50см. Корневище горизонтальное, узловатое. Стебли приподнимающиеся, вверху ветвистые. Стеблевые листья сидячие, тройчатые, с двумя сросшимися крупными прилистниками, кажутся пятипальчатыми. Цветки золотисто-желтые, обычно с четырьмя лепестками, вследствие чего л. прямостоячая отличается от других видов лапчатки, имеющих венчик из пяти лепестков. Ареал распространения — лесная зона европейской части СНГ. В Республике Беларусь произрастает по всей территории, встречается достаточно часто, главным образом на сырых лугах, опушках, полянах, в изреженных хвойных и хвойно-мелколиственных лесах. Корневища выкапывают из земли в период цветения, сушат при температуре до 60С.
Tormentillae rhizomata — лапчатки прямостоячей корневища. ЛРС—корневища длиной до 10см и толщиной1—2см, прямые или изогнутые, часто неопределенной формы, твердые, тяжелые, с многочисленными ямчатыми следами от придаточных корней. Цвет снаружи от красновато-коричневого до темно-коричневого, на изломе — от желтовато-коричневого до красно-коричневого. Запах слабый, ароматный. Вкус сильно вяжущий. Срок хранения сырья 6 лет.
Химический состав ЛРС. Корневища л. прямостоячей содержат дубильные вещества (15—30 %: преобладают конденсированные таннины), антоцианы, катехины, другие флавоноиды, фенолы и фенолкарбоновые кислоты, тритерпеновые сапонины, смолистые вещества, крахмал.
Основное действие. Вяжущее, противовоспалительное.
Использование. Отвар и настой применяют прежде всего внутрь как вяжущее и противовоспалительное средство при воспалительных состояниях рта и гортани, расстройствах ЖКТ, реже — наружно при экземе, рожистом воспалении кожи, ожогах.
Рис. 125. Лапчатка прямостоячая: 1 — лист; 2 — цветок; 3 — корневище
Черника обыкновенная (Vaccinium myrtillus L. ) — сем. Вересковые (Ericaceae), рис. 126. Кустарничек высотой 15—50 см с очередными яйцевидными, по краю пильчатыми листочками. Цветки одиночные, пазушные, поникающие, на коротких цветоножках, невзрачные. Плод — черная с сизоватым налетом сочная ягода с множеством мелких семян в темно-красной мякоти. На верхушке плодов в виде кольцевой оторочки, окружающей вздутый диск с остатками столбика в центре, видны следы чашечки. Цветение происходит в мае—июне, созревание плодов—в июле-августе. Черника широко распространена в тундровой, лесной и лесостепной зонах Евразии. В Беларуси часто образует заросли на почвенном покрове еловых и сосновых лесов. Заготавливают зрелые плоды черники и облиственные неодревесневшие побеги длиной около 15 см до окончания плодоношения. Сушку плодов и побегов начинают с подвяливания их при температуре 35—40С в течение 3—4 ч, а затем сушат при температуре 55—60С.
Myrtilli сormi — черники побеги. Сырье представляет смесь цельных или изломанных верхушек побегов, отдельных стеблей длиной до 15 см, листьев, бутонов, цветков и плодов. Вкус горьковато-вяжущий. Срок годности 2 года 6 месяцев.
Myrtilli fructus siccus — черники плоды сухие. ЛРС — круглые морщинистые ягоды диаметром около5мм. На нижней части имеется рубец или (редко) фрагмент плодоножки. На верхушке заметен остаток чашечки в виде небольшой кольцевой оторочки, окружающей вздутый диск с остатком столбика в центре или с небольшим углублением после его опадения. В мякоти плодов 4—5 гнезд, содержащих многочисленные мелкие семена. Цвет плодов с поверхности сизовато-черный или синий, мякоти—красновато-фиолетовый, семян — коричневый. Запах слабый. Вкус кисло-сладкий, слегка вяжущий. Срок годности сырья 2 года.
Myrtilli fructus recens — черники плоды свежие. ЛРС — шаровидные сочные ягоды диаметром около 5 мм (см. предыдущее описание). Цвет плодов черновато-синий, мякоти — красно-фиолетовый, семян — красновато-коричневый. Вкус кисло-сладкий, слабовяжущий.
Химический состав ЛРС. Листья и плоды черники содержат дубильные вещества(18—20%), в том числе конденсированные (5—12%), флавоноиды (гиперин, рутин), антоцианы (миртиллин и неомиртиллин, называемый еще растительным инсулином, его агликоном является инозит), арбутин, гидрохинон, каротиноиды, витамин С, органические кислоты (лимонную, щавелевую, винную, яблочную, бензойную, галловую), сахара (5—20 %), пектиновые вещества. У побегов содержание основных компонентов ниже, чем у листьев.
Основное действие. Вяжущее, противовоспалительное.
Использование. Плоды черники редко применяют в свежем виде, чаще используют их настой, отвар, кисель при лечении бродильных и гнилостных процессов в кишечнике, колитов. Показано, что плоды черники улучшают кровоснабжение глаз, стабилизируют структуру сетчатки, улучшают ночное зрение. Побеги черники входят в состав антидиабетических сборов Арфазетин, Мирфазетин. Плоды не стоит употреблять при запорах.
Рис. 126. Черника обыкновенная: 1 — плод; 2 — побеги с листьями; 3 — цветок
Черемуха обыкновенная (ч. кистевидная) (Padus avium Mill. (P. racemosa Gilib. )), ч. азиатская (P. asiatica Kom. ) — сем. Розоцветные (Rosaceae), рис. 127. Дерево высотой до 10 м. Имеет темно-серую матовую (на молодых веточках коричневую) кору со светлыми чечевичками. Листья короткочерешковые, очередные, эллиптические, с коротким острым основанием и верхом, тонкопильчатым краем. Цветки белые, душистые, пятилепестные, в многоцветковых густых поникающих кистях: развиваются в конце апреля, а в июле созревают плоды — черные костянки со сладковатой терпко-вяжущей мякотью. Распространена в лесной и лесостепной зонах Евразии, произрастает среди кустарников, на сырых участках лиственных и смешанных лесов, берегах водоемов. Собранные плоды сушат быстро при температуре 40—60С.
Padi Fructus — черемухи плоды. ЛРС — плоды (костянки) шарообразной или продолговато-яйцевидной формы, диаметромдо8мм, морщинистые, без плодоножки, с округлым белым рубцом на месте ее отпадения и с округлой коричневой косточкой диаметром до 7мм внутри. Поверхность плодов морщинистая, косточек — поперечно-ребристая. Цвет плодов черный, матовый, реже блестящий, иногда с беловато-серым или красноватым налетом на складках. Запах слабый. Вкус сладковатый, вяжущий. Срок хранения сырья 3 года.
Химический состав ЛРС. Содержит сахара, витамин С, дубильные вещества (15 %: преимущественно конденсированные), фенолкарбоновые и органические кислоты, терпеноидные гликозиды(амигдалин, прулауразин, пруназин); в кожице — флавоноиды (антоцианы и др. ), фитонциды. В коре и листьях выявлена синильная кислота (0, 05—0, 09 %).
Основное действие. Вяжущее, дезинфицирующее.
Использование. Отвар и настой плодов черемухи применяют как вяжущее и дезинфицирующее ЖКТ средство при дизентерии, диареях. Плоды черемухи — компонент желудочных сборов. Народная медицина использует также цветки и листья как воздухоочищающее, противовоспалительное, ранозаживляющее средство.
Рис. 127. Черемуха обыкновенная: 1 — плоды; 2 — цветок; 3 — соцветие
Лабазник обыкновенный (л. шестилепестный, или таволга обыкновенная) (Filipendula vulgaris Moench., или F. hexapetala Gilib. ) — сем. Розоцветные (Rosaceae), рис. 128. Многолетнее травянистое растение высотой 30—80 см с клубневидно утолщенными корнями. Листья прерывисто-перистые с глубоко надрезанными или зубчатыми краями, волосистые лишь по жилкам. Цветки в основном шестилепестные, белые или бледно-розовые, в метельчатых соцветиях. Типичное болотно-луговое растение.
Filipendulae hexapetalae rhizomata et radices — лабазника шестилепесткового корневища и корни. ЛРС—цельные или изломанные корневища и корни. Корневища длиной до 10 см, толщиной до 1, 5 см с бугорчатой поверхностью. Корни, частично отходящие от корневищ, а также отдельные — тонкие, цилиндрические, в средней части с веретеновидными или почти шарообразными утолщениями. Цвет снаружи темно-коричневый, на изломе буровато-розовый. Запах характерный. Вкус горьковато-вяжущий. Срок годности сырья 3 года.
Химический состав ЛРС. Корневища с корнями содержат крахмал, дубильные вещества (5—33 %), фенолгликозид гаультерин (при гидролизе дает салициловый альдегид); трава—дубильные вещества(14%), салициловую и аскорбиновую кислоты, флавоноиды.
Основное действие. Противовоспалительное, кровоостанавливающее.
Использование. Отвары корневищ и корней л. шестилепесткового применяют внутрь в качестве кровоостанавливающего, противовоспалительного средства при язвах желудка и ДПК.
Рис. 128. Лабазник обыкновенный (шестилепестный): 1 — цветок; 2 — корневище; 3 — корни; 4 — лист

Этот товар купили: 805 раз
Сульфаминовая кислота (аминосульфоновая кислота), ХЧ (арт. 170379)
Основные данные
Сульфаминовая кислота применяется в аналитической химии, в химическом синтезе, для очистки промышленного оборудования, в текстильной промышленности, при никелировании.
ТУ КОМП 2-103-09
Пр-во: Россия
Срок хранения: 1 год
Химическая формула: NH2SO3H
Бесцветные кристаллы в массе белого цвета
Массовая доля основного вещества: 99,63%
Синонимы: аминосульфоновая кислота
Купить сульфаминовую кислоту в нашем интернет-магазине в розницу могут как юридические, так и физические лица
- Описание
- Детали
Меры предосторожности
Данное вещество – химический реактив, не предназначенный для употребления внутрь или наружного применения!
Не является лекарственным (фармацевтическим) препаратом. Не является БАД.
Хранить в местах, исключающих доступ детей!
Хранить в герметичной ёмкости.
Избегайте попадания данного вещества на кожу, в глаза, на слизистые оболочки!
При работе с данным веществом следует применять индивидуальные средства защиты, а также соблюдать правила личной гигиены.
Помещения, в которых проводятся работы, должны быть оборудованы общей приточно-вытяжной вентиляцией.
Похожие товары
Салициловая кислота, имп. (арт. 173252)
от 228 руб.
Подробнее
Перекись водорода ГОСТ (пергидроль, пероксид водорода), Россия, 12 кг (арт. 800002)
от 2640 руб.
Подробнее
Бензойная кислота, ЧДА (арт. 020178)
от 279 руб.
Подробнее
Борная кислота, ХЧ (арт. 020255)
от 33 руб.
Подробнее
Муравьиная кислота (85%), Китай (арт. 123048)
от 380 руб.
Подробнее
Калий гидроокись (гидроксид калия, едкое кали, каустический поташ), Корея (арт. 103190)
от 186 руб.
Подробнее
Стеариновая кислота (арт. 173071)
от 308 руб.
Подробнее
Скипидар живичный в/сорт (техн.) (арт. 173117)
от 1164 руб.
Подробнее
Селенистая кислота, Ч (арт. 170761)
от 867 руб.
Подробнее
Лимонная кислота 1-водная пищевая, имп. (арт. 113018)
от 373 руб.
Подробнее
Сорбиновая кислота (имп) (арт. 173070)
от 225 руб.
Подробнее
Перекись водорода (осч 8-4) (арт. 153142)
от 706 руб.
Подробнее
Ортофосфорная кислота (о-Фосфорная кислота), 85%, 1,6 кг (арт. 203037)
от 574 руб.
Подробнее
Винная кислота, ЧДА (арт. 030042)
от 441 руб.
Подробнее
Аммиак водный ОСЧ, 0,9 кг (арт. 011378)
от 202 руб.
Подробнее
Мочевина (карбамид), техническая, 1 кг (арт. 123088)
от 195 руб.
Подробнее
Борная кислота, ОСЧ (арт. 020297)
от 280 руб.
Подробнее
Борная кислота, Перу (арт. 023047)
от 143 руб.
Подробнее
Щавелевая кислота 2-водная, ХЧ (арт. 250013)
от 156 руб.
Подробнее
Лимонная кислота 1-водная, ХЧ (арт. 110042)
от 149 руб.
Подробнее
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
|
Определение содержания дубильных веществ в лекарственном растительном сырье и лекарственных растительных препаратах |
ОФС.1.5.3.0008.18 |
|
Взамен ОФС.1.5.3.0008.15 |
Определение содержания дубильных веществ в лекарственном растительном сырье и лекарственных растительных препаратах проводят титриметрическим и/или спектрофотометрическим методами. Титриметрический метод заключается в определении суммы дубильных веществ в пересчете на танин, а спектрофотометрический метод позволяет определять сумму дубильных веществ в пересчете на пирогаллол или (+)-катехин в зависимости от группы дубильных веществ (гидролизуемые или конденсируемые соответственно), если в фармакопейной статье не указан другой стандартный образец.
Арбитражным методом определения содержания дубильных веществ в лекарственном растительном сырье и лекарственных растительных препаратах является спектрофотометрический метод.
Метод 1. Определение суммы дубильных веществ
в пересчете на танин
Около 2 г (точная навеска) измельченного лекарственного растительного сырья или лекарственного растительного препарата, просеянного сквозь сито с отверстиями размером 3 мм, помещают в коническую колбу вместимостью 500 мл, заливают 250 мл нагретой до кипения воды и кипятят с обратным холодильником на электрической плитке с закрытой спиралью в течение 30 мин при периодическом перемешивании. Полученное извлечение охлаждают до комнатной температуры и фильтруют через вату в мерную колбу вместимостью 250 мл так, чтобы частицы сырья/препарата не попали в колбу, доводят объем раствора водой до метки и перемешивают. 25,0 мл полученного водного извлечения помещают в коническую колбу вместимостью 1000 мл, прибавляют 500 мл воды, 25 мл раствора индигосульфокислоты и титруют при постоянном перемешивании 0,02 М раствором калия перманганата до золотисто-желтого окрашивания.
Параллельно проводят контрольный опыт: в коническую колбу вместимостью 1000 мл помещают 525 мл воды, 25 мл раствора индигосульфокислоты и титруют при постоянном перемешивании 0,02 М раствором калия перманганата до золотисто-желтого окрашивания.
1 мл 0,02 М раствора калия перманганата соответствует 0,004157 г дубильных веществ в пересчете на танин.
Содержание суммы дубильных веществ в пересчете на танин в абсолютно сухом сырье в процентах (X) вычисляют по формуле:
где:
V — объем 0,02 М раствора калия перманганата, израсходованного на титрование водного извлечения, мл;
V1 — объем 0,02 М раствора калия перманганата, израсходованного на титрование в контрольном опыте, мл;
0,004157 — количество дубильных веществ, соответствующее 1 мл 0,02 М раствора калия перманганата (в пересчете на танин), г;
а — навеска лекарственного растительного сырья или лекарственного растительного препарата, г;
W — влажность лекарственного растительного сырья или лекарственного растительного препарата, %;
250 — общий объем водного извлечения, мл;
25 — объем водного извлечения, взятого для титрования, мл.
Примечание. Приготовление раствора индигосульфокислоты. 1 г индигокармина растворяют в 25 мл серной кислоты концентрированной, затем прибавляют дополнительно 25 мл серной кислоты концентрированной и разбавляют водой до 1000 мл, осторожно вливая полученный раствор в воду, в мерной колбе вместимостью 1000 мл, перемешивают.
Метод 2. Определение суммы дубильных веществ
спектрофотометрическим методом
Около 2,0 г (точная навеска), если иное не указано в частной фармакопейной статье, измельченного лекарственного растительного сырья или лекарственного растительного препарата, просеянного сквозь сито с отверстиями размером 1 мм, помещают в коническую колбу вместимостью 500 мл, заливают 250 мл воды и кипятят с обратным холодильником на электрической плитке с закрытой спиралью в течение 30 мин при периодическом перемешивании. Полученное извлечение охлаждают до комнатной температуры и фильтруют через вату в мерную колбу вместимостью 250 мл так, чтобы частицы сырья не попали в колбу, доводят объем раствора водой до метки и перемешивают. Полученный раствор фильтруют через бумажный фильтр диаметром около 125 мм, отбрасывая первые 50 мл фильтрата.
Раствор А. 1,0 мл фильтрата помещают в мерную колбу вместимостью 25 мл, доводят объем раствора водой до метки и перемешивают. Измеряют оптическую плотность раствора А (А1) на спектрофотометре при длине волны 266 нм (для гидролизуемых дубильных веществ) или 278 нм (для конденсированных дубильных веществ), если иное не указано в фармакопейной статье, в кювете с толщиной слоя 10 мм относительно раствора сравнения. В качестве раствора сравнения используют воду.
Раствор Б. К 5,0 мл фильтрата прибавляют 0,05 г кожного порошка, перемешивают полученную смесь в течение 30 мин и фильтруют через бумажный фильтр диаметром около 125 мм. 1,0 мл полученного фильтрата помещают в мерную колбу вместимостью 25 мл, доводят объем раствора водой до метки и перемешивают. Измеряют оптическую плотность раствора Б (А2) на спектрофотометре при длине волны 266 нм (для гидролизуемых дубильных веществ) или 278 нм (для конденсированных дубильных веществ), если иное не указано в фармакопейной статье, в кювете с толщиной слоя 10 мм относительно раствора сравнения. В качестве раствора сравнения используют воду.
Раствор СО. 0,1 г (точная навеска) СО пирогаллола (для гидролизуемых дубильных веществ) или (+)-(+)-катехина (для конденсированных дубильных веществ), если иное не указано в фармакопейной статье, помещают в мерную колбу вместимостью 100 мл, растворяют в воде, доводят объем раствора водой до метки и перемешивают. 2,0 мл полученного раствора помещают в мерную колбу вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают. Раствор используют свежеприготовленным.
Измеряют оптическую плотность раствора СО (А3) на спектрофотометре при длине волны 266 нм (для гидролизуемых дубильных веществ) или 278 нм (для конденсированных дубильных веществ), если иное не указано в фармакопейной статье, в кювете с толщиной слоя 10 мм относительно раствора сравнения. В качестве раствора сравнения используют воду.
Содержание суммы дубильных веществ в пересчете на пирогаллол или (+)-катехин в абсолютно сухом лекарственном растительном сырье или лекарственном растительном препарате в процентах (X) вычисляют по формуле:
где:
А1 — оптическая плотность раствора А;
А2 — оптическая плотность раствора Б;
А3 — оптическая плотность раствора СО пирогаллола или (+)-катехина;
а — навеска лекарственного растительного сырья или лекарственного растительного препарата, г;
ао — навеска СО пирогаллола или (+)-катехина, г;
P — содержание основного вещества в СО пирогаллола или (+)-катехина, %;
W — влажность лекарственного растительного сырья или лекарственного растительного препарата, %.
Все синонимы в одной строке
биоиндикатор, бленкер, метилоранж, стрелка, указатель, ru.synonym.one, фенолфталеин, эозин, гелиантин, газоиндикатор, гидроиндикатор, глюкозан, диазобордо, дриллометр, казатель, лакмоид, люмогаллион, макроиндикатор, мессур, металлоиндикатор, металлфталеин, микроиндикатор, нейроиндикатор, нуль-индикатор, приемоиндикатор, телеиндикатор, ru.synonym.one, тиоацетамид, феноиндикатор, фенолрот, хинализарин, индекс, стрелочка, барометр, экран, щит, лицо, морда, пурген.
Понравился сайт?
Этот поиск занял 0.0064 сек. Подумайте, как часто вы ищете, чем заменить слово? Наверное, часто. Добавьте в закладки synonym.one, чтобы быстро находить синонимы, антонимы и значения. (нажмите Ctrl + D на клавиатуре).