Иммунопрофилактика инфекционных болезней представляет собой систему мероприятий, направленных на ограничение распространения и ликвидацию инфекционных болезней путем проведения профилактических прививок. Этот термин часто употребляется наряду с термином «вакцинопрофилактика», однако является более общим, поскольку вакцина представляет собой один из видов иммунобиологических лекарственных препаратов, применяемых при профилактических прививках. При этом большая часть профилактических прививок осуществляется с использованием вакцин, что и обусловливает одновременное использование данных понятий.
На протяжении всего своего существования человечество страдает от инфекционных заболеваний и борется с ними. Инфекция представляет собой проникновение во внутреннюю среду организма болезнетворных микроорганизмов. Они являются чужеродными по отношению к организму человека и вызывают изменения нормального функционирования органов и систем. Такие микроорганизмы называют патогенными.
Патогенность — это «способность возбудителя проникать в организм человека или животного, жить и размножаться в нем, вызывая морфологические и функциональные нарушения в органах и тканях макроорганизма, проявляющиеся как инфекционное заболевание».
Микроорганизмы могут быть патогенными, условно-патогенными и непатогенными для человека. При этом патогенные микроорганизмы составляют ничтожно малую долю по отношению к их общему числу. На процессы внедрения, существования и размножения патогенного микроорганизма, происходящие внутри человеческого организма, последний отвечает определенными приспособительными реакциями. Они, в свою очередь, обусловливают ответные реакции со стороны микроорганизма. Эта совокупность сложных взаимодействий микро- и макроорганизма представляет собой инфекционный процесс.
Пример одного из современных определений инфекции или инфекционного процесса: «комплекс взаимных приспособительных реакций в ответ на внедрение и размножение патогенного микроорганизма в макроорганизме, направленных на восстановление нарушенного гомеостаза и биологического равновесия с окружающей средой». Он протекает в определенных условиях внешней среды, ограничен во времени и может закончиться как освобождением организма человека от микроорганизма-возбудителя, так и гибелью человека.
Инфекционная болезнь представляет собой конкретную форму проявления инфекционного процесса, которая отражает степень его развития и имеет характерные признаки. Особенностью инфекционных заболеваний, обусловливающей их высокую опасность, является то, что они, в отличие от других, могут передаваться от зараженного человека или животного здоровому и способны к массовому (эпидемическому) распространению.
Определение инфекционных заболеваний закрепляет Федеральный закон от 30 марта 1999 г. №52-ФЗ «О санитарно-эпидемиологическом благополучии населения» — это инфекционные заболевания человека, возникновение и распространение которых обусловлено воздействием на человека биологических факторов среды обитания (возбудителей инфекционных заболеваний) и возможностью передачи болезни от заболевшего человека, животного к здоровому человеку. Чаще всего возбудителями инфекционных болезней являются бактерии и вирусы.
Не каждый микроорганизм, попадающий в организм человека, вызывает инфекционный процесс, и не всякий инфекционный процесс приводит к развитию заболевания. На возможность развития инфекционного заболевания и характер его течения оказывает влияние состояние человеческого организма и его функциональные и морфогенетические особенности.
Изучение устойчивости человека к инфекциям легло в основу такой науки, как иммунология (предмет которой на сегодняшний день гораздо шире), сформировавшейся в XIX веке. Для защиты от возбудителей инфекций организм человека наделен разнообразными (как врожденными, так и приобретенными) факторами защиты. Важнейшим из них является формирование иммунитета. На определенном этапе развития для защиты организма человека от агрессии (как внешней, так и внутренней) возникла иммунная система, регулирующая процессы иммунной защиты, в том числе и от инфекций. Ее функционирование позволяет предупредить, а в случае возникновения — преодолеть инфекционный процесс.
В зависимости от возникновения иммунитет бывает врожденным (естественным) и приобретенным. Врожденный иммунитет является неспецифическим, он запускается моментально при попадании возбудителя инфекции в организм и обеспечивает противодействие ему до того момента, пока не начнут действовать более сложные специфические механизмы защиты. Большая часть возбудителей разрушается на этом этапе.
Приобретенный иммунитет также бывает двух видов: естественным и искусственным, а каждый из них в свою очередь — активным и пассивным. Естественный активный (постинфекционный) иммунитет формируется после того, как человек переболел каким-либо инфекционным заболеванием, и защищает организм при повторной встрече с тем же патогенным микроорганизмом. Такой иммунитет действует длительное время.
Пассивный естественный иммунитет создается, в первую очередь, при получении новорожденным от матери готовых антител, обусловливающих устойчивость организма ребенка к ряду инфекций. Готовые антитела могут быть введены в организм человека и в дальнейшем, например в виде иммунных сывороток. Такой иммунитет называется искусственным пассивным, он формируется очень быстро, но действует недолго.
И, наконец, активный искусственный иммунитет создается посредством вакцинации человека, начиная с младенческого возраста. При вакцинации в организме образуются собственные специфические антитела, благодаря чему формируется устойчивость против определенных видов и форм инфекционных возбудителей. Так, главным образом, и осуществляется иммунная профилактика инфекционных заболеваний.
На сегодняшний день массовая иммунопрофилактика является признанным методом борьбы с инфекционными болезнями, часть из которых уже удалось победить благодаря ей. Поэтому создание системы предупреждения инфекционных болезней и устранения факторов риска является важнейшей социально-экономической и медицинской задачей государства.
Иммунопрофилактика как объект государственного управления и регулирования представляет собой как социально-экономическую деятельность государства, так и систему медико-санитарных мероприятий, осуществляемых организациями здравоохранения, направленных на обеспечение высокого уровня здоровья граждан путем предупреждения, ограничения распространения и ликвидации инфекционных болезней.
В соответствии с этим мероприятия по профилактике инфекционных болезней можно условно разделить на две большие группы — общие и специальные.
К общим относятся государственные мероприятия, направленные на повышение материального благосостояния населения, улучшение качества медицинского обслуживания и обеспечения, условий труда и отдыха, а также санитарно-технические, агролесотехнические, гидротехнические и мелиоративные мероприятия, что в совокупности обеспечивает достижение целей профилактики и ликвидации инфекционных болезней.
Специальными являются профилактические мероприятия, проводимые медицинскими работниками с целью создания невосприимчивости населения к той или иной инфекции путем профилактических прививок (сюда и относится иммунопрофилактика).
При планировании и проведении профилактических мероприятий их традиционно разделяют на три группы:
— мероприятия в отношении источника инфекции, направленные на его обезвреживание (или устранение);
— мероприятия в отношении механизма передачи, проводимые с целью разрыва путей передачи;
— мероприятия по повышению невосприимчивости населения (вакцинация).
Вакцинация является одним из фундаментальных методов современной иммунопрофилактики. Значение профилактических прививок заключается в снижении заболеваемости среди привитых, а в случае их заболевания — в более легком его течении и тем самым снижении летальности.
Профилактические прививки — введение в организм человека иммунобиологических лекарственных препаратов для иммунопрофилактики в целях создания специфической невосприимчивости к инфекционным болезням.
Защитная реакция организма в отношении чужеродных микроорганизмов может быть как неспецифической, так и специфической. Неспецифическая составляющая иммунных процессов формируется вне зависимости от вида и типа агрессора в ходе естественного развития организма, такие механизмы являются естественными факторами иммунитета.
В отличие от неспецифической, специфическая составляющая иммунитета вырабатывается в процессе взаимодействия с антигенами и направлена против конкретных агрессоров. Именно для создания специфического иммунитета и проводятся профилактические прививки. При этом действует следующий механизм: в организм человека вводится иммунобиологический лекарственный препарат, который содержит антиген возбудителей в очень малых дозах либо ослабленный (аттенуированный) или убитый инфекционный агент. В ответ на это в иммунной системе человека вырабатываются антитела против данного возбудителя. Они могут сохраняться в организме длительное время, способствуя уничтожению возбудителей заболеваний, против которых проводилась прививка. В результате этого в случае повторной встречи возбудителя заболевания с организмом болезнь не развивается.
Такие прививки являются профилактическими, поскольку направлены на предупреждение возможных заболеваний, вызываемых патогенными микроорганизмами.
Прививки могут осуществляться различными методами: внутрикожным, подкожным, внутримышечным, накожным, аэрозольным, пероральным. Основными являются подкожный и внутримышечный методы. Внутрикожный метод производится при введении вакцины БЦЖ, пероральный — при вакцинации против полиомиелита.
Иммунобиологические лекарственные препараты для иммунопрофилактики (ИБЛП), ранее использовался термин «медицинские иммунобиологические препараты» (МИБП), — это лекарственные средства, предназначенные для создания у человека специфической невосприимчивости к инфекционным болезням.
Определение лекарственных средств содержится в Федеральном законе от 12 апреля 2010 г. №61-ФЗ «Об обращении лекарственных средств» — это вещества или их комбинации, вступающие в контакт с организмом человека или животного, проникающие в органы, ткани организма человека или животного, применяемые для профилактики, диагностики (за исключением веществ или их комбинаций, не контактирующих с организмом человека или животного), лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности и полученные из крови, плазмы крови, из органов, тканей организма человека или животного, растений, минералов методами синтеза или с применением биологических технологий. К лекарственным средствам относятся фармацевтические субстанции и лекарственные препараты. Данный Закон определяет, что к иммунобиологическим лекарственным препаратам относятся лекарственные препараты биологического происхождения, предназначенные для иммунологической диагностики, профилактики и лечения заболеваний.
Иммунобиологические лекарственные препараты для иммунопрофилактики являются одной из разновидностей иммунобиологических лекарственных препаратов, что определяется сферой их деятельности — это исключительно иммунопрофилактика инфекционных заболеваний.
Иммунобиологические препараты — это биологически активные вещества, которые вызывают состояние иммунологической защиты, изменяют функции иммунной системы либо необходимы для диагностических целей.
В комментируемом Законе указано, что к ним относятся вакцины, анатоксины, иммуноглобулины и прочие лекарственные средства, предназначенные для указанных целей. Письмо Министерства здравоохранения РФ от 24 февраля 2000 г. №1100/474-0-113 содержит подробный перечень видов иммунобиологических препаратов.
Иммунобиологические препараты можно классифицировать следующим образом, учитывая их механизм действия и природу :
— вакцины (живые и убитые), а также другие препараты, приготовленные из микроорганизмов или их компонентов и производных;
— иммуноглобулины и иммунные сыворотки;
— иммуномодуляторы;
— диагностические препараты.
В зависимости от своего вида, способа изготовления, целей применения они могут проявлять активное или пассивное, специфическое или неспецифическое действие на иммунитет человека.
Вакцины являются наиболее распространенным и широко применяющимся видом иммунобиологических препаратов. Они получаются из ослабленных или убитых микроорганизмов, их производных или из их антигенов, полученных генно-инженерным или химическим путем. Вакцины содержат антиген микроорганизма — возбудителя заболевания, а также другие вещества: стабилизаторы, консерванты, адъюванты (вещества, усиливающие иммунный ответ). Они предназначены для создания специфической составляющей активного иммунитета.
В зависимости от того, какое действующее начало используется в вакцинах и каким способом оно получено, их подразделяют на различные типы. Например, выделяют живые вакцины, убитые (инактивированные) вакцины, рекомбинантные вакцины и др.
Живые вакцины называются так, поскольку содержат живой ослабленный микроорганизм. Они применяются против кори, гриппа, бруцеллеза, полиомиелита, туберкулеза, чумы и т.д.
Внимание!
Информация исключительно для работников здравоохранения.
Являетесь ли Вы специалистом здравоохранения?
Интерфероны
- Интерфероны в комбинациях
- Выбор препаратов
- Синонимы
- МИБП (медицинские иммунобиологические препараты) — противовирусное и противоопухолевое средство
- Цитокин
- Цитокин. Средство для лечения рассеянного склероза
- МИБП (медицинские иммунобиологические препараты)-противовирусное и противоопухолевое средство
- Цитокины
- МИБП (медицинские иммунобиологические препараты)
- Цитокин — противовирусное, иммуномодулирующее средство
Подобрать препарат можно с помощью фильтров. Чтобы увидеть в перечне лекарства, входящие в подгруппы, отметьте галочкой «включить препараты подгрупп». Нажав на иконку , можно добавить препарат в избранное и проверить на дубли и межлекарственные взаимодействия.
Полужирным начертанием выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан еженедельный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
Внимание!
Информация исключительно для работников здравоохранения.
Являетесь ли Вы специалистом здравоохранения?
Наш сайт использует файлы cookie, чтобы улучшить работу сайта, повысить его эффективность и удобство. Продолжая использовать сайт rlsnet.ru, вы соглашаетесь с условиями использования файлов cookie.
Роза Ягудина о том, что нужно учитывать в вопросе заменяемости лекарственных средств
Досье КС
Роза Исмаиловна Ягудина, доктор фармацевтических наук, профессор, зав. кафедрой организации лекарственного обеспечения и фармакоэкономики, зав. лабораторией фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова (Москва), главный редактор журналов «Фармакоэкономика» и «Современная организация лекарственного обеспечения».
Дженерики — это актуально
Замена оригинального препарата на дженерик, подбор аналогов лекарств — очень частая ситуация в аптеке. Это происходит и из‑за того, что нужного препарата не оказывается на полке, и из‑за того, что пациентпросит произвести замену препаратов на более дешевые аналоги. Сэкономить деньги дженерики помогают не только пациентам, но и системе здравоохранения в целом. Цена на воспроизведенное лекарственное средство может быть ниже стоимости оригинального почти на 80 %. Это заставило некоторые страны внимательно отнестись к вопросам генерической замены. США, Канада, Германия, Великобритания и еще ряд стран Европейского союза объявили о том, что увеличение доли дженериков в общей структуре потребления лекарственных средств является стратегической задачей. Мировое потребление дженериков постоянно растет. По данным IMS Health, в период c 2005 по 2010 г. оно выросло с 124 до 234 миллиардов долларов США. По прогнозам компании, к 2015 г. потребление дженериков возрастет еще почти в два раза и составит 400–430 млрд долларов США.
В связи с такой растущей значимостью дженериков особенно остро встает вопрос о том, во всех ли случаях оригинальный препарат может быть заменен на генерический без ущерба для процесса лечения. Существует ряд исследований, которые показывают, что в некоторых случаях в отношении отдельных препаратов такая замена нерациональна. Еще более остро стоит вопрос о возможности взаимозаменяемости биотехнологических препаратов. В ближайшие несколько лет заканчивается срок патентной защиты для целого ряда биотехнологических препаратов и на рынок будут выведены их воспроизведенные версии — биосимиляры (см. публикацию «Биосимиляры: новая группа лекарственных средств и проблема идентичности» в КС № 3 (116), 2013, — прим. авт.). Однако уже сегодня известно, что биосимиляры не всегда являются полностью биоэквивалентными оригинальным препаратам. При этом вопрос взаимозаменяемости биотехнологических препаратов актуален не только в ракурсе «оригинальный — биосимиляр», но и между самими биосимилярами тоже. В связи с этим для практикующих провизоров и фармацевтов очень важно знать, на основании каких документов и рекомендаций принимать решения при синонимической замене биосимиляров, а также других препаратов.
Взаимозаменяемость и замещаемость лекарств — в чем разница
Замена лекарств аналогами может происходить по разным причинам и описываться различными терминами. В частности, врач может заменить один препарат другим препаратом того же класса — это терапевтическая замена, которая может быть произведена только специалистом-медиком. В аптеке, без консультации с врачом, может происходить замена одной лекарственной формы на другую, замена оригинального препарата на дженерик или одного дженерика — на другой в рамках одного международного непатентованного названия (МНН). Во всех перечисленных случаях специалисту аптеки необходимы данные о взаимозаменяемости препарата.
В зарубежных источниках взаимозаменяемость (interchangeability) понимают как медицинскую или фармацевтическую практику перехода с одного лекарственного средства на другое, эквивалентное ему при одинаковых показаниях. А термин замещаемость (substitution or substitutability) относится к аптечной практике и характеризует замену в аптеке одного лекарственного средства на другое эквивалентное и взаимозаменяемое лекарственное средство без требования консультации с врачом, назначившим препарат. Законодательное регулирование замещения в разных странах различается.
В отечественной практике понятия взаимозаменяемости и замещаемости законодательно не закреплены. Сейчас готовятся поправки к Федеральному закону «Об обращении лекарственных средств», в том числе предполагается внесение в закон понятия о взаимозаменяемом лекарственном препарате. На сегодняшний день предлагается следующая трактовка этого термина:
«Взаимозаменяемый лекарственный препарат — лекарственный препарат с доказанной терапевтической эквивалентностью в отношении оригинального лекарственного препарата или, в случае его отсутствия в обращении, в отношении препарата сравнения, применяемый по одним и тем же показаниям, имеющий одинаковый качественный и количественный состав действующих веществ, а также лекарственную форму, дозировку и способ введения».
(Проект ФЗ
«О внесении изменений в Федеральный закон
«Об обращении лекарственных средств»
от 11 марта 2013 г.)
Следует отметить, что в предыдущей версии поправок в ФЗ «Об обращении лекарственных средств» предлагалась несколько иная трактовка понятия взаимозаменяемость:
«Взаимозаменяемый лекарственный препарат — лекарственный препарат, не являющийся биологическим лекарственным препаратом, с доказанной терапевтической эквивалентностью в отношении оригинального лекарственного препарата или, в случае его отсутствия в обращении, в отношении препарата сравнения, применяемый по одним и тем же показаниям, имеющий одинаковый качественный и количественный состав действующих веществ, а также лекарственную форму, дозировку и способ введения».
(Проект ФЗ
«О внесении изменений в Федеральный закон
«Об обращении лекарственных средств»
от 21 января 2013 г.)
Казалось бы — небольшая разница в понятиях. Но на самом деле эта разница (имеется в виду исключение возможности взаимозаменяемости биологических лекарственных препаратов) имеет очень важное значение, в том числе и в сфере государственных закупок. Учитывая, что многие биологические лекарственные препараты входят в различные программы финансирования и государство инвестирует большие средства в бесплатное обеспечение населения этой группой препаратов, данный вопрос находится в центре активных дискуссий фармацевтического сообщества.
Каким в итоге будет понятийный аппарат в законе, покажет время, однако уже сегодня можно определить ключевые вопросы, которые встают перед специалистом аптеки при необходимости заменить оригинальный препарат на дженерик или биосимиляр.
Взаимозаменяемость лекарств: дженерики и биосимиляры
Отдельного рассмотрения требуют два вопроса — взаимозаменяемость оригинальных препаратов и дженериков, а также оригинальных биотехнологических препаратов и биосимиляров.
Дженерики
В России дженериком признается препарат, который обладает фармацевтической (химической) эквивалентностью и биоэквивалентностью (ФЗ № 61 «Об обращении лекарственных средств»). Фармацевтическая эквивалентность подразумевает, что дженерик эквивалентен оригинальному препарату по составу активных веществ, по силе действия или концентрации активных веществ, по идентичности лекарственных форм, по способу введения. Биоэквивалентность означает эквивалентность по фармакокинетическим параметрам. Два препарата признаются биоэквивалентными, если они обладают одинаковой степенью и скоростью всасывания, распределения и вывода лекарственного средства из организма.
Казалось бы, при фармацевтической и биологической эквивалентности препараты должны быть идентичными по своему воздействию на пациента. Однако существуют исследования, показывающие, что это так не во всех случаях. Например, в 2000 г. было опубликовано исследование авторов С. В. Недогода, И. В. Марченко, Т. А. Чаляби, в котором изучалась клиническая эффективность четырех генерических эналаприлов от известных производителей. Исследование показало, что эффективность по достижению целевого уровня артериального давления у исследуемых препаратов была ниже, чем у оригинального препарата, хотя все анализируемые дженерики были биоэквивалентны оригиналу. В итоге был сделан вывод о различной терапевтической эквивалентности воспроизведенных препаратов эналаприла.
Поскольку дженерики и оригинальные препараты могут быть различными по своему терапевтическому воздействию, в некоторых странах не все генерические препараты считаются взаимозаменяемыми. Например, в США еще с 1984 года дженерики признаются терапевтически эквивалентными только в том случае, если они фармацевтически эквивалентны друг другу и в равных дозах оказывают одинаковое действие с равной выраженностью побочных эффектов у одинаковых пациентов. Управление по контролю за пищевыми продуктами и лекарственными препаратами США (FDA) ежегодно издает перечень одобренных к применению препаратов с доказанной терапевтической эквивалентностью — «Оранжевую книгу» (Orange-book). В этом издании не все лекарства, выпущенные в рамках одного МНН, признаются взаимозаменяемыми. Например, в соответствии с 32‑м изданием «Оранжевой книги» (2012 г.) флуконазол нескольких компаний не был признан как терапевтически эквивалентный, а значит — взаимозаменяемый. Дженерики, которые FDA признает терапевтически эквивалентными оригинальному лекарственному средству, автоматически считаются взаимозаменяемыми. Однако в некоторых штатах США могут действовать отдельные ограничения на замену лекарственных препаратов с узким терапевтическим индексом, даже если в «Оранжевой книге» они признаны терапевтически эквивалентными. Например, это сердечные гликозиды, иммунодепрессанты, противоэпилептические лекарственные средства.
Сегодня в странах Европейского союза, в США и в других странах разрешено замещение оригинальных препаратов дженериками. При этом в некоторых странах Евросоюза системой здравоохранения даже предусмотрено автоматическое замещение. Оно подразумевает, что при наличии в аптеке хотя бы одного дженерика, провизор обязан заменить им оригинальный препарат, выписанный врачом. В некоторых штатах США также действует система автоматического замещения, учитывающая рекомендации «Оранжевой книги».
Биосимиляры
Согласно современным исследованиям, произвести биотехнологический аналог, полностью аналогичный оригинальному препарату, достаточно непросто в связи с тем, что биотехнологические препараты представляют собой молекулу очень большого размера, имеющую сложную пространственную конфигурацию, и точно воспроизвести ее не всегда возможно. По этой причине за рубежом признается, что биосимиляры и оригинальные препараты не во всех случаях взаимозаменяемы и их замена осуществляется врачом, а не фармацевтом: «Так как биосимиляр подобен, но не идентичен оригинальному биотехнологическому лекарственному средству, решение о лечении биосимиляром должно приниматься с опорой на мнение врача», — (European Medicines Agency. Q&A document EMEA/74 562/2006 (Rev.1 22 October 2008)). Управление по контролю за пищевыми продуктами и лекарственными препаратами США (FDA) признает биосимиляр взаимозаменяемым, если он биоподобен оригинальному препарату; демонстрирует аналогичные результаты при применении у любого выбранного пациента; показывает тот же уровень безопасности и эффективности, что и оригинальное лекарственное средство.
Получение разрешения для вывода биосимиляра на фармацевтический рынок не гарантирует взаимозаменяемости.
Сегодня для снижения затрат правительства многих стран заинтересованы в широком применении биосимиляров при лечении пациентов. Однако эксперты системы здравоохранения отмечают, что возможное снижение затрат все же не должно служить поводом для того, чтобы разрешать автоматическую замену в аптеках оригинальных препаратов на биосимиляры. По мнению ВОЗ разрешение автоматического замещения оригинального биотехнологического лекарственного средства на биоподобные лекарственные средства должно приниматься на национальном уровне, с учетом профиля безопасности лекарства, а также с учетом научных и клинических данных. Во многих странах оригинальные биотехнологические лекарственные средства и биосимиляры не являются взаимозаменяемыми и выписываются по торговому названию, а не по МНН (Великобритания, Голландия, Польша, Дания, Норвегия, Австрия, Словакия, Франция и др.). В Японии действует схожее с европейским законодательство, регулирующее вопросы обращения биоподобных лекарственных средств и их взаимозаменяемость.
Сегодня необходимо создание руководств во всех странах мира по определению взаимозаменяемости биоподобных лекарственных средств на законодательном уровне. В России также планируется создание подобного документа. В частности, планируется создание перечня взаимозаменяемых лекарственных средств.
Дженерик (генерик) (в российском законодательстве этому термину соответствует синонимичное понятие — воспроизведенное лекарственное средство) — это лекарственное средство, содержащее такую же фармацевтическую субстанцию или комбинацию таких же фармацевтических субстанций в такой же лекарственной форме, что и оригинальное лекарственное средство, и поступившее в обращение после поступления в обращение оригинального лекарственного средства (ФЗ № 61 от 12 апреля 2010 г. «Об обращении лекарственных средств»).
Оригинальное лекарственное средство — лекарственное средство, содержащее впервые полученную фармацевтическую субстанцию или новую комбинацию фармацевтических субстанций, эффективность и безопасность которых подтверждены результатами доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов (ФЗ № 61 от 12 апреля 2010 г. «Об обращении лекарственных средств»).
Биотехнологические лекарственные средства — иммунобиологические лекарственные средства, произведенные с помощью генной инженерии (документы Европейского медицинского агентства, EMA — European Medicines Agency). В российском законодательстве отсутствует определение биотехнологического лекарственного средства. В законе имеется лишь определение иммунобиологических препаратов.
Иммунобиологические лекарственные препараты — лекарственные препараты биологического происхождения, предназначенные для иммунологических диагностики, профилактики и лечения заболеваний (ФЗ № 61 от 12 апреля 2010 г. «Об обращении лекарственных средств»).
Биосимиляр — это биотехнологическое лекарственное средство, схожее с произведенным впервые оригинальным лекарственным средством и представленное на регистрацию после истечения срока действия патента оригинального препарата (Директива Евросоюза 2003 года.). В российском законодательстве понятие биосимиляра в настоящее время отсутствует. Однако, понятие биоаналогичного (биоподобного) включено в текст поправок.
Биоаналоговое (биоподобное) лекарственное средство (биоаналог) — биологическое лекарственное средство, схожее с оригинальным биологическим лекарственным средством по технологии производства, фармацевтической субстанции (комбинации фармацевтических субстанций), лекарственной форме, показаниям к применению и поступившее в обращение с соблюдением интеллектуальных прав на оригинальное лекарственное средство (Проект ФЗ «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» и в статью 333.32.1. части второй Налогового кодекса Российской Федерации»).
Замена лекарства в аптеке
С 1 июля 2013 года вступает в силу Приказ Минздрава РФ от 20 декабря 2012 г. № 1175н «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения». После этого во всех рецептах врачи будут указывать только МНН. Что это означает для специалистов аптек?
После вступления приказа в силу на плечи аптечных работников ложится ответственность по выбору лекарственного средства в рамках одного МНН. Рекомендация провизора будет являться одним из ключевых факторов при выборе лекарственных препаратов пациентом. Исследовательская компания Synovate Comcon в 2010 году опубликовала результаты опроса пациентов, показавшие, что среди факторов, влияющих на выбор препарата посетителем аптеки, на третьем месте (после рекомендации врача и наличия скидок) стоит рекомендация аптечного работника.
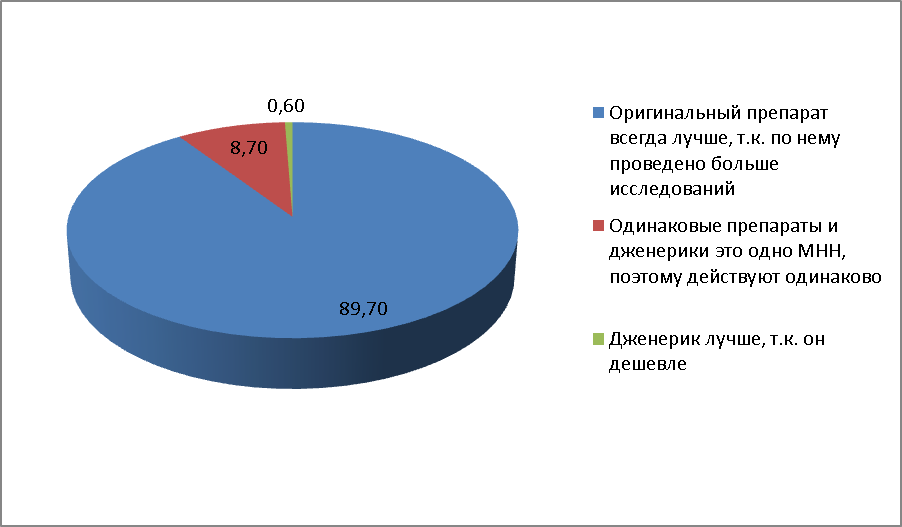
В 2011 году той же компанией было опубликовано исследование, как фармацевты и провизоры относятся к оригинальным препаратам и дженерикам. Исследование показало: 89,7 % опрошенных считают, что оригинальный препарат всегда лучше, чем дженерик, поскольку по нему проведено больше исследований. Лишь 8,7 % опрошенных сообщили, что оригинальные препараты и дженерики действуют одинаково, поскольку выпущены в рамках одного МНН. Наконец, 0,6 % опрошенных считают, что дженерик лучше, поскольку дешевле.
Несмотря на такое отношение к оригинальным препаратам и дженерикам, сотрудники аптек регулярно сталкиваются с необходимостью рекомендовать тот или иной дженерик. Это происходит, когда нужное лекарственное средство отсутствует в аптеке и когда тот или иной препарат недоступен пациенту по цене. Каким образом действовать специалисту аптеки при выборе нужного препарата?
Шаг 1. Экспертиза рецепта. В первую очередь специалист должен провести экспертизу рецепта. Если рецепт оформлен неправильно, то он остается в аптеке и погашается штампом «Рецепт недействителен», Также специалист аптеки проводит проверку совместимости, дозировок и лекарственной формы препарата в соответствии с принципами фармакологии, фармацевтической технологии и фармацевтической химии.
Шаг 2. Отпуск препарата. Дальнейшие действия зависят от того, как выписан рецепт. Если в нем указан конкретный препарат, то специалисту аптеки остается только отпустить этот препарат или, при отсутствии нужного препарата, предложить синонимическую замену, другую лекарственную форму или препарат с другой дозировкой. Отпуск производится с обязательной консультацией пациента о правилах приема лекарственного средства. На обороте рецепта следует указать торговое наименование отпущенного лекарственного препарата, поставить подпись и дату отпуска.
Если же пациент принес рецепт, в котором указано МНН, то провизор должен предложить ему на выбор имеющиеся аналоги и синонимы лекарственных препаратов. При этом нужно учесть несколько принципов.
Во-первых, при выборе одного из синонимов может возникнуть ситуация, когда пациент приобретет препарат с другой дозировкой. В этом случае его необходимо предупредить, каким образом принимать препарат, чтобы соблюсти прописанную врачом дозировку.
Во-вторых, при рекомендации того или иного препарата необходимо учесть платежеспособность пациента. Если для него необходимо приобрести препарат по максимально сниженной цене, то желательно провести экспресс-оценку стоимости синонимов и предложить пациенту тот препарат, курс лечения которым будет стоить дешевле всего.
В-третьих, если у пациента нет предпочтений в выборе из нескольких лекарственных средств с одинаковым составом, формой выпуска, дозировкой и незначительными различиями в цене, то приоритет отдается тому препарату, который пациент принимал ранее (при хроническом заболевании), или препарату, который дольше других находится на фармацевтическом рынке и доказал свою эффективность и безопасность в повседневной практике.
При выборе того или иного препарата специалиста аптеки могут ждать «подводные камни». В частности, необходимо быть внимательным при рекомендации «фармацевтических альтернатив» (по определению FDA) — это препараты, которые содержат одинаковые терапевтические компоненты, но различаются по виду солей, эфиров или комплексам этих компонентов. Они могут иметь различную дозировку и силу действия. Также к фармацевтическим альтернативам относятся лекарственные средства с замедленным высвобождением по сравнению с лекарственными средствами, обладающими ускоренным или «нормальным» высвобождением.
«Альтернативы» могут оказывать на организм пациента различное действие, поэтому провизор должен не только знать, но и учитывать показания и противопоказания таких препаратов. Например, натриевая, калиевая и прокаиновая соли имеют одинаковое фармакологическое действие, фармакокинетику, показания к применению, взаимодействие и режим дозирования. Однако они различаются по дозам применения, побочным действиям и противопоказаниям. Например, натриевая соль противопоказана при эпилепсии (для эндолюмбального введения), калиевая соль — при гиперкалиемии, аритмии, а прокаиновая соль не имеет таких противопоказаний.
Для обеспечения полной безопасности пациентов при замене препаратов в аптеке важна разработка рекомендаций по взаимозаменямости препаратов. Кроме того, принципиальное значение имеет квалифицированный и ответственный подход специалистов аптеки к консультированию пациентов, приобретающий еще большее значение с введением выписки рецептов по международному непатентованному названию.
Статья написана по материалам:
Ягудина Р. И., Аринина Е. Е., Кондратьева Б. Б. «Взаимозаменяемость и замещаемость лекарственных средств»//«Современная организация лекарственного обеспечения» № 1/2013
Для контроля температурного режима используются также термоиндикаторы на флаконах (ФТИ). Они представляют собой наклейки из термочувсвительного материала, которые наносятся на первичную или вторичную упаковку ИЛП производителем.
Если же термоконтейнер снабжен терморегистратором, то необходимо распечатать его показания или скопировать данные на компьютер для дальнейшей распечатки и сохранения информации.
Если показания терморегистраторов или термоиндикаторов говорят о нарушении температурного режима при транспортировании, то сотрудник аптеки, осуществляющий приемочный контроль ИЛП должен доложить об этом руководителю, комиссия по приемке составляет акт о нарушении температурного режима, руководитель принимает решение об отказе в получении ИЛП. Дальнейший порядок возврата определяется условиями договора с поставщиком.
Если необходимые условия хранения подтверждены при транспортировке, то ИЛП выгружают из контейнеров и размещают в холодильниках в течение 10 минут. При приемочном контроле ИЛП, как и всех других ЛП, проверяют соответствие поступивших ИЛП данным в товарно-сопроводительных документах (наименование, количество, серии, сроки годности). Не допускается отгрузка ИЛП на третий уровень «холодовой цепи» (в аптеки) со сроком годности менее четырех месяцев (п. 8.10.3 СП 3.3.2.3332-16). Кроме того, необходимо проверить наличие поступивших ИЛП в базе данных Росздравнадзора о приостановленных или изъятых из обращения ЛП (электронный сервис «Поиск изъятых из обращения лекарственных средств» на сайте Росздравнадзора). Далее проводят визуальный осмотр поступивших ИЛП, проверяют целостность упаковки, соответствие маркировки, а также наличие сведений о документах, подтверждающих соответствие данных ИЛП.
В соответствии с пунктом 12 «Правил продажи отдельных видов товаров…», утвержденных Постановлением правительства РФ от 19.01.1998г. № 55, в товарно-сопроводительных документах указываются сведения о декларации о соответствии (регистрационный № декларации, срок её действия, наименование организации, принявшей декларацию, орган, её зарегистрировавший) или о сертификате соответствия (номер, срок его действия, орган, выдавший сертификат). Соответствие ИЛП в данный момент согласно Постановлению Правительства от 01.12.2009 г. № 982 «Об утверждении единого перечня продукции, подлежащей обязательной сертификации, и единого перечня продукции, подтверждение соответствия которой осуществляется в форме принятия декларации о соответствии» подтверждается декларацией или сертификатом в зависимости от группы ИЛП.
С 29.11.2019 г. отменяется обязательное подтверждение соответствия лекарственных препаратов, в том числе ИЛП, в форме декларирования/ сертификации (согласно федеральному закону от 28.11.2018 № 449-ФЗ). После 29.11.2019 г. ИЛП будут поступать в обращение после принятия Росздравнадзором разрешения о вводе ИЛП в гражданский оборот (статья 52.1 федерального закона от 12.04.2010г. № 61-ФЗ «Об обращении лекарственных средств»). Информация о сериях ИЛП, введенных в гражданский оборот будет публиковаться на сайте Росздравнадзора. Серии ИЛП, выпущенные до 29.11.2019 г., должны поступать в обращение с сертификатом или декларацией о соответствии.
При несоответствии поступивших ИЛП показателям приемочного контроля, их перемещают в карантинную зону, выделенную в холодильнике, и возвращают поставщику или передают на уничтожение.
Если поступившие ИЛП соответствуют установленным требованиям, то сотрудник, ответственный за «холодовую цепь» в аптеке регистрирует поступление ИЛП в Журнале учета движения ИЛП (Приложение 3 к СП 3.3.2.3332-16). В этот же журнал заносятся данные термоиндикаторов, которые использовались при транспортировке, и их показания («норма»).