холекальциферол
- холекальциферол
-
- холекальциферол
-
сущ.
, кол-во синонимов: 2
Словарь синонимов ASIS.
.
2013.
.
Синонимы:
Смотреть что такое «холекальциферол» в других словарях:
-
холекальциферол — холекальциферол … Орфографический словарь-справочник
-
Холекальциферол — … Википедия
-
холекальциферол — Витамин D3 [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN cholecalciferol … Справочник технического переводчика
-
холекальциферол — (cholecaiciferolum; син. витамин D3) жирорастворимый витамин, источником которого для человека являются печень млекопитающих, птиц и рыб, а также яичный желток и рыбий жир; при недостатке X. в пище у детей возникает рахит, а у взрослых остеопороз … Большой медицинский словарь
-
Холекальциферол — то же, что витамин D3; см. Витамины, Кальциферолы … Большая советская энциклопедия
-
ХОЛЕКАЛЬЦИФЕРОЛ — холекальциферол, витамин D3, антирахитичный жирорастворимый витамин. Образуется в коже животных при солнечном облучении из 7 дегидрохолестерина. Оказывает такое же действие, что и эргокальциферол … Ветеринарный энциклопедический словарь
-
холекальциферол — у, ч. Жиророзчинний вітамін, при нестачі якого в їжі в дітей виникає рахіт, а в дорослих – остеопороз, м язові болі, парестезії … Український тлумачний словник
-
Холекальциферол — (cholecalciferolum) – витамин, синтезирующийся в организме животных под влиянием ультрафиолетового облучения, участвует в регуляции минерального, энергетического обмена влияет на использование фосфора из зерновых кормов, трудноусвояемых животными … Словарь терминов по физиологии сельскохозяйственных животных
-
Холекальциферол (Cholecalciferol) — см. витамин D. Источник: Медицинский словарь … Медицинские термины
-
Колекальциферол — Холекальциферол (Cholecalciferolum) Химическое соединение … Википедия
From Wikipedia, the free encyclopedia
 |
|
 |
|
| Clinical data | |
|---|---|
| Pronunciation | |
| Other names | vitamin D3, activated 7-dehydrocholesterol |
| AHFS/Drugs.com | Professional Drug Facts |
| License data |
|
| Routes of administration |
By mouth, intramuscular injection |
| ATC code |
|
| Legal status | |
| Legal status |
|
| Identifiers | |
|
IUPAC name
|
|
| CAS Number |
|
| PubChem CID |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| KEGG |
|
| ChEBI |
|
| ChEMBL |
|
| CompTox Dashboard (EPA) |
|
| ECHA InfoCard | 100.000.612 |
| Chemical and physical data | |
| Formula | C27H44O |
| Molar mass | 384.648 g·mol−1 |
| 3D model (JSmol) |
|
| Melting point | 83 to 86 °C (181 to 187 °F) |
| Boiling point | 496.4 °C (925.5 °F) |
| Solubility in water | Practically insoluble in water, freely soluble in ethanol, methanol and some other organic solvents. Slightly soluble in vegetable oils. |
|
SMILES
|
|
|
InChI
|
Cholecalciferol, also known as vitamin D3 and colecalciferol, is a type of vitamin D that is made by the skin when exposed to sunlight; it is found in some foods and can be taken as a dietary supplement.[1]
Cholecalciferol is made in the skin following UVB light exposure.[2] It is converted in the liver to calcifediol (25-hydroxyvitamin D) which is then converted in the kidney to calcitriol (1,25-dihydroxyvitamin D).[2] One of its actions is to increase calcium uptake by the intestines.[3] It is found in food such as some fish, beef liver, eggs, and cheese.[4][5] Plants, cow milk, fruit juice, yogurt, and margarine also may have cholecalciferol added to them in some countries, including the United States.[4][5]
Cholecalciferol can be taken as an oral dietary supplement to prevent vitamin D deficiency or as a medication to treat associated diseases, including rickets.[6][7] It is also used for familial hypophosphatemia, hypoparathyroidism that is causing low blood calcium, and Fanconi syndrome.[7][8] Vitamin-D supplements may not be effective in people with severe kidney disease.[9][8] Excessive doses in humans can result in vomiting, constipation, weakness, and confusion.[3] Other risks include kidney stones.[9] Doses greater than 40,000 IU (1,000 μg) per day are generally required before high blood calcium occurs.[10] Normal doses, 800–2000 IU per day, are safe in pregnancy.[3]
Cholecalciferol was first described in 1936.[11] It is on the World Health Organization’s List of Essential Medicines.[12] In 2020, it was the 60th most commonly prescribed medication in the United States, with more than 11 million prescriptions.[13][14] Cholecalciferol is available as a generic medication and over the counter.[8][15][16]
Medical uses[edit]
Cholecalciferol appears to stimulate the body’s interferon type I signaling system that protects against bacteria and viruses, unlike Vitamin D2.[17]
Vitamin D deficiency[edit]
Cholecalciferol is a form of vitamin D which is naturally synthesized in skin and functions as a pro-hormone, being converted to calcitriol. This is important for maintaining calcium levels and promoting bone health and development.[2] As a medication, cholecalciferol may be taken as a dietary supplement to prevent or to treat vitamin D deficiency. One gram is 40,000,000 (40×106) IU, equivalently 1 IU is 0.025 μg or 25 ng. Dietary reference intake values for vitamin D (cholecalciferol and/or ergocalciferol) have been established and recommendations vary depending on the country:
- In the US: 15 μg/d (600 IU per day) for all individuals (males, females, pregnant/lactating women) between the ages of 1 and 70 years old, inclusive. For all individuals older than 70 years, 20 μg/d (800 IU per day) is recommended.[18]
- In the EU (except France): 20 μg/d (800 IU per day)
- In France: 25 μg/d (1000 IU per day)
Low levels of vitamin D are more commonly found in individuals living in northern latitudes, or with other reasons for a lack of regular sun exposure, including being housebound, frail, elderly, obese, having darker skin, or wearing clothes that cover most of the skin.[19][20] Supplements are recommended for these groups of people.[20]
The Institute of Medicine in 2010 recommended a maximum uptake of vitamin D of 4,000 IU/day, finding that the dose for lowest observed adverse effect level is 40,000 IU daily for at least 12 weeks,[21] and that there was a single case of toxicity above 10,000 IU after more than 7 years of daily intake; this case of toxicity occurred in circumstances that have led other researchers to dispute it as a credible case to consider when making vitamin D intake recommendations.[21] Patients with severe vitamin D deficiency will require treatment with a loading dose; its magnitude can be calculated based on the actual serum 25-hydroxy-vitamin D level and body weight.[22]
There are conflicting reports concerning the relative effectiveness of cholecalciferol (D3) versus ergocalciferol (D2), with some studies suggesting less efficacy of D2, and others showing no difference. There are differences in absorption, binding and inactivation of the two forms, with evidence usually favoring cholecalciferol in raising levels in blood, although more research is needed.[23]
A much less common use of cholecalciferol therapy in rickets utilizes a single large dose and has been called stoss therapy.[24][25][26] Treatment is given either orally or by intramuscular injection of 300,000 IU (7,500 μg) to 500,000 IU (12,500 μg = 12.5 mg), in a single dose, or sometimes in two to four divided doses. There are concerns about the safety of such large doses.[26]
Low circulating vitamin D levels have been associated with lower total testosterone levels in males. There has been shown information that Vitamin D supplementation could potentially have evidence on total testosterone concentration, although more research is needed.[27]
Other diseases[edit]
A meta-analysis of 2007 concluded that daily intake of 1000 to 2000 IU per day of vitamin D3 could reduce the incidence of colorectal cancer with minimal risk.[28] Also a 2008 study published in Cancer Research has shown the addition of vitamin D3 (along with calcium) to the diet of some mice fed a regimen similar in nutritional content to a new Western diet with 1000 IU cholecalciferol per day prevented colon cancer development.[29] In humans, with 400 IU daily, there was no effect of cholecalciferol supplements on the risk of colorectal cancer.[30]
Supplements are not recommended for prevention of cancer as any effects of cholecalciferol are very small.[31] Although correlations exist between low levels of blood serum cholecalciferol and higher rates of various cancers, multiple sclerosis, tuberculosis, heart disease, and diabetes,[32] the consensus is that supplementing levels is not beneficial.[33] It is thought that tuberculosis may result in lower levels.[34] It, however, is not entirely clear how the two are related.[35]
Biochemistry[edit]
Structure[edit]
Cholecalciferol is one of the five forms of vitamin D.[36] Cholecalciferol is a secosteroid, that is, a steroid molecule with one ring open.[37]
Mechanism of action[edit]
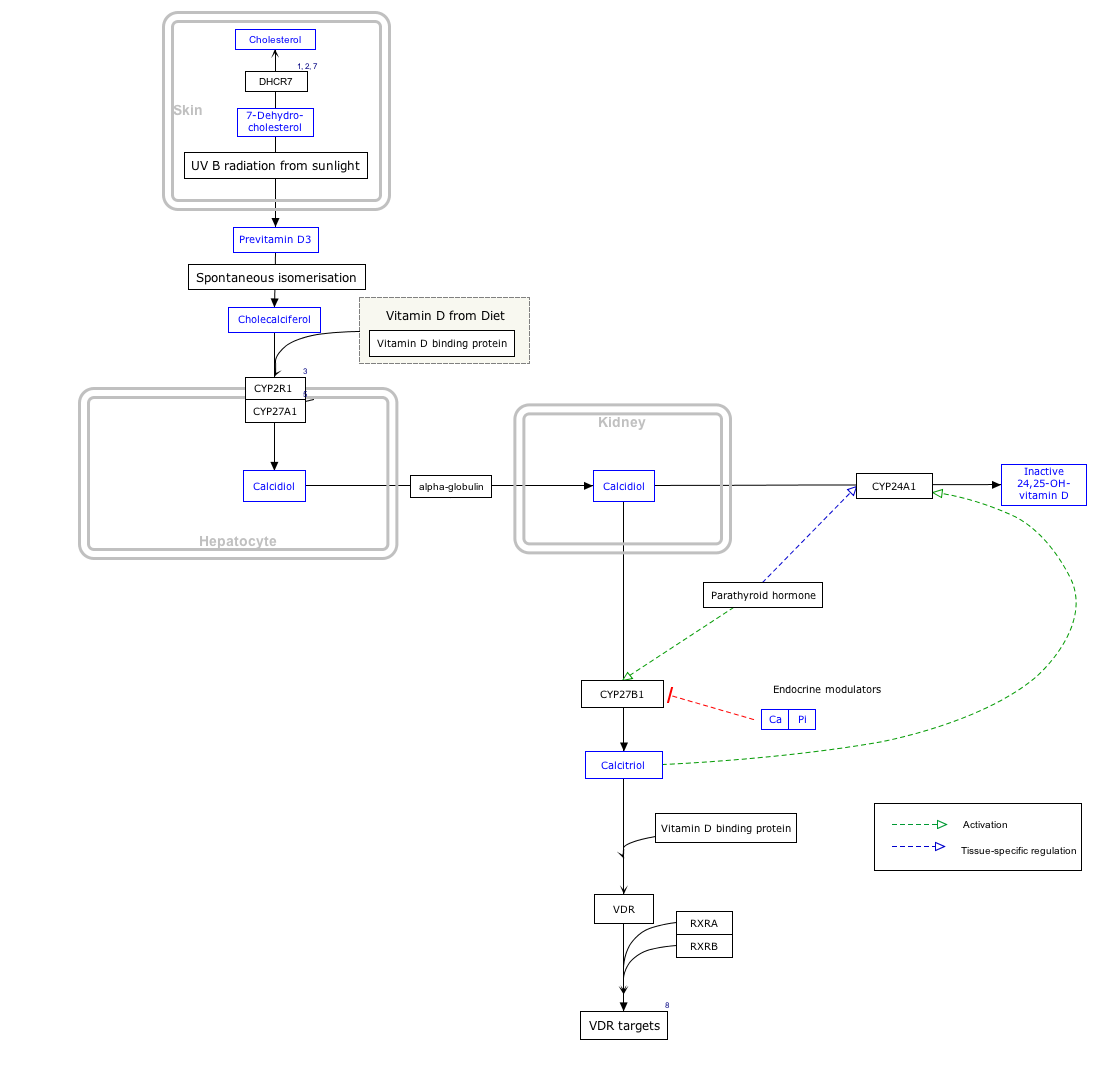
By itself cholecalciferol is inactive. It is converted to its active form by two hydroxylations: the first in the liver, by CYP2R1 or CYP27A1, to form 25-hydroxycholecalciferol (calcifediol, 25-OH vitamin D3). The second hydroxylation occurs mainly in the kidney through the action of CYP27B1 to convert 25-OH vitamin D3 into 1,25-dihydroxycholecalciferol (calcitriol, 1,25-(OH)2vitamin D3). All these metabolites are bound in blood to the vitamin D-binding protein. The action of calcitriol is mediated by the vitamin D receptor, a nuclear receptor which regulates the synthesis of hundreds of proteins and is present in virtually every cell in the body.[2]
Biosynthesis[edit]
Click on icon in lower right corner to open.
Click on genes, proteins and metabolites below to link to respective articles. [§ 1]
[[File:
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
[[]]
|alt=Vitamin D Synthesis Pathway (view / edit)]]
Vitamin D Synthesis Pathway (view / edit)
- ^ The interactive pathway map can be edited at WikiPathways: «VitaminDSynthesis_WP1531».
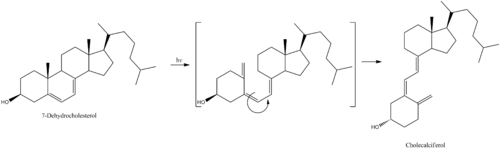
7-Dehydrocholesterol is the precursor of cholecalciferol.[2] Within the epidermal layer of skin, 7-dehydrocholesterol undergoes an electrocyclic reaction as a result of UVB light at wavelengths between 290 and 315 nm, with peak synthesis occurring between 295 and 300 nm.[38] This results in the opening of the vitamin precursor B-ring through a conrotatory pathway making previtamin D3 (pre-cholecalciferol).[39] In a process which is independent of UV light, the pre-cholecalciferol then undergoes a [1,7] antarafacial sigmatropic rearrangement [40] and therein finally isomerizes to form vitamin D3.
The active UVB wavelengths are present in sunlight, and sufficient amounts of cholecalciferol can be produced with moderate exposure of the skin, depending on the strength of the sun.[38] Time of day, season, and altitude affect the strength of the sun, and pollution, cloud cover or glass all reduce the amount of UVB exposure. Exposure of face, arms and legs, averaging 5–30 minutes twice per week, may be sufficient, but the darker the skin, and the weaker the sunlight, the more minutes of exposure are needed. Vitamin D overdose is impossible from UV exposure; the skin reaches an equilibrium where the vitamin degrades as fast as it is created.[38]
Cholecalciferol can be produced in skin from the light emitted by the UV lamps in tanning beds, which produce ultraviolet primarily in the UVA spectrum, but typically produce 4% to 10% of the total UV emissions as UVB. Levels in blood are higher in frequent users of tanning salons.[38]
Whether cholecalciferol and all forms of vitamin D are by definition «vitamins» can be disputed, since the definition of vitamins includes that the substance cannot be synthesized by the body and must be ingested. Cholecalciferol is synthesized by the body during UVB radiation exposure.[2]
The three steps in the synthesis and activation of vitamin D3 are regulated as follows:
- Cholecalciferol is synthesized in the skin from 7-dehydrocholesterol under the action of ultraviolet B (UVB) light. It reaches an equilibrium after several minutes depending on the intensity of the UVB in the sunlight – determined by latitude, season, cloud cover, and altitude – and the age and degree of pigmentation of the skin.
- Hydroxylation in the endoplasmic reticulum of liver hepatocytes of cholecalciferol to calcifediol (25-hydroxycholecalciferol) by 25-hydroxylase is loosely regulated, if at all, and blood levels of this molecule largely reflect the amount of cholecalciferol produced in the skin combined with any vitamin D2 or D3 ingested.
- Hydroxylation in the kidneys of calcifediol to calcitriol by 1-alpha-hydroxylase is tightly regulated: it is stimulated by parathyroid hormone and serves as the major control point in the production of the active circulating hormone calcitriol (1,25-dihydroxyvitamin D3).[2]
Industrial production[edit]
Cholecalciferol is produced industrially for use in vitamin supplements and to fortify foods. As a pharmaceutical drug it is called cholecalciferol (USAN) or colecalciferol (INN, BAN). It is produced by the ultraviolet irradiation of 7-dehydrocholesterol extracted from lanolin found in sheep’s wool.[41] Cholesterol is extracted from wool grease and wool wax alcohols obtained from the cleaning of wool after shearing. The cholesterol undergoes a four-step process to make 7-dehydrocholesterol, the same compound that is produced in the skin of animals. The 7-dehydrocholesterol is then irradiated with ultraviolet light. Some unwanted isomers are formed during irradiation: these are removed by various techniques, leaving a resin which melts at about room temperature and usually has a potency of 25,000,000 to 30,000,000 International Units per gram.
Cholecalciferol is also produced industrially for use in vitamin supplements from lichens, which is suitable for vegans.[42][43]
Stability[edit]
Cholecalciferol is very sensitive to UV radiation and will rapidly, but reversibly, break down to form supra-sterols, which can further irreversibly convert to ergosterol.[citation needed]
Pesticide[edit]
Rodents are somewhat more susceptible to high doses than other species, and cholecalciferol has been used in poison bait for the control of these pests.[44][16]
The mechanism of high dose cholecalciferol is that it can produce «hypercalcemia, which results in systemic calcification of soft tissue, leading to kidney failure, cardiac abnormalities, hypertension, CNS depression, and GI upset. Signs generally develop within 18-36 hr of ingestion and can include depression, loss of appetite, polyuria, and polydipsia.»[15] High-dose cholecalciferol will tend to rapidly accumulate in adipose tissue yet release more slowly[45] which will tend to delay time of death for several days from the time that high-dose bait is introduced.[44]
In New Zealand, possums have become a significant pest animal. For possum control, cholecalciferol has been used as the active ingredient in lethal baits.[46] The LD50 is 16.8 mg/kg, but only 9.8 mg/kg if calcium carbonate is added to the bait.[47][48] Kidneys and heart are target organs.[49] LD50 of 4.4 mg/kg has been reported in rabbits, with lethality to almost all rabbits ingesting doses greater than 15 mg/kg.[50] Toxicity has been reported across a wide range of cholecalciferol dosages, with LD50 as high as 88 mg/kg or as low as 2 mcg/kg reported for dogs.[51]
Researchers have reported that the compound is less toxic to non-target species than earlier generations of anticoagulant rodenticides (Warfarin and congeners) or Bromethalin,[52] and that relay toxicosis (poisoning by eating a poisoned animal) has not been documented.[15] Nevertheless, the same source reports that use of cholecalciferol in rodenticides may still pose a significant hazard to other animals, such as dogs and cats, when rodenticide bait or other forms of cholecalciferol are directly ingested.[15]
See also[edit]
- Hypervitaminosis D, Vitamin D poisoning
- Ergocalciferol, vitamin D2.
- 25-Hydroxyvitamin D3 1-alpha-Hydroxylase, a kidney enzyme that converts calcifediol to calcitriol.
References[edit]
- ^ Coulston AM, Boushey C, Ferruzzi M (2013). Nutrition in the Prevention and Treatment of Disease. Academic Press. p. 818. ISBN 9780123918840. Archived from the original on 30 December 2016. Retrieved 29 December 2016.
- ^ a b c d e f g Norman AW (August 2008). «From vitamin D to hormone D: fundamentals of the vitamin D endocrine system essential for good health». The American Journal of Clinical Nutrition. 88 (2): 491S–499S. doi:10.1093/ajcn/88.2.491S. PMID 18689389.
- ^ a b c «Cholecalciferol (Professional Patient Advice) — Drugs.com». www.drugs.com. Archived from the original on 30 December 2016. Retrieved 29 December 2016.
- ^ a b «Office of Dietary Supplements — Vitamin D». ods.od.nih.gov. 11 February 2016. Archived from the original on 31 December 2016. Retrieved 30 December 2016.
- ^ a b Ross AC, Taylor CL, Yaktine AL, Del Valle HB, et al. (Institute of Medicine (US); Committee to Review Dietary Reference Intakes for Vitamin D and Calcium) (2011). Dietary Reference Intakes for Calcium and Vitamin D (PDF). doi:10.17226/13050. ISBN 978-0-309-16394-1. PMID 21796828. S2CID 58721779.
- ^ British national formulary : BNF 69 (69 ed.). British Medical Association. 2015. pp. 703–704. ISBN 9780857111562.
- ^ a b World Health Organization (2009). Stuart MC, Kouimtzi M, Hill SR (eds.). WHO Model Formulary 2008. World Health Organization. hdl:10665/44053. ISBN 9789241547659.
- ^ a b c Hamilton R (2015). Tarascon Pocket Pharmacopoeia 2015 Deluxe Lab-Coat Edition. Jones & Bartlett Learning. p. 231. ISBN 9781284057560.
- ^ a b «Aviticol 1 000 IU Capsules — Summary of Product Characteristics (SPC) — (eMC)». www.medicines.org.uk. Archived from the original on 30 December 2016. Retrieved 29 December 2016.
- ^ Vieth R (May 1999). «Vitamin D supplementation, 25-hydroxyvitamin D concentrations, and safety» (PDF). The American Journal of Clinical Nutrition. 69 (5): 842–56. doi:10.1093/ajcn/69.5.842. PMID 10232622.
- ^ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 451. ISBN 978-3-527-60749-5. Archived from the original on 30 December 2016. Retrieved 29 December 2016.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ «The Top 300 of 2020». ClinCalc. Retrieved 7 October 2022.
- ^ «Cholecalciferol — Drug Usage Statistics». ClinCalc. Retrieved 7 October 2022.
- ^ a b c d Khan SA, Schell MM (November 2014). «Merck Veterinary Manual — Rodenticide Poisoning: Introduction». Retrieved 10 October 2021.
Incidence of vitamin D3 toxicosis in animals is relatively less than that of anticoagulant and bromethalin toxicosis. Relay toxicosis from vitamin D3 has not been documented.
{{cite web}}: CS1 maint: url-status (link) - ^ a b Rizor SE, Arjo WM, Bulkin S, Nolte DL. Efficacy of Cholecalciferol Baits for Pocket Gopher Control and Possible Effects on Non-Target Rodents in Pacific Northwest Forests. Vertebrate Pest Conference (2006). USDA. Archived from the original on 14 September 2012. Retrieved 27 August 2019.
0.15% cholecalciferol bait appears to have application for pocket gopher control.’ Cholecalciferol can be a single high-dose toxicant or a cumulative multiple low-dose toxicant.
- ^ Haridy R (28 February 2022). «One type of vitamin D found to boost immune system, another may hinder it». New Atlas. Retrieved 7 April 2022.
- ^ DRIs for Calcium and Vitamin D Archived 24 December 2010 at the Wayback Machine
- ^ Mithal A, Wahl DA, Bonjour JP, Burckhardt P, Dawson-Hughes B, Eisman JA, El-Hajj Fuleihan G, Josse RG, Lips P, Morales-Torres J (November 2009). «Global vitamin D status and determinants of hypovitaminosis D». Osteoporos Int. 20 (11): 1807–20. doi:10.1007/s00198-009-0954-6. PMID 19543765. S2CID 52858668.
- ^ a b «Vitamins and minerals – Vitamin D». National Health Service. 3 August 2020. Retrieved 15 November 2020.
- ^ a b Vieth R (May 1999). «Vitamin D supplementation, 25-hydroxyvitamin D concentrations, and safety». The American Journal of Clinical Nutrition. 69 (5): 842–56. doi:10.1093/ajcn/69.5.842. PMID 10232622.
- ^ van Groningen L, Opdenoordt S, van Sorge A, Telting D, Giesen A, de Boer H (April 2010). «Cholecalciferol loading dose guideline for vitamin D-deficient adults». European Journal of Endocrinology. 162 (4): 805–11. doi:10.1530/EJE-09-0932. PMID 20139241.
- ^ Tripkovic L, Lambert H, Hart K, Smith CP, Bucca G, Penson S, et al. (June 2012). «Comparison of vitamin D2 and vitamin D3 supplementation in raising serum 25-hydroxyvitamin D status: a systematic review and meta-analysis». The American Journal of Clinical Nutrition. 95 (6): 1357–64. doi:10.3945/ajcn.111.031070. PMC 3349454. PMID 22552031.
- ^ Shah BR, Finberg L (September 1994). «Single-day therapy for nutritional vitamin D-deficiency rickets: a preferred method». The Journal of Pediatrics. 125 (3): 487–90. doi:10.1016/S0022-3476(05)83303-7. PMID 8071764.
- ^ Chatterjee D, Swamy MK, Gupta V, Sharma V, Sharma A, Chatterjee K (March 2017). «Safety and Efficacy of Stosstherapy in Nutritional Rickets». Journal of Clinical Research in Pediatric Endocrinology. 9 (1): 63–69. doi:10.4274/jcrpe.3557. PMC 5363167. PMID 27550890.
- ^ a b Bothra M, Gupta N, Jain V (June 2016). «Effect of intramuscular cholecalciferol megadose in children with nutritional rickets». Journal of Pediatric Endocrinology & Metabolism. 29 (6): 687–92. doi:10.1515/jpem-2015-0031. PMID 26913455. S2CID 40611968.
- ^ Chen C, Zhai H, Cheng J, Weng P, Chen Y, Li Q, et al. (August 2019). «Causal Link Between Vitamin D and Total Testosterone in Men: A Mendelian Randomization Analysis». The Journal of Clinical Endocrinology and Metabolism. 104 (8): 3148–3156. doi:10.1210/jc.2018-01874. PMID 30896763. S2CID 84841517.
- ^ Gorham ED, Garland CF, Garland FC, Grant WB, Mohr SB, Lipkin M, et al. (March 2007). «Optimal vitamin D status for colorectal cancer prevention: a quantitative meta analysis». American Journal of Preventive Medicine (Meta-Analysis). 32 (3): 210–6. doi:10.1016/j.amepre.2006.11.004. PMID 17296473.
- ^ Yang K, Kurihara N, Fan K, Newmark H, Rigas B, Bancroft L, et al. (October 2008). «Dietary induction of colonic tumors in a mouse model of sporadic colon cancer». Cancer Research. 68 (19): 7803–10. doi:10.1158/0008-5472.CAN-08-1209. PMID 18829535.
- ^ Wactawski-Wende J, Kotchen JM, Anderson GL, Assaf AR, Brunner RL, O’Sullivan MJ, et al. (February 2006). «Calcium plus vitamin D supplementation and the risk of colorectal cancer». The New England Journal of Medicine. 354 (7): 684–96. doi:10.1056/NEJMoa055222. PMID 16481636. S2CID 20826870.
- ^ Bjelakovic G, Gluud LL, Nikolova D, Whitfield K, Wetterslev J, Simonetti RG, et al. (January 2014). «Vitamin D supplementation for prevention of mortality in adults». The Cochrane Database of Systematic Reviews. 1 (1): CD007470. doi:10.1002/14651858.cd007470.pub3. PMID 24414552.
- ^ Garland CF, Garland FC, Gorham ED, Lipkin M, Newmark H, Mohr SB, Holick MF (February 2006). «The role of vitamin D in cancer prevention». American Journal of Public Health. 96 (2): 252–61. doi:10.2105/AJPH.2004.045260. PMC 1470481. PMID 16380576.
- ^ Ross AC, Manson JE, Abrams SA, Aloia JF, Brannon PM, Clinton SK, et al. (January 2011). «The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know». The Journal of Clinical Endocrinology and Metabolism. 96 (1): 53–8. doi:10.1210/jc.2010-2704. PMC 3046611. PMID 21118827.
- ^ Gou X, Pan L, Tang F, Gao H, Xiao D (August 2018). «The association between vitamin D status and tuberculosis in children: A meta-analysis». Medicine. 97 (35): e12179. doi:10.1097/MD.0000000000012179. PMC 6392646. PMID 30170465.
- ^ Keflie TS, Nölle N, Lambert C, Nohr D, Biesalski HK (October 2015). «Vitamin D deficiencies among tuberculosis patients in Africa: A systematic review». Nutrition. 31 (10): 1204–12. doi:10.1016/j.nut.2015.05.003. PMID 26333888.
- ^ «cholecalciferol» at Dorland’s Medical Dictionary
- ^ «About Vitamin D». University of California, Riverside. November 2011. Archived from the original on 16 October 2017. Retrieved 15 October 2017.
- ^ a b c d Wacker M, Holick MF (January 2013). «Sunlight and Vitamin D: A global perspective for health». Dermato-Endocrinology. 5 (1): 51–108. doi:10.4161/derm.24494. PMC 3897598. PMID 24494042.
- ^ MacLaughlin JA, Anderson RR, Holick MF (May 1982). «Spectral character of sunlight modulates photosynthesis of previtamin D3 and its photoisomers in human skin». Science. 216 (4549): 1001–3. Bibcode:1982Sci…216.1001M. doi:10.1126/science.6281884. PMID 6281884. S2CID 23011680.
- ^ Okamura WH, Elnagar HY, Ruther M, Dobreff S (1993). «Thermal [1,7]-sigmatropic shift of previtamin D3 to vitamin D3: synthesis and study of pentadeuterio derivatives». Journal of Organic Chemistry. 58 (3): 600–610. doi:10.1021/jo00055a011.
- ^ Vitamin D3 Story. Archived 22 January 2012 at the Wayback Machine Retrieved 8 April 2012.
- ^ «Vitashine Vegan Vitamin D3 Supplements». Archived from the original on 4 March 2013. Retrieved 15 March 2013.
- ^ Wang T, Bengtsson G, Kärnefelt I, Björn LO (September 2001). «Provitamins and vitamins D2and D3in Cladina spp. over a latitudinal gradient: possible correlation with UV levels». Journal of Photochemistry and Photobiology B: Biology. 62 (1–2): 118–22. doi:10.1016/s1011-1344(01)00160-9. PMID 11693362. Archived from the original on 28 October 2012.
- ^ a b CHOLECALCIFEROL: A UNIQUE TOXICANT FOR RODENT CONTROL. Proceedings of the Eleventh Vertebrate Pest Conference (1984). University of Nebraska Lincoln. March 1984. Archived from the original on 27 August 2019. Retrieved 27 August 2019.
Cholecalciferol is an acute (single-feeding) and/or chronic (multiple-feeding) rodenticide toxicant with unique activity for controlling commensal rodents including anticoagulant-resistant rats. Cholecalciferol differs from conventional acute rodenticides in that no bait shyness is associated with consumption and time to death is delayed, with first dead rodents appearing 3-4 days after treatment.
- ^ Brouwer DA, van Beek J, Ferwerda H, Brugman AM, van der Klis FR, van der Heiden HJ, Muskiet FA (June 1998). «Rat adipose tissue rapidly accumulates and slowly releases an orally-administered high vitamin D dose». The British Journal of Nutrition. 79 (6): 527–532. doi:10.1079/BJN19980091. PMID 9771340.
We investigated the effect of oral high-dose cholecalciferol on plasma and adipose tissue cholecalciferol and its subsequent release, and on plasma 25-hydroxyvitamin D (25(OH)D). … We conclude that orally-administered cholecalciferol rapidly accumulates in adipose tissue and that it is very slowly released while there is energy balance.
- ^ «Pestoff DECAL Possum Bait — Rentokil Initial Safety Data Sheets» (PDF). Archived from the original (PDF) on 15 January 2021. Retrieved 10 May 2020.
- ^ Morgan D (2006). «Field efficacy of cholecalciferol gel baits for possum (Trichosurus vulpecula) control». New Zealand Journal of Zoology. 33 (3): 221–8. doi:10.1080/03014223.2006.9518449. S2CID 83765759.
- ^ Jolly SE, Henderson RJ, Frampton C, Eason CT (1995). «Cholecalciferol Toxicity and Its Enhancement by Calcium Carbonate in the Common Brushtail Possum». Wildlife Research. 22 (5): 579–83. doi:10.1071/WR9950579.
- ^ «Kiwicare Material Safety Data Sheet» (PDF). Archived from the original (PDF) on 10 February 2013.
- ^ R. J. Henderson and C. T. Eason (2000), Acute toxicity of cholecalciferol and gliftor baits to the European rabbit, Oryctolagus cuniculus, Wildlife Research 27(3) 297-300.
- ^ Michael E.Peterson & Kerstin Fluegeman, Cholecalciferol (Topic Review), Topics in Companion Animal Medicine, Volume 28, Issue 1, February 2013, Pages 24-27.
- ^ Kocher DK, Kaur G, Banga HS, Brar RS (2010). «Histopathological Changes in Vital Organs of House Rats Given Lethal Dose of Cholecalciferol (Vitamin D3)». Indian Journal of Animal Research. 2 (3): 193–6. ISSN 0367-6722.
Use of cholecalciferol as a rodenticide in bait lowered the risk of secondary poisoning and minimized the toxicity of non-target species
External links[edit]
- NIST Chemistry WebBook page for cholecalciferol
- Vitamin D metabolism, sex hormones, and male reproductive function.
- «Cholecalciferol». Drug Information Portal. U.S. National Library of Medicine.
Содержание
-
Структурная формула
-
Русское название
-
Английское название
-
Латинское название
-
Химическое название
-
Брутто формула
-
Фармакологическая группа вещества Колекальциферол
-
Нозологическая классификация
-
Код CAS
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Колекальциферол
-
Противопоказания
-
Ограничения к применению
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Колекальциферол
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Меры предосторожности
-
Торговые названия с действующим веществом Колекальциферол
-
Список БАДов
Структурная формула
Русское название
Колекальциферол
Английское название
Colecalciferol
Латинское название
Colecalciferolum (род. Colecalciferoli)
Химическое название
(3бета,5Z,7E)-9,10-Секохолеста-5,7,10(19)-триен-3-ол
Брутто формула
C27H44O
Фармакологическая группа вещества Колекальциферол
Нозологическая классификация
Список кодов МКБ-10
-
E20 Гипопаратиреоз
-
E55 Недостаточность витамина D
-
E55.0 Рахит активный
-
E83.3.1* Гипофосфатемия
-
E83.5 Нарушения обмена кальция
-
E83.5.1* Гипокальциемия
-
F10.2 Синдром алкогольной зависимости
-
K50 Болезнь Крона [регионарный энтерит]
-
K59.1 Функциональная диарея
-
K63.9 Болезнь кишечника неуточненная
-
K72.9 Печеночная недостаточность неуточненная
-
K74 Фиброз и цирроз печени
-
K90 Нарушения всасывания в кишечнике
-
K90.1 Тропическая спру
-
K90.4 Нарушения всасывания, обусловленные непереносимостью, не классифицированные в других рубриках
-
M81.9 Остеопороз неуточненный
-
M83.9 Остеомаляция у взрослых неуточненная
-
M90.8 Остеопатия при других болезнях, классифицированных в других рубриках
-
N28.9 Болезнь почки и мочеточника неуточненная
-
R17 Неуточненная желтуха
-
R29.0 Тетания
-
T42.3 Барбитуратами
-
T42.7 Противосудорожными, седативными и снотворными средствами неуточненными
Код CAS
67-97-0
Фармакологическое действие
—
регулирующее кальций-фосфорный обмен.
Характеристика
Витамин D3.
Белый кристаллический порошок. Нерастворим в воде, растворим в спирте, эфире, хлороформе, растительных маслах. Малоустойчив к действию света, легко окисляется.
Фармакология
Усиливает всасывание кальция в кишечнике и реабсорбцию фосфора в почечных канальцах, нормализует формирование костного скелета и зубов у детей, способствует сохранению структуры костей. Повышает проницаемость клеточных и митохондриальных мембран кишечного эпителия, облегчая чрезмембранный транспорт катионов кальция и других двухвалентных катионов, активирует вторичное всасывание фосфатов, увеличивает захват этих ионов костной тканью, усиливает процесс оссификации. Всасывается в дистальном отделе тонкой кишки (необходимо присутствие желчи), поступает в лимфатическую систему, попадает в печень и общий кровоток. В крови связывается с альфа2-глобулинами и частично — альбуминами, переносится в ткани печени, костей, скелетных мышц, почек, надпочечников, миокарда, жировую ткань. Cmax в тканях создается через 4–5 ч после введения, затем несколько снижается, сохраняясь длительное время на постоянном уровне. В форме полярных метаболитов локализуется преимущественно в мембранах клеток, микросом, митохондрий и ядер. Депонируется в печени. В результате биотрансформации в печени и почках образуются активные метаболиты. Большая часть колекальциферола и продуктов его обмена выделяется с желчью в кишечник, из которого они могут вновь всасываться, создавая систему энтерогепатической циркуляции, или экскретироваться с фекалиями.
Применение вещества Колекальциферол
Гипо- и авитаминоз витамина D (профилактика и лечение), состояние повышенной потребности организма в витамине D: рахит, спазмофилия, остеомаляция, остеопороз, нефрогенная остеопатия, неполноценное и несбалансированное питание (в т.ч. парентеральное, вегетарианская диета), недостаточная инсоляция, гипокальциемия, гипофосфатемия, алкоголизм, печеночная недостаточность, цирроз, механическая желтуха, заболевания ЖКТ (глютеновая энтеропатия, персистирующая диарея, тропическая спру, болезнь Крона), мальабсорбция; прием барбитуратов, минеральных масел, противосудорожных средств (в т.ч. фенитоин, примидон); гипопаратиреоз (послеоперационный, идиопатический, тетания), псевдогипопаратиреоз.
Противопоказания
Гиперчувствительность, гиперкальциемия, гиперкальциурия, кальциевый нефроуролитиаз, длительная иммобилизация (большие дозы), почечная остеодистрофия с гиперфосфатемией, саркоидоз, активная форма туберкулеза легких.
Ограничения к применению
Хроническая сердечная недостаточность, атеросклероз, хроническая почечная недостаточность, нефроуролитиаз в анамнезе.
Применение при беременности и кормлении грудью
При беременности не следует назначать в высоких дозах (возможно тератогенное действие). С осторожностью назначают в период грудного вскармливания (при применении в высоких дозах у матери возможно развитие симптомов передозировки у ребенка).
В экспериментах на животных показано, что кальцитриол в дозах, в 4–15 раз превышающих рекомендуемые дозы для человека, обладает тератогенным эффектом. Гиперкальциемия у матери (связанная с длительной передозировкой витамина D во время беременности) может вызвать у плода повышение чувствительности к витамину D, подавление функции паращитовидной железы, синдром специфической эльфоподобной внешности, задержку умственного развития, аортальный стеноз.
Побочные действия вещества Колекальциферол
Головная боль, желудочно-кишечные расстройства, раздражение почек, обострение туберкулезного процесса в легких.
Взаимодействие
Эффект снижают дифенин, колестирамин, токсичность — витамин A. Скорость биотрансформации увеличивают барбитураты.
Передозировка
При повышенной чувствительности и передозировке могут наблюдаться гиперкальциемия, гиперкальциурия и симптомы, ими обусловленные, — нарушение сердечного ритма, тошнота, рвота, головная боль, слабость, раздражительность, снижение массы тела, сильная жажда, учащенное мочеиспускание, образование почечных камней, нефрокальциноз, кальциноз мягких тканей, анорексия, артериальная гипертензия, запор, почечная недостаточность.
При хроническом отравлении — деминерализация костей, отложение кальция в почках, сосудах, сердце, легких, кишечнике, нарушение функции органов, что может привести к смертельному исходу.
Лечение: отмена колекальциферола, назначение кортикостероидов, витамина E, препаратов магния, калия, кислоты аскорбиновой, ретинола, тиамина.
Способ применения и дозы
Внутрь, в/м. Режим дозирования индивидуальный, в зависимости от показаний и возраста пациента.
Меры предосторожности
При профилактическом применении необходимо иметь в виду возможность передозировки, особенно у детей (не следует назначать более 10–15 мг в год). Во время лечения обязателен контроль содержания кальция в крови и моче (особенно при сочетании с тиазидными диуретиками). Продолжительное применение в высоких дозах приводит к хроническому гипервитаминозу D3. Следует иметь в виду, что чувствительность к витамину D у разных пациентов индивидуальна и у ряда пациентов прием даже терапевтических доз может вызвать явления гипервитаминоза. Чувствительность новорожденных к витамину D может быть различной, некоторые из них могут быть чувствительными даже к очень низким дозам. У детей, получающих витамин D в течение длительного периода времени, повышается риск возникновения задержки роста. Для профилактики гиповитаминоза D наиболее предпочтительно сбалансированное питание. Новорожденные, находящиеся на грудном вскармливании, особенно рожденные матерями с темной кожей и/или получавшие недостаточную инсоляцию, имеют высокий риск возникновения дефицита витамина D.
В пожилом возрасте потребность в витамине D может возрастать вследствие уменьшения абсорбции витамина D, снижения способности кожи синтезировать провитамин D3, уменьшения времени инсоляции, возрастания частоты возникновения почечной недостаточности.
Торговые названия с действующим веществом Колекальциферол
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Аквадетрим |
от 430.00 до 812.00 |
| Вигантол® |
от 137.00 до 158.00 |
| Витамин D3 |
649.00 |
| Витамин Д3 |
149.00 |
| ДэТриФерол |
от 240.00 до 240.00 |
| Фортедетрим |
от 993.00 до 1505.00 |
| Юнивит® Аква Д3 |
от 325.00 до 325.00 |
Список БАДов
Статьи
Опубликовано в журнале:
Практика педиатра
Май, 2007
О.А. Громова, профессор кафедры фармакологии и клинической фармакологии ГОУ ВПО «Ивановская государственная медицинская академия» Росздрава, научный консультант Российского сотрудничающего центра Института микроэлементов ЮНЕСКО, д-р мед. наук
По современной функциональной классификации витаминов, разработанной В.Б. Cпиричевым с соавт. (2005), витамин D относится к гормонам, производным холестерина. Кроме того, теперь этот витамин следует рассматривать как гормон, не только регулирующий кальциевый гомеостаз, но и контролирующий пролиферацию и дифференциацию клеток.
Открытие De Luca Hector (1998) специфических рецепторов для витамина D не только в тканях-мишенях – кишечнике, костях, почках, – но и в других тканях, а также идентификация рецепторов в раковых клетках указывают на более широкие функции витамина, чем только регуляция обмена кальция и остеогенеза. В ходе научных исследований было установлено, что витамин D модулирует секрецию инсулина, тиреоидных гормонов и паратгормона. Адекватный фотосинтез в коже витамина D3 рассматривается как важный антиканцерогенный фактор, а также как дополнительный фактор в преодолении глюкозотолерантности, в борьбе с ожирением.
Генетический контроль обмена витамина D3 и ретиноидов взаимосвязан. RXR (pregnane X receptor) может действовать в виде гетеродимеров, уровень которых повышается при патологии беременности и бесплодии. Активация непермиссивных гетеродимеров может быть достигнута только в присутствии лиганда партнера RXR – VDR (vitamin D receptor). При недостаточной или избыточной активации ретинолом и при недостаточности витамина D3 формируются дефекты морфогенеза плаценты, сердца, глаза, ведущие к гибели эмбрионов. При длительном дефиците витамина D3 формируются многообразные нарушения обмена холестерина, происходит экспрессия ряда цитохромов Р450, регуляторами которых служат димеры RXR: отмечается укорочение жизни гепатоцитов, особенно при регенерации и при возрастании плоидности клеток. Разрушение гена RXR-бета сопровождается нарушением сперматогенеза и преждевременным формированием альвеол легких; гена RXR-гамма – нарушением формирования холинергических нейронов и экстрапирамидных путей мозга, функций гипокампа.
В последние годы показано активное участие витамина D в регуляции иммуногенеза и клеточной пролиферации (T. Suda et al., 1990).
Ниже суммированы иммунотропные эффекты витамина D:
- подавляет экспрессию рецепторов к трансферрину на макрофагах (W.F.C. Rigby et al., 1985);
- подавляет образование СD23-клеток (Ch. Fargeaset al., 1990);
- подавляет активность и пролиферацию Т-хелперов в зависимости от концентрации ИЛ-1: при низкой концентрации ИЛ-1 стимулирует пролиферацию Т-хелперов почти в 50 раз; в оптимальных (физиологических) концентрациях подавляет индукцию и пролиферацию; при повышенной концентрации ИЛ-1 повышает индукцию, но блокируют пролиферацию Т-хелперов (D.L. Lacey et al., 1987);
- ИФН-гамма дозозависимо усиливает образование кальцитриола (1,25-(ОН)2-D3) альвеолярными макрофагами, что оптимизирует антиген-презентирующую функцию (H. Koeffler, Phillihe et al., 1990);
- повышенные дозы витамина D оказывают подавляющее действие на процессы гуморального и клеточного иммунных ответов (S.K. Shiozawa et al., 1985; K. Muller et al., 1988);
- под действием кальцитриола происходит окончательная дифференцировка промиелоцитов HL-60 в макрофаги (R.L. Paguetteet al., 1991). Поэтому витамин D3 нашел применение в качестве дифференцирующего агента в схемах лечения недифференцированных лейкозов и карцином;
- кальцитриол индуцирует синтез Ca-связывающих белков: кольбиндина кишечного эпителия, S100 нейронов, парвальбулина и тропонина мышечной ткани и кальцимединов в многочисленных тканях (в том числе в лимфоидной).
Надо отметить, что для восстановления функции макрофагов и лимфоцитов при иммунодефиците, обусловленном D-недостаточностью, необходим прием 450 МЕ витамина D3 в день в течение 2–3 месяцев.
Фармакодинамика
В группе витамина D наиболее активными соединениями являются эргокальциферол (витамин D2) и холекальциферол (витамин D3) (табл. 1). Витамин D2 образуется из облученных дрожжей и хлеба, витамин D3 постоянно образуется в коже под действием ультрафиолетовых лучей, являясь основным источником витамина D. Меньшая его часть поступает с пищей (печень рыб, облученное молоко). По действию в организме человека витамины D2 и D3 сходны как качественно, так и количественно.
Таблица 1
Полная номенклатура метаболитов витамина D (C. Geisesler, H. Powers, 2006)
| Обычное название (рус., лат.) | Рекомендуемое название | Аббревиатура | Mr |
|---|---|---|---|
| Витамин D3 | |||
| Холекальциферол (cholecalciferol) |
Кальциол (calciol ) |
– | 384,6 |
| 25-гидроксикальциферол (25-hydroxycalciferol) |
Кальцидиол (calcidiol) |
25-(OH)D3 | 400,6 |
| 1альфа-гидроксихолекальциферол (1альфа-hydroxycholecalciferol) |
1(S)-гидроксикальциол (1(S)-hydroxycalciol) |
1альфа-(OH)D3 | 400,6 |
| 24,25-дигидрооксихолекальциферол (24,25-dihydroxycholecalciferol) |
24(R)-гидроксикальцидиол (24(R)-hydroxycalcidiol) |
24,25-(OH)2D3 | 416,6 |
| 1,25-дигидрооксихолекальциферол (1,25-dihydroxycholecalciferol) |
Кальцитриол (calcitriol) |
1,25-(OH)2D3 | 416,6 |
| 1,24,25-тригидрооксихолекальциферол (1,24,25-trihydroxycholecalciferol) |
Кальцететрол (calcitetrol) |
1,24,25-(OH)3D3 | 432,6 |
| Витамин D2 | |||
| Эргокальциферол (ergocalciferol) |
Эргокальциол (ercalciol) |
– | 396,6 |
| 25-гидроксиэргокальциферол (25-hydroxyergocalciferol) |
Эргокальцидиол (ercalcidiol) |
25-(OH)D2 | 412,6 |
| 24,25-дигидроксиэргокальциферол (24,25-dihydroxyergocalciferol) |
24(R)-hydroxyercalcidiol | 24,25-(OH)2D2 | 428,6 |
| 1,25-дигидроксиэргокальциферол (1,25-dihydroxyergocalciferol) |
Эркальцитриол (ercalcitriol) |
1,25-(OH)2D2 | 428,6 |
| 1,24,25-тригидроксиэргокальциферол (1,24,25-trihydroxyergocalciferol) |
Эркальцитетрол (ercalcitetrol) |
1,24,25-(OH)3D2 | 444,6 |
Витамин D2 имеет природный провитамин – эргостерин, относящийся к стеринам растительного происхождения. Природным провитамином витамина D3 является 7-дегидрохолестерин, содержащийся в животных тканях, в частности в коже. Он превращается в витамин D3 под влиянием солнечного света. Витамин D влияет на общий обмен веществ при метаболизме кальция (Ca2+) и фосфата (НРО42-), при этом он повышает проницаемость эпителия кишечника для кальция и фосфора. Существенное значение имеет участие витамина D в минерализации костной ткани.
Фармакокинетика
Всасывание витамина D происходит в проксимальном отделе тонкого кишечника, обязательно в присутствии желчи. Часть витамина D абсорбируется в средних отделах тонкой кишки и незначительная часть – в подвздошной. После всасывания холекальциферол обнаруживается в составе хиломикронов в свободном виде и лишь частично в форме эфира. В крови большая его часть находится в связанном состоянии с гамма-глобулинами и альбуминами. Витамин D депонируется главным образом в жировой ткани. Основные процессы биотрансформации витамина D происходят в коже, печени и почках. В коже под действием ультрафиолетового облучения образуется витамин D3 из предшественников. В печени витаминD, гидроксилируясь, превращается в 25-оксихолекальциферол (25-ОН-D3). Последний в почках с участием паратгормона переходит в самый активный метаболит витамина D – кальцитриол, или 1,25-дигидрооксихолекальциферол (1,25(ОН)2-D3), который рассматривается как сильнодействующий почечный гормон стероидной структуры. 1,25-(ОН)2-D3 выполняет важную роль в регуляции метаболизма Са, Р и двухвалентных микроэлементов (Cd, Ni, Zn, Hg, Be, Sr). Период полувыведения витамина D из организма составляет около 19 дней. Он выводится путем экскреции с желчью, первоначально в кишечник (15–30% от введенной дозы в течение суток), где подвергается энтерогепатической циркуляции (повторное всасывание). Оставшаяся часть выводится с содержимым кишечника. Скорость исчезновения исходного витамина из плазмы крови составляет 19–25 часов, но при накоплении в тканях время его пребывания в организме может составить до 6 месяцев. (В.Г. Кукес, 2006).
Механизм действия
Витамин D можно рассматривать как витамин и как гормон. Как витамин, он поддерживает уровень неорганического фосфора и кальция в плазме выше порогового значения и повышает всасывание кальция в тонкой кишке, таким образом, предупреждая развитие рахита и остеомаляции. В качестве гормона рассматривается калицитриол. Он действует на клетки кишечника, почек и мышц. В клетках слизистой оболочки кишечника витамин D стимулирует синтез белка-носителя, необходимого для транспорта Са. Действие паратгормона, проявляющееся усилением абсорбции кальция, осуществляется полностью через его стимулирующее влияние на продукцию 1,25-(ОН)2-D3 почками. Всасывание Р также стимулируется витамином D. Усиление процессов минерализации тканей при лечении витамином D, по-видимому, является следствием повышения содержания Са и Р в плазме. Калицитриол способен повышать реабсорбцию Са, но в умеренной степени, так как 99% Са реабсорбируется и в отсутствие витамина D. В мышечной ткани при дефиците витамина D снижается захват Са саркоплазматическим ретикулумом, что проявляется мышечной слабостью. Процесс образования гормона регулируется потребностью организма в Са и Р и опосредуется паратгормоном и содержанием Р в крови.
Симптомы гиповитаминоза
У детей недостаток витамина D проявляется развитием рахита с нарушением обызвествления костей, деформацией позвоночника, нижних конечностей, замедленным общим развитием. У подростков гиповитаминоз D проявляется остеопенией, нарушением формирования кожи и ее придатков (ломкость ногтей, сухость и ломкость волос). К дефициту витамина D приводит преимущественное употребление высокоуглеводистой пищи, несбалансированной по соотношению в ней Са и Р. Недостаток витамина D может возникать у детей, исключивших из употребления продукты животного происхождения (молоко, творог, сливочное масло, желтки яиц, рыбу), а также при недостатке солнечного света.
Суточная потребность в витамине D2 – 500–1000 МЕ; в витамине D3 – 500 МЕ (дети до года), 200–400 МЕ (дети старше года и взрослые).
Передозировка и побочные явления
При применении неадекватных доз препаратов витамина D и продолжительном лечении может развиться острое или хроническое отравление (D-гипервитаминозы). Проявляется заболевание патологической деминерализацией костей, отложением кальция в почках, сосудах, сердце, легких, кишечнике и значительным нарушением функций этих органов.
При наблюдении за 230 больными с отравлением эргокальциферолом отмечались следующие симптомы: астенизация, головная боль, головокружение, тошнота, рвота, нарушение сна, жажда, полиурия, оссалгии и артралгии. У 16 больных был выявлен высокий уровень кальциемии. Как отмечают авторы, получен положительный эффект от применения глюкокортикостероидов, антагонистов кальция (верапамила), симптоматических препаратов (О.А. Пуртова и др., 1996).
Передозировка витамина D возможна при длительном использовании не только монопрепаратов, но и при бесконтрольном использовании поливитаминных комплексов с высокими дозами данного витамина. Во избежание угрозы гипервитаминоза витамина D при необоснованно высоком или необоснованно длительном применении следует обращать внимание на дозирование витамина в составе препаратов.
Экспериментальные и клинические исследования
Существует масса заключений экспертов о необходимости систематического приема пищи, богатой кальцием и витамином D, особенно при остеопорозе. Это достоверно увеличивает костную массу, устраняет нарушения микроархитектоники костей, снижает риск переломов. (Lane et al., 2003, Ebeling, 2003). Остеопороз может возникать во все возрастные периоды. Обследование детей показало, что от младенческого до юношеского возраста могут быть обнаружены разные по степени выраженности симптомы остеопороза. В США рекомендуют минимальное потребление витамина D (200 МЕ в день) не только младенцам, в том числе и тем, которые находятся на грудном вскармливании, но всем детям вплоть до юношеского возраста (L.M. Gartner et al., 2003).
Установлено, что в географических областях, где пища бедна витамином D, например в Скандинавии, повышена заболеваемость атеросклерозом, артритами, диабетом, особенно в юношеской форме. Дефицит витамина D существенно повышает индекс канкрофилии (О.В. Джиташвили, 2002).
Наличие болезни Крона или иных воспалительных заболеваний толстой кишки может служить фактором, способствующим развитию остеопороза. В тех случаях, когда болезнь Крона требует постоянного приема кортикостероидных препаратов, лечение больных необходимо дополнять препаратами кальция и витамина D. Это препятствует развитию стероидного остеопороза (J. Hoffmann et al., 2000).
Необходимость профилактического приема препаратов кальция, витамина D, а также эстрогенов при признаках остеопороза общепринята. Показано, что потеря кальция костями в пожилом возрасте сопровождается эктопической кальцификацией других тканей, особенно артерий и почек. При анализе смертности доказано, что эктопическая кальцификация более опасна, чем непосредственно сам остеопороз. Помимо этого известно, что кальцификация артерий при атеросклерозе встречается почти у 90% пациентов. В исследовании, проведенном на 173 пациентах, показано, что при выраженной кальцификации артерий отмечается снижение уровня витамина D в сыворотке крови (A. Watson et al., 1997).
Рак предстательной железы связан с нарушением баланса андрогенов, и получены веские аргументы в пользу влияния кальцитриола на рост и дифференцирование раковых клеток простаты: он замедляет прогрессирование рака предстательной железы. Аналогичное действие кальцитриол оказывает на пролиферацию эпителия двенадцатиперстной кишки. Скорость образования криптальных клеток после добавления витамина к культуре клеток двенадцатиперстной кишки снижается с 2,42 до 1,41 клеток в час на крипту. На этом основании сделано заключение, что витамин D3 угнетает пролиферацию дуоденального эпителия и снижает риск опухолей двенадцатиперстной кишки (А.В. Кудрин, О.А. Громова, 2007).
Заслуживает внимание изучение роли витамина D3 в регуляции фосфорно-кальциевого обмена у больных с хронической почечной недостаточностью. Обследовано 24 ребенка в возрасте от 7 до 15 лет с хронической почечной недостаточностью, развившейся на фоне врожденной патологии почек или аутоиммунного процесса. Больные находились на гемо- или перитониальном диализе. В комплексную терапию был включен метаболит витамина D3. Анализ показателей иммунного статуса выявил улучшение функции моноцитов практически у всех больных. Этот эффект был более выражен при врожденной патологии почек, чем при аутоиммунном процессе. Воздействие на нейтрофилы имело разнонаправленный характер. На фоне терапии метаболитом витамина D3 увеличилась активность Т-лимфоцитов, количество Т-супрессоров, ответ лимфоцитов на митоген КонА, уровень IgA. Уменьшилось количество активных Т-лимфоцитов, В-лимфоцитов, ответ на митоген ФГА и уровни IgМ и IgG. Количество нормальных клетоккиллеров, регуляторный индекс и ответ на митоген лаконоса возросли у детей с врожденной патологией почек, в то время как у детей с аутоиммунным процессом эти показатели снизились (Г.А. Cамсыгин и др., 1997).
Количество витамина D, синтезируемого в коже под действием солнечного света, зависит от длины волны, пигментации кожи и уровня загрязненности атмосферы. В жарких, но загрязненных районах земного шара, несмотря на высокую инсоляцию, дефицит витамина D чрезвычайно распространен. Кроме того, биоусвояемость витамина D зависит от возраста, и по мере старения она неуклонно падает (H. Harris et al., 1999). Недостаток витамина D – преимущественно «зимняя» проблема. В зимний период дефицит витамина D (в крови) встречается чаще, чем летом.
Существует теория, утверждающая, что дефицит витамина D усугубляет течение внелегочного туберкулеза. Наблюдение A. Davies (1997) заключалось в том, что эмигранты из стран тропического пояса заражались туберкулезом в стране своего рождения. Но благодаря высокой степени инсоляции в их организме образовывалось большое количество витамина D, сдерживающего развитие заболевания. Переезд в страны Европы и Северной Америки, где степень инсоляции ниже, чем в странах Азии, Африки и Латинской Америки, откуда эмигранты прибыли, приводил к снижению содержания в организме витамина D, на фоне чего манифестировал туберкулез.
Таким образом, на современном этапе наблюдается значительная эволюция знаний о витамине D, уточнены метаболические пути и новые рецепторно опосредованные механизмы иммунологического действия (антиканцерогенное, иммуномодулирующее при аутоиммунных заболеваниях, противовоспалительное). Однако на большей части территории России инсоляция понижена, многие дети и подростки проходят весь период становления жизненных программ развития в условиях северных территорий. При этом приверженность к здоровому образу жизни у Россиян очень низкая. Отмечается повсеместное нарушение диетических рекомендаций, отсутствует плановая и научно обоснованная коррекции рациона, отмечается недостаточность уровня ежедневной физической нагрузки, особенно у девочек, не искоренены вредные привычки, деформирующие витаминный баланс, нет системы информированности детей и подростков о последствиях несоблюдения здорового образа жизни. Поэтому вновь проводниками идей здорового образа жизни, в том числе нормализации обмена витамина D, являются представители медицины.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)