Номер CAS: 528-16-5
Номер ЕС: 208-429-7
Натриевая соль глюкуроновой кислоты использовалась:
Глюкуроновая кислота как компонент для создания синтетической межклеточной жидкости.
Глюкуроновая кислота используется как углевод.
Глюкуроновая кислота, используемая в качестве заменителя хлорида натрия для создания среды, не содержащей хлора (Cl-).
Глюкуроновая кислота — одна из наиболее важных природных кислот, которую в умеренных количествах получают из глюкозы в результате несложного процесса окисления.
Глюкуроновая кислота упрощается за счет бактерий глюкозодегидрогеназы, таких как (Gluconobacter), и фермента глюкозооксидазы (грибов).
Глюкуроновая кислота от микробов — желательная процедура. Типичный широко применяемый метод ферментации резюмируется с использованием грибов (Aspergillus niger). Производные глюкуроновой кислоты; основные из них, такие как глюконат натрия, широко применяются в сельском хозяйстве и пищевой промышленности.
Глюкуроновая кислота используется во многих сферах фармацевтической, пищевой, текстильной, цементной промышленности, в хелатирующих агентах для металлов, коже, напитках и молочных продуктах.
Глюкуроновая кислота, производимая в процессе ферментации грибами, хорошо зарекомендовала себя на рынке.
Поэтому механизм процессов ферментации, эффективные микроорганизмы используются для получения высоких выходов, более экономичного процесса, эффективного преобразования источников углерода из дешевых субстратов для производства глюкуроновой кислоты с большим выходом и качеством.
Первоначально глюкуроновая кислота подавалась на использование в качестве коагулянта при производстве тофу.
Глюкуроновую кислоту можно использовать в производстве «шелковистого» тофу (имеющего консистенцию йогурта) путем смешивания с горячим соевым молоком непосредственно в розничных контейнерах.
Глюкуроновая кислота снижает вероятность микробной ферментации и продлевает срок хранения продукта.
Глюкуроновая кислота имеет несколько других применений в производстве пищевых продуктов из-за ее кислотных и хелатирующих свойств.
Глюкуроновая кислота используется в качестве подкислителя при производстве молочных продуктов, требующих медленного снижения pH, таких как творог, сыр фета и моцарелла.
Глюкуроновая кислота также используется в качестве подкислителя в заправках для салатов, готовых к употреблению макаронах и рисе.
Глюконо-дельта-лактон используется в качестве отвердителя в мясных продуктах.
Глюкуроновая кислота также используется в качестве разрыхлителя в хлебе и выпечке и вызывает более медленную скорость выделения диоксида углерода по сравнению с другими разрыхлителями.
Все эти общепризнанные безопасные (GRAS) применения глюконо дельта-лактона разрешены при переработке органических продуктов питания.
Глюкуроновая кислота — уроновая кислота, которая была впервые выделена из мочи (отсюда и название).
Глюкуроновая кислота содержится во многих камедях, таких как гуммиарабик (около 18%), ксантан и чайный гриб, и важна для метаболизма микроорганизмов, растений и животных.
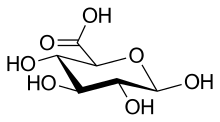
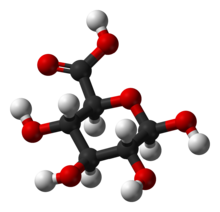
Глюкуроновая кислота представляет собой D-глюкуроновую кислоту в форме циклической пиранозы.
Глюкуроновая кислота играет роль метаболита водорослей.
Глюкуроновая кислота представляет собой конъюгат кислоты D-глюкопирануроната.
Глюкуроновая кислота является энантиомером L-глюкопирануроновой кислоты.
Глюкуроновая кислота (CAS: 6556-12-3) представляет собой карбоновую кислоту, имеющую структуру молекулы глюкозы, у которой был окислен шестой атом углерода (из шести).
Соли глюкуроновой кислоты известны как глюкуронаты.
Глюкуроновая кислота хорошо растворяется в воде.
У людей глюкуроновая кислота часто связана с токсичными или ядовитыми веществами, чтобы обеспечить последующее выведение, и с гормонами, чтобы облегчить транспортировку.
Эти звенья включают О-гликозидные связи.
Глюкуроновая кислота известна как глюкуронизация, а полученные вещества известны как глюкурониды (или глюкуронозиды).
Глюкуроновая кислота использует UDP-глюкуроновую кислоту (глюкуроновая кислота, связанная гликозидной связью с дифосфатом уридина) в качестве промежуточного продукта.
УДФ-глюкуроновая кислота образуется в печени всех животных.
Глюкуроновая кислота и вредное вещество соединяются в печени, а затем выводятся с мочой.
Использование глюкуроновой кислоты
Определение стероидов в моче и стероидных конъюгатов в крови.
Этилглюкуронид и этилсульфат выводятся с мочой в виде метаболитов этанола и используются для контроля употребления алкоголя или зависимости от него.
Глюкуроновая кислота и глюконовая кислота являются продуктами ферментации чая Комбуча.
Глюкуроновая кислота является предшественником аскорбиновой кислоты (витамин С, ранее называвшийся L-гексуроновой кислотой).
Аскорбат может быть биосинтезирован высшими растениями, водорослями, дрожжами и большинством животных.
Взрослый козел производит ~ 13 г витамина С в день. Эта способность отсутствует у некоторых млекопитающих (включая людей и морских свинок), а также у насекомых, беспозвоночных и большинства рыб.
заявка
Глюкуроновая кислота использовалась:
модель пищеварения человека in vitro
в виде порошка волокнистой целлюлозы, чтобы проверить пищевые предпочтения экспериментальных термитов
в качестве стандарта для количественного определения глюкуроновой кислоты в образце мочи
Карбоновая кислота со структурным сходством с глюкозой, обладающая детоксицирующей активностью.
Ксенобиотический метаболизм различных веществ, таких как лекарственные препараты, загрязнители, билирубин, андрогены, эстрогены, минералокортикоиды, глюкокортикоиды, производные жирных кислот, ретиноиды и даже кислоты, включает глюкуронирование, процесс, в котором водорастворимые экскретируемые глюкурониды этих веществ образуются посредством гликозидные связи с глюкуроновой кислотой.
Глюкуроновая кислота, образующаяся в печени в результате связывания глюкуроновой кислоты с уридиндифосфатом (UDP) через гликозидную связь, является промежуточным продуктом в процессе глюкуронизации.
Глюкуроновая кислота — это электролитная добавка, используемая при полном парентеральном питании.
Нуклеозиддифосфатный сахар, который служит источником глюкуроновой кислоты для биосинтеза полисахаридов.
Глюкуроновая кислота также может быть эпимеризована до UDP-идуроновой кислоты, которая отдает идуроновую кислоту полисахаридам.
У животных глюкуроновая кислота используется для образования многих глюкозидуронидов с различными агликонами.
Глюкуроновая кислота — это мягкая органическая кислота, полученная из глюкозы в результате простой реакции окисления.
Реакции способствуют ферменты глюкозооксидаза (грибы) и глюкозодегидрогеназа (бактерии, такие как Gluconobacter).
Микробиологическое производство глюкуроновой кислоты является предпочтительным методом и существует уже несколько десятилетий.
В наиболее изученном и широко используемом процессе ферментации участвует гриб Aspergillus niger.
Глюкуроновая кислота и ее производные, главным из которых является глюконат натрия, находят широкое применение в пищевой и фармацевтической промышленности.
Глюкуроновая кислота — это мягкая органическая кислота, не едкая и не вызывающая коррозии, обладающая отличной изолирующей способностью.
Нетоксичный и легко биоразлагаемый (98% через 2 дня), он естественным образом встречается в растениях, фруктах и других продуктах питания, таких как вино (до 0,25%) и мед (до 1%).
Глюкуроновая кислота обладает разнообразными свойствами, так как является полигидроксикарбоновой кислотой с гидроксильными и карбоксильными группами, которые могут вступать в реакцию.
Концентрированные растворы глюкуроновой кислоты содержат некоторое количество лактона (GdL), нейтрального циклического эфира, который менее растворим на холоду и не обладает действительными кислотными свойствами.
Около 5% GdL присутствует в растворе глюкуроновой кислоты при комнатной температуре.
Выдающимся свойством глюкуроновой кислоты является ее превосходная хелатирующая способность, особенно в щелочных и концентрированных щелочных растворах.
В этом отношении глюкуроновая кислота превосходит все другие хелатирующие агенты, такие как EDTA, NTA и родственные соединения.
Кальций, железо, медь, алюминий и другие тяжелые металлы прочно хелатируются в щелочном растворе и замаскированы таким образом, чтобы исключить их влияние.
Глюкуроновая кислота устойчива при температуре кипения даже в концентрированных щелочных растворах.
Однако глюкуроновая кислота легко и полностью разлагается на очистных сооружениях (98% через 2 дня).
Глюкуроновая кислота — это мягкая органическая кислота, полученная из глюкозы в результате простой реакции окисления.
Реакции способствуют ферменты глюкозооксидаза (грибы) и глюкозодегидрогеназа (бактерии, такие как Gluconobacter).
Микробное производство глюкуроновой кислоты — это
предпочтительный метод, и он восходит к нескольким десятилетиям.
Наиболее изучены и широко используются
В процессе брожения участвует гриб Aspergillus niger.
Глюкуроновая кислота и ее производные, главным из которых является глюконат натрия, находят широкое применение в пищевой и фармацевтической промышленности.
Глюкуроновая кислота — это карбоновая кислота, имеющая структуру молекулы глюкозы, у которой был окислен шестой атом углерода (из шести).
Соли глюкуроновой кислоты известны как глюкуронаты.
Глюкуроновая кислота хорошо растворяется в воде.
В организме животных глюкуроновая кислота часто связана с ядовитыми веществами, чтобы обеспечить их последующее выведение, и с гормонами, чтобы облегчить транспортировку. Эти звенья включают О-гликозидные связи.
Глюкуроновая кислота известна как глюкуронизация, а полученные вещества известны как глюкурониды (или глюкуронозиды).
При глюкуронизации используется UDP-глюкуроновая кислота (глюкуроновая кислота, связанная гликозидной связью с дифосфатом уридина) в качестве промежуточного продукта.
Глюкуроновая кислота образуется в печени всех животных.
Широко распространен в растениях, где он содержится в камедях, слизях, сапонинах и флавоновых гликозидах, а также у животных в составе мукополисахаридов.
Глюкуроновая кислота образуется в печени для детоксикации ядовитых гидроксилсодержащих веществ.
Фенил, крезил и индоксил гликозиды присутствуют в нормальной моче.
Глюкуроновая кислота содержится во многих продуктах, среди которых есть орехи кешью, американская клюква, вишня и соевые бобы.
Принадлежит к классу органических соединений, известных как производные глюкуроновой кислоты.
Производные глюкуроновой кислоты представляют собой соединения, содержащие фрагмент глюкуроновой кислоты (или производное), который состоит из фрагмента глюкозы с углеродом C6, окисленным до карбоновой кислоты.
Глюкуроновая кислота — это водорастворимая органическая кислота, принадлежащая к семейству гидроксикарбоновых кислот.
Глюкуроновая кислота — это продукт окисления глюкозы, который широко встречается в природе и присутствует во фруктах, вине, меде и других природных источниках.
Химическая структура глюкуроновой кислоты из шестиуглеродной цепи с пятью гидроксильными (-ОН) группами, оканчивающимися группой карбоновой кислоты.
Непосредственная близость атомов кислорода в химической структуре обеспечивает его функцию высокоэффективного хелатирующего агента.
Хелатирующие агенты связываются с положительно заряженными ионами металлов в растворе и тем самым предотвращают образование нерастворимых осадков с другими ионами, которые могут присутствовать.
Глюкуроновая кислота действует как хелатирующий агент в широком диапазоне pH.
Глюкуроновая кислота эффективна в образовании стабильных хелатов с ионами двух- и трехвалентных металлов, таких как кальций, медь, железо, алюминий и другие металлы, уменьшая неблагоприятное воздействие этих металлов на системы.
Глюкуроновая кислота также действует как увлажнитель, что означает, что глюкуроновая кислота притягивает воду и увеличивает гидратацию продуктов.
Глюкуроновая кислота используется в качестве высокоэффективного хелатирующего агента, технологической добавки и увлажнителя во множестве областей применения и продуктовых секторов.
Глюкуроновая кислота, мягкая органическая кислота, полученная из сахара, в основном используется в качестве регулятора кислотности и хелатирующего агента в пищевых продуктах с европейской пищевой добавкой E574. Этот ингредиент также используется для производства глюконатов (E576, 577, 578, 579, 585) и глюконо-дельта-лактон (E575) для использования в различных пищевых продуктах и других областях.
Как производится глюкуроновая кислота?
Как правило, глюкуроновая кислота производится путем окисления D-глюкозы (полученной в результате гидролиза крахмала) с помощью различных производственных процессов:
бромная вода
Микроорганизмы, такие как Aspergillus niger и Acetobactor suboxydans Ферменты, полученные из микроорганизмов
Какое использование глюкуроновой кислоты?
В основном используется из-за разрыхлителей и кислотности в пищевых продуктах; хелатирующие и отдушки в косметических продуктах; также его можно использовать в промышленности для хелатирования тяжелых металлов.
еда
Следующая еда может содержать глюкуроновую кислоту:
Хлебобулочные изделия: в качестве разрыхлителя в составе разрыхлителя для увеличения объема теста за счет выделения газа в результате реакции с пищевой содой.
Молочные продукты: как хелатирующий агент и предотвращающий появление молочного камня.
Некоторые продукты питания и напитки: в качестве регулятора кислотности для передачи мягкой органической кислоты и регулирования уровня pH, а также в качестве консерванта и противогрибкового агента.
Также глюкуроновую кислоту можно использовать для очистки алюминиевых банок.
Питание животных
Глюкуроновая кислота действует как слабая кислота в кормах для поросят, птице и аквакультуре, обеспечивая пищеварение и способствуя росту, а также увеличивая производство масляной кислоты и SCFA (короткоцепочечных жирных кислот).
косметические средства
Глюкуроновая кислота может использоваться в качестве хелатирующего и парфюмерного агента в косметических продуктах и средствах личной гигиены.
Промышленное использование
Способность хелатировать тяжелые металлы сильнее, чем у EDTA, например, хелатировать кальций, железо, медь и алюминий в щелочных условиях.
Глюкуроновая кислота может использоваться в моющих средствах, гальванике, текстиле и так далее.
Глюкуроновая кислота, продукт окисления глюкозы, является слабой, не едкой и не агрессивной, нетоксичной и легко биоразлагаемой органической кислотой, представляющей большой интерес для многих применений.
В качестве многофункциональной угольной кислоты, относящейся к основным химическим веществам, и благодаря своим физиологическим и химическим характеристикам, сама глюкуроновая кислота, ее соли (например, соли щелочных металлов, особенно глюконат натрия) и форма глюконолактона нашли широкое применение в химической и фармацевтической промышленности. , пищевая, строительная и другие отрасли.
Настоящая обзорная статья представляет исчерпывающую информацию из патентной библиографии по производству глюкуроновой кислоты и сравнивает преимущества и недостатки известных процессов.
В международной библиографии и патентной литературе за последние 100 лет описаны многочисленные производственные процессы по производству глюкуроновой кислоты из глюкозы, включая химический и электрохимический катализ, ферментативный биокатализ свободными или иммобилизованными ферментами в специализированных ферментных биореакторах, а также прерывистую и непрерывную ферментацию. процессы с использованием свободно растущих или иммобилизованных клеток различных микроорганизмов, включая бактерии, дрожжеподобные грибы и грибы.
В качестве альтернативы, были разработаны и подробно описаны новые превосходные процессы ферментации для непрерывного и прерывистого производства глюкуроновой кислоты изолированными штаммами дрожжеподобной плесени Aureobasidium pullulans, предлагая многочисленные преимущества по сравнению с традиционными прерывистыми процессами грибов.
Многочисленные применения глюкуроновой кислоты и некоторых ее солей вызывают растущий интерес к этим соединениям и уровням их производства.
Хотя глюкуроновую кислоту и глюконаты можно получить химическим путем, в настоящее время они почти исключительно производятся биотехнологическими методами, в основном методами, основанными на грибах.
Однако продолжается поиск альтернативных микроорганизмов, чтобы избежать проблем, связанных с использованием грибов для этой цели, и повысить продуктивность процесса.
Особенно многообещающими в этом отношении являются уксуснокислые бактерии, особенно штаммы Gluconobacter.
ОПИСАНИЕ:
Глюкуроновая кислота состоит из равновесия между свободной кислотой и двумя лактонами.
На это равновесие влияют концентрация и температура смеси.
Высокая концентрация дельта-лактона будет способствовать сдвигу равновесия в сторону образования гамма-лактона и наоборот.
Низкая температура способствует образованию глюконо-дельта-лактон, в то время как высокие температуры увеличивают образование глюконо-гамма-лактон.
В нормальных условиях PMP-глюкуроновая кислота демонстрирует стабильную стабилизацию по отношению к глюкуроновым кислотам от прозрачного до светло-желтого цвета с низким уровнем коррозионной активности и токсичности.
ЗАЯВЛЕНИЕ:
Глюкуроновая кислота обладает разнообразными свойствами, так как является полигидроксикарбоновой кислотой с гидроксильными и карбоксильными группами, которые могут вступать в реакцию.
Концентрированные растворы глюкуроновой кислоты содержат некоторое количество лактона (GDL), нейтрального циклического эфира, который менее растворим на холоду и не обладает действительными кислотными свойствами.
Около 5% GdL присутствует в растворе глюкуроновой кислоты при комнатной температуре.
Выдающимся свойством глюкуроновой кислоты является превосходная хелатирующая способность глюкуроновой кислоты, особенно в щелочных и концентрированных щелочных растворах.
В этом отношении глюкуроновая кислота превосходит все другие хелатирующие агенты, такие как EDTA, NTA и родственные соединения.
Кальций, железо, медь, алюминий и другие тяжелые металлы прочно хелатируются в щелочном растворе и замаскированы таким образом, чтобы исключить их влияние.
Глюкуроновая кислота устойчива при температуре кипения даже в концентрированных щелочных растворах.
Однако глюкуроновая кислота легко и полностью разлагается на очистных сооружениях.
Этим видам требуется внешнее поступление аскорбата, потому что у них отсутствует биосинтетический фермент L-гулонолактоноксидаза.
Глюкуронид 4-метилумбеллиферил-β-D-глюкуронид (MUG) используется для проверки наличия Escherichia coli.
E. coli продуцирует фермент β-глюкуронидазу, который гидролизует молекулу MUG до флуоресцентного продукта, обнаруживаемого в ультрафиолетовом свете.
Глюкуроновая кислота (C6H10O7), производное глюкозы, вырабатывается в печени человека и большинства животных.
Глюкуроновая кислота — это хорошо растворимое соединение, которое может связываться с такими веществами, как гормоны, лекарства и токсины, чтобы облегчить их перенос по телу.
Таким образом, глюкуроновая кислота в значительной степени отвечает за устранение ядовитых веществ, таких как полихлорированные бифенилы.
Общее описание
Глюкуроновая кислота является одним из компонентов основной цепи ксилана, гемицеллюлозы, присутствующей в стенке растительной клетки.
Номер CAS: 528-16-5
Молекулярная формула: C6H10O7
Молекулярный вес: 194,14
Химическая чистота: мин. 98% [1H-ЯМР]
Внешний вид: белое кристаллическое твердое вещество
Точка плавления: 166-168 ° C
СИНОНИМЫ:
Глюкуроновая кислота [Wiki]
18968-14-4 [RN]
229-486-4 [EINECS]
576-37-4 [RN]
8A5D83Q4RW
Ацид D-глюкуроник [французский] [название ACD / IUPAC]
D — (+) — глюкуроновая кислота
D — (+) ГЛЮКУРОНОВАЯ КИСЛОТА
D-глюкуроновая кислота [ACD / название индекса] [название ACD / IUPAC]
D-Glucuronsäure [немецкий] [название ACD / IUPAC]
(2S, 3S, 4S, 5R) -2,3,4,5-тетрагидрокси-6-оксогексановая кислота
(2S, 3S, 4S, 5R) -2,3,4,5-Тетрагидрокси-6-оксогексановая кислота
12758-41-7 [RN]
1700-90-8 [RN]
1727083 [Beilstein]
2050314 [Beilstein]
229-486-4MFCD00077778
36116-79-7 [RN]
63074-07-7 [RN]
6556123
87090-89-9 [RN]
87246-82-0 [RN]
альдгидо-D-глюкуронат
альдгидо-D-глюкуроновая кислота
d (+) — глюкуроновая кислота
D (+) — глюкуроновая кислота
D020723
d-глюкуроновая кислота, 98%
d-глюкуроновая кислота, свободная кислота
D-ГЛЮКУРОНОВАЯ КИСЛОТА
(2S, 3S, 4S, 5R) -3,4,5,6-тетрагидроксиоксан-2-карбоновая кислота
- Справочник
- Справочник структурных формул
- г
- Глюкуроновая кислота
Глюкуроновая кислота
HO_(A-15)_(x%a:1.4,y%d:.4)<_(A-115)HOOC>_(x%b:1.5,y-%d)O_(x%c:.6,y1.2)<-~OH>_(x-%a,y-%d,W+)<_(x.3,y.8,w1)OH>_(x-%b,y%d)<_(A-165,w1)HO>_(W-)#2
O`//|<`-H><-OH>|<`-HO><-H>|<`-H><-OH>|<`-H><-OH>|`/O/OH
HO|O`|/<`|wOH><|dOH>/<`|dOH><|dOH>/`||O
Брутто-формула: C6H10O7
Молекулярная масса: 194.139
Химический состав
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод (Carbon) | 12.011 | 6 | 37.1% |
| H | Водород (Hydrogen) | 1.008 | 10 | 5.2% |
| O | Кислород (Oxygen) | 15.999 | 7 | 57.7% |
Синонимы
- Глюкуроновая кислота
- Glucuronic acid
Входит в группы
Уроновые кислоты
глюкуроновая кислота
| глюкуроновая кислота | |
 |
|
 |
|
| Структура глюкуроновой кислоты | |
| Удостоверение личности | |
|---|---|
| название ИЮПАК | 3,4,5,6-тетрагидрокситетрагидропиран -2-карбоновая кислота |
| Синонимы |
|
| КАС № _ | 6556-12-3 |
| ЭЧА № _ | 100.026.807 |
| ЭК № _ | 229-486-4 |
| PubChem | 610 |
| УЛЫБКИ | |
| Внешность | бесцветный порошок |
| Химические свойства | |
| Формула | C 6 H 10 O 7 [Изомеры] |
| Молярная масса [ 1 ] | 194,139 4 ± 0,007 6 г / моль С 37,12 %, Н 5,19 %, О 57,69 %, |
| Физические свойства | |
| Температура плавления | 165 °С [ 2 ] |
| Меры предосторожности | |
| Директива 67/548/ЕЭС | |
|
Фразы R : 36/37/38, S-фразы : 26, 37/39, |
|
| Родственные соединения | |
| Изомер(ы) | глюконовая кислота , идуроновая кислота , галактуроновая кислота |
|
|
|
| Единицы СИ и CNTP , если не указано иное. | |
| модифицировать |
Глюкуроновая кислота представляет собой уроновую кислоту , образованную из глюкозы , окисленной по ее углероду номер 6. Она входит в состав гликозаминогликанов , таких как гепарин , гиалуроновая кислота и т. д.
Глюкуроновая кислота присутствует в глицирризиновой кислоте в виде димера , присоединенного к терпену .
Глюконовая кислота также служит для связывания билирубина в гепатоцитах , делая его водорастворимым и позволяя выводить его с желчью .
Примечания и ссылки
- ↑ Молярная масса рассчитана из « Атомных весов элементов 2007 » , на www.chem.qmul.ac.uk.
- ↑ (en) « Глюкуроновая кислота » , на ChemIDplus , по состоянию на 23 июля 2008 г.
From Wikipedia, the free encyclopedia
|
|
|
|
| Names | |
|---|---|
| IUPAC name
(2S,3S,4S,5R,6R)-3,4,5,6-Tetrahydroxyoxane-2-carboxylic acid |
|
| Other names
β-D-Glucopyranuronic acid, GlcA |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.026.807 |
| KEGG |
|
| MeSH | Glucuronic+acid |
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C6H10O7 |
| Molar mass | 194.139 g·mol−1 |
| Melting point | 159 to 161 °C (318 to 322 °F; 432 to 434 K)[1] |
| Related compounds | |
|
Related uronic acids |
Alluronic acid, Altruronic acid, Arabinuronic acid, Fructuronic acid, Galacturonic acid, Guluronic acid, Iduronic acid, Lyxuronic acid, Mannuronic acid, Psicuronic acid, Riburonic acid, Ribuluronic acid, Sorburonic acid, Tagaturonic acid, Taluronic acid, Xyluluronic acid, Xyluronic acid |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Glucuronic acid (from Greek γλεῦκος «wine, must» and οὖρον «urine«) is a uronic acid that was first isolated from urine (hence the name). It is found in many gums such as gum arabic (approx. 18%), xanthan, and kombucha tea and is important for the metabolism of microorganisms, plants and animals.
Properties[edit]
The β—D-methyl glycoside of glucuronic acid in the low energy 4C1 conformation of D-glucose
Glucuronic acid is a sugar acid derived from glucose, with its sixth carbon atom oxidized to a carboxylic acid. In living beings, this primary oxidation occurs with UDP-α-D-glucose (UDPG), not with the free sugar.
Glucuronic acid, like its precursor glucose, can exist as a linear (carboxo-)aldohexose (<1%), or as a cyclic hemiacetal (furanose or pyranose). Aldohexoses such as D-glucose are capable of forming two furanose forms (α and β) and two pyranose forms (α and β). By the Fischer convention, glucuronic acid has two stereoisomers (enantiomers), D— and L-glucuronic acid, depending on its configuration at C-5. Most physiological sugars are of the D-configuration. Due to ring closure, cyclic sugars have another asymmetric carbon atom (C-1), resulting in two more stereoisomers, named anomers. Depending on the configuration at C-1, there are two anomers of glucuronic acid, α- and β-form. In β-D-glucuronic acid the C-1 hydroxy group is on the same side of the pyranose ring as the carboxyl group. In the free sugar acid, the β-form is prevalent (~64%), whereas in the organism, the α-form UDP-α-D-glucuronic acid (UDPGA) predominates.
Carbohydrate stereoisomers, which differ in configuration at only one (other) asymmetric C-atom, are named epimers. For example, D-mannuronic (C-2), D-alluronic (C-3), D-galacturonic (C-4), and L-iduronic acid (C-5) are epimers of glucuronic acid.
The nonplanar pyranose rings can assume either chair (in 2 variants) or boat conformation. The preferred conformation depends on spatial interference or other interactions of the substituents. The pyranose form of D-glucose and its derivative D-glucuronic acid prefer the chair 4C1.
Additional oxidation at C-1 to the carboxyl level yields the dicarboxylic glucaric acid. Glucuronolactone is the self-ester (lactone) of glucuronic acid.
Direct oxidation of an aldose affects the aldehyde group first. A laboratory synthesis of a uronic acid from an aldose requires protecting the aldehyde and hydroxy groups from oxidation, for example by conversion to cyclic acetals (e. g., acetonides).
Sodium glucuronate can be produced by the direct oxidation of starch with concentrated nitric acid. In this preparation the low availability of water keeps the starch polymers from hydrolyzing and only oxidizes the free hydroxyls, in much the same way that nitrogen dioxide would oxidize the starch. Once this reaction is complete, and the starch/nitric acid mix turns clear (after giving off nitrogen dioxide gas), the solution can be diluted, and hydrolyzed with another mineral acid. Then the oxidation is slowly quenched with sodium hydroxide (or sodium bicarbonate), forming sodium glucuronate, which can be crystallized out of solution. With transition metals, it forms complexes such as iron(III) glucuronate, iron(II) glucuronate, and copper(II) glucuronate.
Functions[edit]
Proteoglycans[edit]
Glucuronic acid is a common building block of proteoglycans and glycoglycerolipids:[citation needed]
- Heparin is an inhibitor of blood coagulation, and occurs in mast cells, lung and liver.
- Chondroitin sulfate is found in large quantities in cartilage, aorta, connective tissue, bone, and skin.
- Dermatan sulfate is a proteoglycan in skin, heart, and blood vessels.
- Keratan sulfate is found in the cornea, cartilage, and bone.
- Hyaluronic acid occurs in large quantities in connective tissues, skin, cartilage, and synovial fluid.
- Glycoglycerolipids of glucuronic or galacturonic acids form the cell walls of bacteria.
Glucuronidation[edit]
UDP-α-D-glucuronic acid (UDPGA) is often involved in the phase II metabolism (conjugation) of lipophilic xeno- and endobiotics. These linkages involve glycosidic bonds with thiol, amine and hydroxy groups, or esterification with the carboxyl and hydroxyl groups. This linkage process is known as glucuronidation (or glucuronide conjugation). Glucuronidation occurs mainly in the liver, although the enzymes responsible for its catalysis, UDP-glucuronyltransferases (UDP-GT), have been found in all major body organs, e.g., intestine, kidneys, brain, adrenal gland, spleen, and thymus.[2][3] Analogous reactions occur with other UDP-uronic acids (e. g., D-galacturonic acid).
Glycosides resulting from glucuronidation are named β-D-glucuronides, its salts and esters are named glucuronates. The human body uses glucuronidation to make alcohols, phenols, carboxylic acids, mercaptans, primary and secondary aliphatic amines, and carbamates more water-soluble, and, in this way, allows for their subsequent elimination from the body through urine or faeces (via bile from the liver) at a significantly increased rate. The carboxyl group is ionized at physiological pH, making the conjugated compound water-soluble. Compounds with molecular masses > 60,000 are too large for renal excretion and will be excreted with bile into the intestine. Neonates are deficient in this conjugating system, making them particularly vulnerable to drugs such as chloramphenicol, which is inactivated by the addition of glucuronic acid, resulting in gray baby syndrome. Bilirubin is excreted in the bile as bilirubin diglucuronide (80%), bilirubin glucuronide (20%), and unconjugated bilirubin (< 1%). In the Crigler–Najjar syndrome and the Gilbert syndrome, UDPGT activity is reduced or nearly absent due to mutations, resulting in jaundice.
It is possible to exhaust the body’s supply of glucuronic acid by combining multiple drugs/substances whose metabolism and excretion are primarily or entirely dependent on glucuronidation. Although most such substances have secondary metabolic routes which become prominent following GCA depletion, the rate of metabolism is reduced enough to produce a marked accumulation of all GCA substrates in the system; this often increases drug concentrations in the blood by medically relevant amounts. In the most severe cases permanent and debilitating organ damage (particularly the liver, kidneys, heart, and brain), and even death, have been known to occur. Ethanol, morphine, paracetamol (acetaminophen), cyclooxygenase inhibitors (NSAIDs), endogenous steroids, and certain benzodiazepines are all capable of contributing to GCA depletion, with ethanol and acetaminophen being the most commonly implicated substances involved in cases of accidental overdoses which have been positively attributed to glucuronic acid depletion.
Excessive quantities of GCA can also be hazardous to health[citation needed], tobacco smoke, most barbiturates, and some carbamates are known to actually stimulate GCA production. Increased GCA activity results in a decrease of the concentration and metabolic half-life of glucuronic acid substrates, causing the plasma levels of glucuronidated drugs to fall below their therapeutic threshold. Excessive glucuronidation of the substrates may result in an inadequate response to traditional doses of affected medications and, unless the drug has a very wide therapeutic index, will generally result in the acute failure of the pharmacotherapy and necessitate the transition of one or more implicated drugs to an equivalent regimen of non-glucuronidated alternatives. A select number of antidepressants and a wide range of anti-psychotic agents are glucuronidation ligands but due to their delayed mechanism of action and pharmacokinetic properties the decrease of their plasma concentrations may not be immediately apparent and tends to present as a sudden and intense relapse of symptoms instead of a gradual regression to the behaviors and thought patterns exhibited by the patient prior to the initiation of their pharmacological treatment.
Glucuronides may be hydrolyzed by β-glucuronidase present in intestinal microflora to the respective aglycone, which may be reabsorbed from the intestine and translocated back to the liver with the blood. The resulting cycle is called enterohepatic circulation. Compounds that undergo enterohepatic circulation are only slowly excreted and usually have a longer half-life in the body.
Certain glucuronides are electrophilic and may function in toxication processes. Covalent binding of the aglycone portions of several carboxylic acid (ester) glucuronides is known to occur to nucleophilic sites on serum albumin via transacylation reactions, for example.[4]
Phenols, quantitatively important P450-derived metabolites of aromatic hydrocarbons, are substrates for both UDP-GT and sulfotransferases. Glucuronides predominate with phenol or a phenol precursor (benzene) in mammals because sulfate formation is a high-affinity, low-capacity system (due to sulfate depletion), whereas glucuronidation is a low-affinity, high-capacity (although still exhaustible) system.[4]
Role in disease[edit]
Glucuronic acid, as well as the glucuronidated metabolite of ethanol, ethyl glucuronide (ETG), act on toll-like receptor 4 to aggravate both acute and chronic inflammatory conditions as well as increasing the perceived severity of pain in patients with chronic pain conditions, via up-regulation of the production and release of endogenous inflammatory signaling molecules within the body. Long-term agonism of the TLR4 receptor (such as that which occurs from GCA, ETG, and opiates) results in chronically painful conditions being perceived as considerably more severe than they did previously while pre-existing tolerable yet occasionally painful activities can become more painful than before and will begin to be aggravated by briefer and less physically demanding activities. It can also cause equally painful responses to decreasingly noxious (irritating) stimuli, eventually resulting in considerable agony from stimuli which wouldn’t cause any amount of pain to most individuals.[5]
Use[edit]
Determination of urinary steroids and of steroid conjugates in blood. Ethyl glucuronide and ethyl sulfate are excreted in urine as metabolites of ethanol and are used to monitor alcohol use or dependence.
Glucuronic acid and gluconic acid are fermentation products in Kombucha tea.[6]
Glucuronic acid is a precursor of ascorbic acid (vitamin C, formerly called L-hexuronic acid). Ascorbate can be biosynthesized by higher plants, algae, yeast and most animals. An adult goat produces ~13 g of vitamin C per day. This ability is lacking in some mammals (including humans and guinea pigs) and also in insects, invertebrates and most fishes. These species require external ascorbate supply, because they lack the biosynthetic enzyme L-gulonolactone oxidase.[7]
The glucuronide 4-methylumbelliferyl-β-D-glucuronide (MUG) is used to test for the presence of Escherichia coli. E. coli produces the enzyme β-glucuronidase, which hydrolyzes the MUG molecule to a fluorescent product that is detectable under ultraviolet light.
See also[edit]
- Gluconic acid
- Isosaccharinic acid
- Uronic acid
References[edit]
- ^ D-Glucuronic acid at Sigma-Aldrich
- ^ Ohno, Shuji; Nakajin, Shizuo (2008-10-06). «Determination of mRNA Expression of Human UDP-Glucuronosyltransferases and Application for Localization in Various Human Tissues by Real-Time Reverse Transcriptase-Polymerase Chain Reaction». Drug Metabolism and Disposition. American Society for Pharmacology and Experimental Therapeutics. 37 (1): 32–40. doi:10.1124/dmd.108.023598. PMID 18838504. S2CID 5150289. Retrieved 2010-11-07.
- ^ Bock K, Köhle C (2005). «UDP-glucuronosyltransferase 1A6: structural, functional, and regulatory aspects». Methods Enzymol. Methods in Enzymology. 400: 57–75. doi:10.1016/S0076-6879(05)00004-2. ISBN 9780121828059. PMID 16399343.
- ^ a b Tanya C McCarthy; Christopher J Sinal (2005), «Biotransformation», Encyclopedia of Toxicology, vol. 1 (2nd ed.), Elsevier, pp. 299–312, ISBN 0-12-745354-7
- ^ Lewis SS, Hutchinson MR, Zhang Y, Hund DK, Maier SF, Rice KC, Watkins LR (2013). «Glucuronic acid and the ethanol metabolite ethyl-glucuronide cause toll-like receptor 4 activation and enhanced pain». Brain, Behavior, and Immunity. 30: 24–32. doi:10.1016/j.bbi.2013.01.005. PMC 3641160. PMID 23348028.
- ^ Blanc, P.J. (February 1996). «Characterization of the tea fungus metabolites». Biotechnology Letters. 18 (2): 139–142. doi:10.1007/BF00128667. S2CID 34822312.
- ^ Gerhard Michal; Dietmar Schomburg (2012), Biochemical Pathways: An Atlas of Biochemistry and Molecular Biology (2nd ed.), Wiley, p. 145a, ISBN 978-0-470-14684-2
00:00
Оксана Михайловна Драпкина, профессор, доктор медицинских наук:
– В нашей секции «Гепатология» профессор Рейзис Анна Романовна. Синдром Жильбера.
Обычно очень много вопросов вызывает.
«Синдром Жильбера. Современные воззрения, исходы и терапия».
Ара Романовна Рейзис, профессор, доктор медицинских наук:
– Дорогие коллеги.
Существуют заболевания, которые сквозной линией проходят через всю жизнь человека – от детства и отрочества до самых преклонных лет. На этом пути попадают в поле зрения врачей самых разных специальностей, очень широкого круга врачей. Важно, чтобы этот широкий круг был в курсе того нового, что происходит в наших представлениях об этом заболевании.
К таким заболеваниям относится синдром Жильбера (СЖ). С тех пор как в 1901-м году Августин Жильбер описал этот синдром, прошло более века. За это время появилось много нового в наших представлениях об этом заболевании. Именно в аспекте этого нового мне и хочется сегодня представить эту патологию.
С институтских времен мы помним, что это такое. Синдром Жильбера – то наследственное нарушение обмена билирубина, которое состоит в недостаточности его глюкуронирования (обязательного для его поступления в желчевыводящие пути) и развитии в связи с этим доброкачественной неконьюгированной гипербилирубинемии.
Мы знаем также тот набор клинических и лабораторных критериев, которые всегда лежали в основе постановки этого диагноза нами. Известно, что он выявляется в основном у подростков в препубертатном и пубертатном возрасте. Чаще всего в семье мы имеем некие данные о наследственной семейной предрасположенности к этому синдрому.
Как правило, интенсивность желтухи небольшая. Максимум – субиктеричность кожи и иктеричность склер. Появление или усиление желтухи часто связано с интеркурентными заболеваниями или с голоданием, физическим или психоэмоциональным перенапряжением. А также с применением ряда лекарств. Особенно так называемых аглюконов, сульфамидов, группы салицилатов. Об этом мы будем говорить чуть дальше более подробно.
Чаще всего гепатомегалия отсутствует либо незначительная. В лабораторных тестах повышение билирубина в 2-5 (редко более) раз за счет преимущественно свободной фракции. При нормальной активности трансаминаз и отсутствии маркеров вирусных гепатитов и данных за гемолитическую анемию.
Такого набора клинико-лабораторных данных нам бывало достаточно, чтобы диагностировать этот синдром.
03:24
Последнее время ситуация изменилась в том смысле, что мы получили возможность объективного генетического анализа, который подтверждает или не подтверждает этот диагноз.
Стало известно генетическое лицо СЖ, которое заключается в том, что в промоторной области кодирующего фермента глюкуронил-трансферазы происходит мутация. Она заключается в ди-нуклеотивной вставке тирозин-аргинин. Эта вставка повторяется различное число раз. В зависимости от этого мы имеем либо классический вариант СЖ, либо его вариации (аллели).
Возможность объективного подтверждения этого диагноза, объективной его постановки во многом коренным образом изменила наши представления об этом синдроме. Изменила некоторые мифы, которые были достаточно устойчивы на протяжении всего века, что мы знакомы с этим синдромом.
Первое – распространенность СЖ. Считалось, что это достаточно редкое заболевание. С помощью генетического диагноза стало очевидно, что это достаточно частое заболевание. От 7% до 10% Земного шара страдают СЖ. Это каждый десятый. Для наследственного заболевания это необычайная частота.
В африканской популяции до 36%. В нашей популяции (европейской и азиатской) 2-5%. В нашей стране и в нашей популяции происходит учащение постановки этого диагноза.
(Демонстрация слайда).
Данные нашей клиники, где с СЖ мы встречаемся как с объектом дифференциальной диагностики вирусного гепатита. За 20 лет мы имеем (с 1990-х годов до нынешнего времени) рост частоты постановки этого диагноза более чем в 4 раза.
Второй миф, который уходит в прошлое с возможностью генетической постановки диагноза СЖ. Это миф о том, что СЖ – это, прежде всего, желтуха. Это совершенно необязательный симптом для СЖ. Это лишь верхушка, видимая часть айсберга. Основная часть больных СЖ не имеет желтухи или проявляет ее в каких-то особых жизненных ситуациях. Это совсем не обязательный симптом, что тоже очень важно.
07:10
Третий миф, с которым мы должны в наше время расстаться. Миф о том, что СЖ – заболевание совершенно безобидное. Мы привыкли к тому, что это так и есть. Он не ведет к фиброзированию или переходу в цирроз печени. В связи с этим он не требует нашего внимания.
На самом деле в последнее время выяснилось, что он вносит очень серьезную лепту в развитие и частоту развития желчнокаменной болезни (ЖКБ) в мире. В частности, ряд исследований об этом говорит достаточно масштабно.
Генетическое исследование 2009-го года, где около двухсот пациентов с ЖКБ и около 150-ти пациентов без таковой были обследованы генетически на СЖ. Выяснилось с высокой достоверностью, что среди тех, кто имеет СЖ, существенно чаще встречается ЖКБ.
В 2010-м году появилось еще более масштабное исследование. Это мета-анализ целого ряда исследований. Оно охватывает около трех тысяч пациентов с ЖКБ и около полутора тысяч пациентов без нее. Выяснилось, что пациенты, у которых генетически подтвержден СЖ, имеют полный риск ЖКБ. Главным образом, этот привар имеют мужчины.
Женщины вообще чаще страдают ЖКБ в силу гормонального устройства, эстрогенов и так далее. Мужчины же попадают в эту категорию, главным образом, если имеют СЖ. Увеличение ЖКБ у мужчин при СЖ происходит на 21%.
Еще одно новое направление, совершенно новый аспект в наших современных представлениях о СЖ. Этот тот факт, что изучение особенностей метаболизма лекарств на фоне СЖ легло в основу возникновения совершенно нового направления в фармакологии. Так называемые фармакогенетики, которые имеют огромное значение для разработки лекарственных средств и их практического использования.
Многие лекарства, так называемые аглюконы для того, чтобы быть выведенными из организма и вообще пройти свой путь метаболизма в организме, должны также соединиться с глюкуроновой кислотой, как билирубин. Нагружают тот же самый фермент – глюкуронил-трансферазу.
Соответственно, билирубин из связи с глюкуроновой кислотой вытесняют. Нарушают его выведение в желчные канальцы, в результате чего и появляется желтуха.
10:57
При разработке и испытании целого ряда препаратов на большом контингенте пациентов фармакологи столкнулись с тем, что ряд пациентов выявляют выраженную желтуху. Это могло трактоваться как истинная гепатотоксичность препарата, что иногда бросало тень на весьма важные и перспективные препараты, существенные для соответствующей категории больных.
Работа 2011-го года показывает, как при испытании «Токсилизумаба» («Tocilizumab») – перспективного препарата, применяемого при ревматоидном артрите, у двух пациентов был высокий подъем уровня билирубина. Когда же этих пациентов обследовали, то оказалось, что у обоих этих пациентов (и только у них из всех участвующих в испытании) оказался генотип, характерный для СЖ.
Это вывело этот препарат из под подозрения в плане истинной гепатотоксичности.
Но количество соответствующих публикаций множится. Вот еще одно указание на это. При таком заболевании как акромегалия сейчас нередко бывает устойчивость к соматостатину. Новый препарат, который при этом испытывался, показал высокую степень, высокую частоту развития желтухи. Выяснилось, что у всех этих пациентов был СЖ.
Значительно более близкий нам пример – это противовирусная терапия хронического гепатита С интерферонами с «Рибавирином» («Ribavirin»). Такая же картина. Два пациента дали подъем уровня билирубина в 17 раз. Но оказалось, что именно у этих двух пациентов имеется СЖ. Отмена «Рибавирина» привела к нормализации билирубина. Дополнительной тени на «Рибавирин» не бросило.
До сих пор речь шла преимущественно о данных мировой литературы. Хочу привести собственные данные за 20 лет детской клиники. Мы за это время наблюдали 181-го ребенка и подростка с СЖ. Выяснилось, что очень высокий процент этих пациентов (более половины из них) имели дискинезию желчевыводящих путей со сладж-синдромом и без такового, имели развитие ЖКБ, при том, что это дети.
Но особенно важные и интересные сведения мы получили тогда, когда своих пациентов разделили на две группы, на два десятилетия: 1992 – 2000 годы и 2001 – 2010 годы. Эти десятилетия отличались тем, что на первом этапе они не получали препаратов «Урсодезоксихолиевой кислоты» («Ursodeoxycholic acid»). Или получали по показаниям, когда мы уже имели развившуюся картину поражения билиарного тракта.
У этих пациентов нормальное состояние билиарного тракта было только у 11,8% детей. У 76,5% имелась дискинезия желчевыводящих путей, почти у половины из них со сладж-синдромом. Почти у 12% детей уже развившаяся ЖКБ.
15:40
На втором этапе (второе десятилетие) 105 пациентов. Уже начиная с первых шагов, как только ставился диагноз СЖ, проводили превентивные курсы «Урсодезоксихолиевой кислоты» (УДХК) два раза в год в виде препарата «Урсосан» («Ursosan»), с которым мы работаем уже много лет.
Результаты. У этих пациентов почти в 65% случаев нормальное состояние билиарного тракта. Количество больных с ЖКБ сократилось в 4,5 раза (до 2,8%).
Это говорит о том, что все-таки СЖ заслуживает нашего внимания и некоторого терапевтического воздействия. Оно направлено на снижение общего уровня билирубина, как непрямого, свободного для уменьшения общей интоксикации (поскольку непрямой билирубин токсичен для нервной системы). А также снижение прямого связанного билирубина для предотвращения поражений билиарного тракта.
Что мы для этого сегодня имеем. В плане снижения уровня непрямого билирубина по-прежнему применяется препарат «Фенобарбитал» («Phenobarbital»). Известно, что он имеет некую способность повышения активности глюкуранил-трансфераз. Благодаря этому в какой-то степени снижается уровень непрямой гипербилирубинемии и уменьшается интоксикация, влияние на центральную нервную систему (ЦНС).
Для того чтобы уменьшить или предотвратить поражение билиарного тракта, мы считаем правильным применение УДХК («Урсосан», в частности). Она, по нашим данным, существенно уменьшает или даже предотвращает осложнения со стороны билиарного тракта, включая ЖКБ.
18:17
(Демонстрация слайда).
Здесь есть стрелочка от УДХК к уменьшению влияния на ЦНС. Нам попались на глаза любопытные данные пока экспериментальных исследований. Они говорят о том, что УДХК способна уменьшить чувствительность нервных клеток к поражающему действию непрямого билирубина.
Культура нервных клеток крысы (астроциты и нейроны) инкубировались с непрямым билирубином или с непрямым билирубином в присутствии УДХК. В случае инкубации моно имелось повышение апоптоза в 4-7 раз в этих клетках.
В случае, когда они инкубировались непрямым билирубином в присутствии УДХК, шла существенная защита (60%). Снижение уровня апоптоза менее 7%.
Таким образом, лечение СЖ на сегодня, как нам представляется, что должно в себе содержать. Что касается диетических ограничений, то они могут быть связаны только с возможной фолий-патией и носить такой характер. Достаточно строгими они быть не должны, но в порядке здорового образа жизни.
Что касается второго пункта – режим щажения – он очень важен. Пациенты должны об этом хорошо знать. Физическое и психоэмоциональное перенапряжение чрезвычайно неблагоприятно и напрямую приведет к пожелтению.
Очень важным пунктом является медикаментозное щажение – минимизация лекарственных воздействий по всем направлениям. В первую очередь, это касается глюкокортикостероидов, которые являются прямыми аглюконами. Салицилаты – вся группа. Сульфаниламиды. «Диакарб» («Diacarb»), достаточно часто применяющийся. «Ментол» («Меnthоlum») и целый ряд других препаратов.
Вообще на знамени пациента с СЖ должно быть написано: «Минимизация лекарственных воздействий».
Что касается лекарственной терапии самого синдрома, то «Фенобарбиталом» в возрастной дозировке пользуются только в случаях высокого подъема билирубина (выше пяти и более норм). При меньшем уровне подъема билирубина – «Валокордин» («Valocordin»), который в малых количествах содержит фенобарбитал. У детишек или подростков 1 капля на год жизни, 20 – 30 капель у взрослых 3 раза в сутки.
Что касается УДХК, то 10 – 12 мг на килограмм в сутки. Профилактические курсы по 3 месяца (весна-осень) ежегодно полезны и, как я показала на нашем опыте, достаточно эффективны в плане профилактики поражения желчевыводящих путей и ЖКБ.
Показано при повышении прямого билирубина до его нормализации. При возникновении дискинезии желчевыводящих путей со сладж-синдромом до их ликвидации и 1-2 месяца после для удержания полученного.
22:24
Таким образом, СЖ – это наследственное нарушение билирубинного обмена, своевременное распознавание и коррекция которого имеет существенное значение, как для пациента, так и для популяции в целом.
Современный этап развития медицины, сделавший возможным объективное подтверждение диагноза СЖ генетическими методами, ставит его диагностику на новую ступень.
Доброкачественность синдрома, состоящая в отсутствии фиброзирования и исхода в цирроз печени, не исключает таких неблагоприятных последствий, как заболевания билиарного тракта, вплоть до ЖКБ.
Последнее. Для профилактики и лечения этих неблагоприятных последствий целесообразно применение УДХК, в частности «Урсосана».
Благодарю за внимание.



