Гемолитическая желтуха (Надпечёночная желтуха, Плейохолическая желтуха)
Гемолитическая желтуха — это вариант надпеченочного желтушного синдрома, обусловленный гемолизом эритроцитов. Проявляется желтушностью и бледностью кожных покровов и слизистых, спленомегалией, потемнением мочи и кала, гемолитическими кризами. Диагностируется с помощью общего анализа крови, определения концентрации непрямого и общего билирубина, УЗИ органов брюшной полости. Для лечения используют кортикостероиды, цитостатики, антибиотики, активаторы печеночных ферментов, инфузионную и фототерапию, переливание компонентов крови. По показаниям проводят спленэктомию.
Общие сведения
Гемолитическая (плейохолическая) желтуха развивается при превышении уровня свободного билирубина, который может беспрепятственно конъюгироваться в печени. В обычных условиях в человеческом организме разрушается до 100-200 млн. эритроцитов за час, при этом срок жизни красных клеточных элементов крови составляет в среднем 120 дней. Из 1 г гемоглобина, выделяющегося при гемолизе, образуется 35 мг неконъюгированного пигмента (около 250-350 г/сут).
Печень обладает 3-4-кратным функциональным резервом для связывания избытка билирубина. При укорочении срока жизни эритроцитов, их ускоренном разрушении концентрация пигмента превышает предельный печеночный порог конъюгации, непрямой билирубин накапливается в крови, откладывается в тканях, что сопровождается формированием характерной клинической картины.
Гемолитическая желтуха
Причины
Заболевание развивается на фоне гемолиза с образованием большого количества непрямого билирубина, который не успевает конъюгироваться гепатоцитами. Гемолитическая форма желтухи вызывается теми же этиологическими факторами, что и патологические состояния с усиленным внутрисосудистым или внесосудистым разрушением эритроцитов. Специалисты в сфере современной гастроэнтерологии и гематологии выделяют следующие причины расстройства:
- Наследственные дефекты эритроцитов и гемоглобина. Гемолиз может быть обусловлен генетически обусловленными энзимопатиями (недостаточностью пируваткиназы, глюкозо-6-фосфатдегидрогеназы), несостоятельностью эритроцитарных оболочек (наследственным микросфероцитозом, акантоцитозом, овалоцитозом, пароксизмальной ночной гемоглобинурией). Желтуха гемолитического типа также наблюдается при гемоглобинопатиях (талассемии, серповидно-клеточной анемии и др.).
- Воздействие гемолитических плазматических факторов. Реакцию гемолиза вызывают антитела при гемолитической болезни новорожденных и переливании изонесовместимой крови, гемолизины возбудителей кори, краснухи, сепсиса, эпидемического паротита, лептоспироза, малярийные плазмодии, змеиный и другие гемотоксичные яды (сероводород, мышьяк, свинец, фосфор, анилин, нитробензол), Эритроциты разрушаются под влиянием ряда фармпрепаратов (сульфаниламидов, антипиретиков, хининов).
- Обширные кровоизлияния, инфаркты. Повышенное образование свободного билирубина связано с массивным распадом элементов крови при рассасывании крупных гематом в мягких тканях, паренхиматозных органах, полостях тела. Гемолитической надпеченочной желтухой осложняются массивные желудочно-кишечные кровотечения, расслаивающая аневризма аорты, инфаркт миокарда, легкого, геморрагический инсульт, гемоторакс. Обычно такое состояние связано с существующим заболеванием, травмой.
- Механическое разрушение эритроцитов в сосудах. Красные кровяные тельца подвергаются внутрисосудистому гемолизу при их сдавлении в периферических кровеносных сосудах, прилегающих к костным выступам (маршевая гемоглобинурия), турбуленции потока крови при дисфункции протезов сердечных клапанов. Гемолиз также возникает при прохождении эритроцитов через фибриновые депозиты в артериолах при ДВС-синдроме, гемолитико-уремическом синдроме, тромботической тромбоцитопенической пурпуре.
У части пациентов разрушение красных кровяных клеток с развитием надпеченочной желтухи наблюдается в рамках клинической картины злокачественных опухолей разной локализации, лейкозов, лимфопролиферативных заболеваний, пернициозной анемии Аддисона-Бирмера, системных патологий соединительной ткани. Гемотоксическое действие оказывают мощные ионизирующие воздействия при лучевой болезни, радиотерапии. Физиологическая желтуха возникает у новорожденных при усиленном гемолизе фетального гемоглобина на фоне низкой активности печеночных ферментов.
Патогенез
В основе механизма развития гемолитической желтухи лежит относительная функциональная недостаточность печеночных клеток, неспособных связать большое количество свободного билирубина, образовавшегося при гемолизе эритроцитов. Дополнительным патогенетическим фактором является нарушение внутриклеточного транспорта пигмента в гепатоцитах при его высокой концентрации. В результате неконъюгированный билирубин связывается с альбуминами и циркулирует в крови в виде водонерастворимых билирубин-альбуминовых комплексов, которые не могут выводиться с мочой.
Жирорастворимый свободный пигмент легко проникает через клеточные и митохондриальные мембраны, окрашивает в желтый цвет кожу и слизистые оболочки, нарушает процессы окислительного фосфорилирования, синтез белков, трансмембранный потенциал клеток. Поражение ядер головного мозга, особо чувствительных к токсическому эффекту непрямого билирубина, приводит к развитию энцефалопатии (ядерной желтухи) с выраженной неврологической симптоматикой. Связывающая способность альбуминов оказывается недостаточной при непрямой гипербилирубинемии более 260-550 мкмоль/л.
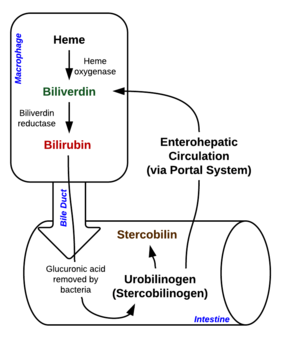
Активная конъюгация пигмента в печени сопровождается его усиленной экскрецией в просвет кишечника с образованием уробилиногена в тонкой кишке и затем стеркобилиногена — в толстой. Избыточное количество всосавшегося в кровь уробилиногена, который не может полностью элиминироваться гепатоцитами, продолжает циркулировать в крови. Высокий уровень экскретируемого с мочой стеркобилиногена, всосавшегося в геморроидальных венах, и стеркобилина в кале придает экскрементам характерную коричневую окраску. После исчерпания способности гепатоцитов выделять прямой (конъюгированный) билирубин в желчь происходит обратная диффузия связанной формы пигмента в кровь.
Классификация
Систематизация форм гемолитической желтухи учитывает этиологические факторы, под влиянием которых произошел гемолиз. Такой подход позволяет выбрать оптимальную терапевтическую тактику, максимально компенсирующую действие первопричины заболевания. Гастроэнтерологи и гематологи различают следующие типы гемолитических надпеченочных желтух:
- Гемолитические корпускулярные желтухи. Связаны с различными видами несостоятельности эритроцитов — дефицитом или недостаточной активностью ферментных систем, дефектами гемоглобина, мембранных структур. Обычно корпускулярные плейохолические желтухи вызваны генетическими аномалиями, их лечение является преимущественно симптоматическим.
- Гемолитические экстракорпускулярные желтухи. К разрушению эритроцитов приводит действие различных внешних факторов — антител, микробных токсинов, гемолитических ядов, механических нагрузок. Наряду с устранением отдельных симптомов это позволяет использовать методы, направленные на элиминацию этиопатогена и отдельные звенья патогенеза гемолиза.
- Гемолитические постгеморрагические желтухи. Возникают на фоне массивного распада эритроцитов в участках кровоизлияний. Обычно осложняют течение тяжелых травм и других неотложных состояний. Прогнозирование развития надпеченочной желтухи дает возможность назначить превентивную терапию для предупреждения дальнейших осложнений.
Симптомы гемолитической желтухи
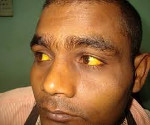
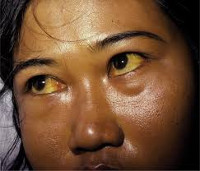
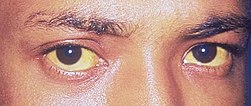
Характерный признак заболевания — сочетание бледности кожных покровов с лимонно-желтым окрашиванием кожи, конъюнктивы глаз при отсутствии кожного зуда. У большинства пациентов с надпеченочной желтухой наблюдается потемнение мочи. Могут возникать умеренные боли в животе, диспепсические расстройства – тошнота, отрыжка, диарея. Обострение заболевания (гемолитический криз) клинически проявляется фебрильной лихорадкой, головной болью, миалгиями, интенсивными болями в левом подреберье вследствие увеличения селезенки. Если заболевание вызвано острым отравлением химическими соединениями или лекарственными средствами, присоединяются интоксикационные симптомы в виде угнетения сознания вплоть до комы, выраженной тахикардии, падения АД, расстройств дыхания и мочевыделения.
Осложнения
Наличие у пациента надпеченочной желтухи повышает риск застойных явлений в желчном пузыре, что приводит к формированию пигментных камней и обструкции желчевыводящих протоков. Осложнением гемолитической желтухи может стать токсическая нефропатия с острой почечной недостаточностью, развивающаяся при выраженных нарушениях биохимического состава крови и накоплении токсических соединений. При длительном течении заболевания возможно возникновение печеночной недостаточности, при которой происходит резкое угнетение всех функций органа, что клинически проявляется кахексией, дистрофическими изменениями, стойкими нарушениями метаболических процессов. Плейохолическая желтуха иногда осложняется билирубиновой энцефалопатией вследствие интоксикации головного мозга.
Диагностика
Постановка диагноза не представляет затруднений при наличии типичной клинической картины заболевания. Отличительный признак гемолитической желтухи — желтушное окрашивание кожи без кожного зуда и увеличения печени. Диагностический поиск направлен на выявление первопричины болезни. План обследования включает следующие инструментальные и лабораторные методы:
- Общий анализ крови. При проведении исследования определяется резкое уменьшение количества гемоглобина и эритроцитов с одновременным повышением содержания ретикулоцитов свыше 1%. При морфологической оценке могут выявляться специфические клетки, указывающие на определенный вид гемолитической анемии: сфероциты, мишеневидные, серповидные эритроциты. В остром периоде и при аутоиммунных процессах наблюдается лейкоцитоз со сдвигом формулы влево.
- Биохимический анализ крови. Патогномоничный признак надпеченочной желтухи — повышение концентрации свободного билирубина. Исследование позволяет установить степень тяжести болезни по уровню общего билирубина: до 80 мкмоль/л — легкая, 80-150 мкмоль/л — средняя, свыше 150 мкмоль/л — тяжелая форма. О гемолитической природе заболевания свидетельствует повышение содержания ЛДГ-5, выделяющейся из разрушенных эритроцитов, и снижение гаптоглобина.
- УЗИ брюшной полости. При плейохолической желтухе во время ультразвукового исследования ОБП определяется значительное увеличение селезенки при обычно нормальных размерах печени и структуре печеночной паренхимы. Также сонографически удается выявить заболевания гепатобилиарной системы, которые могут сочетаться с гемолитической патологией: желчнокаменную болезнь, холецистит, фиброзные поражения печени, изменения печеночных сосудов.
Концентрация АЛТ, АСТ, щелочной фосфатазы обычно в пределах нормы. В общем анализе мочи обнаруживается высокое содержание стеркобилиногена и уробилина, билирубинурия отсутствует. В копрограмме отмечается повышенный уровень стеркобилина. Для комплексной оценки состояния печени при желтухе может выполняться КТ, МРТ, холангиопанкреатография. Дополнительно проводится исследование осмотической резистентности эритроцитов, которая повышается при талассемии и снижается при гемолитической сфероцитарной анемии. В тесте Кумбса могут выявляться антиэритроцитарные антитела.
Дифференциальную диагностику осуществляют с синдромом Жильбера, паренхиматозной и механической желтухой, а также с заболеваниями, которые могут служить причиной указанных видов гипербилирубинемий — гепатитами, лептоспирозом, желтушной формой инфекционного мононуклеоза, псевдотуберкулезом, иерсиниозом, амебиазом, желчнокаменной болезнью, опухолями печени и Фатерова соска. По направлению врача-гастроэнтеролога при наличии показаний пациента консультирует гематолог, абдоминальный хирург и другие специалисты.
Лечение гемолитической желтухи
Рекомендована комплексная терапия, позволяющая по возможности устранить причину гемолиза, воздействовать на патогенетические звенья, купировать угрожающие жизни симптомы. Лечение гемолитической формы надпеченочной желтухи обычно является консервативным и сочетается с диетотерапией, направленной на поддержание нормальной работы печени. Показано существенное ограничение или полное исключение жирных, жареных, острых блюд, продуктов, содержащих много каротина и грубой клетчатки. С учетом возможной причины гемолитической анемии и желтухи план лечения включает:
- Кортикостероиды. Назначение иммуносупрессорной гормональной терапии оправдано при диагностике аутоиммунных расстройств, провоцирующих развитие приобретенной гемолитической анемии. У некоторых пациентов с желтухой более эффективным оказывается прием цитостатических препаратов.
- Антибиотики. Используются при гемолизе, обусловленном действием бактериальных токсинов. Рекомендуются средства, не вступающие в конкурентное вытеснение билирубина из соединений с глюкуроновой кислотой. Препараты из групп амфениколов, цефалоспоринов, сульфаниламидов применяются с осторожностью.
- Инфузионная терапия. Проводится при гемолитических процессах токсического происхождения. Введение коллоидных и кристаллоидных растворов при необходимости дополняется форсированным диурезом, энтеросорбентами, антидотами для связывания отравляющих веществ, гемосорбцией, плазмаферезом, гемодиализом.
- Индукторы ферментов печени. Активируют микросомальную ферментную систему, которая связана с цитохромом P450. В результате повышения метаболизма гепатоцитов улучшается связывание билирубина, циркулирующего в крови. Стимуляция ферментов эффективна при наличии функционального резерва печени.
- Фототерапия. Направлена на снижение гипербилирубинемии. Используется при повышении уровня билирубина до субтоксических и токсических концентраций. Способствует переводу неконъюгированного пигмента в водорастворимую изомерную форму, которая экскретируется почками и печенью без образования альбуминовых комплексов.
- Обменное переливание крови. Обычно выполняется при иммунных гемолитических состояниях с критическим для нервной системы содержанием свободного билирубина. За одну процедуру может заменяться до 70% ОЦК, благодаря чему уменьшается билирубинемия, восполняется дефицит эритроцитов, купируется гипоксия.
- Удаление селезенки. Хирургическое лечение показано при тяжелом течении гемолитической корпускулярной желтухи у пациентов с наследственными эритроцитарными ферментопатиями и мембранопатиями. Спленэктомия позволяет исключить деструкцию эритроцитов в синусах органа и их утилизацию макрофагами.
Прогноз и профилактика
Поскольку гемолитический вариант надпеченочной желтухи зачастую проявляется на фоне наследственных анемий, которые трудно поддаются лечению, прогноз заболевания считается серьезным. Полное выздоровление наблюдается у пациентов без тяжелых интеркуррентных патологий при отсутствии необратимых нарушений функций печени. Специфическая профилактика гемолитической желтухи не разработана. Для предупреждения болезни необходимо проводить своевременную диагностику и комплексную терапию гемолитических анемий, тяжелых инфекционных заболеваний, соблюдать правила совместимости крови при гемотрансфузиях, избегать полипрагмазии и назначения потенциально гемотоксичных медикаментов.
|
Литература 1. Желтухи неонатального периода : учебно-методическое пособие / Ткаченко А.К. – 2017. 2. Дифференциальная диагностика желтух/ Самсон А.А.// Медицина неотложных состояний. – 2013 — №5(52). 3. Дифференциальная диагностика синдрома желтухи у детей: учебно-методическое пособие/ Артемчик Т. А. – 2017. |
Код МКБ-10 D59 P58 |
Гемолитическая желтуха — лечение в Москве
Желтуха представляет собой клинико-лабораторный синдром, характеризующийся появлением желтого окрашивания кожных покровов и видимых слизистых оболочек в результате повышения уровня билирубина в крови. Такой патологический процесс встречается довольно часто как в детском возрасте, так и у взрослых людей.
Как было сказано выше, основной причиной появления желтухи является накопление билирубина в крови и тканях организма. Билирубин является важным компонентом желчи и представляет собой ее пигмент. Он образуется в результате распада белковых структур, а именно гемоглобина, миоглобина и цитохрома. Существует две фракции билирубина: прямая и непрямая. Их принципиальное отличие заключается в том, что непрямая фракция имеет тенденцию к образованию комплексов с альбумином. Прямая фракция билирубина соединяется с глюкуроновой кислотой. В норме показатель общего билирубина у взрослых людей составляет от 5,1 до 17 мкмоль/л.
Существует три основные группы причин, из-за которых может развиваться желтуха. К ним относятся:
- Закупорка желчевыводящих путей, препятствующая нормальному оттоку желчи;
- Разнообразные болезни печени;
- Слишком быстрая гибель эритроцитов.
Закупорка желчевыводящих путей является наиболее часто встречающейся причиной развития желтухи. При этом употребляется такой термин, как механическая желтуха. В качестве факторов, которые способствуют перекрытию желчевыводящих путей, могут выступать различные опухолевые образования, камни, образующиеся в желчном пузыре, кисты и так далее.
Желтуха, возникающая в результате разнообразных заболеваний печени, проявляется холестатическим и цитолитическим синдромами. В основе ее возникновения лежит нарушение обмена билирубина в гепатоцитах. В качестве провоцирующих факторов к возникновению такого патологического состояния могут выступать цирроз, гепатиты, употребление некоторых видов лекарственных средств, разнообразные интоксикации и вирусные воздействия на организм.
Если происходит слишком быстрое разрушение эритроцитов — мы говорим о гемолитической желтухе. Она развивается в том случае, если имеются какие-либо патологии со стороны селезенки, аутоиммунные процессы в организме, а также определенные виды анемий. Кроме этого, в качестве причины такого патологического процесса могут выступать некоторые формы генетических заболеваний.
Механическая желтуха
Как было сказано ранее, в основе механической желтухи лежит закупорка просвета желчевыводящих путей, в результате которых желчь не может полноценно выводиться из желчного пузыря. Это приводит к пропитыванию стенки данного органа желчью и проникновению ее компонентов в кровеносное русло. В результате этого уровень билирубина в крови повышается.
В первую очередь механическая желтуха характеризуется появлением желтого окрашивания кожных покровов и видимых слизистых оболочек. Стоит отметить, что для данной разновидности патологии характерно довольно быстрое нарастание концентрации билирубина в кровеносном русле, что приводит к тому, что желтое окрашивание кожи практически всегда очень интенсивно. Отмечается обесцвечивание каловых масс и появление темного цвета мочи. Кроме этого, возникает такой симптом, как зуд кожи. Это связано с тем, что в крови скапливается больше количество желчных кислот. Больной человек обращает внимание на постепенное снижение массы тела и появление симптомов, свидетельствующих о недостаточном поступлении в организм витаминов.
Гемолитическая желтуха
Гемолитическая желтуха имеет второе название — надпеченочная. Она формируется в результате слишком интенсивного разрушения эритроцитов, средняя продолжительность жизни которых составляет сто двадцать дней. При этом характерными лабораторными признаками являются повышение уровня непрямой фракции билирубина и низкий уровень гемоглобина в крови.
Гемолитическая желтуха сопровождается появлением ярко-желтого цвета кожи и слизистых оболочек. В некоторых случаях при сильно выраженной анемии на первое место может выступать бледность кожных покровов. Возникает темная окраска мочи и каловых масс. В большинстве случаев отмечается увеличение селезенки в размерах, что иногда может сопровождаться гепатомегалией.
Печеночная желтуха
В основе развития печеночной желтухи лежит непосредственное повреждение паренхимы печени в результате воздействия на нее различных неблагоприятных факторов, например, вирусов или токсических веществ. В этом случае происходит разрушение гепатоцитов, из которых в кровоток поступает билирубин, что и обуславливает повышение его концентрации.
В клинической картине данного патологического процесса очень часто возникает интоксикационный синдром. Больной человек может испытывать тошноту с периодической рвотой, а также боль в области правого подреберья. Кожные покровы и слизистые оболочки становятся оранжево-желтыми, моча светлеет, а кал темнеет. Нередко возникает кожный зуд, однако он носит не такой интенсивный характер, как при механической закупорке желчевыводящих путей. При объективном осмотре можно обнаружить увеличенную в размерах и болезненную печень.
Методы обследования
В первую очередь при такой патологии проводится общий осмотр больного человека, а также сбор его жалоб и анамнеза. С целью выявления причины данного заболевания назначаются общий анализ крови, биохимический анализ крови и ультразвуковое исследование печени и желчного пузыря.
Лечение желтухи и особенности диеты
Принципы лечения желтухи складываются из того, какая причина вызвала данный патологический процесс. При механической желтухе в большинстве случаев проводится оперативное вмешательство для удаления камней, опухолей и так далее. При печеночной патологии лечится основное заболевание с обязательным использованием гепатопротекторов.
Кроме этого, могут назначаться ферментные препараты в сочетании с жирорастворимыми витаминами, а также уродезоксихолиевая кислота.
При данном заболевании необходимо соблюдать диету с ограничением алкоголя, слишком жирной и острой пищи. Под запретом находятся все жареные блюда.
Инфекционные болезни и эпидемиология / Покровский В.И., Пак С.Г., Брико Н.И., Данилкин Б.К. – 2007
Клиническая гастроэнтерология / Григорьев П.А., Яковенко А.В. – 2004
Желтуха
(болезнь Госпела) (лат. icterus) — желтушное
окрашивание кожи и видимых слизистых
оболочек, обусловленное повышенным
содержанием в крови и тканях
билирубина.Желтуха (истинная) —
симптомокомплекс, характеризующийся
желтушным окрашиванием кожи и слизистых
оболочек, обусловленный накоплением
в тканях и крови билирубина. Истинная
желтуха может развиться в результате
трёх основных причин:
чрезмерного
разрушения эритроцитов и повышенной
выработки билирубина — гемолитическая
или надпечёночная желтуха;
нарушения
улавливания клетками печени билирубина
и связывания его с глюкуроновой кислотой
— паренхиматозная или печёночноклеточная
желтуха;
наличия
препятствия к выделению билирубина с
желчью в кишечник и обратного всасывания
связанного билирубина в кровь —
механическая или подпечёночная
желтуха.Желтуха ложная (псевдожелтуха,
каротиновая желтуха) — желтушное
окрашивание кожи (но не слизистых
оболочек) вследствие накопления в ней
каротинов при длительном и обильном
употреблении в пищу моркови, свеклы,
апельсинов, тыквы, а также возникающая
при приёме внутрь акрихина, пикриновой
кислоты и некоторых других препаратов.
Гемолитическая
желтуха (синоним: надпеченочная,
уробилиновая) является результатом
избыточного образования билирубина
при усилении кроворазрушения в
организме.Встречается при гемолитической
анемии (см.), а также при сепсисе, крупозной
пневмонии, болезни Аддисона — Бирмера,
малярии, затяжном септическом эндокардите,
при интоксикации ядами, вызывающими
гемолиз (см. Гемолитические
яды).Окраска кожи при гемолитической
желтухе лимонно-желтого оттенка. Больные
больше бледны, чем желты. Цифры свободного
билирубина (см.) в крови умеренно
повышены. Желтуха не сопровождается
кожным зудом. Она может носить
волнообразный характер. Брадикардия
обычно отсутствует. При выраженном
малокровии можно выслушать систолический
шум. Печень обычно не пальпируется,
иногда может быть увеличена. Функциональные
пробы ее не изменены. Селезенка обычно
увеличена. Могут образовываться
пигментные камни, и присоединяется
клиническая картина желчнокаменной
болезни (см.). При исследовании мочи
обнаруживают повышенное содержание
уробилина, а билирубин отсутствует. В
кале — повышенное содержание стеркобилина.
При исследовании крови — гипохромного
типа анемия, понижение осмотической
резистентности эритроцитов и положительная
реакция Кумбса (см. Кумбса реакция).Печеночная
желтуха (синоним: паренхиматозная,
гепатоцеллюлярная) наблюдается при
поражениях печеночной ткани инфекционного
или токсического характера. При
повреждении печеночной клетки снижается
функциональная способность по выделению
билирубина из крови в желчные пути.При
исследовании сыворотки крови обнаруживают
повышенное содержание связанного и
свободного билирубина. В моче появляются
билирубин и желчные кислоты, количество
их постепенно нарастает. Количество
стеркобилина в кале уменьшается. В
разгар печеночной желтухи в моче
отсутствует уробилин, а в кале —
стеркобилин. Дуоденальное содержимое
обесцвечено. По мере уменьшения желтухи
в моче появляется уробилин, количество
билирубина в крови начинает убывать;
дуоденальное содержимое и кал приобретают
обычную окраску. Характерной особенностью
данного вида желтухи является изменение
всех функциональных проб печени.
Наиболее чувствительным тестом для
диагноза печеночной желтухи является
бромсульфалеиновая проба.Наиболее
типичным клиническим проявлением
печеночной желтухи является желтуха
при эпидемическом гепатите (см. Гепатит
эпидемический).
Соседние файлы в предмете Биохимия
- #
- #
27.01.202069.31 Кб32BKh_28-45.odt
- #
- #
- #
- #
- #
- #
- #
- #
- #
From Wikipedia, the free encyclopedia
Hemolytic jaundice, also known as prehepatic jaundice, is a type of jaundice arising from hemolysis or excessive destruction of red blood cells, when the byproduct bilirubin is not excreted by the hepatic cells quickly enough.[1] Unless the patient is concurrently affected by hepatic dysfunctions or is experiencing hepatocellular damage, the liver does not contribute to this type of jaundice.[1]
As one of the three categories of jaundice, the most obvious sign of hemolytic jaundice is the discolouration or yellowing of the sclera and the skin of the patient, but additional symptoms may be observed depending on the underlying causes of hemolysis. Hemolytic causes associated with bilirubin overproduction are diverse and include disorders such as sickle cell anemia,[2] hereditary spherocytosis,[3] thrombotic thrombocytopenic purpura,[4] autoimmune hemolytic anemia,[5] hemolysis secondary to drug toxicity,[6] thalassemia minor,[7] and congenital dyserythropoietic anemias.[8] Pathophysiology of hemolytic jaundice directly involves the metabolism of bilirubin, where overproduction of bilirubin due to hemolysis exceeds the liver’s ability to conjugate bilirubin to glucuronic acid.[9]
Diagnosis of hemolytic jaundice is based mainly on visual assessment of the yellowing of the patient’s skin and sclera, while the cause of hemolysis must be determined using laboratory tests.[10] Treatment of the condition is specific to the cause of hemolysis, but intense phototherapy and exchange transfusion can be used to help the patient excrete accumulated bilirubin.[11] Complications related to hemolytic jaundice include hyperbilirubinemia and chronic bilirubin encephalopathy, which may be deadly without proper treatment.[12][13]
Signs and symptoms[edit]
Yellowing of the sclera due to jaundice.
The signs and symptoms additional to the development of a yellowish colour in the sclera and skin are specific to the causes of hemolysis.
For example, if the patient has hemolytic jaundice resulting from sickle cell disease, vaso-occlusive phenomena like acute vaso-occlusive pain and acute chest syndrome may be observed in the acute phases, while in anemia, neurologic deficits and various pulmonary conditions may manifest in the chronic phase.[2]
Regardless of the causes, laboratory-confirmed elevation is predominantly seen in unconjugated bilirubin.[10] Serum bilirubin concentration rarely exceeds 4 mg/dL, unless the patient has concurrent liver disease.[14]
Causes[edit]
The underlying causes of hemolytic jaundice, as its name suggests, are disorders associated with hemolysis. Such disorders are manifold and the common causes include:
-
Blood smear of a patient with sickle cell disease. The characteristic sickle-shaped appearance of red blood cells can be observed.
Sickle cell disease, in which a mutation in the globin gene causes the formation of sickle hemoglobin.[2] This disease is marked by the manifestation of chronic compensated hemolytic anemia, with laboratory findings not limited to unconjugated hyperbilirubinemia but also elevated serum lactate dehydrogenase and low serum haptoglobin.[2]
- Thrombotic thrombocytopenic purpura, in which the reduced activity of the von Willebrand factor-cleaving protease ADAMTS13 causes a thrombotic microangiopathy.[4] This disease, acquired or hereditary, is marked by very severe microangiopathic hemolytic anemia, with laboratory findings including extremely high serum lactate dehydrogenase and negative anti-RBC antibodies and Coombs test.[4] Clinically, dark urine from hemoglobinuria may be observed because the hemolysis is intravascular (see Pathophysiology below).[4]
Blood smear of a patient with Thrombotic Thrombocytopenic Purpura (TTP). Notice that some red blood cells are nucleated. This is a characteristic finding in such blood smears.
- Autoimmune hemolytic anemia (AIHA), in which autoantibodies react with self red blood cells and cause their destruction.[5] This disease is marked by increased extravascular hemolysis, with laboratory findings including increased lactate dehydrogenase and decreased or absent haptoglobin in both warm and cold AIHA, and positive Coombs test.[5] Clinically, jaundice or dark urine present in approximately one-third of the cases, and most of the symptoms are related to anemia.[5]
Other less commonly observed causes of hemolysis include:
- Hemolysis secondary to drug toxicity[15]
- Thalassemia minor[16]
- Congenital dyserythropoietic anemia[17]
The above list is not exhaustive, and rare causes of hemolysis such as Bartonella infection,[18] hemolysis due to transfusion reactions,[19] and microangiopathic hemolytic anemia[20] should be suspected when symptoms specific to those causes manifest.
Pathophysiology[edit]
Bilirubin overproduction[edit]
The mechanisms by which bilirubin is overproduced in hemolytic jaundice can be understood in relation to the two major sites of hemolysis: intravascular and extravascular.
Process of heme breakdown that leads to the production of bilirubin, in extravascular hemolysis.
During intravascular hemolysis, red blood cells are broken down within the vasculature, allowing hemoglobin from the ruptured red blood cells to form haptoglobin-hemoglobin complexes with haptoglobin, which will be internalized and degraded by hepatocytes and the spleen.[21] If the degree of hemolysis is abnormally high, the unbound hemoglobin is converted to methemoglobin from which the heme moiety is bound to hemopexin or to albumin, and both heme-hemopexin and heme-bound albumin are internalized by hepatocytes and subsequently degraded to bilirubin.[22][10]
Zones of cephalocaudal jaundice progression according to the Kramer’s scale.
During extravascular hemolysis, red blood cells are destroyed by phagocytosis by macrophages in the reticuloendothelial system and digested by phagosomes.[23] Hemoglobin within red blood cells are then degraded to release heme, which will be converted by microsomal heme oxygenase to iron, carbon monoxide and biliverdin, and are immediately reduced to unconjugated bilirubin by biliverdin reductase and released into the plasma.[24]
Affinity of unconjugated bilirubin to albumin[edit]
In both settings of hemolysis mentioned above, only low levels of conjugated bilirubin may accumulate in the serum, with the amount falling within the normal limits of 4 percent of total bilirubin as conjugated bilirubin can be efficiently excreted in bile through being secreted across canalicular membrane.[25] Increased levels of conjugated bilirubin will only be observed with coexisting hepatobiliary abnormalities. Only when the canalicular excretion capacity is exceeded, conjugated bilirubin will accumulate in the plasma.[26] As unconjugated bilirubin has a high affinity to albumin, at high level it is not efficiently cleared through glomerular filtration and it binds to the elastic tissue of the skin and sclera, where high albumin content can be found.[25] This explains the yellow discolouration observed in these tissues in hemolytic jaundice.
Diagnosis[edit]
Symptoms of jaundice can be observed superficially, thus visual methods are used to identify the condition.[27] However, underlying causes of jaundice must be diagnosed through laboratory testing.[28]
Visual assessment[edit]
In both newborns and adults, yellowing of the skin is a marker for jaundice.[27] As most cases of jaundice are observed in newborns, healthcare workers use visual methods to identify the presence of this condition.[29] A clinical jaundice scale, an adapted version of the Kramer’s scale, is used to quantify the severity of jaundice through the spread of skin discoloration from zone 1, the head, to zone 5, the palms and soles of the neonate’s body.[29][30] Cephalocaudal progression of jaundice to zone 4 and 5 of the Kramer’s scale shows a significant positive correlation with serum bilirubin concentration of at least 11.0 mg per 100 ml, indicating the need for treatment.[29]
Jaundice Eye Colour Index (JECI)[edit]
Conjunctival icterus can be quantified by the Jaundice Eye Colour Index (JECI) through digital photography of the sclera, where a JECI of 0 indicates a white colour, and a JECI of 0.1 indicates an intense yellow colour, which is a sign of hemolytic jaundice.[31]
Screening laboratory tests[edit]
Multiple tests can be used to diagnose jaundice, but results of different parameters must be compared to determine its etiology.[10]
| Method | Parameter | Results |
|---|---|---|
| Urinalysis | Urobilinogen | Increased |
| Bilirubin | Absent | |
| Colour of urine | Normal | |
| Stool analysis | Colour of faeces | Darker than normal |
| Complete blood count | Hemoglobin | Decreased[28] |
| Schistocytes | Present | |
| Reticulocytes | Increased | |
| Serum testing | Total serum bilirubin | Increased[27] |
| Conjugated bilirubin | Normal | |
| Unconjugated bilirubin | Increased | |
| Liver biopsy | Alkaline phosphatase | Normal |
| Aspartate transaminase (AST) | Normal | |
| Alanine transaminase (ALT) | Normal |
When a patient shows signs of jaundice such as the yellowing of the skin and sclera, a urine test is performed to check the levels of urobilinogen present.[32] The presence of urobilinogen and its increased levels indicate that there are more than normal amounts of bilirubin in the intestine, showing that jaundice observed is not due to the blockage of bile flow, and is of pre-hepatic or hepatic causes.[32] Normal colour of the patient’s urine indicates the absence of unconjugated bilirubin.[27]
Results from the urine test should be confirmed by a complete blood count (CBC) and serum testing for total serum bilirubin and fractionated bilirubin.[32] Increased reticulocytes and the presence of schistocytes in the blood smear of the patient observed during CBC indicates hemolysis.[28] If the patient has hemolytic jaundice, serum testing will show that conjugated bilirubin will only account for less than 15% of the total serum bilirubin due to the increase of unconjugated bilirubin.[33]
Analysis of liver biopsies will show the levels of alkaline phosphatase, aspartate transaminase, and alanine transaminase in the patient, which has a negative correlation with liver function.[27] Normal levels of these enzymes indicate that there is no significant hepatocellular damage.[27]
When an infant is suspected to have hemolytic jaundice, abnormal morphologies of erythrocytes can be analyzed to find out the causes of hemolysis.[34] A Coomb’s test should be performed, and end-tidal carbon monoxide concentration should be monitored to understand the rate of hemolysis in the infant’s body.[35] If chronic hemolytic jaundice is diagnosed in a newborn, development of anemia and bilirubin cholelithiasis should be monitored as well.[34]
Haptoglobin testing[edit]
If other symptoms of anemia is present, the amount of serum haptoglobin in the patient can be measured to test for hemolysis.[36] During hemolysis, hemoglobin in blood dissociates and forms complexes with haptoglobins in the plasma, which are then catabolized.[37] Low levels of haptoglobin resulting from the test shows that there are large amounts of free hemoglobin in the blood to be bound, acting as an indicator of hemolysis.[36]
Treatment[edit]
As jaundice is not common in adults, most treatment methods for this condition are centered around neonates, of which 50% develop jaundice.[27][38]
Neonates[edit]
Phototherapy for newborns with jaundice.
Intensive phototherapy at saturation dose is used as a first-line clinical treatment which decreases the amount of accumulated unconjugated bilirubin in the infant’s serum by the addition of oxygen, thus allowing it to dissolve in water so the liver can more easily convert it into products which can be excreted without further metabolism.[38] For infants with hemolytic jaundice, severe and prolonged cases of hyperbilirubinemia, or high serum bilirubin that does not decrease after phototherapy, blood exchange transfusion is carried out at the umbilical venous catheter to mechanically remove bilirubin.[38][39][40] In cases of immune hemolytic jaundice, intravenous immunoglobulin therapy may be used to treat the condition.[41] Administration of intravenous immunoglobulin can block monocyte Fc-receptors, preventing or reducing further hemolysis.[11]
Adults[edit]
In adults, hemolytic jaundice is uncommon, and medical treatment methods should be determined by recognizing the underlying causes of hemolysis in the patient.[42]
Complications[edit]
In cases where patients receive poor or no treatment of jaundice, neurodevelopmental complications may follow the condition, eventually leading to hearing loss, visual impairment, and in severe cases, mortality.[38]
Hyperbilirubinemia[edit]
Hyperbilirubinemia may be observed when hemolysis produces too much bilirubin through the excessive breakdown of red blood cells, and the bilirubin builds up in the patient’s blood and tissue fluids without proper excretion.[43] Untreated or inadequately treated hyperbilirubinemia will lead to other complications such as kernicterus.[12]
Kernicterus[edit]
Chronic bilirubin encephalopathy, also known as kernicterus, is a brain-damaging complication associated with both preterm and full term infants with jaundice, where the large amounts of unconjugated bilirubin in the infants become neurotoxic.[39][44] Kernicterus affects mainly the basal ganglia, and its effects can spread to the hippocampus, geniculate nuclei, and cranial nerve nuclei.[13] Symptoms of kernicterus include athetoid cerebral palsy and in severe cases, may lead to death of the patient.[39] Most cases of kernicterus develop in infants following early hospital discharge from phototherapy.[44]
References[edit]
- ^ a b Hall J (2015). Pocket Companion to Guyton and Hall Textbook of Medical Physiology. Saunders. ISBN 978-1455770069.
- ^ a b c d Rees DC, Williams TN, Gladwin MT (December 2010). «Sickle-cell disease». Lancet. 376 (9757): 2018–31. doi:10.1016/S0140-6736(10)61029-X. PMID 21131035. S2CID 29909566.
- ^ «Hereditary spherocytosis | Genetic and Rare Diseases Information Center (GARD) – an NCATS Program». rarediseases.info.nih.gov. Retrieved 2021-04-01.
- ^ a b c d Page EE, Kremer Hovinga JA, Terrell DR, Vesely SK, George JN (April 2017). «Thrombotic thrombocytopenic purpura: diagnostic criteria, clinical features, and long-term outcomes from 1995 through 2015». Blood Advances. 1 (10): 590–600. doi:10.1182/bloodadvances.2017005124. PMC 5728353. PMID 29296701.
- ^ a b c d Brodsky RA (August 2019). «Warm Autoimmune Hemolytic Anemia». The New England Journal of Medicine. 381 (7): 647–654. doi:10.1056/NEJMcp1900554. PMID 31412178. S2CID 199662490.
- ^ Dausset J, Contu L (1967). «Drug-induced hemolysis». Annual Review of Medicine. 18: 55–70. doi:10.1146/annurev.me.18.020167.000415. PMID 5337612.
- ^ Robinson S, Vanier T, Desforges JF, Schmid R (September 1962). «Jaundice in thalassemia minor: a consequence of «ineffective erythropoiesis»«. The New England Journal of Medicine. 267: 523–9. doi:10.1056/NEJM196209132671101. PMID 14492944.
- ^ Kamiya T, Manabe A (October 2010). «Congenital dyserythropoietic anemia». International Journal of Hematology. 92 (3): 432–8. doi:10.1007/s12185-010-0667-9. PMID 20820969. S2CID 71018193.
- ^ Billing BH (June 1978). «Twenty-five years of progress in bilirubin metabolism (1952-77)». Gut. 19 (6): 481–91. doi:10.1136/gut.19.6.481. PMC 1412033. PMID 98394.
- ^ a b c d Brodsky R (2021). «Diagnosis of hemolytic anemia in adults». UpToDate.
- ^ a b Ergaz Z, Arad I (1993-01-01). «Intravenous immunoglobulin therapy in neonatal immune hemolytic jaundice». Journal of Perinatal Medicine. 21 (3): 183–7. doi:10.1515/jpme.1993.21.3.183. PMID 8229608. S2CID 41214946.
- ^ a b Watson RL (March 2009). «Hyperbilirubinemia». Critical Care Nursing Clinics of North America. The High-Risk Neonate: Part I. 21 (1): 97–120, vii. doi:10.1016/j.ccell.2008.11.001. PMID 19237047. S2CID 243878612.
- ^ a b Hamza A (2019). «Kernicterus». Autopsy & Case Reports. 9 (1): e2018057. doi:10.4322/acr.2018.057. PMC 6394357. PMID 30863731.
- ^ Shaked O (2020). «Evaluation of jaundice caused by unconjugated hyperbilirubinemia in children». UpToDate.
- ^ Beutler E (March 1969). «Drug-induced hemolytic anemia». Pharmacological Reviews. 21 (1): 73–103. PMID 4887725.
- ^ Galanello R, Origa R (May 2010). «Beta-thalassemia». Orphanet Journal of Rare Diseases. 5: 11. doi:10.1186/1750-1172-5-11. PMC 2893117. PMID 20492708.
- ^ «Congenital dyserythropoietic anemia — Conditions — GTR — NCBI». www.ncbi.nlm.nih.gov. Retrieved 2021-04-14.
- ^ Orf K, Cunnington AJ (2015). «Infection-related hemolysis and susceptibility to Gram-negative bacterial co-infection». Frontiers in Microbiology. 6: 666. doi:10.3389/fmicb.2015.00666. PMC 4485309. PMID 26175727.
- ^ Harewood J, Ramsey A, Master SR (2021). Hemolytic Transfusion Reaction. StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 28846280. Retrieved 2021-04-01.
- ^ Brain MC (1970-02-01). «Microangiopathic hemolytic anemia». Annual Review of Medicine. 21 (1): 133–44. doi:10.1146/annurev.me.21.020170.001025. PMID 4913945.
- ^ Rother RP, Bell L, Hillmen P, Gladwin MT (April 2005). «The clinical sequelae of intravascular hemolysis and extracellular plasma hemoglobin: a novel mechanism of human disease». JAMA. 293 (13): 1653–62. doi:10.1001/jama.293.13.1653. PMID 15811985.
- ^ Berlin NI, Berk PD (June 1981). «Quantitative aspects of bilirubin metabolism for hematologists». Blood. 57 (6): 983–99. doi:10.1182/blood.V57.6.983.983. PMID 7225572.
- ^ Lang F, Lang E, Föller M (October 2012). «Physiology and pathophysiology of eryptosis». Transfusion Medicine and Hemotherapy. 39 (5): 308–14. doi:10.1159/000342534. PMC 3678267. PMID 23801921.
- ^ Sticova E, Jirsa M (October 2013). «New insights in bilirubin metabolism and their clinical implications». World Journal of Gastroenterology. 19 (38): 6398–407. doi:10.3748/wjg.v19.i38.6398. PMC 3801310. PMID 24151358.
- ^ a b Roy-Chowdhury N (2020). «Bilirubin metabolism». UpToDate.
- ^ Roy-Chowdhury N (2020). «Classification and causes of jaundice or asymptomatic hyperbilirubinemia». UpToDate.
- ^ a b c d e f g Fargo MV, Grogan SP, Saguil A (February 2017). «Evaluation of Jaundice in Adults». American Family Physician. 95 (3): 164–168. PMID 28145671.
- ^ a b c Roche SP, Kobos R (January 2004). «Jaundice in the adult patient». American Family Physician. 69 (2): 299–304. PMID 14765767.
- ^ a b c Knudsen A (April 1990). «The cephalocaudal progression of jaundice in newborns in relation to the transfer of bilirubin from plasma to skin». Early Human Development. 22 (1): 23–8. doi:10.1016/0378-3782(90)90022-B. PMID 2335140.
- ^ Hatzenbuehler L, Zaidi AK, Sundar S, Sultana S, Abbasi F, Rizvi A, Darmstadt GL (September 2010). «Validity of neonatal jaundice evaluation by primary health-care workers and physicians in Karachi, Pakistan». Journal of Perinatology. 30 (9): 616–21. doi:10.1038/jp.2010.13. PMID 20357808.
- ^ Leung TS, Outlaw F, MacDonald LW, Meek J (March 2019). «Jaundice Eye Color Index (JECI): quantifying the yellowness of the sclera in jaundiced neonates with digital photography». Biomedical Optics Express. 10 (3): 1250–1256. doi:10.1364/BOE.10.001250. PMC 6420273. PMID 30891343.
- ^ a b c Greenberg A (2014-01-01). «Chapter 4 — Urinalysis and Urine Microscopy». In Gilbert SJ, Weiner DE (eds.). National Kidney Foundation Primer on Kidney Diseases (Sixth ed.). Philadelphia: W.B. Saunders. pp. 33–41. doi:10.1016/b978-1-4557-4617-0.00004-2. ISBN 978-1-4557-4617-0.
- ^ Tisdale WA, Klatskin G, Kinsella ED (February 1959). «The significance of the direct-reacting fraction of serum bilirubin in hemolytic jaundice». The American Journal of Medicine. 26 (2): 214–27. doi:10.1016/0002-9343(59)90310-9. PMID 13617278.
- ^ a b Christensen RD, Yaish HM, Lemons RS (2014). «Neonatal hemolytic jaundice: morphologic features of erythrocytes that will help you diagnose the underlying condition». Neonatology. 105 (4): 243–9. doi:10.1159/000357378. PMID 24526179.
- ^ Herschel M, Karrison T, Wen M, Caldarelli L, Baron B (2002-07-01). «Evaluation of the direct antiglobulin (Coombs’) test for identifying newborns at risk for hemolysis as determined by end-tidal carbon monoxide concentration (ETCOc); and comparison of the Coombs’ test with ETCOc for detecting significant jaundice». Journal of Perinatology. 22 (5): 341–7. doi:10.1038/sj.jp.7210702. PMID 12082466.
- ^ a b Shih AW, McFarlane A, Verhovsek M (April 2014). «Haptoglobin testing in hemolysis: measurement and interpretation». American Journal of Hematology. 89 (4): 443–7. doi:10.1002/ajh.23623. PMID 24809098.
- ^ Tolosano E, Fagoonee S, Hirsch E, Berger FG, Baumann H, Silengo L, Altruda F (December 2002). «Enhanced splenomegaly and severe liver inflammation in haptoglobin/hemopexin double-null mice after acute hemolysis». Blood. 100 (12): 4201–8. doi:10.1182/blood-2002-04-1270. PMID 12393471.
- ^ a b c d Woodgate P, Jardine LA (May 2015). «Neonatal jaundice: phototherapy». BMJ Clinical Evidence. 2015. PMC 4440981. PMID 25998618.
- ^ a b c Murki S, Kumar P (June 2011). «Blood exchange transfusion for infants with severe neonatal hyperbilirubinemia». Seminars in Perinatology. Newborn Jaundice Technologies. 35 (3): 175–84. doi:10.1053/j.semperi.2011.02.013. PMID 21641492.
- ^ Mishra S, Agarwal R, Deorari AK, Paul VK (February 2008). «Jaundice in the newborns». Indian Journal of Pediatrics. 75 (2): 157–63. doi:10.1007/s12098-008-0024-7. PMID 18334797. S2CID 11031084.
- ^ Maisels MJ (December 2006). «Neonatal jaundice». Pediatrics in Review. 27 (12): 443–54. doi:10.1542/pir.27-12-443. PMID 17142466.
- ^ Ferri’s clinical advisor 2015 : 5 books in 1. Fred F. Ferri. Philadelphia, PA. 2015. ISBN 978-0-323-08430-7. OCLC 880898938.
{{cite book}}: CS1 maint: others (link) - ^ Porter ML, Dennis BL (February 2002). «Hyperbilirubinemia in the term newborn». American Family Physician. 65 (4): 599–606. PMID 11871676.
- ^ a b Gourley GR (1997). «Bilirubin metabolism and kernicterus». Advances in Pediatrics. 44: 173–229. PMID 9265971.
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Гемолитическая желтуха — это вариант надпеченочного желтушного синдрома, обусловленный гемолизом эритроцитов. Проявляется желтушностью и бледностью кожных покровов и слизистых, спленомегалией, потемнением мочи и кала, гемолитическими кризами. Диагностируется с помощью общего анализа крови, определения концентрации непрямого и общего билирубина, УЗИ органов брюшной полости. Для лечения используют кортикостероиды, цитостатики, антибиотики, активаторы печеночных ферментов, инфузионную и фототерапию, переливание компонентов крови. По показаниям проводят спленэктомию.
МКБ-10
D59 P58
- Причины
- Патогенез
- Классификация
- Симптомы гемолитической желтухи
- Осложнения
- Диагностика
- Лечение гемолитической желтухи
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Гемолитическая (плейохолическая) желтуха развивается при превышении уровня свободного билирубина, который может беспрепятственно конъюгироваться в печени. В обычных условиях в человеческом организме разрушается до 100-200 млн. эритроцитов за час, при этом срок жизни красных клеточных элементов крови составляет в среднем 120 дней. Из 1 г гемоглобина, выделяющегося при гемолизе, образуется 35 мг неконъюгированного пигмента (около 250-350 г/сут).
Печень обладает 3-4-кратным функциональным резервом для связывания избытка билирубина. При укорочении срока жизни эритроцитов, их ускоренном разрушении концентрация пигмента превышает предельный печеночный порог конъюгации, непрямой билирубин накапливается в крови, откладывается в тканях, что сопровождается формированием характерной клинической картины.
Гемолитическая желтуха
Причины
Заболевание развивается на фоне гемолиза с образованием большого количества непрямого билирубина, который не успевает конъюгироваться гепатоцитами. Гемолитическая форма желтухи вызывается теми же этиологическими факторами, что и патологические состояния с усиленным внутрисосудистым или внесосудистым разрушением эритроцитов. Специалисты в сфере современной гастроэнтерологии и гематологии выделяют следующие причины расстройства:
- Наследственные дефекты эритроцитов и гемоглобина. Гемолиз может быть обусловлен генетически обусловленными энзимопатиями (недостаточностью пируваткиназы, глюкозо-6-фосфатдегидрогеназы), несостоятельностью эритроцитарных оболочек (наследственным микросфероцитозом, акантоцитозом, овалоцитозом, пароксизмальной ночной гемоглобинурией). Желтуха гемолитического типа также наблюдается при гемоглобинопатиях (талассемии, серповидно-клеточной анемии и др.).
- Воздействие гемолитических плазматических факторов. Реакцию гемолиза вызывают антитела при гемолитической болезни новорожденных и переливании изонесовместимой крови, гемолизины возбудителей кори, краснухи, сепсиса, эпидемического паротита, лептоспироза, малярийные плазмодии, змеиный и другие гемотоксичные яды (сероводород, мышьяк, свинец, фосфор, анилин, нитробензол), Эритроциты разрушаются под влиянием ряда фармпрепаратов (сульфаниламидов, антипиретиков, хининов).
- Обширные кровоизлияния, инфаркты. Повышенное образование свободного билирубина связано с массивным распадом элементов крови при рассасывании крупных гематом в мягких тканях, паренхиматозных органах, полостях тела. Гемолитической надпеченочной желтухой осложняются массивные желудочно-кишечные кровотечения, расслаивающая аневризма аорты, инфаркт миокарда, легкого, геморрагический инсульт, гемоторакс. Обычно такое состояние связано с существующим заболеванием, травмой.
- Механическое разрушение эритроцитов в сосудах. Красные кровяные тельца подвергаются внутрисосудистому гемолизу при их сдавлении в периферических кровеносных сосудах, прилегающих к костным выступам (маршевая гемоглобинурия), турбуленции потока крови при дисфункции протезов сердечных клапанов. Гемолиз также возникает при прохождении эритроцитов через фибриновые депозиты в артериолах при ДВС-синдроме, гемолитико-уремическом синдроме, тромботической тромбоцитопенической пурпуре.
У части пациентов разрушение красных кровяных клеток с развитием надпеченочной желтухи наблюдается в рамках клинической картины злокачественных опухолей разной локализации, лейкозов, лимфопролиферативных заболеваний, пернициозной анемии Аддисона-Бирмера, системных патологий соединительной ткани. Гемотоксическое действие оказывают мощные ионизирующие воздействия при лучевой болезни, радиотерапии. Физиологическая желтуха возникает у новорожденных при усиленном гемолизе фетального гемоглобина на фоне низкой активности печеночных ферментов.
Патогенез
В основе механизма развития гемолитической желтухи лежит относительная функциональная недостаточность печеночных клеток, неспособных связать большое количество свободного билирубина, образовавшегося при гемолизе эритроцитов. Дополнительным патогенетическим фактором является нарушение внутриклеточного транспорта пигмента в гепатоцитах при его высокой концентрации. В результате неконъюгированный билирубин связывается с альбуминами и циркулирует в крови в виде водонерастворимых билирубин-альбуминовых комплексов, которые не могут выводиться с мочой.
Жирорастворимый свободный пигмент легко проникает через клеточные и митохондриальные мембраны, окрашивает в желтый цвет кожу и слизистые оболочки, нарушает процессы окислительного фосфорилирования, синтез белков, трансмембранный потенциал клеток. Поражение ядер головного мозга, особо чувствительных к токсическому эффекту непрямого билирубина, приводит к развитию энцефалопатии (ядерной желтухи) с выраженной неврологической симптоматикой. Связывающая способность альбуминов оказывается недостаточной при непрямой гипербилирубинемии более 260-550 мкмоль/л.
Активная конъюгация пигмента в печени сопровождается его усиленной экскрецией в просвет кишечника с образованием уробилиногена в тонкой кишке и затем стеркобилиногена — в толстой. Избыточное количество всосавшегося в кровь уробилиногена, который не может полностью элиминироваться гепатоцитами, продолжает циркулировать в крови. Высокий уровень экскретируемого с мочой стеркобилиногена, всосавшегося в геморроидальных венах, и стеркобилина в кале придает экскрементам характерную коричневую окраску. После исчерпания способности гепатоцитов выделять прямой (конъюгированный) билирубин в желчь происходит обратная диффузия связанной формы пигмента в кровь.
Классификация
Систематизация форм гемолитической желтухи учитывает этиологические факторы, под влиянием которых произошел гемолиз. Такой подход позволяет выбрать оптимальную терапевтическую тактику, максимально компенсирующую действие первопричины заболевания. Гастроэнтерологи и гематологи различают следующие типы гемолитических надпеченочных желтух:
- Гемолитические корпускулярные желтухи. Связаны с различными видами несостоятельности эритроцитов — дефицитом или недостаточной активностью ферментных систем, дефектами гемоглобина, мембранных структур. Обычно корпускулярные плейохолические желтухи вызваны генетическими аномалиями, их лечение является преимущественно симптоматическим.
- Гемолитические экстракорпускулярные желтухи. К разрушению эритроцитов приводит действие различных внешних факторов — антител, микробных токсинов, гемолитических ядов, механических нагрузок. Наряду с устранением отдельных симптомов это позволяет использовать методы, направленные на элиминацию этиопатогена и отдельные звенья патогенеза гемолиза.
- Гемолитические постгеморрагические желтухи. Возникают на фоне массивного распада эритроцитов в участках кровоизлияний. Обычно осложняют течение тяжелых травм и других неотложных состояний. Прогнозирование развития надпеченочной желтухи дает возможность назначить превентивную терапию для предупреждения дальнейших осложнений.
Симптомы гемолитической желтухи
Характерный признак заболевания — сочетание бледности кожных покровов с лимонно-желтым окрашиванием кожи, конъюнктивы глаз при отсутствии кожного зуда. У большинства пациентов с надпеченочной желтухой наблюдается потемнение мочи. Могут возникать умеренные боли в животе, диспепсические расстройства – тошнота, отрыжка, диарея. Обострение заболевания (гемолитический криз) клинически проявляется фебрильной лихорадкой, головной болью, миалгиями, интенсивными болями в левом подреберье вследствие увеличения селезенки. Если заболевание вызвано острым отравлением химическими соединениями или лекарственными средствами, присоединяются интоксикационные симптомы в виде угнетения сознания вплоть до комы, выраженной тахикардии, падения АД, расстройств дыхания и мочевыделения.
Осложнения
Наличие у пациента надпеченочной желтухи повышает риск застойных явлений в желчном пузыре, что приводит к формированию пигментных камней и обструкции желчевыводящих протоков. Осложнением гемолитической желтухи может стать токсическая нефропатия с острой почечной недостаточностью, развивающаяся при выраженных нарушениях биохимического состава крови и накоплении токсических соединений. При длительном течении заболевания возможно возникновение печеночной недостаточности, при которой происходит резкое угнетение всех функций органа, что клинически проявляется кахексией, дистрофическими изменениями, стойкими нарушениями метаболических процессов. Плейохолическая желтуха иногда осложняется билирубиновой энцефалопатией вследствие интоксикации головного мозга.
Диагностика
Постановка диагноза не представляет затруднений при наличии типичной клинической картины заболевания. Отличительный признак гемолитической желтухи — желтушное окрашивание кожи без кожного зуда и увеличения печени. Диагностический поиск направлен на выявление первопричины болезни. План обследования включает следующие инструментальные и лабораторные методы:
- Общий анализ крови. При проведении исследования определяется резкое уменьшение количества гемоглобина и эритроцитов с одновременным повышением содержания ретикулоцитов свыше 1%. При морфологической оценке могут выявляться специфические клетки, указывающие на определенный вид гемолитической анемии: сфероциты, мишеневидные, серповидные эритроциты. В остром периоде и при аутоиммунных процессах наблюдается лейкоцитоз со сдвигом формулы влево.
- Биохимический анализ крови. Патогномоничный признак надпеченочной желтухи — повышение концентрации свободного билирубина. Исследование позволяет установить степень тяжести болезни по уровню общего билирубина: до 80 мкмоль/л — легкая, 80-150 мкмоль/л — средняя, свыше 150 мкмоль/л — тяжелая форма. О гемолитической природе заболевания свидетельствует повышение содержания ЛДГ-5, выделяющейся из разрушенных эритроцитов, и снижение гаптоглобина.
- УЗИ брюшной полости. При плейохолической желтухе во время ультразвукового исследования ОБП определяется значительное увеличение селезенки при обычно нормальных размерах печени и структуре печеночной паренхимы. Также сонографически удается выявить заболевания гепатобилиарной системы, которые могут сочетаться с гемолитической патологией: желчнокаменную болезнь, холецистит, фиброзные поражения печени, изменения печеночных сосудов.
Концентрация АЛТ, АСТ, щелочной фосфатазы обычно в пределах нормы. В общем анализе мочи обнаруживается высокое содержание стеркобилиногена и уробилина, билирубинурия отсутствует. В копрограмме отмечается повышенный уровень стеркобилина. Для комплексной оценки состояния печени при желтухе может выполняться КТ, МРТ, холангиопанкреатография. Дополнительно проводится исследование осмотической резистентности эритроцитов, которая повышается при талассемии и снижается при гемолитической сфероцитарной анемии. В тесте Кумбса могут выявляться антиэритроцитарные антитела.
Дифференциальную диагностику осуществляют с синдромом Жильбера, паренхиматозной и механической желтухой, а также с заболеваниями, которые могут служить причиной указанных видов гипербилирубинемий — гепатитами, лептоспирозом, желтушной формой инфекционного мононуклеоза, псевдотуберкулезом, иерсиниозом, амебиазом, желчнокаменной болезнью, опухолями печени и Фатерова соска. По направлению врача-гастроэнтеролога при наличии показаний пациента консультирует гематолог, абдоминальный хирург и другие специалисты.
Лечение гемолитической желтухи
Рекомендована комплексная терапия, позволяющая по возможности устранить причину гемолиза, воздействовать на патогенетические звенья, купировать угрожающие жизни симптомы. Лечение гемолитической формы надпеченочной желтухи обычно является консервативным и сочетается с диетотерапией, направленной на поддержание нормальной работы печени. Показано существенное ограничение или полное исключение жирных, жареных, острых блюд, продуктов, содержащих много каротина и грубой клетчатки. С учетом возможной причины гемолитической анемии и желтухи план лечения включает:
- Кортикостероиды. Назначение иммуносупрессорной гормональной терапии оправдано при диагностике аутоиммунных расстройств, провоцирующих развитие приобретенной гемолитической анемии. У некоторых пациентов с желтухой более эффективным оказывается прием цитостатических препаратов.
- Антибиотики. Используются при гемолизе, обусловленном действием бактериальных токсинов. Рекомендуются средства, не вступающие в конкурентное вытеснение билирубина из соединений с глюкуроновой кислотой. Препараты из групп амфениколов, цефалоспоринов, сульфаниламидов применяются с осторожностью.
- Инфузионная терапия. Проводится при гемолитических процессах токсического происхождения. Введение коллоидных и кристаллоидных растворов при необходимости дополняется форсированным диурезом, энтеросорбентами, антидотами для связывания отравляющих веществ, гемосорбцией, плазмаферезом, гемодиализом.
- Индукторы ферментов печени. Активируют микросомальную ферментную систему, которая связана с цитохромом P450. В результате повышения метаболизма гепатоцитов улучшается связывание билирубина, циркулирующего в крови. Стимуляция ферментов эффективна при наличии функционального резерва печени.
- Фототерапия. Направлена на снижение гипербилирубинемии. Используется при повышении уровня билирубина до субтоксических и токсических концентраций. Способствует переводу неконъюгированного пигмента в водорастворимую изомерную форму, которая экскретируется почками и печенью без образования альбуминовых комплексов.
- Обменное переливание крови. Обычно выполняется при иммунных гемолитических состояниях с критическим для нервной системы содержанием свободного билирубина. За одну процедуру может заменяться до 70% ОЦК, благодаря чему уменьшается билирубинемия, восполняется дефицит эритроцитов, купируется гипоксия.
- Удаление селезенки. Хирургическое лечение показано при тяжелом течении гемолитической корпускулярной желтухи у пациентов с наследственными эритроцитарными ферментопатиями и мембранопатиями. Спленэктомия позволяет исключить деструкцию эритроцитов в синусах органа и их утилизацию макрофагами.
Прогноз и профилактика
Поскольку гемолитический вариант надпеченочной желтухи зачастую проявляется на фоне наследственных анемий, которые трудно поддаются лечению, прогноз заболевания считается серьезным. Полное выздоровление наблюдается у пациентов без тяжелых интеркуррентных патологий при отсутствии необратимых нарушений функций печени. Специфическая профилактика гемолитической желтухи не разработана. Для предупреждения болезни необходимо проводить своевременную диагностику и комплексную терапию гемолитических анемий, тяжелых инфекционных заболеваний, соблюдать правила совместимости крови при гемотрансфузиях, избегать полипрагмазии и назначения потенциально гемотоксичных медикаментов.
Вы можете поделиться своей историей болезни, что Вам помогло при лечении гемолитической желтухи.
Источники
- Желтухи неонатального периода : учебно-методическое пособие / Ткаченко А.К. – 2017.
- Дифференциальная диагностика желтух/ Самсон А.А.// Медицина неотложных состояний. – 2013 — №5(52).
- Дифференциальная диагностика синдрома желтухи у детей: учебно-методическое пособие/ Артемчик Т. А. – 2017.
- Настоящая статья подготовлена по материалам сайта: https://www.krasotaimedicina.ru/
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.