Оксана Семячкина-Глушковская,
доктор биологических наук, Саратовский государственный университет им. Н. Г. Чернышевского
«Наука и жизнь» №7, 2015
В последнее десятилетие всё чаще врачи сталкиваются с инсультом новорождённых, но лечить его пока не очень получается. Трудности связаны с гематоэнцефалическим барьером — одной из самых загадочных систем мозга, «перегородкой» между кровью, циркулирующей в теле, и мозгом. Именно он решает, что допустить в мозг, а что — нет. Сегодня тема преодоления гематоэнцефалического барьера нужными лекарствами стала одной из горячих и «денежных» в нейрофизиологии.
Гематоэнцефалический барьер — тонкая физиологическая организация — оставался вне поля зрения учёных до тех пор, пока не стало очевидно, что именно он тормозит успехи современной медицины и именно в его работе скрыты ресурсы для новой эпохи в фармакологии. За последние 20 лет в мире было синтезировано более 40 новых препаратов, из которых всего два — для лечения болезней мозга. Гематоэнцефалический барьер создаёт для некоторых веществ «зелёный» коридор, но для целого ряда препаратов он остаётся непроницаемым, и потому врачи безоружны в борьбе со многими неврологическими патологиями, такими, например, как инсульт мозга. Задача проницаемости барьера встала, когда было признано, что у новорождённых это заболевание встречается так же часто, как у взрослых.
Десять лет назад диагноз «инсульт» детям ставили крайне редко. Сегодня прогресс в развитии безопасных технологий для внутреннего исследования мозга (визуализация) позволил исследователям увидеть серьёзность проблемы. Особенность детского инсульта в том, что он проходит зачастую бессимптомно или «маскируется» под другие заболевания. Последствия катастрофичны для ребёнка. У большинства маленьких пациентов возникают серьёзные нарушения: задержка умственного и речевого развития, гиперреактивность, затруднения в концентрации внимания, у них страдают логика и адаптация к стрессам, что не сразу и не очевидно проявляется в первые дни жизни.
Но диагностика инсульта мозга у новорождённых — лишь первый этап. Главный вопрос — как лечить и как предупредить это заболевание. Детский и взрослый инсульты — разные! Мы знаем, какие факторы провоцируют развитие инсульта у взрослых — к примеру, гипертензия. Но для малышей эти факторы не так актуальны, и даже такие очевидные на первый взгляд причины, как родовые травмы, не вошли в лидирующую десятку провокаторов инсульта у детей.
Почему инсульты мозга у новорождённых и взрослых так различаются? После появления на свет мозг ребёнка ещё продолжает развиваться, причём особенно интенсивно в первые дни после рождения. В настоящий момент не существует тактики лечения инсульта мозга у новорождённых. Мало зная об этом заболевании у младенцев, врачи вынуждены применять к ним терапию, показанную для взрослых. Она оказывается неэффективной, а иногда даже мешает выздоровлению. Успех в лечении таких детей — зачастую случайность, а не результат заранее спланированной тактики врача.
Возникло предположение, что многие препараты, которые существуют в арсенале врача для лечения инсульта, просто не доходят до мозга новорождённого из-за капризного гематоэнцефалического барьера, который закрывается и не даёт поработать препаратам.
Несмотря на прорывные технологии в визуализации структур мозга, решения проблем детского инсульта не было, потому что не хватало подходящего инструментария для исследования «ворот», пропускающих лекарства в гематоэнцефалическом барьере.
В экспериментальной медицине платформа для изучения любых болезней — моделирование патологии на животных. Среди существующих на сегодняшний день моделей инсульта ни одна не пригодна для новорождённых.
Есть два типа инсульта — ишемический, когда сосуды мозга сужаются, что ограничивает его питание и кровоснабжение, и геморрагический, когда сосуды рвутся без явных на то причин. У новорождённых преобладает второй тип инсульта. Однако модели, традиционно применяемые для изучения геморрагического инсульта, работают по принципу механического введения крови в мозг экспериментальных животных, что сильно ограничивает исследовательские возможности.
На биологическом факультете Саратовского государственного университета им. Н. Г. Чернышевского разработали модель инсульта, с помощью которой можно увидеть, как сосуды мозга разрываются самостоятельно, без дополнительных вмешательств. Для этого используется звуковой стресс (120 дБ, 7 Гц). Звуковые волны за счёт способности глубоко проникать в мозг нарушают центры регуляции его кровотока.
Сосудистые «катастрофы» у новорождённых случаются не сразу, а через два-три дня после рождения. Аналогичные изменения происходят с сосудами лабораторных животных после влияния звукового стресса. И хотя звук — это неадекватный провоцирующий фактор для детского инсульта, на сегодняшний день это единственная модель, которая позволяет изучать развитие данной патологии без инвазивных вмешательств, запуская внутренние патологические процессы, максимально приближенные к естественному ходу событий.
Однако для взрослых животных простого стресса недостаточно, чтобы вызвать инсульт головного мозга. Для них требуется наличие хронически высокого артериального давления, изнашивающего сосуды и делающего их стресс-неустойчивыми. Для того чтобы изучать, как работает «барьер» на первых этапах жизни и на последующих этапах развития, мы вооружились современными методами флуоресцентного обнаружения белков окклудин и клаудин-5, работающих «таможенниками» на границе между мозгом и кровью. Воспользовались и старым методом изучения прохождения барьера красителем Evans blue (голубой Эванса), связывающимся с белками крови. Именно этот краситель в 1885 году помог открыть гематоэнцефалический барьер немецкому нейрофизиологу Паулю Эрлиху. Когда он ввёл краситель в кровь, то обнаружил, что все внутренние органы окрасились, а мозг нет. Позже опыты повторил его ученик Эдвин Голдман, но он вводил краситель уже непосредственно в спинномозговой канал лабораторного животного. Мозг становился синим, при этом вся краска оставалась в нём, не проникая на периферию. И по сей день краситель Evans blue — надёжный способ проверки работы гематоэнцефалического барьера. Конечно, появились и другие, более точные способы тестирования проницаемости барьера, например светящиеся метки, закреплённые на полисахаридах — декстранах разной массы (3 кДа и 70 кДа).
А теперь посмотрим, как работает гематоэнцефалический барьер при развитии геморрагического инсульта и как эти процессы отличаются друг от друга в первые дни после рождения лабораторного животного и в последующем его развитии.
Оказалось, внутривенное введение красителя крысам на фоне развития инсульта сопровождается появлением голубой окраски тканей мозга только у взрослых, но не у новорождённых особей.
Мы исследовали, какие вещества проходят через гематоэнцефалический барьер в условиях, когда организму необходимо бороться с инсультом. Для этого использовали флуоресцентные метки — лёгкие (декстран 3 кДа) и тяжёлые (декстран 70 кДа), которые своим свечением подсказывают нам их местонахождение и помогают определить путь движения.
Как оказалось, у взрослых крыс мозг при инсульте как решето: пропускает даже высокомолекулярные соединения (декстран 70 кДа). А у новорождённых декстрановые флуоресцентные метки застревают в сосудах: барьер закрывается так плотно, что даже низкомолекулярные соединения (декстран 3 кДа) остаются в пределах сосудов и не попадают в мозг.
Используя метод иммуноблоттинга (метод определения специфических белков), удалось увидеть белки, которые и делают барьер непроницаемым. Мы наблюдали за двумя критически важными белками — клаудином-5 и окклудином. У новорождённых крыс этих белков в разы больше, чем у взрослых. Вот почему краситель Evans blue и флуоресцентные метки у новорождённых особей «застревают» в барьере, в то время как у взрослых он становится более «лояльным» — проницаемым для веществ, которые в обычных условиях в мозг не попадают.
Возможно ли найти объяснение разного поведения мозга в момент его начального развития и когда статус организма уже сформировался? Мозг развивается по принципу избыточности. Он старается иметь сразу всё и много и только потом разбирается, что с этим делать. Часть его структур, к примеру адренергические нейроны, у которых медиаторами служат норадреналин и адреналин, образуется задолго до рождения, но созревает только к двум годам жизни. Другие структуры, альфа2-адренорецепторы, наоборот, созревают до рождения в огромном количестве, а после их плотность заметно снижается. Но так или иначе, многие молекулярные структуры мозга, равно как и его биохимия, формируются заведомо с избытком. Возможно, это одна из причин, почему у новорождённых наблюдается повышенная экспрессия «барьерных» белков, препятствующих проникновению многих «взрослых» препаратов, которые применяют при лечении инсульта мозга.
Тайна гематоэнцефалического барьера — как грань между небом, землёй и воздухом. Его можно «увидеть», но трудно постичь. Нужны бойцы-невидимки, которые могли бы обмануть строгих стражей барьера, пронести необходимую «гуманитарную помощь» страдающему мозгу маленького пациента и помочь ему в борьбе с инсультом. Такими помощниками могут стать транспортные системы — липосомы, капсулы, углеродные нанотрубки, которые активно разрабатываются с этой целью во всём мире.
Исследования проводились на биологическом факультете Саратовского государственного университета им. Н. Г. Чернышевского в рамках проекта Российского научного фонда (№14-15-00128) и гранта Президента РФ (МД-2216.2014.4).
Ключевые слова
гематоэнцефалический барьер
нейроваскулярная единица
гематоликворный барьер
интратекальный путь введения препаратов
спинномозговая жидкость
Как цитировать
Горбачев ВИ, Брагина НВ Гематоэнцефалический барьер с позиции анестезиолога-реаниматолога. Обзор литературы. Часть 1. Вестник интенсивной терапии имени А.И. Салтанова. 2020;(3):35–45. doi:10.21320/1818-474X-2020-3-35-45.
Статистика
Просмотров аннотации: 208
PDF_2020-03_35-45 загрузок: 16
HTML_2020-03_35-45 загрузок: 12
Статистика с 21.01.2023
Аннотация
Гематоэнцефалический барьер (ГЭБ) предотвращает проникновение нейротоксичных компонентов плазмы, клеток крови и патогенов в мозг. В то же время он регулирует транспорт молекул в центральной нервной системе, поддерживая строго контролируемый химический состав нейрональной среды. В этом обзоре рассматриваются молекулярные и клеточные механизмы, лежащие в основе функционирования ГЭБ, физиология транспортных систем ГЭБ, структурные компоненты гематоликворного барьера и особенности интратекального введения лекарственных средств. На основании физико-химических свойств антибактериальных препаратов оценивается, какие соединения в настоящее время являются наиболее перспективными для лечения инфекций центральной нервной системы.
Библиографические ссылки
- Erdő F., Denes L., de Lange E. Age-associated physiological and pathological changes at the blood-brain barrier: A review. J. Cerebral Blood Flow &Metabolism. 2017; 37(1): 4–24. DOI: 10.1177/0271678X16679420
- Dalvi S., On N., Nguyen H., et al. The Blood Brain Barrier — Regulation of Fatty Acid and Drug Transport. Neurochemistry. 2014; 1–33. DOI: 10.5772/57604
- Моргун А.В., Кувачева Н.В., Комлева Ю.К. и др. Модели гематоэнцефалического барьера in vitro: современное состояние проблемы и перспективы. Анналы клинической и экспериментальной неврологии. 2012; 6(4): 42–51. [Morgun A.V., Kuvacheva N.V., Komleva Ju.K., et al. Modeli gematoencefalicheskogo bar’era in vitro: sovremennoe sostoyanie problemy i perspektivy. Annaly klinicheskoj i jeksperimental’noj nevrologii. 2012; 6(4):42–51. (In Russ)]
- Чехонин В.П., Баклаушев В.П., Юсубалиева Г.М. и др. Фундаментальные и прикладные аспекты изучения гематоэнцефалического барьера. Вестник Российской академии медицинских наук. 2012; 8: 66–78. [Chehonin V.P., Baklaushev V.P., Jusubalieva G.M., et al. Fundamental’nye i prikladnye aspekty izucheniya gematoencefalicheskogo bar’era. Vestnik Rossijskoj akademii medicinskih nauk. 2012; 8: 66–78. (In Russ)]
- Пикалюк В.С., Корсунская Л.Л., Роменский А.О., Шаймарданова Л.Р. Циркумвентрикулярная система как «ворота» в головной мозг. Таврический медико-биологический вестник. 2013; 16(1–1): 270–275. [Pikaljuk V.S., Korsunskaja L.L., Romenskij A.O., Shajmardanova L.R. Cirkumventrikulyarnaya sistema kak “vorota” v golovnoj mozg. Tavricheskij mediko-biologicheskij vestnik. 2013; 16(1–1): 270–275. (In Russ)]
- Lu C., Zhao Y., Wong H.L., et al. Current approaches to enhance CNS delivery of drugs across the brain barriers. Int. J. Nanomedicine. 2014; 9: 2241–2257. DOI: 10.2147/IJN.S61288
- Блинов Д.В. Современные представления о роли нарушения резистентности гематоэнцефалического барьера в патогенезе заболеваний ЦНС. Часть 2: функции и механизмы повреждения гематоэнцефалического барьера. Эпилепсия и пароксизмальные состояния. 2014; 6(1):70–84. [Blinov D.V. Sovremennye predstavleniya o roli narusheniya rezistentnosti gematoencefalicheskogo bar’era v patogeneze zabolevanij CNS. CHast’ 2: funkcii i mekhanizmy povrezhdeniya gematoencefalicheskogo bar’era. Jepilepsija i paroksizmal’nye sostojanija. 2014; 6(1): 70–84. (In Russ)]
- Weiss N., Miller F., Cazaubon S., Couraud P.O. The blood-brain barrier in brain homeostasis and neurological diseases. Biochimica et Biophysica Acta. 2009; 1788: 842–857. DOI: 10.1016/j.bbamem.2008.10.022
- Warren K.E. Beyond the blood-brain barrier: the importance of central nervous system (CNS) pharmacokinetics for the treatment of CNS tumors, including diffuse intrinsic pontine glioma. Frontiers in Oncology. 2018; 8: 239. DOI: 10.3389/fonc.2018.00239
- Горбачев В.И., Маньков А.В., Христенко И.В., Капустина А.В. О некоторых механизмах гомеостаза центральной нервной системы. Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. 2006; 5(51): 52–55. [Gorbachev V.I., Man‘kov A.V., Hristenko I.V., Kapustina A.V. O nekotoryh mekhanizmah gomeostaza central’noj nervnoj sistemy. Bjulleten’ Vostochno-Sibirskogo nauchnogo centra Sibirskogo otdelenija Rossijskoj akademii medicinskih nauk. 2006; 5(51): 52–55. (In Russ)]
- Nau R., Sörgel F., Eiffert H. Penetration of drugs through the blood-cerebrospinal fluid/blood-brain barrier for treatment of central nervous system infections. Clinical Microbiology Reviews. 2010; 23(4): 858–883. DOI: 10.1128/CMR.00007-10
- Cabrera-Maqueda J.M., Rumí L.F., López G.V., et al. Antibiotic diffusion to central nervous system. Revista Espanola de Quimioterapia. 2018; 31(1): 1–12. (In Spain)
- Djukic M., Munz M., Sörgel F., et al. Overton’s rule helps to estimate the penetration of anti-infectives into patients’ cerebrospinal fluid. Antimicrobial Agents Chemotherapy. 2012; 56(2): 979–988. DOI: 10.1128/AAC.00437-11
- Flierl M.A., Stahel P.F., Rittirsch D., et al. Inhibition of complement C5a prevents breakdown of the blood-brain barrier and pituitary dysfunction in experimental sepsis. Critical Care. 2009; 13: 12. DOI: 10.1186/cc7710
- Hofer S., Bopp C., Hoerner C., et al. Injury of the blood brain barrier and up-regulation of icam-1 in polymicrobial sepsis. J. Surgical Research. 2008; 146: 276–28. DOI: 10.1016 / j.jss.2007.07.021
- Viladrich P.F., Cabellos C., Pallares R., et al. High doses of cefotaxime in treatment of adult meningitis due to Streptococcus pneumoniae with decreased susceptibilities to broad-spectrum cephalosporins. Antimicrobial Agents and Chemotherapy. 1996; 40(1): 218–220. DOI: 10.1128/AAC.40.1.218
- Wong V.K., Wright H.T., Ross L.A.Jr., et al. Imipenem/cilastatin treatment of bacterial meningitis in children. The Pediatric Infectious Disease Journal. 1991; 10: 122–125.
- De Sarro A., Ammendola D., Zappala M., et al. Relationship between structure and convulsant properties of some beta-lactam antibiotics following intracerebroventricular microinjection in rats. Antimicrobial Agents and Chemotherapy. 1995; 39: 232–237.
- Tunkel A.R., Hartman B.J., Kaplan S.L., et al. Practice Guidelines for the Management of Bacterial Meningitis. Clinical Infectious Diseases. 2004; 39(9): 1267–1284. DOI: 10.1086/425368
- Cawley M.J., Suh C., Lee S., Ackerman B.H. Nontraditional dosing of ampicillin-sulbactam for multidrug-resistant Acinetobacter baumannii meningitis. Pharmacotherapy. 2002; 22: 527–532.
- Debruyne D. Clinical pharmacokinetics of fluconazole in superficial and systemic mycoses. Clinical pharmacokinetics. 1997; 33: 52–77.
- Лебедев И.А., Левитина Е.В., Акимжанова А.К. и др. Интратекальное введение лекарственных препаратов. Журнал неврологии и психиатрии. 2016; 10,89–92. DOI: 10.17116/jnevro201611610189-92 [Lebedev I.A., Levitina E.V., Akimzhanova A.K., et al. Intratekal’noe vvedenie lekarstvennyh preparatov. Zhurnal nevrologii i psihiatrii. 2016; 10: 89–92. (In Russ)]
- Потапов А.А., Крылов В.В., Гаврилов А.Г. и др. Рекомендации по диагностике и лечению тяжелой черепно-мозговой травмы. Часть 2. Интенсивная терапия и нейромониторинг. Вопросы нейрохирургии. 2016; 1: 98–106. DOI: 10.17116/neiro201680198-106 [Potapov A.A., Krylov V.V., Gavrilov A.G., et al. Rekomendacii po diagnostike i lecheniyu tyazheloj cherepno-mozgovoj travmy. CHast’ 2. Intensivnaya terapiya i nejromonitoring. Voprosy nejrohirurgii. 2016; 1: 98–106. (In Russ)]
- Nau R., Blei C., Eiffert H. Intrathecal antibacterial and antifungal therapies. Clinical Microbiology Reviews. 2020; 33(3): 00190–19. DOI: 10.1128/CMR.00190-19.
- Агаркова А.А., Покровский М.В., Корокина Л.В., Землянский О.А. Пневмококковый менингит: современные аспекты диагностики и лечения. Клиническая фармакология и терапия. 2019; 28(2): 84–92. DOI: 10.32756/0869-5490-2019-2-84-92 [Agarkova A.A., Pokrovskii M.V., Korokina L.V., Zemlyanskii O.A. Pnevmokokkovyj meningit: sovremennye aspekty diagnostiki i lecheniya. Klinicheskaya farmakologiya i terapiya. 2019; 28(2): 84–92. (In Russ)]
- Van de Beek D., Cabellos C., Dzupova O., et al. ESCMID guideline: diagnosis and treatment of acute bacterial meningitis. Clinical microbiology and infection: the official publication of the European Society of Clinical Microbiology and Infectious Diseases. 2016; 22: 37–62. DOI: 10.1016/j.cmi.2016.01.007.
- Edwards R.J., Drake J.M. Cerebrospinal fluid devices. Youmans & Winn Neurological Surgery. 7th ed. 2017: 1638–1643.
- Карпов И.А., Шанько Ю.Г., Соловей Н.В. и др. Менингиты и вентрикулиты, связанные с оказанием медицинской помощи: диагностика, лечение и профилактика. Клиническая микробиология и антимикробная химиотерапия. 2018; 20(4): 260–288. Режим доступа: https://cyberleninka.ru/article/n/meningity-i-ventrikulity-svyazannye-s-okazaniem-meditsinskoy-pomoschi-diagnostika-lechenie-i-profilaktika. Ссылка активна на 02.05.2020. [Karpov I.A., Shan‘ko Yu.G., Solovei N.V., et al. Meningity i ventrikulity, svyazannye s okazaniem medicinskoj pomoshchi: diagnostika, lechenie i profilaktika. Klinicheskaya mikrobiologiya i antimikrobnaya khimioterapiya. 2018; 20(4): 260–288. Available at: https://cyberleninka.ru/article/n/meningity-i-ventrikulity-svyazannye-s-okazaniem-meditsinskoy-pomoschi-diagnostika-lechenie-i-profilaktika. Accessed: 02.05.2020. (In Russ)]
- Потапов А.А., Крылов В.В., Лихтерман Л.Б. и др. Клинические рекомендации по лечению пострадаших с тяжелой черепно-мозговой травмой. М., 2014: 21. [Potapov A.A., Krylov V.V., Likhterman L.B., et al. Klinicheskie rekomendacii po lecheniyu postradashih s tyazheloj cherepno-mozgovoj travmoj. M., 2014: 21. (In Russ)]
- Khan S.A., Waqas M., Siddiqui U.T., et al. Intrathecal and intraventricular antibiotics for postoperative Gram-negative meningitis and ventriculitis. Surgical Neurology International. 2017; 8: 226. DOI: 10.4103/sni.sni_81_17
- Lich B.F., Conner A.K., Burks J.D., et al. Intrathecal/intraventricular linezolid in multidrug-resistant Enterococcus faecalis ventriculitis. J. Neurological Surgery Reports. 2016; 77(04): 160–161. DOI: 10.1055 / s-0036-1593439
- Wang H., Zhao S., Chen B., et al. Comparison of the curative efficacy of intrathecal and intravenous injection of ceftriaxone and vancomycin in the treatment of intracranial infection during the perioperative period. International journal of clinical and experimental medicine. 2017; 10(11): 15485–15491.
- Mader M.M., Czorlich P., König C., et al. Intrathecal penetration of meropenem and vancomycin administered by continuous infusion in patients suffering from ventriculitis — a retrospective analysis. Acta Neurochirurgica. 2018; 160: 2099–2105. DOI: 10.1007/s00701-018-3680-z
- Zhang Q., Chen H., Zhu C., et al. Efficacy and safety of intrathecal meropenem and vancomycin in the treatment of postoperative intracranial infection in patients with severe traumatic brain injury. Experimental and Therapeutic Medicine. 2019; 17: 4605–4609. DOI: 10.3892 / etm.2019.7503.
- Ziai W.C., Lewin J.J. Improving the role of intraventricular antimicrobialagents in the management of meningitis. Current opinion in neurology. 2009; 22: 277–282. DOI: 10.1097/WCO.0b013e32832c1396
- Tunkel A.R., Hasbun R., Bhimraj A., et al. Infectious diseases society of America’s clinical practice guidelines for healthcare-associated ventriculitis and meningitis. Clinical Infectious Diseases. 2017; 64(6): 34–65. DOI: 10.1093/cid/ciw861
- McCracken G.H., Mize S.G.Jr., Threlkeld N. Intraventricular gentamicin therapy in Gram-negative bacillary meningitis of infancy. Report of the Second Neonatal Meningitis Cooperative Study Group. Lancet. 1980; 1: 787–791.
- Shah S.S., Ohlsson A., Shah V.S. Intraventricular antibiotics for bacterial meningitis in neonates. Cochrane Database of Systematic Reviews. 2004; 4: CD004496. DOI: 10.1002/14651858.CD004496.pub2
Наиболее читаемые статьи этого автора (авторов)
-
Владимир Ильич Горбачев,
Е.С. Нетесин,
М.Ю. Итыгилов,
С.В. Горбачев,
Н.Н. Уткин,Нормативно-правовое регулирование ошибок и осложнений в анестезиологии-реаниматологии в Российской Федерации: обзор литературы
,Вестник интенсивной терапии имени А.И. Салтанова: № 4 (2022)
-
Горбачев Владимир Ильич,
Е.С. Нетесин,
С.М. Горбачева,
С.А. Сумин,
М.В. Хамидулин,
Н.Н. Уткин,Анализ уголовных дел против врачей хирургических специальностей по статье «Причинение смерти по неосторожности вследствие ненадлежащего исполнения лицом своих профессиональных обязанностей»
,Вестник интенсивной терапии имени А.И. Салтанова: № 4 (2020)
-
Е.С. Нетесин,
Владимир Ильич Горбачев,
Н.Н. Уткин,Юридические аспекты оценки качества медицинской помощи
,Вестник интенсивной терапии имени А.И. Салтанова: № 1 (2022)
-
Владимир Ильич Горбачев,
Н.В. Брагина,Гематоэнцефалический барьер с позиции анестезиолога-реаниматолога. Обзор литературы. Часть 2
,Вестник интенсивной терапии имени А.И. Салтанова: № 3 (2020)
-
Вадим Иванович Ершов,
А.А. Белкин,
Игорь Борисович Заболотских,
В.И. Горбачев,
А.И. Грицан,
К.М. Лебединский,
Д.Н. Проценко,
И.Н. Лейдерман,
А.В. Щеголев,
С.С. Петриков,
А.А. Солодов,
А.А. Газенкампф,
А.Н. Чирков,
В.В. Силкин,
С.К. Сухотин,
С.Ю. Шамаев,
С.В. Горбачев,
В.В. Фишер,
И.В. Балаев,
Р.Р. Садриев,
И.В. Мирошниченко,
А.В. Карпец,
А.В. Редюков,
И.В. Султанова,
К.Д. Зыбин,
А.А. Тихомирова,
Т.И. Конарева,
В.В. Ходченко,
Р.Ш. Зарипов,
Н.А. Борцов,
А.А. Голубкина,
Д.А. Горбунов,
В.В. Туханов,
С.В. Ершова,
А.О. Мещеряков,
Д.А. Кузьмичев,
К.С. Болодурин,
Н.В. Брагина,
В.В. Стадлер,
А.Г. Катасонов,Российское многоцентровое обсервационное клиническое исследование «Регистр респираторной терапии у пациентов с ОНМК (RETAS)»: сравнительный анализ исходов ОНМК при осуществлении ИВЛ
,Вестник интенсивной терапии имени А.И. Салтанова: № 4 (2020)
-
Д.Д. Мориков,
А.В. Шелехов,
Владимир Ильич Горбачев,
В.В. Дворниченко,
А.Г. Павлов,
С.И. Радостев,Некоторые особенности интраоперационной инфузионно-трансфузионной терапии при выполнении циторедуктивных операций с применением гипертермической внутрибрюшинной химиотерапии у больных раком яичника: ретроспективное когортное исследование
,Вестник интенсивной терапии имени А.И. Салтанова: № 3 (2021)
-
О.Г. Смирнов,
Владимир Ильич Горбачев,
Н.Г. Алейникова,
Н.В. Брагина,Ультразвуковой контроль позиции зонда для питания у новорожденных: проспективное исследование
,Вестник интенсивной терапии имени А.И. Салтанова: № 2 (2022)
-
А.М. Анурьев,
Владимир Ильич Горбачев,
Т.М. Анурьева,
И.Л. Петрова,Применение нервно-регулируемой искусственной вентиляции легких у недоношенных новорожденных
,Вестник интенсивной терапии имени А.И. Салтанова: № 2 (2020)
-
Владимир Ильич Горбачев,
Е.С. Нетесин,
С.М. Горбачева,
С.А. Сумин,
Н.Н. Уткин ,Уголовные дела против врачей — анестезиологов-реаниматологов по статьям 109, 118, 238, 290 и 293 Уголовного Кодекса РФ: обсервационное исследование
,Вестник интенсивной терапии имени А.И. Салтанова: № 3 (2021)
-
К.А. Токмаков,
Владимир Ильич Горбачев,
В.В. Унжаков,
С.М. Горбачева,Английский язык для врача анестезиолога-реаниматолога: дань моде или необходимость?
,Вестник интенсивной терапии имени А.И. Салтанова: № 3 (2018)
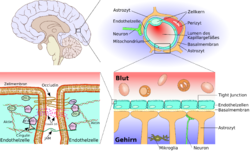
Гематоэнцефалический барьер (ГЭБ) – нейроваскулярная структура, которая играет ведущую роль в обеспечении защиты нервных клеток от повреждения, поэтому относится к значимым факторам поддержания гомеостаза мозга. Основные функции – локальная регуляция церебрального кровотока с учетом текущих потребностей разных участков мозга и защита ЦНС от проникновения чужеродных веществ, в том числе некоторых патогенных микроорганизмов.

Характеристика
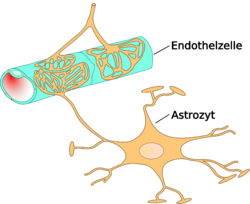
ГЭБ в медицине – это мозговая структура, образованная клетками разного типа, в том числе нейронами (электрически возбудимые клеточные элементы), астроцитами (глиальные клеточные элементы), перицитами (клеточные элементы соединительной ткани), эндотелиоцитами (клеточные элементы мезенхимного происхождения).
Это высокоорганизованная, многофункциональная система, которая присутствует в микроциркуляторном церебральном русле с диаметром сосудов меньше 100 мкм (капилляры). По данным гистологии, эндотелиоциты, входящие в состав гематоэнцефалического барьера, расположенные в церебральных капиллярах, анатомически и функционально связаны с клетками других типов.
Они играют ключевую роль в создании препятствия для проникновения посторонних соединений. Эндотелиоциты церебральных капилляров отличаются от аналогичных клеточных элементов в составе других тканей и органов. Отличительные особенности церебральных эндотелиоцитов:
- Увеличенное содержание митохондрий (органелла с двумя мембранами).
- Отсутствие фенестраций (неполных удвоений сосуда с единым началом и концом) капилляров.
- Повышенная устойчивость к воздействию электрических стимулов.
- Пиноцитозная активность (захват окружающей жидкости клеточной поверхностью) на минимальном уровне.
- Формирование плотных межклеточных контактов.
Протекторную функцию эндотелиоцитов также обеспечивают факторы – уникальный набор рецепторов, комбинация транспортных белков, комплекс помп неселективного типа. Рассматривая гистологическое строение гематоэнцефалического барьера, следует выделить другие клеточные элементы, например, перициты – удлиненные элементы с многочисленными отростками, которые пролегают вдоль капиллярной оси.

Многочисленные отростки направлены к капиллярам и посткапиллярным (образованным слиянием нескольких капилляров) венулам. Взаимодействуют с эндотелиальными клеточными элементами и аксонами, отходящими от нейронов симпатического отдела вегетативной системы. Передают импульсы от нейронов эндотелиоцитам, что обуславливает регуляцию процесса аккумуляции или потери жидкости клеточными элементами.
В результате происходит расширение или сужение сосудистого русла. Оказывают стабилизирующее действие на вновь сформировавшиеся сосуды, замедляют их дальнейший рост. Увеличение концентрации перицитов на фоне аккумуляции матричных белков за пределами клетки приводит к окончательному созреванию сосудов и стабилизации их состояния.
Снижение количества перицитов сопровождается увеличенной проницаемостью гематоэнцефалического комплекса, что связано с эндотелиальной гиперплазией (патологическая пролиферация клеток эндотелия), патологической васкуляризацией (образование новых сосудов) мозгового вещества Гематоэнцефалический барьер головного мозга состоит из клеток разного типа, которые выполняют разные задачи.
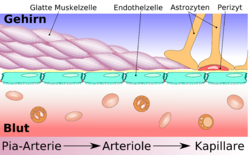
Основная функция астроцитов – координация работы транспортных систем внутри структуры. Отростки астроцитов направлены к сосудам и взаимодействуют с эндотелиоцитами, влияя на их активность. Исследования показывают, астроциты определяют функциональные характеристики эндотелиоцитов и влияют на процесс развития ткани, образующей сосуды микроциркуляторного русла.
Таким способом астроциты регулируют степень проницаемости ГЭБ. Влияние астроцитов на эндотелиоциты прослеживается в стимуляции такого свойства, как выталкивание ксенобиотиков (чужеродных химических соединений) из нервной ткани. Исследования показывают, увеличение количества астроцитов в комплексе ГЭБ способствует понижению проницаемости для чужеродных организму соединений.

Астроциты выполняют функции посредников, которые осуществляют связь нейронов, передающих управляющие сигналы, и эндотелиоцитов. Взаимодействие астроцитов и эндотелиоцитов осуществляется через кальций-опосредованные каналы. Передача импульсов от нейронов эндотелиоцитам также выполняется пуринергическим способом передачи – посредством пуриновых нуклеотидов и нуклеозидов.
Астроциты в составе гемато-энцефалического барьера продуцируют нейроактивные компоненты – нейропептиды (регулируют физиологические функции), факторы роста (соединения, стимулирующие рост и пролиферацию клеточных элементов), стероиды (участвуют в регуляции физиологических, молекулярных функций и процессе обмена веществ), эйкозаноиды (окисленные производные жирных кислот).
Большое количество астроцитов, окружающих сосуды, связано с увеличенной потребностью нейронов в питании. Астроциты стимулирующим образом воздействуют на транспорт глюкозы, преобразуют глюкозу в лактат, контролируют доставку лактата к нейронам. Капилляры мозгового вещества иннервируются нейронами холинергической, ГАМК-ергической, серотонинергической и других рецепторных систем.
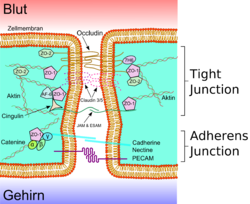
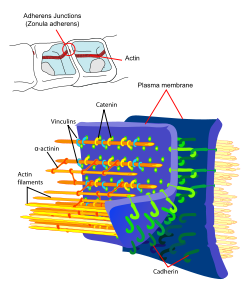
Нейроны в составе ГЭБ определяют функции нейроваскулярной структуры, что, например, проявляется в таком процессе, как стимуляция синтеза белков в эндотелиоцитах. Межклеточные соединения ГЭБ представлены плотными контактами и контактами сцепления. Плотные контакты, представленные непрерывной линией, образуются благодаря тесному взаимодействию отдельных эндотелиоцитов.

Наличие плотных контактов – фенотипическая особенность гематоэнцефалического барьера, который условно разделяет ткани ЦНС и кровеносную систему организма. Плотные контакты образую физическую преграду для чужеродных соединений, ограничивают транспорт молекул через межклеточное пространство, что приводит к увеличению транспорта через клеточную цитоплазму.
Контакты сцепления поддерживают устойчивые связи между эндотелиоцитами. Они участвуют в сдерживании роста сосудов посредством контактного взаимодействия, тормозят процессы реваскуляризации (восстановление, образование нового капиллярного русла). Контакты сцепления образованы трансмембранными белками.
Структура, аналогичная ГЭБ – гемато-тимусный барьер, который представляет собой физиологическое препятствие между кровеносной системой и тимусом (орган иммунной системы), располагается в корковом слое вилочковой железы, предотвращает воздействие антигенов, циркулирующих в крови, на процесс созревания Т-лимфоцитов.
Изучение особенностей проницаемости ГЭБ имеет значение в контексте выбора антибактериальной терапии при нейроинфекциях (менингит, энцефалит). Лечение инфекций ЦНС предполагает необходимость проникновения антибиотиков в мозговое вещество. Антибиотики, проходящие через гематоэнцефалический барьер и проникающие в ткани мозга, обеспечивают терапевтическое действие.
Функции
Гематоэнцефалический барьер – это такое образование в пределах мозга, которое выполняет защитную функцию, что выражается в препятствовании прохождению нейротоксических веществ, негативно влияющих на структуры ЦНС. Другие функции связаны с регуляцией церебрального кровотока и метаболических процессов в нейронах и синаптических контактах.
Одна из основных задач ГЭБ – задержка веществ, поступающих извне или образующихся в организме, способных повредить клетки нервной ткани. Гематоэнцефалический барьер невозможно назвать непреодолимой преградой для нейротоксических веществ, структура защищает нервную ткань относительно. Степень надежности защитной функции зависит от факторов:
- Количество (уровень) содержащихся в крови нейротоксических веществ.
- Общее состояние здоровья человека.
- Длительность нахождения вредных веществ в организме.
- Влияние внешней среды.

Принцип действия ГЭБ основан на совокупном участии в обороне клеточных элементов и межклеточных контактов, которые ограничивают перемещение водорастворимых соединений, замедляют эндоцитоз (процесс захвата клеткой внешнего материала) и трансцитоз (перенос веществ через клетку).
Гематоэнцефалический барьер координирует деятельность мозговых структур, обеспечивает питание нервных клеток и выведение вторичных продуктов жизнедеятельности. В физиологии главная функция ГЭБ определяется, как поддержание гомеостаза (саморегуляция, способность обеспечивать постоянство физиологического состояния) нервной ткани.
ГЭБ препятствует попаданию в мозг эндотоксинов и экзотоксинов, обеспечивает транспорт питательных веществ, необходимых для функциональной активности нейронов, поддержания энергетического баланса нервных клеток и их пластического потенциала. Функция ГЭБ заключается в противостоянии воздействию токсичных соединений, предотвращении их проникновения из капилляров в мозговое вещество.
Патологии
Нарушение деятельности гематоэнцефалического барьера связывают с развитием многих патологий ЦНС, что подтверждает такую его функцию, как защита нервной ткани от повреждений. Нарушение проницаемости ГЭБ участвует в патогенезе заболеваний:
- Эпилепсия.
- Опухолевые процессы.
- Сосудистые патологии.
- Нейродегенеративные процессы.
- Гипоксически-ишемическое повреждение нервной ткани.
- Демиелинизирующие процессы.

Например, раковые клетки проникают в мозг при помощи молекул микроРНК, которые разрушают плотные контакты между эндотелиоцитами, что приводит к увеличению проницаемости ГЭБ. Усиление прохождения чужеродных соединений через гистогематический барьер – это фактор интенсивного развития патологического процесса при черепно-мозговых и родовых травмах. Выделяют механизмы транспорта веществе через клеточную мембрану в пределах ГЭБ:
- Простая диффузия (молекулы и ионы движутся через отверстия в клеточной мембране или через межклеточное пространство без участия переносчиков).
- Облегченная диффузия при взаимодействии с переносчиком.
- Транспорт, поддерживаемый переносчиком (например, эндоцитоз – захват клеткой внешнего материала).
- Эффлюксный транспорт (передвижение молекул и ионов при участии эффлюксных белков-транспортеров).
Основные механизмы нарушения деятельности ГЭБ связаны с физическим повреждением нейроваскулярного комплекса, разъединением плотных контактов, сформированных между эндотелиоцитами, повреждением токсического генеза клеточных мембран астроцитов и эндотелиоцитов.
Разъединение плотных контактов сопровождается отеком и расширением диаметра конечных ответвлений астроцитов. Подобный механизм увеличения проницаемости ГЭБ типичен для нарушения мозгового кровотока, протекающего в острой форме, инсульта, асфиксии (удушья) новорожденных. Последние исследования демонстрируют аналогичное развитие патогенетического процесса при эпилепсии.

Повреждение клеточных мембран происходит вследствие воздействия токсинов разного типа, что приводит к нарушению транспорта через мембранный комплекс. Подобные нарушения деятельности ГЭБ происходят на фоне нейроинфекций, алкогольной энцефалопатии, протекающей в острой форме, и других патологиях, сопровождающихся обширным инфекционно-токсическим шоком и ДВС-синдромом.
Механическое повреждение структур ГЭБ происходит при черепно-мозговых и родовых травмах, опухолевых очагах, интенсивно разрастающихся в тканях мозга. Прорыв целостности ГЭБ всегда сопровождается мозговым отеком, что нередко ассоциируется с угрозой для жизни.
Гематоэнцефалический барьер – нейроваскулярный комплекс, состоящий из клеток разного типа, призванный поддерживать гомеостаз мозга и защищать нервную ткань от нейротоксического воздействия чужеродных веществ.
Схема строения гематоэнцефалического барьера
Гематоэнцефалический барьер (ГЭБ) (от др.-греч. αἷμα, род.п. αἷματο — «кровь» и др.-греч. εγκεφαλος — «головной мозг») — физиологический барьер между кровеносным руслом и центральной нервной системой. Имеется у всех позвоночных. Главной функцией гематоэнцефалического барьера является поддержание гомеостаза мозга.
Гематоэнцефалический барьер защищает мозг от циркулирующих в крови микроорганизмов, токсинов и различных других веществ. Он выполняет функцию высокоселективного фильтра, через который в мозг поступают питательные вещества, а из мозга выводятся продукты его жизнедеятельности.
С другой стороны наличие ГЭБ затрудняет лечение многих заболеваний, так как он не пропускает целый ряд лекарственных препаратов.
Первые исследования показавшие наличие барьера между кровью и мозгом были проведены Паулем Эрлихом в 1885 году. Окончательные доказательства существования ГЭБ были получены в 1967 году при электрономикроскопических исследованиях.
Содержание
- 1 Задачи гематоэнцефалического барьера
- 2 Строение
- 2.1 Эндотелий
- 2.2 Плотные контакты
- 2.3 Базальная мембрана
- 2.4 Перициты
- 2.4.1 Клеточные контакты перицит — эндотелиоцит
- 2.4.2 Сократительная функция
- 2.4.3 Макрофагальная активность
- 2.5 Астроциты
- 2.6 Области мозга без ГЭБ
- 2.7 Характеристика ГЭБ
- 2.8 Развитие
- 2.9 Эволюция
- 3 Гематоликворный барьер
- 4 Транспорт веществ через ГЭБ
- 4.1 Межклеточный транспорт
- 4.2 Свободная диффузия
- 5 Функции
- 6 Механизм действия
- 7 Примечания
Задачи гематоэнцефалического барьера
Масса головного мозга человека составляет приблизительно 2 % от массы его тела. При этом потребность в кислороде центральной нервной системы составляет 20 % от потребностей всего организма. Также в противоположность другим органам мозг обладает наименьшими запасами питательных веществ. Нервные клетки не могут обеспечить свои энергетические потребности анаэробно (путём одного лишь гликолиза). Прекращение поступления крови к мозгу в течение нескольких секунд приводит к потере сознания, а через 10 минут отмечается полная гибель нейронов [1]. Данная особенность головного мозга требует от ГЭБ активно транспортировать кислород и питательные вещества[2].
Нормальное функционирование мозга возможно также в условиях электролитного и биохимического гомеостаза. Колебания pH, концентрации калия крови и других показателей не должны отражаться на ткани головного мозга. Попадение циркулирующих в кровеносном русле нейромедиаторов в нервную ткань может разбалансировать её работу [1]. Также мозг должен быть защищён от попадания в него чужеродных веществ, таких как ксенобиотики и патогенные микроорганизмы. ГЭБ представляет собой в том числе и иммунологический барьер, так как является непроницаемым для различных микроорганизмов, антител и лейкоцитов[3] [4].
Чтобы обеспечить задачи обеспечения, выведения продуктов жизнедеятельности и поддержания гомеостаза вещества мозга, система сосудов центральной нервной системы имеет целый ряд структурно-функциональных отличий от сосудов других органов и тканей[1].
Изменения в функционировании ГЭБ могут вызывать нарушения функционирования центральной нервной системы. Целый ряд неврологических заболеваний напрямую или косвенно связан с его повреждением[2].
Строение
Сравнительная схема строения периферического и церебрального капилляров
нем. Periphere Kapillare — периферический капилляр
нем. Zerebrale Kapillare — церебральный капилляр
нем. Zellkern — клеточное ядро
нем. Lumen des Kapillargefäßes — просвет капиллярного сосуда
англ. Tight Junction — плотный контакт
нем. Intrazellularspalt — межклеточная щель
нем. Endothelzelle — эндотелиальная клетка
нем. Fenestrierung — фенестрация
Строение ГЭБ — от ткани мозга к плотному контакту
Схематическое строение сосудистой стенки артерии, артериолы и капилляра мозга
Существенным элементом структуры ГЭБ являются эндотелиальные клетки. Особенностью эндотелия сосудистой стенки церебральных сосудов является наличие между ними плотных межклеточных контактов. В структуре ГЭБ также большое значение имеют перициты и астроциты[1]. Межклеточные промежутки между эндотелиальными клетками, перицитами и астроцитами нейроглии ГЭБ являются наиболее узкими в сравнении с другими клетками организма. Эти три вида клеток являются структурной основой ГЭБ не только у человека, но и у большинства позвоночных[5] [6].
Эндотелий
Капиллярные сосуды выстланы эндотелиальными клетками. Эндотелий периферических сосудов содержит открытые промежутки (фенестрации) диаметром около 50 нм. и межклеточные щели от 0,1 до 1 мкм. Через эти пространства происходит свободная циркуляция воды и растворённых в ней веществ между кровью и межклеточным пространством. В церебральных сосудах между эндотелиальными клетками отсутствуют как фенестрации, так и межклеточные щели[7]. Таким образом можно говорить о сплошной эндотелиальной выстилке просвета капилляров мозга[8].
Другим отличием эндотелия церебральных капилляров от периферических является низкое количество в них пиноцитозных пузырьков (везикул)[9] [10].
В то же время количество митохондрий в эндотелиальных клетках сосудов мозга в 5-10 раз выше, чем в эндотелии периферических сосудов. Митохондрии являются органеллами синтезирующими молекулы АТФ, являющихся основным источником энергии для клетки. Большое количество митохондрий соответственно является показателем значительных энергетических потребностей эндотелиальных клеток ГЭБ, что связано с процессами активного транспорта и обмена веществ[4].
ГЭБ является также метаболическим или ферментативным (энзиматическим) барьером [11] [12] [13] [14] [15]. На поверхности клеточных мембран эндотелиальных клеток ГЭБ находится целый ряд ферментов в значительно большем количестве чем на других клетках паренхимы. Среди них стоит отметить гамма-глутамилтрансферазы и фосфатазы (в частности глюкоза-6-фосфатазу), катехол-О-метилтрансферазу, моноаминоксидазу и цитохром Р450[16] [17] [18]. В связи с большой концентрацией различных ферментов в эндотелиальных клетках ГЭБ многие вещества при транспортировании через цитоплазму эндотелия метаболизируются[10]. При этом по высоте эндотелиальная клетка ГЭБ составляет от 0,3 до 0,5 мкм. Энтероциты, эпителиальные клетки кишечника, к примеру имеют в высоту 17-30 мкм[19].
Схематическое изображение плотного контакта
Схематическое изображение плотного контакта
Соотношение холестерина к фосфолипидам в эндотелиальных клетках ГЭБ такое же, как и в эндотелиальных клетках периферических сосудов и составляет ≈ 0,7[20]. Пассивный транспорт через клеточные мембраны ГЭБ мало чем отличается от пассивной диффузии в других эндотелиальных клетках[21]. В мембранах эндотелиальных клеток содержится большое количество каналов, которые свободно пропускают моллекулы воды. Они делают возможным свободную диффузию моллекул воды как в направлении мозга, так и кровеносной системы[22].
Отсутствие фенестраций и небольшое число пиноцитарных везикул делают эндотелиальную выстилку капилляров мозга механическим барьером для крупных молекул и инородных веществ. Кроме этого ГЭБ обладает значительным электрическим сопротивлением — около 1500—2000 Ом. К примеру электрическое сопротивление для стенок капилляров мышечной ткани составляет 30 Ом[23].
Плотные контакты
Эндотелиальные клетки плотно прилежат к другу. Между соседними клетками образуются так называемые плотные контакты. Они вносят значительный вклад в обеспечении главной функции ГЭБ — предотвращении проникновения в ткань мозга различных нежелательных веществ из кровеносного русла[24] [25]. Плотные контакты между эндотелиальными клетками блокируют межклеточный (парацеллюлярный) пассивный транспорт[26] [27] [28]. При этом блокируется парацеллюлярный транспорт веществ как из кровеносного русла в ткань мозга, так и в обратном направлении — из мозга в кровь[6].
Большое количество трансмембранных белков, таких как окклюдин, разнообразные клаудины и замыкательные адгезионные молекулы связывают латеральные отделы клеточных стенок между собой, участвуют в формировании плотных контактов и делают возможным межклеточный транспорт и обмен веществ[29]. Основными белками обеспечивающими адгезию эндотелиальных клеток и формирование плотных контактов явдяются клаудин-5 и клаудин-24 [30]. Выключение (блокирование) CLDN5—гена, ответственного за синтез белка клаудина-5, приводил у подопытных мышей к тому, что их ГЭБ становился проницаемым для молекул с молярной массой до 800 г/моль. Такие подопытные генетически изменённые животные умирали через несколько часов после рождения[31].
Базальная мембрана
Базальная мембрана эпителиальной клетки
Эндотелиальные клетки полностью покрывают подлежащий белковый слой, называемый базальной мембраной[8]. Вертикальный размер базальной мембраны колеблется от 40 до 50 нм. Она различима только под электронным микроскопом. Состоит в основном из коллагена IV типа, гепаринсульфат-протеогликанов, ламининов, фибронектина и других белков внеклеточного матрикса. Со стороны мозга базальная мембрана ограничена плазматической мембраной пластинчатых окончаний отростков астроцитов[10] [26].
Перициты
Электронномикроскопическое изображение перицита (справа) и просвета сосуда с тремя эритроцитами (слева)
Перициты, ранее называвшиеся по имени первооткрывателя Шарля Мари Бенджамина Руже (1824—1904) клетками Руже[32], являются важной составной частью ГЭБ[33]. Они обладают несколькими важными для его функционирования свойствами: способностью к сокращению, регулированию функций эндотелия и макрофагальной активностью[34].
Около 20 % поверхности эндотелиальных клеток церебральных капилляров покрыты относительно маленькими, овальными перицитами. Каждая 2—4-я эндотелиальная клетка имеет контакт с клеткой-перицитом[6]. В основном перициты располагаются в местах контакта эндотелиальных клеток[35] [36]. Перициты имеются практически во всех артериолах, венулах и капиллярах организма. Уровень покрытия ими эндотелиального слоя капилляра коррелирует с проницаемостью сосудистой стенки. В органах и тканях с проницаемой сосудистой стенкой они могут мигрировать из кровеносного русла в межклеточное пространство. Так например в капиллярах скелетной мускулатуры соотношение перициты:эндотелиоциты составляет 1:100[37] [38].
Перициты, как и эндотелиоциты располагаются на базальной мембране[8].
Также перициты синтезируют целый ряд вазоактивных веществ[38] и играют важную роль в ангиогенезе[39] [40].
Клеточные контакты перицит — эндотелиоцит
Фокальные клеточные адгезии
Перициты крепко связаны с эндотелиоцитами. Эта связь осуществляется благодаря трём типам контактов: щелевым соединениям, фокальным адгезиям и инвагинациям мембраны одной клетки в полость другой[34]. Щелевые соединения непосредственно связывают цитоплазму двух клеток, являясь проницаемыми для ионов и небольших молекул[41]. С помощью фокальных адгезий осуществляется прочная механическая связь двух типов клеток[42]. нвагинации участков цитоплазмы одной клетки в другую обеспечивают как механическое связывание так и межклеточный обмен веществ[34] [43].
Благодаря тесным контактам клетки опосредованно влияют на митотическую активность, экспрессию генов и соответственно фенотип друг друга[39].
Сократительная функция
Перициты содержат большое количество способного к сокращению белка актина. Благодаря этой своей структурной особенности они в состоянии изменять просвет капилляров и таким образом регулировать местное кровяное давление[44] [45].
Макрофагальная активность
Данное свойство характерно только для церебральных перицитов. В капиллярной сети мозга они выполняют функцию макрофагов. Соответственно в цитоплазме церебральных перицитов располагается большое количество лизосом. В культуре тканей доказана способность перицитов к фагоцитозу[34] [46] [47] и презентации антигенов [48] [49].
Астроцит (окрашен зелёным) в клеточной культуре
Макрофагальные свойства перицитов образуют «вторую линию защиты мозга» от нейротоксических молекул, которые преодолели барьер эндотелиальных клеток[50]. Таким образом они являются важной составной частью иммуной системы мозга. Сбой макрофагальной активности перицитов может стать одним из факторов развития целого ряда аутоиммунных заболеваний. Имеются данные об опосредованной роли перицитов в развитии болезни Альцгеймера[51] [52].
Астроциты
Взаимоотношение астроцитов и эндотелиоцитов
Астроциты — большие нейроглиальные клетки звёздчатой формы. Своими отростками лни выстилают стенки мозговых капилляров со стороны мозговой ткани. В то же время, несмотря на то, что пластинчатыми окончаниями их клеточных отростков выстлано около 99% капиллярных сосудов, астроциты не выполняют прямой барьерной функции[6] [53]. Астроциты тесно взаимодействуют с эндотелиальными клетками. Между ними осуществляется постоянный обмен веществ[54]. Астроглиальные клетки индуцируют возникновение и формирование ГЭБ. При проведении экспериментов по пересадке сосудов мозга в периферические органы и наоборот — периферических сосудов в ткань головного мозга, отмечено формирование ГЭБ в периферических сосудах пересаженных в мозг (образование плотных контактов, перестройка эндотелиальных клеток) и разобщение эндотелиальных клеток и появление фенестраций между ними при пересадке мозговые сосуды[1] [55]. Также in vitro показано влияние астроцитов на фенотип эндотелия. В клеточной культуре содержащей астроциты и эндотелиоциты отмечено более плотное расположение эндотелия по сравнению с его чистой клеточной культурой[56].
Астроциты выделяют целый ряд веществ, которые влияют на проницаемость эндотелия[57]. Эндотелиоциты в свою очередь выделяют ингибирующий лейкемию фактор (LIF), цитокин интерлейкин-6, которые воздействуют на процесс дифференциации астроцитов[57]. Расстояние от пластинчатых окончаний отростков астроцитов до клеток эндотелия и перицитов составляет всего лишь 20 нм[8] [58].
Главными задачами астроглиальных клеток является обеспечение нейронов питательными веществами и поддержание необходимой концентрации электролитов внеклеточного пространства[57] [59]. Астроциты синтезируют большую часть необходимого клеткам мозга холестерина. Холестерин не проникает через ГЭБ. В то же время в ткани мозга находится 25% от общего холестерина организма. Большая его часть входит в состав миелина, который окутывает отростки нейронов аксоны. Нарушения процессов миелинизации нервных волокон вызывают развитие демиелинизирующих заболеваний, в частности рассеянный склероз[60].
Пластинчатые окончания отростков астроцитов неплотно покрывают со стороны мозга базальную мембрану сосудистой стенки с расположенными на ней эндотелиоцитами и перицитами. За счёт этого между эндотелиоцитами и тканью мозга возможна прямая диффузия различных веществ[57].
Заболевания, при которых происходит прямое или опосредованное поражение астроцитов (например, болезнь Альцгеймера, астроцитомы), сопровождаются нарушением функционирования ГЭБ.
Области мозга без ГЭБ
ГЭБ имеется в капиллярах большинства, но не всех областей мозга. В 6 анатомических образованиях мозга ГЭБ отсутствует:
- Самое заднее поле (лат. area postrema) ромбовидной ямки (дна IV желудочка) — располагается между треугольником блуждающего нерва (лат. trigonum nervi vagi) с окрамляющим его самостоятельным канатиком (лат. funiculus separans) и бугорком тонкого ядра[61]
- шишковидное тело (лат. corpus pineale) (синоним — эпифиз)
- Нейрогипофиз
- Прикреплённая пластинка (лат. lamina affixa) — эмбриональный остаток стенки конечного мозга, покрывающий верхнюю поверхность таламуса. Медиально она истончается, образует извитую пластинку — сосудистую ленту (лат. tenia choroidea)[62]
- Субфорникальный орган
- Субкомиссуральный орган
Данная гистологическая особенность имеет своё обоснование. Так например, нейрогипофиз выделяет в кровь гормоны, которые не могут пройти через ГЭБ, а нейроны лат. area postrema улавливают в крови наличие токсических веществ и стимулируют рвотный центр[63]. Защитным барьером соседней с данными образованиями мозговой ткани является скопление таницитов. Они представляют собой клетки эпендимы с плотными контактами[64].
Характеристика ГЭБ
Сеть из более чем 100 миллиардов капилляров суммарной протяжённостью около 600 км пронизывает мозг взрослого человека[21]. В среднем просвет капилляра составляет около 40 нм[65]. Мозг кровоснабжается значительно сильнее многих других тканей и органов организма. Наибольшая плотность сосудов характерна для коры головного мозга — от 300 до 800 капилляров на 1 мм2 ткани[1].
Суммарная поверхность стенок сосудов мозга составляет 12[66] — 20[67] м2. Ежеминутно через сосудистую сеть мозга протекает около 610 мл крови со средней скоростью 1 мм/с. Давление в ней колеблется в пределах 15-35 мм рт. ст.[4] Среднее время прохождения крови через капиллярное русло (англ. mean transit time (MTT)) составляет всего лишь 5 секунд. Для сравнения, в кишечнике, площадь сосудов которого достигает 180 м2 оно равно 40 часам[68] [69], а в печени с 70 м2 — 30 секунд[70] [71] [72].
Развитие
До конца 20-го столетия считалось, что у эмбриона и новорожденных ГЭБ не сформирован в полной степени и соответственно не выполняет своей функции. Причиной этого, до сих пор широко распространённого мнения, являются недостатки ранее проводившихся физиологических опытов. Эксперименты заключались в введении либо связанных с белками красителей либо других маркеров взрослым животным и эмбрионам. Первые опыты такого плана проводились в 1920 году [73]. Маркеры вводимые эмбрионам проникали в ткань мозга и спинномозговую жидкость в то время как у взрослых животных — нет. В ходе данных экспериментов был допущен ряд методических ошибок (использование чрезмерного объёма вводимого вещества, повышение осмотического давления) из-за которых происходило частичное повреждение сосудистой стенки и соответственно маркер попадал в ткань мозга[74] [75] [76]. При правильной постановке экспериментов пассажа маркера через сосудистую сеть отмечено не было[77] [78] [79].
В крови плода в большом количестве содержатся молекулы таких веществ как альбумин, α1-фетопротеин и трансферрин, отсутствуя при этом в межклеточном пространстве ткани мозга[80]. В эмбриональном эндотелии обнаружен транспортёр Р-гликопротеин[81]. Это свидетельствует о наличии ГЭБ в пренатальном периоде. В ходе развития организма происходит дальнейшее совершенствование ГЭБ[80].
Для небольших поляризированных молекул, например инулина и сахарозы, проницаемость ГЭБ эмбриона и новорожденного значительно выше чем у взрослых[82] [83] [84]. Схожий эффект отмечен и для ионов[85]. Транспорт аминокислот и инсулина через ГЭБ, по всей видимости в связи с большой потребностью в них растущего мозга, значительно ускорен[86] [87] [88] [89].
С другой стороны в мозге эмбриона имеется дополнительный, отсутствующий у взрослых, барьер на границе между ликвором и тканью мозга — так называемые ремневые контакты (англ. Strap Junctions) между клетками эпендимы[90].
Эволюция
В ходе эволюции нервной ткани от беспозвоночных к позвоночным с одной стороны отмечено её увеличение и приобретение центральных функций в жизнедеятельности организмов. С другой стороны большая масса мозга требует лучшего обеспечения питательными веществами и выведения ненужных и отработанных продуктов распада. Это привело к развитию густой капиллярной сети в ткани мозга. Следующим этапом эволюции стало появление защитного барьера от циркулирующих в крови токсичных для нейронов веществ — ксенобиотиков и токсинов[5] [91].
У многих беспозвоночных ГЭБ отсутствует. У них эндотелий капилляров нервной ткани не образует сплошной выстилки сосудистой стенки. У высших беспозвоночных — насекомых, ракообразных и головоногих[92] — защитный барьер между нейронами и кровью представлен исключительно глиальной тканью[93]. В этом случае речь идёт о глиальном гематоэнцефалическом барьере[94].
У всех видов позвоночных имеется ГЭБ, и у большинства из них он образован преимущественно клетками эндотелия сосудистой стенки скреплёнными между собой плотными контактами. Только у пластиножаберных (среди них акул и скатов), а также семейства осетровых рыб ГЭБ формируется периваскулярными астроцитами. Из этого следует, что в процессе эволюции происходит увеличение количества эндотелиальных клеток сосудов головного мозга, которые перенимают на себя барьерные функции.
Структурные различия глиального и эндотелиального гематоэнцефалических барьеров достаточно велики. Эндотелиальный барьер имеет целый ряд преимуществ. Одним из них является строгое разграничение функций эндотелиальных клеток и клеток астроглии, которые обеспечивают гомеостаз внеклеточной среды вещества мозга[93].
Гематоликворный барьер
Кроме гематоэнцефалического барьера существует также гематоликворный, который ограничивает центральную нервную систему от кровеносного русла. Он образован эпителиальными клетками с плотными контактами выстилающими сосудистое сплетение желудочков мозга[95] [96]. Гематоликворный барьер также имеет свою роль в поддержании гомеостаза мозга. Через него из крови в омывающую мозг спинномозговую жидкость поступают витамины, нуклеотиды и глюкоза. Общий вклад гематоликворного барьера в процессы обмена между мозгом и кровью невелик. Суммарная площадь гематоликворного барьера сосудистых сплетений желудочков мозга приблизительно в 5000 раз меньше в сравнении с площадью гематоэнцефалического.
Кроме гематоэнцефалического и гематоликворного барьеров в организме человека существуют гематоплацентарный, гематотестикулярный, гематоклубочковый, гематоретинальный, гематотимальный и гематолёгочный барьеры.
Транспорт веществ через ГЭБ
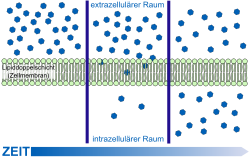
Схема транспорта различных веществ черех гематоэнцефалический барьер
Простая диффузия через клеточную мембрану
Гематоэнцефалический барьер не только задерживает и не пропускает целый ряд веществ из крови в вещество мозга, но и выполняет противоположную функцию — транспортируют необходимые для метаболизма ткани мозга вещества. Гидрофобные вещества и пептиды проникают в мозг либо с помощью специальных транспортных систем, либо каналы клеточной мембраны. Для большинства других веществ возможна пассивная диффузия[11] [15].
Межклеточный транспорт
В капиллярах периферических органов и тканей, транспорт веществ осуществляется в основном через фенестрации сосудистой стенки и межклеточные промежутки. В норме между клетками эндотелия сосудов мозга такие промежутки отсутствуют. В связи с этим питательные вещества проникает в мозг лишь через клеточную стенку[97]. Вода, глицерин и мочевина являются примерами тех небольших поляризированных молекул, которые могут свободно диффундировать через плотные контакты между эндотелиальными клетками ГЭБ[98].
Свободная диффузия
Модель пассивной диффузии через клеточную мембрану
Самой простой формой транспорта через ГЭБ является свободная (или пассивная) диффузия. Она может осуществляться как через клеточные мембраны эндотелиоцитов так и через плотные межклеточные контакты. Для диффузии веществ движущей силой является разница концентраций. Диффузия веществ пропорциональна разнице концентраций в кровяном русле и ткани мозга. Для неё не требуется затрат клеточной энергии[99].
Липофильные структурные элементы клеточной мембраны, а также плотные межклеточные контакты снижают количество веществ, которые могут свободно диффундировать через ГЭБ. Проницаемость ГЭБ напрямую зависит от липофильности каждого конкретного вещества[100].
Проницаемость ГЭБ также зависит от молярной массы вещества. Молекулы с массой более 500 г/моль не могут диффундировать через ГЭБ. В то же время ГЭБ не является механическим барьером, который свободно пропускает молекулы меньшего размера и не пропускает большего. Процесс клеточной диффузии является динамическим, при этом он легче для веществ с молярной массой 200 г/моль, чем для веществ с 450 г/моль[20] [101].
Чем липофильнее и меньше вещество, тем легче оно диффундирует через клеточную мембрану[11].
Немецким биофизиком Германном Тройбле в 1971 году была высказана гипотеза о транспорте небольших молекул через клеточную мембрану. Согласно ней они проникают в клетку через небольшие промежутки между цепями жирных кислот двойного слоя мембраны. Эти промежутки изменчивы, их образование не требует клеточной энергии[102] [103] [104] [105]. Теория Тройбле была спектроскопически доказана в 1974 году[106] [107].
Прогноз и исследования относительно проницаемости ГЭБ для того или иного вещества возможно проводить как in vitro [15] [108] [109] [101] [110] так и in silico [111].
Липофильность и небольшая молекулярная масса не являются гарантией проницаемости ГЭБ для данного вещества. Высокомолекулярные соединения (например, моноклональные антитела, рекомбинантные белки и другие) удерживаются ГЭБ[112].
Функции
- поддержание гомеостаза
- транспортная
- защитная
Механизм действия
Гематоэнцефалический барьер непроницаем для множества соединений, как чужеродных, так и вырабатываемых самим организмом.
Гематоэнцефалический барьер препятствует проникновению в центральную нервную систему переносимых кровью токсических веществ, нейромедиаторов, гормонов, антибиотиков (что затрудняет лечение инфекционных поражений мозга и его оболочек), поддерживает электролитный баланс мозга, обеспечивает избирательный транспорт ряда веществ (глюкозы, аминокислот) из крови в мозг.
Для преодоления гематоэнцефалического барьера молекулы должны быть либо малы (как молекулы кислорода), либо обладать способностью растворяться в липидных компонентах мембран глиальных клеток (как этанол). Кроме того, некоторые вещества могут переноситься через гематоэнцефалический барьер путём активного транспорта.
Примечания
- ↑ 1 2 3 4 5 6 S. Wolf, B. Seehaus, Minol K. und andere Die Blut-Hirn-Schranke: Eine Besonderheit des cerebralen Mikrozirkulationssystems // Naturwissenschaften. — 1996. — № 83. — С. 302-311.
- ↑ 1 2 S. Ohtsuki New Aspects of the Blood–Brain Barrier Transporters; Its Physiological Roles in the Central Nervous System // Biological & Pharmaceutical Bulletin. — 2004. — № 27 (10). — С. 1489–1496.
- ↑ W. Risau, B. Engelhardt, H. Wekerle Immune function of the blood-brain barrier: incomplete presentation of protein (auto-) antigens by rat brain microvascular endothelium in vitro // The Journal of Cell Biology. — 1990. — № 110. — С. 1757–1766.
- ↑ 1 2 3 B. Bauer In vitro Zellkulturmodelle der Blut-Hirn-Schranke zur Untersuchung der Permeation und P-Glykoprotein-Interaktion von Arzneistoffen // Диссертация. Гейдельбергский университет им. Рупрехта-Карла. — 2002.
- ↑ 1 2 M. Bundgaard, N. J. Abbott All vertebrates started out with a glial blood-brain barrier 4-500 million years ago // Glia. — 2008. — № 56. — С. 699–708.
- ↑ 1 2 3 4 W. M. Pardridge Molecular biology of the blood–brain barrier // Mol Biotechnol. — 2005. — № 30 (1). — С. 57–70.
- ↑ J. C. Lee Evolution in the concept of the blood-brain barrier phenomen // Progress in neuropathology. — Verlag Grune und Stratton, 1971. — Т. 1. — С. 84–145. — ISBN 0-88167-188-6
- ↑ 1 2 3 4 M. Pavelka, J. Roth Funktionelle Ultrastruktur. — Verlag Springer. — С. 234–235. — ISBN 3-211-83563-6.
- ↑ J. Cervos-Navarro Elektronenmikroskopische Befunde an den Kapillaren der Hirnrinde // Arch Psychiatr Nervenkr. — 1963. — № 204. — С. 484–504.
- ↑ 1 2 3 B. T. Hawkins, T. P. Davis The blood-brain barrier/neurovascular unit in health and disease // Pharmacol Rev. — 2005. — № 57. — С. 173–185.
- ↑ 1 2 3 S. Nobmann Isolierte Gehirn-Kapillaren als in vitro-Modell der Blut-Hirn Schranke // Диссертация. Гейдельбергский университет им. Рупрехта-Карла. — 2001.
- ↑ R. S. el-Bacha, A. Minn Drug metabolizing enzymes in cerebrovascular endothelial cells afford a metabolic protection to the brain // Cell Mol Biol. — 1999. — № 45. — С. 15–23.
- ↑ Chat M, Bayol-Denizot C, Suleman G, Roux F, Minn A. Drug metabolizing enzyme activities and superoxide formation in primary and immortalized rat brain endothelial cells // Life Sci. — 1998. — № 62. — С. 151–163.
- ↑ Minn A, Ghersi-Egea JF, Perrin R, Leininger B, Siest G. Drug metabolizing enzymes in the brain and cerebral microvessels // Life Sci. — 1991. — № 116. — С. 65–82.
- ↑ 1 2 3 Takakura Y, Audus KL, Borchardt RT. Blood-brain barrier: transport studies in isolated brain capillaries and in cultured brain endothelial cells // Adv Pharmacol. — 1991. — № 22. — С. 137–165.
- ↑ Méresse S, Dehouck MP, Delorme P, Bensaïd M, Tauber JP, Delbart C, Fruchart JC, Cecchelli R. Bovine brain endothelial cells express tight junctions and monoamine oxidase activity in long-term culture // J Neurochem. — 1989. — № 53. — С. 1363–1371.
- ↑ Perrin R, Minn A, Ghersi-Egea JF, Grassiot MC, Siest G. Distribution of cytochrome P450 activities towards alkoxyresorufin derivatives in rat brain regions, subcellular fractions and isolated cerebral microvessels // Biochem Pharmacol. — 1990. — № 40. — С. 2145–2151.
- ↑ Bendayan R, Lee G, Bendayan M. Functional expression and localization of P-glycoprotein at the blood brain barrier // Res Tech. — 2002. — № 57. — С. 365–380.
- ↑ Su Y, Sinko PJ. Drug delivery across the blood-brain barrier: why is it difficult? how to measure and improve it? // Expert Opin Drug Deliv. — 2006. — № 3. — С. 419–435.
- ↑ 1 2 Fischer H, Gottschlich R, Seelig A. Blood-brain barrier permeation: molecular parameters governing passive diffusion // J Membr Biol. — 1998. — № 165. — С. 201–211.
- ↑ 1 2 U. Fagerholm The highly permeable blood-brain barrier: an evaluation of current opinions about brain uptake capacity // J Membr Biol. — 2007. — № 12. — С. 1076–1082.
- ↑ Nico B, Frigeri A, Nicchia GP, Quondamatteo F, Herken R, Errede M, Ribatti D, Svelto M, Roncali L. Role of aquaporin-4 water channel in the development and integrity of the blood-brain barrier // J Cell Sci. — 2001. — № 114. — С. 1297–1307.
- ↑ Butt AM, Jones HC, Abbott NJ. Electrical resistance across the blood-brain barrier in anaesthetized rats: a developmental study // J Physiol. — 1990. — № 429. — С. 47-62.
- ↑ P. Claude, D. A. Goodenough Fracture faces of zonulae occludentes from «tight» and «leaky» epithelia // J Cell Biol. — 1973. — № 58. — С. 390-400.
- ↑ Wolburg H, Neuhaus J, Kniesel U, Krauss B, Schmid EM, Ocalan M, Farrell C, Risau W. Modulation of tight junction structure in blood-brain barrier endothelial cells. Effects of tissue culture, second messengers and cocultured astrocytes // J Cell Sci. — 1994. — № 107. — С. 1347–1357.
- ↑ 1 2 H. B. Newton Advances in strategies to improve drug delivery to brain tumors // Expert Rev Neurother. — 2006. — № 6. — С. 1495–1509.
- ↑ J. L. Madara Tight junction dynamics: is paracellular transport regulated? // Cell. — 1988. — № 53. — С. 497–498.
- ↑ H. C. Bauer et al. Proteins of the tight junctions in the blood-brain barrier // Blood-spinal Cord and Brain Barriers in Health and Disease. — Verlag Elsevier, 2004. — С. 1–10.
- ↑ Cecchelli R, Berezowski V, Lundquist S, Culot M, Renftel M, Dehouck MP, Fenart L. Modelling of the blood-brain barrier in drug discovery and development // Nat Rev Drug Discov. — 2007. — № 6. — С. 650–661.
- ↑ Matter K, Balda MS. Holey barrier: claudins and the regulation of brain endothelial permeability // J Cell Biol.. — 2003. — № 161. — С. 459–460.
- ↑ Nitta T, Hata M, Gotoh S, Seo Y, Sasaki H, Hashimoto N, Furuse M, Tsukita S. Size-selective loosening of the blood-brain barrier in claudin-5-deficient mice // J Cell Biol. — 2003. — № 161. — С. 653–660.
- ↑ P. Dore-Duffy Pericytes: pluripotent cells of the blood brain barrier // Curr Pharm Des. — 2008. — № 14. — С. 1581-1593.
- ↑ Balabanov R, Dore-Duffy P. Role of the CNS microvascular pericyte in the blood-brain barrier // J Neurosci Res.. — 1998. — № 53. — С. 637-644.
- ↑ 1 2 3 4 Rucker HK, Wynder HJ, Thomas WE. Cellular mechanisms of CNS pericytes // Brain Res Bull. — 2000. — № 51. — С. 363-369.
- ↑ P. A. D’Amore Culture and Study of Pericytes // Cell Culture Techniques in Heart and Vessel Research. — Verlag Springer, 1990. — С. 299. — ISBN 3-540-51934-3.
- ↑ N. J. Abbott Neurobiology. Glia and the blood-brain barrier // Nature. — 1987. — № 325. — С. 195.
- ↑ Lai CH, Kuo KH. The critical component to establish in vitro BBB model: Pericyte // Brain Res Brain Res Rev. — 2005. — № 50. — С. 258-265.
- ↑ 1 2 Shepro D, Morel NM. Pericyte physiology // FASEB. — 1993. — № 7. — С. 1031–1038.
- ↑ 1 2 Sims DE. Diversity within pericytes // Clin Exp Pharmacol Physiol. — 2000. — № 27. — С. 842–846.
- ↑ Engelhardt B. Development of the blood-brain barrier // Cell Tissue Res. — 2003. — № 314. — С. 119–129.
- ↑ Fujimoto K. Pericyte-endothelial gap junctions in developing rat cerebral capillaries: a fine structural study // Anat Rec. — 1995. — № 242. — С. 562-565.
- ↑ Díaz-Flores L, Gutiérrez R, Varela H, Rancel N, Valladares F. Microvascular pericytes: A review of their morphological and functional characteristics // Histol Histopath. — 1991. — № 6. — С. 269–286.
- ↑ D. E. Sims Recent advances in pericyte biology—implications for health and disease // Can J Cardiol. — 1991. — № 7. — С. 431–443.
- ↑ Herman IM, D’Amore PA. Microvascular pericytes contain muscle and nonmuscle actins // J Cell Biol. — 1985. — № 101. — С. 43–52.
- ↑ Hirschi KK, D’Amore PA. Pericytes in the microvasculature // Cardiovasc Res. — 1996. — № 32. — С. 687-698.
- ↑ Mato M, Ookawara S, Sugamata M, Aikawa E. Evidence for the possible function of the fluorescent granular perithelial cells in brain as scavengers of high-molecular-weight waste products // Experientia. — 1984. — № 40. — С. 399-402.
- ↑ Balabanov R, Washington R, Wagnerova J, Dore-Duffy P. CNS microvascular pericytes express macrophage-like function, cell surface integrin alphaM, and macrophage marker ED-2 // Microvasc Res. — 1996. — № 52. — С. 127-142.
- ↑ Hickey WF, Kimura H. Perivascular microglial cells of the CNS are bone marrow-derived and present antigen in vivo // Science. — 1988. — № 239. — С. 290-292.
- ↑ Fabry Z, Sandor M, Gajewski TF, Herlein JA, Waldschmidt MM, Lynch RG, Hart MN. Differential activation of Th1 and Th2 CD4+ cells by murine brain microvessel endothelial cells and smooth muscle/pericytes // J Immunol. — 1993. — № 151. — С. 38-47.
- ↑ Krause D, Kunz J, Dermietzel R. Cerebral pericytes — a second line of defense in controlling blood-brain barrier peptide metabolism // Adv Exp Med Biol. — 1993. — № 331. — С. 149-152.
- ↑ Thomas WE. Brain macrophages: on the role of pericytes and perivascular cells // Brain Res Brain Res Rev. — 1999. — № 31. — С. 42-57.
- ↑ Iadecola C. Neurovascular regulation in the normal brain and in Alzheimer’s disease // Nat Rev Neurosci. — 2004. — № 5. — С. 347-360.
- ↑ Johanson CE. Permeability and vascularity of the developing brain: cerebellum vs cerebral cortex // Brain Res. — 2004. — № 190. — С. 3–16.
- ↑ Neuhaus J, Risau W, Wolburg H. Induction of blood-brain barrier characteristics in bovine brain endothelial cells by rat astroglial cells in transfilter coculture // Ann N Y Acad Sci. — 1991. — № 633. — С. 578–580.
- ↑ Stewart PA, Wiley MJ. Developing nervous tissue induces formation of blood-brain barrier characteristics in invading endothelial cells: a study using quail–chick transplantation chimeras // Dev Biol.. — 1981. — № 84. — С. 183–192.
- ↑ Raub TJ, Kuentzel SL, Sawada GA. Permeability of bovine brain microvessel endothelial cells in vitro: barrier tightening by a factor released from astroglioma cells // Exp Cell Res. — 1992. — № 199. — С. 330–340.
- ↑ 1 2 3 4 Abbott NJ. Astrocyte-endothelial interactions and blood-brain barrier permeability // J Anat.. — 2002. — № 200. — С. 629–638.
- ↑ Paulson OB, Newman EA. Does the release of potassium from astrocyte endfeet regulate cerebral blood flow? // Science. — 1987. — № 237. — С. 896-898.
- ↑ Abbott NJ, Rönnbäck L, Hansson E. Astrocyte-endothelial interactions at the blood-brain barrier // Nat Rev Neurosci. — 2006. — № 7. — С. 41–53.
- ↑ Björkhem I, Meaney S. Brain cholesterol: long secret life behind a barrier. // Arterioscler Thromb Vasc Biol. — 2004. — № 24. — С. 806-815.
- ↑ Синельников Р.Д., Синельников Я.Р. Атлас анатомии человека в 4 томах. Т.4.. — М.:: Медицина, 1996. — С. 82. — 320 с. — ISBN 5-225-02723-7
- ↑ Синельников Р.Д., Синельников Я.Р. Атлас анатомии человека в 4 томах. Т.4.. — М.:: Медицина, 1996. — С. 56. — 320 с. — ISBN 5-225-02723-7
- ↑ Duvernoy HM, Risold PY. The circumventricular organs: an atlas of comparative anatomy and vascularization // Brain Res Rev. — 2007. — № 56. — С. 119-147.
- ↑ C. Lohmann Die Blut-Hirn-Schranke in vitro: Regulation der Permeabilität durch Matrixmetalloproteasen // Диссертация. Вестфальский университет имени Вильгельма. — 2003.
- ↑ W. M. Pardridge Peptide Drug Delivery to the Brain. — Raven Press, 1991. — С. 123. — ISBN 0-88167-793-0
- ↑ Chiou WL, Barve A. Linear correlation of the fraction of oral dose absorbed of 64 drugs between humans and rats // Pharm Res. — 1998. — № 15. — С. 1792-1795.
- ↑ Goodwin JT, Clark DE. In silico predictions of blood-brain barrier penetration: considerations to «keep in mind» // J Pharmacol Exp Ther. — 2005. — № 315. — С. 477-483.
- ↑ Lindstedt L, Schaeffer PJ. Use of allometry in predicting anatomical and physiological parameters of mammals // Lab Anim. — 2002. — № 36. — С. 1-19.
- ↑ Lindstedt L, Schaeffer PJ A proposed blood circulation model for Reference Man // Health Phys. — 1995. — № 69. — С. 187-201.
- ↑ Willmann S, Schmitt W, Keldenich J, Lippert J, Dressman JB. A physiological model for the estimation of the fraction dose absorbed in humans // J Med Chem. — 2004. — № 47. — С. 4022-4031.
- ↑ Fagerholm U, Johansson M, Lennernäs H Comparison between permeability coefficients in rat and human jejunum // J Med Chem. — 1996. — № 13. — С. 1336-1342.
- ↑ Leggett RW, Williams LR. Suggested reference values for regional blood volumes in humans // Health Phys. — 1991. — № 60. — С. 139-154.
- ↑ G. B. Wislocki Experimental studies on fetal absorption. I. The vitally stained fetus // Contrib Embryol Carnegie Inst. — 1920. — № 5. — С. 45-52.
- ↑ Wakai S, Hirokawa N. Development of the blood-brain barrier to horseradish peroxidase in the chick embryo // Cell Tissue Res. — 1978. — № 195. — С. 195-203.
- ↑ Risau W, Hallmann R, Albrecht U. Differentiation-dependent expression of proteins in brain endothelium during development of the blood-brain barrier // Dev Biol.. — 1986. — № 117. — С. 537-545.
- ↑ Reynolds ML, Evans CA, Reynolds EO, Saunders NR, Durbin GM, Wigglesworth JS. Intracranial haemorrhage in the preterm sheep fetus // Early Hum Dev. — 1979. — № 3. — С. 163-186.
- ↑ L. Stern, R. Peyrot Le fonctionnement de la barrière hémato-éncephalique aux divers stades de développement chez les diverses espèces animales // Compte Rendu des Societe de Biologie (Paris). — 1927. — № 96. — С. 1124–1126.
- ↑ L. Stern et al Le fonctionnement de la barrière hémato-éncephalique aux divers stades de développement chez les diverses espèces animales // Compte Rendu Soc Biol. — 1929. — № 100. — С. 231–233.
- ↑ Saunders NR, Habgood MD, Dziegielewska KM. Barrier mechanisms in the brain, II. Immature brain // Clin Exp Pharmacol Physiol. — 1999. — № 26. — С. 85–91.
- ↑ 1 2 N. R. Saunders Development of the blood–brain barrier to macromolecules // The Fluids and Barriers of the Eye and Brain / M. B. Segal. — Verlag MacMillan. — Raven Press, 1991. — С. 128-155. — ISBN 0-8493-7707-2
- ↑ Schumacher U, Mollgård K. The multidrug-resistance P-glycoprotein (Pgp, MDR1) is an early marker of blood-brain barrier development in the microvessels of the developing human brain // Histochem Cell Biol. — 1997. — № 108. — С. 179–182.
- ↑ Dziegielewska KM, Evans CA, Malinowska DH, Møllgård K, Reynolds JM, Reynolds ML, Saunders NR. Studies of the development of brain barrier systems to lipid insoluble molecules in fetal sheep // J Physiol. — 1979. — № 292. — С. 207–231.
- ↑ Ferguson RK, Woodbury DM. Penetration of 14C-inulin and 14C-sucrose into brain, cerebrospinal fluid and skeletal muscle of developing rats // Exp Brain Res. — 1969. — № 7. — С. 181–194.
- ↑ Habgood MD, Knott GW, Dziegielewska KM, Saunders NR. The nature of the decrease in blood-cerebrospinal fluid barrier exchange during postnatal brain development in the rat // J Physiol. — 1993. — № 468. — С. 73–83.
- ↑ C. E. Johanson Ontogeny of the blood–brain barrier // Implications of the Blood–Brain Barrier and Its Manipulation / E. A. Neuwelt. — Plenum Press, 1989. — С. 157-198.
- ↑ Braun LD, Cornford EM, Oldendorf WH. Newborn rabbit blood-brain barrier is selectively permeable and differs substantially from the adult // J Neurochem. — 1980. — № 34. — С. 147–152.
- ↑ Cornford EM, Braun LD, Oldendorf WH. Developmental modulations of blood–brain barrier permeability as an indicator of changing nutritional requirements in the brain // Pediatr Res. — 1982. — № 16. — С. 324–328.
- ↑ Brenton DP, Gardiner RM. Transport of L-phenylalanine and related amino acids at the ovine blood-brain barrier // J Physiol. — 1988. — № 402. — С. 497–514.
- ↑ Frank HJ, Jankovic-Vokes T, Pardridge WM, Morris WL. Enhanced insulin binding to blood–brain barrier in vivo and to brain microvessels in vitro in newborn rabbits // Diabetes. — 1985. — № 34. — С. 728–733.
- ↑ Saunders NR, Knott GW, Dziegielewska KM. Barriers in the immature brain // Cell Mol Neurobiol. — 2000. — № 20. — С. 29–40.
- ↑ Abbott NJ, Bundgaard M Electron-dense tracer evidence for a blood-brain barrier in the cuttlefish Sepia officinalis // J Neurocytol. — 1992. — № 21. — С. 276–294.
- ↑ Abbott NJ, Pichon Y The glial blood-brain barrier of crustacea and cephalopods: a review // J Physiol (Paris). — 1982. — № 21. — С. 304–313.
- ↑ 1 2 Abbott NJ. Dynamics of CNS barriers: evolution, differentiation, and modulation // Cell Mol Neurobiol. — 2005. — № 25. — С. 5–23.
- ↑ N. J. Abbott Comparative physiology of the blood-brain barrier // Physiology and pharmacology of the bloodbrain barrier / M. W. B. Bradbury. — Springer-Verlag, 1992. — С. 371-396. — ISBN 0-387-54492-5
- ↑ N. Hettenbach Einfluss chronischer elektromagnetischer Befeldung mit Mobilfunkstrahlen (GSM und UMTS) auf die Integrität der Blut-Hirn-Schranke von Ratten // Диссертация. Мюнхенский университет Людвига-Максимилиана. — 2008.
- ↑ S. I. Rapoport Blood-brain Barrier in Physiology and Medicine. — Raven Press, 1976. — ISBN 0-89004-079-6
- ↑ M. Fromm Physiologie des Menschen // Transport in Membranen und Epithelien / R. F. Schmidt, F. Lang. — Verlag Springer. — С. 41-54. — ISBN 978-3-540-32908-4
- ↑ I. Sauer Apolipoprotein E abgeleitete Peptide als Vektoren zur Ьberwindung der Blut-Hirn-Schranke // Диссертация. Свободный университет Берлина. — 2004.
- ↑ Egleton RD, Davis TP Development of neuropeptide drugs that cross the blood-brain barrier // NeuroRx. — 2005. — № 2. — С. 44-53.
- ↑ Oldendorf WH Lipid solubility and drug penetration of the blood brain barrier // Proc Soc Exp Biol Med. — 1974. — № 147. — С. 813-815.
- ↑ 1 2 R. Kaliszan, M. Markuszewski Brain/blood distribution described by a combination of partition coefficient and molecular mass // International Journal of Pharmaceutics. — 1996. — № 145. — С. 9-16.
- ↑ Träuble H Carriers and specificity in membranes. 3. Carrier-facilitated transport. Kinks as carriers in membranes // Neurosci Res Program Bull. — 1971. — № 9. — С. 361-372.
- ↑ Träuble H Phase transitions in lipids. Possible switch processes in biological membranes // Naturwissenschaften. — 1971. — № 58. — С. 277-284.
- ↑ O. Vostowsky Chemie der Naturstoffe — Lipoproteine und Membranen // Эрлангенский университет. — 2005. — № 58. — С. 42.
- ↑ W. Hoppe, R. D. Bauer Biophysik. — Verlag Birkhäuser, 1982. — С. 447-448. — ISBN 0-387-11335-5
- ↑ Seelig A, Seelig J. The dynamic structure of fatty acyl chains in a phospholipid bilayer measured by deuterium magnetic resonance // Biochemistry. — 1974. — № 13. — С. 4839-4845.
- ↑ A. Elbert Die Permeation kleiner polarer Moleküle durch Phospholipidmodellmembranen // Диссертация. Университет Кайзерслаутерна. — 1999.
- ↑ Seelig A, Gottschlich R, Devant RM A method to determine the ability of drugs to diffuse through the blood-brain barrier // Proc Natl Acad Sci U S A. — 1994. — № 91. — С. 68-72.
- ↑ Dhopeshwarkar GA, Mead JF Uptake and transport of fatty acids into the brain and the role of the blood-brain barrier system // Adv Lipid Res. — 1973. — № 11. — С. 109-142.
- ↑ Gerebtzoff G, Seelig A In silico prediction of blood-brain barrier permeation using the calculated molecular cross-sectional area as main parameter // J Chem Inf Model. — 2006. — № 46. — С. 2638-2650.
- ↑ Seelig A, Gottschlich R, Devant RM A method to determine the ability of drugs to diffuse through the blood-brain barrier // Proc Natl Acad Sci USA. — 1994. — № 91. — С. 68-72.
- ↑ Pardridge WM The blood-brain barrier: bottleneck in brain drug development // NeuroRx. — 2005. — № 2. — С. 3-14.
Биологические барьеры или гистиоцитарные барьеры (гематоэнцефалический, гематогепатический, гематолабиринтный, гематолиенальный, гематоофтальмический, гематопульмональный, гематоренальный)
Биологические барьеры — совокупность биологических мембран, которые отделяют ткани друг от друга и регулируют проникновение (перенос) биологически активных веществ и лекарственных веществ, их распределение в организме.
Мембраны, образующие биологические барьеры в организме человека, представлены 4 типами. Каждый тип мембран регулирует проникновение субстанций в зависимости от их физических и химических свойств.
Общее название таких биологических барьеров — гистогематические (гист-, гистио-, гисто-; греч. Histion — уменьшительное от histos — ткань + haіma, haіmatos — кровь; синонимы: гистиоцитарный барьер, внутренний барьер,). Они регулируют обменные процессы и обеспечивают постоянство состава, физических и химических свойств тканевой жидкости, а также задерживают переход к ней из крови чужеродных соединений и промежуточных продуктов обмена, создавая адекватное среду для выполнения специфических функций клеточных элементов. Гистогематический биологический барьер — липидопроницаемая мембрана, которая разделяет сравнительно небольшой внутрисосудистый сектор (плазма крови — приблизительно у человека 3,5 литров за исключением форменных элементов крови) от межклеточного (интерстициального) сектора жидкости (в среднем приблизительно у человека 10,5 л), из которого в клетки поступает все необходимое. Различают гематоэнцефалический, гематогепатический, гематолабиринтний, гематолиенальный, гематоофтальмический, гематопульмональний, гематоренальний, гематотестикулярный, печеночный, плацентарный, гематолимфатичный, гематосиновиальний и другие биологические барьеры.
Основными структурными элементами гистогематического барьера является стенки кровеносных капилляров, имеющие особенности строения их эндотелиальных клеток, структурными особенностями основного вещества (гликозаминогликанов) и базальной мембраны сосудов; в мозге — периваскулярные ножки астроглии, которые пролегают до капилляров. Гистогематические биологические барьеры — саморегулирующиеся системы, предназначенные для нормального течения метаболических процессов в органах и тканях. Эти системы подлежат гуморальным и нервным влияниям.
Гематоэнцефалический биологический барьер
Гематоэнцефалический биологический барьер (от греческого — Haіma — кровь и enkephalos — головной мозг; синоним: мозговой барьер) — гистогематические барьеры между кровью и цереброспинальной жидкостью. Он образован структурой плотных контактов клеток эндотелия и стенки капилляров, базальной мембраной, которая окружает капилляры, и нейроглийными клетками, которые плотно прилегают к капиллярам. Обладает двойной функции — регуляторная и защитная. Функции барьера зависят от проницаемости менингеальных оболочек, сосудистых сплетений мозга, мезодермальных структур и ультраструктурных элементов в виде мембранных механизмов. Переход субстанций из крови в мозг происходит двумя путями: непосредственно в мозг и с цереброспинальной жидкостью. Скорость прохождения лекарственного вещества через этот биологический барьер зависит от ее растворимости в липидах. Липофильные вещества (диэтиловый эфир, фторотан) легко проникают в мозг, плохорастворимые вещества (тубокурарин, дитилин, метацин и др.) почти не проникают в ткань мозга. Проникновение в мозг чужеродных веществ связано с нарушением защитной функции гематоэнцефалического биологического барьера, что приводит в некоторых случаях к развитию патологических процессов.
Гематогепатический биологический барьер
Гематогепатический биологический барьер (от греческого слова — Haіma — кровь + hepar — печень) определяет относительное постоянство свойств и состава внутренней среды печени и имеет две функции — защитную и регуляторную. Первая функция регулирует проникновение в печень физиологически активных веществ; вторая — защищает от проникновения в печень чужеродных веществ.
Гематолабиринтный биологический барьер
Гематолабиринтный биологический барьер — специализированное барьерное образования, селективная проницаемость которого является существенным фактором нормальной функции звукового и вестибулярного анализаторов.
Определяет проникновения в лабиринт как физиологически активных биогенных, так и других лекарственных веществ.
Гематолиенальный биологический барьер
Гематолиенальный биологический барьер (от греческого слова — Haіma — кровь + lien — селезенка) находится между кровью и тканевой жидкостью селезенки; имеет регуляторные и защитные функции.
Гематоофтальмический биологический барьер
Гематоофтальмический биологический барьер (от греческого слова Haіma — кровь + ophthalmos — глаз) является физиологическим механизмом, который выполняет барьерную функцию относительно прозрачных сред глаза. Регулирует относительное постоянство состава внутриглазной жидкости, влияет на метаболизм роговицы глаза, хрусталика и других тканей глаза. В генезе внутриглазной жидкости важнейшая роль принадлежит эпителию цилиарного тела и эпителию капилляров. Они являются главными анатомическими барьерами, через которые осуществляется обмен между внутриглазной жидкостью и кровью.
Гематопульмональный биологический барьер
Гематопульмональный биологический барьер (от греческого слова Haіma — кровь и латинского — Pulmo — легкое) регулирует, защищает относительное постоянство состава и свойств внутренней среды легких, гомеостаз легочной ткани. Чуждые организму субстанции накапливаются в легких чрезвычайно медленно. Наряду с этим антибиотики при электрофоретической ингаляции в значительных количествах накапливаются в органах дыхания. Но это касается специфических антибиотиков, используемых при терапии легочных болезней.
Гематоренальный биологический барьер
Гематоренальный биологический барьер (от греческого слова — Haіma — кровь и латинского слова Ren — почка) находится между кровью и сосудистой системой почки имеет защитную и регуляторную функции, участвует в регуляции обмена веществ, энергии и электролитов.
Гематотестикулярный биологический барьер
Гематотестикулярный биологический барьер (от греческого слова — Haіma — кровь и латинского — Testis — яичко) — это биологическая мембрана, отделяющая кровь от яичка.
Печеночный биологический барьер
Печеночный биологический барьер — общее название биохимических и физиологических процессов, происходящих в печени, направленных на детоксикацию ядовитых веществ, которые образуются в результате обмена или поступают извне.
Плацентарный биологический барьер
Плацентарный биологический барьер — биологическая мембрана, отделяющая кровь матери от крови эмбриона и плода. Вещества и лекарственные препараты с молекулярной массой меньше 500 D быстро проходят через плацентарный барьер; для веществ с молекулярной массой более 1000 D плацента практически непроницаема. Также на проницаемость лекарственных препаратов через плацентарный барьер влияют растворимость их в липидах, способность связываться с белками плазмы крови, степень ионизации, активность ферментов плаценты, способных биотрансформуваты эти лекарственные препараты (до 32-35 недель беременности проницаемость плаценты повышается). Зная свойства проницаемости лекарственных препаратов, можно способствовать их активности или предотвращать развитие их токсического воздействия на плод.
^Наверх
Полезно знать
- Аминофенoлы (химические свойства)
- Бацитрацин (Bacitracinum) – антибиотик широкого спектра действия, инструкция по применению
- Галотерапия (методика, показания, противопоказания)