Джардинс®
Таб., покр. пленочной оболочкой, 10 мг: 10 или 30 шт.
рег. №: ЛП-002735
от 28.11.14
Дата перерегистрации: 12.07.21
Таб., покр. пленочной оболочкой, 25 мг: 10 или 30 шт.
рег. №: ЛП-002735
от 28.11.14
Дата перерегистрации: 12.07.21
Инвокана®
Таб., покр. пленочной оболочкой, 100 мг: 10, 30, 90 или 100 шт.
рег. №: ЛП-002977
от 28.04.15
Дата перерегистрации: 29.04.20
Таб., покр. пленочной оболочкой, 300 мг: 10, 30, 90 или 100 шт.
рег. №: ЛП-002977
от 28.04.15
Дата перерегистрации: 29.04.20
Стиглатра
Таб., покрытые пленочной оболочкой, 5 мг: 28 или 30 шт.
рег. №: ЛП-005959
от 02.12.19
Таб., покрытые пленочной оболочкой, 15 мг: 28 или 30 шт.
рег. №: ЛП-005959
от 02.12.19
Суглат
Таб., покрытые пленочной оболочкой, 50 мг: 10, 30, 60 или 90 шт.
рег. №: ЛП-005535
от 22.05.19
Агарта®
Таб. 50 мг: 28 шт.
рег. №: ЛП-(000266)-(РГ-RU )
от 04.06.21
Амарил®
Таб. 1 мг: 30, 60, 90 или 120 шт.
рег. №: П N015530/01
от 23.03.09
Дата перерегистрации: 13.12.16
Таб. 2 мг: 30, 60, 90 или 120 шт.
рег. №: П N015530/01
от 23.03.09
Дата перерегистрации: 13.12.16
Таб. 3 мг: 30, 60, 90 или 120 шт.
рег. №: П N015530/01
от 23.03.09
Дата перерегистрации: 13.12.16
Таб. 4 мг: 30, 60, 90 или 120 шт.
рег. №: П N015530/01
от 23.03.09
Дата перерегистрации: 13.12.16
Произведено:
SANOFI
(Италия)
Амарил® М
Таб., покр. пленочной оболочкой, 2 мг+500 мг: 30 шт.
рег. №: ЛП-(000166)-(РГ-RU )
от 22.03.21
Предыдущий рег. №: ЛП-000130
Произведено:
HANDOK
(Республика Корея)
Асиглия®
Таб., покр. пленочной оболочкой 25 мг
рег. №: ЛП-(000655)-(РГ-RU )
от 29.03.22
Таб., покр. пленочной оболочкой 50 мг
рег. №: ЛП-(000655)-(РГ-RU )
от 29.03.22
Таб., покр. пленочной оболочкой 100 мг
рег. №: ЛП-(000655)-(РГ-RU )
от 29.03.22
Асиглия® Мет
Таб., покр. пленочной оболочкой 850 мг+50 мг
рег. №: ЛП-(000695)-(РГ-RU )
от 14.04.22
Таб., покр. пленочной оболочкой 1000 мг+50 мг
рег. №: ЛП-(000695)-(РГ-RU )
от 14.04.22
Астрозон
Таб. 30 мг: 30 или 60 шт.
рег. №: ЛСР-010488/08
от 24.12.08
Баета®
Р-р д/п/к введения 250 мкг/1 мл: картриджи в шприц-ручках 1.2 мл или 2.4 мл
рег. №: ЛС-002221
от 09.06.11
Дата перерегистрации: 06.12.19
Выпускающий контроль качества:
ASTRAZENECA
(Швеция)
Велметия®
Таб., покр. пленочной обол., 850 мг+50 мг: 56 шт.
рег. №: ЛП-004547
от 20.11.17
Таб., покр. пленочной обол., 1000 мг+50 мг: 56 шт.
рег. №: ЛП-004547
от 20.11.17
Виктоза®
Р-р д/п/к введения 6 мг/1 мл: картридж в шприц-ручке 3 мл 1, 2 или 3 шт.
рег. №: ЛСР-004405/10
от 18.05.10
Дата перерегистрации: 01.06.17
Вилдаглиптин
Таб. 50 мг: 10, 14, 20, 28, 40, 56, 60, 84, 120 или 168 шт.
рег. №: ЛП-007839
от 01.02.22
Произведено:
ОЗОН
(Россия)
Вилдаглиптин Канон
Таб. 50 мг
рег. №: ЛП-008157
от 12.05.22
Вилдаглиптин Медисорб
Таб. 50 мг: 7, 10, 14, 20, 21, 28, 30, 35, 40, 42, 49, 50, 56, 60, 63, 70, 80, 84, 90, 98, 100, 112, 120, 126 или 140 шт.
рег. №: ЛП-005958
от 02.12.19
Вилдаглиптин-СЗ
Таб. 50 мг
рег. №: ЛП-(000907)-(РГ-RU )
от 20.06.22
Випдомет®

Таб., покр. пленочной оболочкой, 12.5 мг+1000 мг: 14, 28 или 56 шт.
рег. №: ЛП-004576
от 11.12.17
Дата перерегистрации: 18.03.22
Таб., покр. пленочной оболочкой, 12.5 мг+500 мг: 14, 28 или 56 шт.
рег. №: ЛП-004576
от 11.12.17
Дата перерегистрации: 18.03.22
контакты:
ШТАДА
(Россия)
Випдомет® 850
Таб., покр. пленочной оболочкой, 12.5 мг+850 мг: 14, 28 или 56 шт.
рег. №: ЛП-005825
от 27.09.19
Произведено:
TAKEDA
(Германия)
контакты:
ШТАДА
(Россия)
Випидия®
Таб., покр. пленочной оболочкой, 12.5 мг: 28 шт.
рег. №: ЛП-002644
от 08.10.14
Дата перерегистрации: 17.06.22
Таб., покр. пленочной оболочкой, 25 мг: 28 шт.
рег. №: ЛП-002644
от 08.10.14
Дата перерегистрации: 17.06.22
контакты:
ШТАДА
(Россия)
Галвус Мет®
Таб., покр. пленочной оболочкой, 50 мг+1000 мг: 6, 10, 18, 30, 36, 50, 60, 72, 108, 120, 180, 216 или 360 шт.
рег. №: ЛСР-001749/09
от 10.03.09
Дата перерегистрации: 20.09.18
Галвус Мет®
Таб., покр. пленочной оболочкой, 50 мг+1000 мг: 6, 10, 18, 30, 36, 50, 60, 72, 108, 120, 180, 216 или 360 шт.
рег. №: ЛСР-001749/09
от 10.03.09
Дата перерегистрации: 20.09.18
Галвус Мет®
Таб., покр. пленочной оболочкой, 50 мг+500 мг: 6, 10, 18, 30, 36, 50, 60, 72, 108, 120, 180, 216 или 360 шт.
рег. №: ЛСР-001749/09
от 10.03.09
Дата перерегистрации: 20.09.18
Галвус Мет®
Таб., покр. пленочной оболочкой, 50 мг+500 мг: 6, 10, 18, 30, 36, 50, 60, 72, 108, 120, 180, 216 или 360 шт.
рег. №: ЛСР-001749/09
от 10.03.09
Дата перерегистрации: 20.09.18
Галвус Мет®
Таб., покр. пленочной оболочкой, 50 мг+850 мг: 6, 10, 18, 30, 36, 50, 60, 72, 108, 120, 180, 216 или 360 шт.
рег. №: ЛСР-001749/09
от 10.03.09
Дата перерегистрации: 20.09.18
Галвус Мет®
Таб., покр. пленочной оболочкой, 50 мг+850 мг: 6, 10, 18, 30, 36, 50, 60, 72, 108, 120, 180, 216 или 360 шт.
рег. №: ЛСР-001749/09
от 10.03.09
Дата перерегистрации: 20.09.18
Галвус®
Таб. 50 мг: 14, 28, 56, 84, 112 или 168 шт.
рег. №: ЛП-(000761)-(РГ-RU )
от 05.05.22
Предыдущий рег. №: ЛСР-008119/08
Фасовка, упаковка и выпускающий контроль качества:
НОВАРТИС НЕВА
(Россия)
Глемауно
Таб. 1 мг: 30 шт.
рег. №: ЛП-000519
от 01.03.11
Таб. 2 мг: 30 шт.
рег. №: ЛП-000519
от 01.03.11
Таб. 3 мг: 30 шт.
рег. №: ЛП-000519
от 01.03.11
Таб. 4 мг: 30 шт.
рег. №: ЛП-000519
от 01.03.11
Глибекс
Таб. 1.75 мг: 120 шт.
рег. №: П N014959/01-2003
от 18.10.11
Глибекс
Таб. 3.5 мг: 120 шт.
рег. №: П N014959/01-2003
от 18.10.11
Глибекс
Таб. 5 мг: 120 шт.
рег. №: П N014959/01-2003
от 18.10.11
Глибенкламид
Таб. 1.75 мг: 10, 14, 20, 25, 28, 30, 40, 42, 50, 56, 60, 70, 75, 80, 84, 90, 100, 112, 120, 125, 140, 150, 180, 200, 240, 300, 400 или 500 шт.
рег. №: ЛП-003742
от 19.07.16
Таб. 3.5 мг: 10, 14, 20, 25, 28, 30, 40, 42, 50, 56, 60, 70, 75, 80, 84, 90, 100, 112, 120, 125, 140, 150, 180, 200, 240, 300, 400 или 500 шт.
рег. №: ЛП-003742
от 19.07.16
Таб. 5 мг: 10, 14, 20, 25, 28, 30, 40, 42, 50, 56, 60, 70, 75, 80, 84, 90, 100, 112, 120, 125, 140, 150, 180, 200, 240, 300, 400 или 500 шт.
рег. №: ЛП-003742
от 19.07.16
Произведено:
ОЗОН
(Россия)
Глибенкламид
Таб. 1.75 мг: 10, 20, 30, 60 или 120 шт.
рег. №: ЛП-005650
от 10.07.19
Таб. 3.5 мг: 10, 20, 30, 60 или 120 шт.
рег. №: ЛП-005650
от 10.07.19
Глибенкламид
Таб. 5 мг: 10, 20, 30 или 50 шт.
рег. №: ЛП-000933
от 18.10.11
Глибенкламид
Таб. 5 мг: 40 или 50 шт.
рег. №: ЛС-002056
от 30.12.11
Глибенкламид
Таб. 5 мг: 50 шт.
рег. №: ЛС-002499
от 11.09.12
Глибенкламид+Метформин
Таб., покр. пленочной оболочкой, 2.5 мг+400 мг: 5, 10, 15, 20, 25, 30, 40, 45, 50, 60, 75, 80, 90, 100, 120, 150, 200, 225, 250 или 300 шт.
рег. №: ЛП-007896
от 18.02.22
Произведено:
ОЗОН
(Россия)
Глибенкламид+Метформин
Таб., покр. пленочной оболочкой, 2.5 мг+500 мг: 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 75, 80, 90, 100, 120, 125, 150, 175, 200, 225, 250 или 300 шт.
рег. №: ЛП-005084
от 28.09.18
Произведено:
ОЗОН
(Россия)
Глибенкламид+Метформин
Таб., покр. пленочной оболочкой, 5 мг+500 мг: 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 75, 80, 90, 100, 120, 125, 150, 175, 200, 225, 250 или 300 шт.
рег. №: ЛП-005084
от 28.09.18
Произведено:
ОЗОН
(Россия)
Глибенкламида таблетки 0.005 г
Таб. 5 мг: 50 шт.
рег. №: 95/370/10
от 27.12.95
Глибенфаж
Таб., покр. пленочной оболочкой, 2.5 мг+ 500 мг: 10, 20, 30, 40, 60, 90, 100 или 120 шт.
рег. №: ЛП-004612
от 25.12.17
Глибенфаж
Таб., покр. пленочной оболочкой, 5 мг+ 500 мг: 10, 20, 30, 40, 60, 90, 100 или 120 шт.
рег. №: ЛП-004612
от 25.12.17
Глибенфор
Таб., покр. пленочной оболочкой, 2.5 мг+500 мг: 20, 30, 40, 60, 80 или 90 шт.
рег. №: ЛП-006453
от 10.09.20
Таб., покр. пленочной оболочкой, 5 мг+500 мг: 20, 30, 40, 60, 80 или 90 шт.
рег. №: ЛП-006453
от 10.09.20
Глибомет®
Таб., покр. пленочной оболочкой, 2.5 мг+400 мг: 40, 60 или 100 шт.
рег. №: П N012183/01
от 16.09.11
Дата перерегистрации: 12.09.19
Глидиаб®
Таб. 80 мг: 60 шт.
рег. №: Р N000001/01
от 16.05.11
Глидиаб® МВ
Таб. с модифиц. высвобождением 30 мг: 30 или 60 шт.
рег. №: ЛС-000002
от 25.02.10
Глидиаб® МВ
Таб. с модифиц. высвобождением 30 мг: 30 или 60 шт.
рег. №: ЛП-(000069)-(РГ-RU )
от 26.06.20
Глидика®М
Таб., покр. плен. оболочкой 1 мг+250 мг: 30, 60 или 90 шт.
рег. №: ЛП-005081
от 27.09.18
Таб., покр. плен. оболочкой 2 мг+500 мг: 30 или 60 шт.
рег. №: ЛП-005081
от 27.09.18
Гликлада®
Таб. пролонгир. действия 60 мг: 30, 60, 90 или 120 шт.
рег. №: ЛП-002725
от 24.11.14
Гликлада®
Таб. с пролонгир. высвобождением 30 мг: 30, 60 или 90 шт.
рег. №: ЛП-(000116)-(РГ-RU )
от 18.01.21
Предыдущий рег. №: ЛСР-005824/09
Гликлазид
Таб. 80 мг: 10, 20, 30, 40, 50, 60 или 100 шт.
рег. №: ЛП-006674
от 28.12.20
Гликлазид Канон
Таб. с пролонгированным высвобождением 30 мг: 30 или 60 шт.
рег. №: ЛП-003964
от 15.11.16
Таб. с пролонгированным высвобождением 60 мг: 30 или 60 шт.
рег. №: ЛП-003964
от 15.11.16
Гликлазид МВ
Таб. с модифиц. высвобождением 30 мг: 10, 20, 30, 40, 50, 60, 80, 90, 100, 120, 150, 180, 200 или 300 шт.
рег. №: ЛП-002218
от 04.09.13
Произведено:
ОЗОН
(Россия)
Гликлазид МВ
Таб. с модифиц. высвобождением 60 мг: 10, 14, 20, 25, 28, 30, 40, 42, 50, 56, 60, 75, 84, 90, 100, 120, 125, 140, 150, 180, 250 или 300 шт.
рег. №: ЛП-003109
от 21.07.15
Произведено:
ОЗОН
(Россия)
Гликлазид МВ Фармстандарт
Таб. с пролонгированным высвобождением 30 мг: 30 или 60 шт.
рег. №: ЛП-003625
от 13.05.16
Гликлазид МВ Фармстандарт
Таб. с пролонгированным высвобождением 60 мг: 30 или 60 шт.
рег. №: ЛП-003625
от 13.05.16
Гликлазид МВ-Вертекс
Таб. с пролонгированным высвобождением 30 мг: 30, 60 или 90 шт.
рег. №: ЛП-005762
от 29.08.19
Гликлазид МВ-Вертекс
Таб. с пролонгированным высвобождением 60 мг: 30, 60 или 90 шт.
рег. №: ЛП-005762
от 29.08.19
Гликлазид Пролонг-АКОС
Таб. с пролонгир. высвобождением 30 мг: 10, 20, 30, 60, 100 или 120 шт.
рег. №: ЛП-007266
от 05.08.21
Таб. с пролонгир. высвобождением 60 мг: 10, 20, 30, 60, 100 или 120 шт.
рег. №: ЛП-007266
от 05.08.21
Произведено:
СИНТЕЗ
(Россия)
Гликлазид-СЗ
Таб. с пролонгир. высвобождением 60 мг: 30, 60 или 90 шт.
рег. №: ЛП-№(001556)-(РГ-R U)
от 15.12.22
Предыдущий рег. №: ЛП-004551
Гликсамби
Таб., покр. пленочной оболочкой, 5 мг+10 мг: 10 или 30 шт.
рег. №: ЛП-(000633)-(РГ-RU )
от 18.03.22
Предыдущий рег. №: ЛП-004108
Таб., покр. пленочной оболочкой, 5 мг+25 мг: 10 или 30 шт.
рег. №: ЛП-(000633)-(РГ-RU )
от 18.03.22
Предыдущий рег. №: ЛП-004108
Глимекомб®
Таб. 40 мг+500 мг: 60 шт.
рег. №: ЛСР-009886/09
от 04.12.09
Глимепирид
Таб. 1 мг: 30, 60 или 100 шт.
рег. №: ЛП-005629
от 02.07.19
Глимепирид
Таб. 1 мг: от 10 до 600 шт.
рег. №: ЛП-(000760)-(РГ-RU )
от 05.05.22
Предыдущий рег. №: ЛП-003488
Таб. 2 мг: от 10 до 600 шт.
рег. №: ЛП-(000760)-(РГ-RU )
от 05.05.22
Предыдущий рег. №: ЛП-003488
Таб. 3 мг: от 10 до 600 шт.
рег. №: ЛП-(000760)-(РГ-RU )
от 05.05.22
Предыдущий рег. №: ЛП-003488
Таб. 4 мг: от 10 до 600 шт.
рег. №: ЛП-(000760)-(РГ-RU )
от 05.05.22
Предыдущий рег. №: ЛП-003488
Произведено:
ОЗОН
(Россия)
Глимепирид
Таб. 2 мг: 10, 15, 30, 60 или 100 шт.
рег. №: ЛП-004195
от 16.03.17
Глимепирид
Таб. 2 мг: 30 шт.
рег. №: ЛП-002967
от 22.04.15
Глимепирид
Таб. 2 мг: 30, 60 или 100 шт.
рег. №: ЛП-(000441)-(РГ-RU )
от 22.11.21
Предыдущий рег. №: ЛСР-009962/09
Таб. 3 мг: 30, 60 или 100 шт.
рег. №: ЛП-(000441)-(РГ-RU )
от 22.11.21
Предыдущий рег. №: ЛСР-009962/09
Глимепирид
Таб. 3 мг: 10, 15, 30, 60 или 100 шт.
рег. №: ЛП-004195
от 16.03.17
Глимепирид
Таб. 3 мг: 30 шт.
рег. №: ЛП-002967
от 22.04.15
Глимепирид
Таб. 4 мг: 10, 15, 30, 60 или 100 шт.
рег. №: ЛП-004195
от 16.03.17
Глимепирид
Таб. 4 мг: 30 шт.
рег. №: ЛП-002967
от 22.04.15
Глимепирид
Таб. 4 мг: 30, 60 или 100 шт.
рег. №: ЛП-(000403)-(РГ-RU )
от 28.10.21
Предыдущий рег. №: ЛП-001795
Глимепирид Канон
Таб. 1 мг: 10, 30, 60, 90, 100 или 120 шт.
рег. №: ЛП-001446
от 20.01.12
Глимепирид Канон
Таб. 2 мг: 10, 30, 60, 90, 100 или 120 шт.
рег. №: ЛП-001446
от 20.01.12
Глимепирид Канон
Таб. 3 мг: 10, 30, 60, 90, 100 или 120 шт.
рег. №: ЛП-001446
от 20.01.12
Глимепирид-Вертекс
Таб. 1 мг: 30 или 60 шт.
рег. №: ЛП-002219
от 04.09.13
Дата перерегистрации: 10.10.18
Глимепирид-Вертекс
Таб. 2 мг: 30 или 60 шт.
рег. №: ЛП-002219
от 04.09.13
Дата перерегистрации: 10.10.18
Глимепирид-Вертекс
Таб. 3 мг: 30 или 60 шт.
рег. №: ЛП-002219
от 04.09.13
Дата перерегистрации: 10.10.18
Глимепирид-Вертекс
Таб. 4 мг: 30 или 60 шт.
рег. №: ЛП-002219
от 04.09.13
Дата перерегистрации: 10.10.18
Глимепирид-Вертекс
Таб. 6 мг: 30 или 60 шт.
рег. №: ЛП-002219
от 04.09.13
Дата перерегистрации: 10.10.18
Глимепирид-СЗ
Таб. 2 мг: 30, 60 или 90 шт.
рег. №: ЛП-005504
от 06.05.19
Глимепирид-СЗ
Таб. 3 мг: 30, 60 или 90 шт.
рег. №: ЛП-005504
от 06.05.19
Глимепирид-СЗ
Таб. 4 мг: 30, 60 или 90 шт.
рег. №: ЛП-005504
от 06.05.19
Глимепирид-Тева
Таб. 1 мг: 30 шт.
рег. №: ЛСР-005208/08
от 03.07.08
Произведено:
USV
(Индия)
Глимепирид-Тева
Таб. 2 мг: 30 шт.
рег. №: ЛСР-005208/08
от 03.07.08
Произведено:
USV
(Индия)
Глимепирид-Тева
Таб. 3 мг: 30 шт.
рег. №: ЛСР-005208/08
от 03.07.08
Произведено:
USV
(Индия)
Глипвило®
Таб. 50 мг
рег. №: ЛП-(000662)-(РГ-RU )
от 05.04.22
Глюкованс®
Таб., покр. пленочной оболочкой, 2.5 мг+500 мг: 30 или 60 шт.
рег. №: ЛС-000304
от 05.04.10
Дата перерегистрации: 28.01.20
Таб., покр. пленочной оболочкой, 5 мг+500 мг: 30 или 60 шт.
рег. №: ЛС-000304
от 05.04.10
Дата перерегистрации: 28.01.20
Глюконорм®
Таб., покр. пленочной оболочкой, 2.5 мг+400 мг: 40 шт.
рег. №: ЛСР-009610/09
от 30.11.09
Глюконорм® Плюс
Таб., покр. пленочной оболочкой, 2.5 мг+500 мг: 30 шт.
рег. №: ЛП-004249
от 17.04.17
Дата перерегистрации: 04.07.22
Глюконорм® Плюс
Таб., покр. пленочной оболочкой, 5 мг+500 мг: 30 шт.
рег. №: ЛП-004249
от 17.04.17
Дата перерегистрации: 04.07.22
Глюкофаж®
Таб., покр. пленочной оболочкой, 1000 мг: 30, 45, 50, 60 или 120 шт.
рег. №: П N014600/01
от 13.08.08
Дата перерегистрации: 04.04.18
Произведено:
MERCK
(Испания)
или
НАНОЛЕК
(Россия)
Глюкофаж®
Таб., покр. пленочной оболочкой, 1000 мг: 30, 45, 50, 60 или 120 шт.
рег. №: П N014600/01
от 13.08.08
Дата перерегистрации: 04.04.18
Глюкофаж®
Таб., покр. пленочной оболочкой, 500 мг: 30, 50, 60 или 100 шт.
рег. №: П N014600/01
от 13.08.08
Дата перерегистрации: 04.04.18
Произведено:
MERCK
(Испания)
или
НАНОЛЕК
(Россия)
Глюкофаж®
Таб., покр. пленочной оболочкой, 500 мг: 30, 50, 60 или 100 шт.
рег. №: П N014600/01
от 13.08.08
Дата перерегистрации: 04.04.18
Глюкофаж®
Таб., покр. пленочной оболочкой, 850 мг: 30, 60 или 100 шт.
рег. №: П N014600/01
от 13.08.08
Дата перерегистрации: 04.04.18
Произведено:
MERCK
(Испания)
или
НАНОЛЕК
(Россия)
Глюкофаж®
Таб., покр. пленочной оболочкой, 850 мг: 30, 60 или 100 шт.
рег. №: П N014600/01
от 13.08.08
Дата перерегистрации: 04.04.18
Глюкофаж® Лонг
Таб. с пролонгир. высвобождением 500 мг: 30 или 60 шт.
рег. №: ЛСР-002098/10
от 16.03.10
Дата перерегистрации: 17.10.19
Таб. с пролонгир. высвобождением 750 мг: 30 или 60 шт.
рег. №: ЛП-000509
от 01.03.11
Дата перерегистрации: 25.10.19
Таб. с пролонгир. высвобождением 1000 мг: 28, 30, 56 или 60 шт.
рег. №: ЛП-002396
от 12.03.14
Дата перерегистрации: 25.10.19
Глюмедекс
Таб. 2 мг: 30 шт.
рег. №: ЛСР-003007/08
от 22.04.08
Глюренорм®
Таб. 30 мг: 30, 60 или 120 шт.
рег. №: ЛП-(000093)-(РГ-RU )
от 30.11.20
Голда МВ
Таб. с модифицированным высвобождением 30 мг: 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 150, 180, 200 или 300 шт.
рег. №: ЛП-(000402)-(РГ-RU )
от 28.10.21
Предыдущий рег. №: ЛП-004364
Таб. с модифицированным высвобождением 60 мг: 7, 10, 14, 20, 25, 28, 30, 40, 42, 50, 56, 60, 70, 75, 80, 84, 90, 100, 120, 125, 140, 150, 180, 250 или 300 шт.
рег. №: ЛП-(000402)-(РГ-RU )
от 28.10.21
Предыдущий рег. №: ЛП-004364
Голдлайн® Комби
Набор таб. с пролонгир. высвобождением и капс.: таб. 500 мг (10-90 шт.) и капс. 10 мг+158.5 мг (10-90 шт.)
рег. №: ЛП-007728
от 27.12.21
Набор таб. с пролонгир. высвобождением и капс.: таб. 500 мг (10-90 шт.) и капс. 15 мг+153.5 мг (10-90 шт.)
рег. №: ЛП-007728
от 27.12.21
Набор таб. с пролонгир. высвобождением и капс.: таб. 750 мг (10-90 шт.) и капс. 10 мг+158.5 мг (10-90 шт.)
рег. №: ЛП-007728
от 27.12.21
Набор таб. с пролонгир. высвобождением и капс.: таб. 750 мг (10-90 шт.) и капс. 15 мг+153.5 мг (10-90 шт.)
рег. №: ЛП-007728
от 27.12.21
Набор таб. с пролонгир. высвобождением и капс.: таб. 1000 мг (10-90 шт.) и капс. 10 мг+158.5 мг (10-90 шт.)
рег. №: ЛП-007728
от 27.12.21
Набор таб. с пролонгир. высвобождением и капс.: таб. 1000 мг (10-90 шт.) и капс. 15 мг+153.5 мг (10-90 шт.)
рег. №: ЛП-007728
от 27.12.21
Диабеталонг®
Таб. с пролонгированным высвобождением 30 мг: 30 шт.
рег. №: ЛСР-008619/09
от 28.10.09
Дата перерегистрации: 26.10.20
Диабеталонг®
Таб. с пролонгированным высвобождением 60 мг: 10, 20, 30, 60, 100 или 120 шт.
рег. №: ЛП-(000939)-(РГ-RU )
от 27.06.22
Предыдущий рег. №: ЛП-003155
Диабетон® МВ
Таб. с модифицир. высвобождением 30 мг: 30 или 60 шт.
рег. №: П N011940/01
от 03.11.09
Дата перерегистрации: 02.07.19
Диабетон® МВ
Таб. с модифицир. высвобождением 60 мг: 30 или 60 шт.
рег. №: ЛП-(000531)-(РГ-RU )
от 26.01.22
Предыдущий рег. №: ЛСР-006030/09
Таб. с модифицир. высвобождением 60 мг: 28, 30 или 60 шт.
рег. №: ЛП-(000531)-(РГ-RU )
от 26.01.22
Предыдущий рег. №: ЛСР-006030/09
Диабефарм®
Таб. 80 мг: 30 или 60 шт.
рег. №: Р N003217/01
от 24.11.09
Дата перерегистрации: 04.12.20
Диабефарм® МВ
Таб. с модиф. высвобождением 30 мг: 28, 30, 56 или 60 шт.
рег. №: ЛСР-004790/07
от 13.12.07
Дата перерегистрации: 11.06.19
Диабефарм® МВ
Таб. с пролонгир. высвобождением 60 мг: 30, 60, 90 или 120 шт.
рег. №: ЛП-005359
от 20.02.19
Диабинакс
Таб. 20 мг: 10 или 20 шт.
рег. №: П N014190/01
от 23.10.09
Таб. 40 мг: 10 или 20 шт.
рег. №: П N014190/01
от 23.10.09
Таб. 80 мг: 10, 20 или 60 шт.
рег. №: П N014190/01
от 23.10.09
Диаглинид®
Таб. 1 мг: 30 или 60 шт.
рег. №: ЛП-001261
от 22.11.11
Таб. 2 мг: 30 или 60 шт.
рег. №: ЛП-001261
от 22.11.11
Таб. 500 мкг: 30 или 60 шт.
рег. №: ЛП-001261
от 22.11.11
Диамерид®
Таб. 1 мг: 30 или 60 шт.
рег. №: ЛП-000029
от 10.11.10
Дата перерегистрации: 28.09.16
Таб. 2 мг: 30 или 60 шт.
рег. №: ЛП-000029
от 10.11.10
Дата перерегистрации: 28.09.16
Таб. 3 мг: 30 или 60 шт.
рег. №: ЛП-000029
от 10.11.10
Дата перерегистрации: 28.09.16
Таб. 4 мг: 30 или 60 шт.
рег. №: ЛП-000029
от 10.11.10
Дата перерегистрации: 28.09.16
Диамерид®
Таб. 1 мг: 30 шт.
рег. №: ЛП-(000063)-(РГ-RU )
от 25.05.20
Таб. 2 мг: 30 шт.
рег. №: ЛП-(000063)-(РГ-RU )
от 25.05.20
Таб. 3 мг: 30 шт.
рег. №: ЛП-(000063)-(РГ-RU )
от 25.05.20
Таб. 4 мг: 30 шт.
рег. №: ЛП-(000063)-(РГ-RU )
от 25.05.20
Диаформин® ОД
Таб. с пролонгир. высвобождением 500 мг: 30, 60 или 90 шт.
рег. №: ЛП-000636
от 28.09.11
Дата перерегистрации: 18.07.18
Земигло
Таб., покр. пленочной оболочкой, 50 мг: 28 или 56 шт.
рег. №: ЛП-005247
от 11.12.18
Произведено:
LG CHEM
(Республика Корея)
Иглинид
Таб. 0.5 мг: 30, 60 или 90 шт.
рег. №: ЛП-(000676)-(РГ-RU )
от 07.04.22
Предыдущий рег. №: ЛП-004383
Таб. 1 мг: 30, 60 или 90 шт.
рег. №: ЛП-(000676)-(РГ-RU )
от 07.04.22
Предыдущий рег. №: ЛП-004383
Таб. 2 мг: 30, 60 или 90 шт.
рег. №: ЛП-(000676)-(РГ-RU )
от 07.04.22
Предыдущий рег. №: ЛП-004383
Инкресинк®

Таб., покр. пленочной оболочкой, 25 мг+15 мг: 28 шт.
рег. №: ЛП-(000188)-(РГ-RU )
от 02.04.21
Таб., покр. пленочной оболочкой, 25 мг+30 мг: 28 шт.
рег. №: ЛП-(000188)-(РГ-RU )
от 02.04.21
Произведено:
TAKEDA
(Германия)
Фасовка, упаковка и выпускающий контроль качества:
TAKEDA IRELAND
(Ирландия)
контакты:
ШТАДА
(Россия)
Инстолит
Таб. 1 мг: 30, 60, 90, 100 или 120 шт.
рег. №: ЛП-(000789)-(РГ-RU )
от 16.05.22
Предыдущий рег. №: ЛП-004334
Таб. 2 мг: 30, 60, 90, 100 или 120 шт.
рег. №: ЛП-(000789)-(РГ-RU )
от 16.05.22
Предыдущий рег. №: ЛП-004334
Таб. 3 мг: 30, 60, 90, 100 или 120 шт.
рег. №: ЛП-(000789)-(РГ-RU )
от 16.05.22
Предыдущий рег. №: ЛП-004334
Таб. 4 мг: 30, 60, 90, 100 или 120 шт.
рег. №: ЛП-(000789)-(РГ-RU )
от 16.05.22
Предыдущий рег. №: ЛП-004334
Комбоглиз Пролонг®
Таб. с модифицированным высвобождением, покр. пленочной оболочкой, 1000 мг+2.5 мг: 28 или 56 шт.
рег. №: ЛП-002068
от 14.05.13
Дата перерегистрации: 07.03.17
Комбоглиз Пролонг®
Таб. с модифицированным высвобождением, покр. пленочной оболочкой, 1000 мг+5 мг: 28 шт.
рег. №: ЛП-002068
от 14.05.13
Дата перерегистрации: 07.03.17
Комбоглиз Пролонг®
Таб. с модифицированным высвобождением, покр. пленочной оболочкой, 500 мг+5 мг: 28 шт.
рег. №: ЛП-002068
от 14.05.13
Дата перерегистрации: 07.03.17
Кселевия®
Таб., покр. пленочной оболочкой, 100 мг: 28 шт.
рег. №: ЛП-004456
от 12.09.17
Кутерн
Таб. покр. пленочной оболочкой, 10 мг+5 мг: 30 шт.
рег. №: ЛП-005718
от 12.08.19
Расфасовано и упаковано:
ASTRAZENECA
(Швеция)
МАНИНИЛ®
Таб. 1.75 мг: 120 шт.
рег. №: П N012252/01
от 16.03.12
Дата перерегистрации: 06.06.19
Таб. 3.5 мг: 120 шт.
рег. №: П N012253/01
от 02.03.12
Дата перерегистрации: 05.06.19
Таб. 5 мг: 120 шт.
рег. №: П N011519/01
от 07.03.12
Дата перерегистрации: 31.10.17
Мерифатин
Таб., покр. пленочной оболочкой, 500 мг: 10, 15, 20, 30, 40, 50, 60, 80, 90, 100 или 120 шт.
рег. №: ЛП-(000591)-(РГ-RU )
от 21.02.22
Предыдущий рег. №: ЛП-004363
Таб., покр. пленочной оболочкой, 850 мг: 10, 15, 20, 30, 40, 50, 60, 80, 90, 100 или 120 шт.
рег. №: ЛП-(000591)-(РГ-RU )
от 21.02.22
Предыдущий рег. №: ЛП-004363
Таб., покр. пленочной оболочкой, 1000 мг: 10, 15, 20, 30, 40, 50, 60, 80, 90, 100 или 120 шт.
рег. №: ЛП-(000591)-(РГ-RU )
от 21.02.22
Предыдущий рег. №: ЛП-004363
Мерифатин МВ
Таб. с пролонгир. высвобождением, 500 мг: от 10 до 120 шт.
рег. №: ЛП-(000787)-(РГ-RU )
от 13.05.22
Предыдущий рег. №: ЛП-005280
Таб. с пролонгир. высвобождением, 750 мг: от 10 до 120 шт.
рег. №: ЛП-(000787)-(РГ-RU )
от 13.05.22
Предыдущий рег. №: ЛП-005280
Таб. с пролонгир. высвобождением, 1000 мг: от 10 до 120 шт.
рег. №: ЛП-(000787)-(РГ-RU )
от 13.05.22
Предыдущий рег. №: ЛП-005280
Метаглиптин Медисорб
Таб., покр. пленочной оболочкой, 50 мг+500 мг: 7, 10, 14, 20, 21, 28, 30, 35, 40, 42, 49, 50, 56, 60, 63, 70, 80, 84, 90, 98, 100, 112, 120, 126 или 140 шт.
рег. №: ЛП-007118
от 24.06.21
Таб., покр. пленочной оболочкой, 50 мг+850 мг: 7, 10, 14, 20, 21, 28, 30, 35, 40, 42, 49, 50, 56, 60, 63, 70, 80, 84, 90, 98, 100, 112, 120, 126 или 140 шт.
рег. №: ЛП-007118
от 24.06.21
Таб., покр. пленочной оболочкой, 50 мг+1000 мг: 7, 10, 14, 20, 21, 28, 30, 35, 40, 42, 49, 50, 56, 60, 63, 70, 80, 84, 90, 98, 100, 112, 120, 126 или 140 шт.
рег. №: ЛП-007118
от 24.06.21
Метадиен
Таб. пролонгированного действия 500 мг: 100 шт.
рег. №: ЛСР-005999/10
от 25.06.10
Метглиб
Таб., покр. пленочной оболочкой, 2.5 мг+400 мг: 10, 20, 30, 40, 60 или 90 шт.
рег. №: ЛП-001954
от 25.12.12
Метглиб® Форс
Таб., покр. пленочной оболочкой, 2.5 мг+500 мг: 10, 20, 30, 40, 60 или 90 шт.
рег. №: ЛП-003571
от 14.04.16
Таб., покр. пленочной оболочкой, 2.5 мг+500 мг: 30, 40, 60 или 90 шт.
рег. №: ЛП-003571
от 14.04.16
Таб., покр. пленочной оболочкой, 5 мг+500 мг: 10, 20, 30, 40, 60 или 90 шт.
рег. №: ЛП-003571
от 14.04.16
Таб., покр. пленочной оболочкой, 5 мг+500 мг: 30, 40, 60 или 90 шт.
рег. №: ЛП-003571
от 14.04.16
Метфорвел
Таб., покр. пленочной оболочкой, 500 мг: 10, 20, 30, 40, 50 или 60 шт.
рег. №: ЛП-005107
от 15.10.18
Таб., покр. пленочной оболочкой, 850 мг: 10, 20, 30, 40, 50 или 60 шт.
рег. №: ЛП-005107
от 15.10.18
Метформин
Таб. 1000 мг: 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 180, 240, 300, 360, 420, 480, 540, 600 или 720 шт.
рег. №: ЛП-002189
от 20.08.13
Произведено:
ОЗОН
(Россия)
Метформин
Таб. 500 мг: 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 180, 240, 300, 360, 420, 480, 540, 600 или 720 шт.
рег. №: ЛП-002189
от 20.08.13
Произведено:
ОЗОН
(Россия)
Метформин
Таб. 850 мг: 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 180, 240, 300, 360, 420, 480, 540, 600 или 720 шт.
рег. №: ЛП-002189
от 20.08.13
Произведено:
ОЗОН
(Россия)
Метформин
Таб., покр. пленочной обол., 500 мг: 30, 40, 50 или 60 шт.
рег. №: ЛП-004046
от 27.12.16
Таб., покр. пленочной обол., 850 мг: 20, 30, 40, 60 или 80 шт.
рег. №: ЛП-004046
от 27.12.16
Таб., покр. пленочной обол., 1000 мг: 30, 45, 50 или 60 шт.
рег. №: ЛП-004046
от 27.12.16
Метформин
Таб., покр. пленочной оболочкой 500 мг
рег. №: ЛП-008633
от 25.10.22
Метформин

Таб., покр. пленочной оболочкой, 1000 мг: 10, 30, 60, 100 или 120 шт.
рег. №: ЛП-003848
от 20.09.16
Метформин
Таб., покр. пленочной оболочкой, 1000 мг: 15, 30 или 60 шт.
рег. №: ЛП-002975
от 27.04.15
Метформин
Таб., покр. пленочной оболочкой, 1000 мг: 30 шт.
рег. №: ЛП-004380
от 19.07.17
Метформин

Таб., покр. пленочной оболочкой, 1000 мг: 30, 60, 90 или 120 шт.
рег. №: ЛП-004257
от 25.04.17
Метформин
Таб., покр. пленочной оболочкой, 500 мг: 10, 30, 60, 100 или 120 шт.
рег. №: ЛП-003848
от 20.09.16
Метформин
Таб., покр. пленочной оболочкой, 500 мг: 15, 30 или 60 шт.
рег. №: ЛП-002975
от 27.04.15
Метформин
Таб., покр. пленочной оболочкой, 500 мг: 30 или 60 шт.
рег. №: ЛП-005966
от 05.12.19
Дата перерегистрации: 27.01.20
Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт.
рег. №: ЛП-005966
от 05.12.19
Дата перерегистрации: 27.01.20
Метформин
Таб., покр. пленочной оболочкой, 500 мг: 30 или 60 шт.
рег. №: ЛП-005463
от 11.04.19
Метформин
Таб., покр. пленочной оболочкой, 500 мг: 30 или 60 шт.
рег. №: ЛП-005456
от 09.04.19
Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт.
рег. №: ЛП-005456
от 09.04.19
Таб., покр. пленочной оболочкой, 1000 мг: 30 или 60 шт.
рег. №: ЛП-005456
от 09.04.19
Метформин
Таб., покр. пленочной оболочкой, 500 мг: 30 или 60 шт.
рег. №: ЛСР-000779/08
от 15.02.08
Дата перерегистрации: 20.12.17
Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт.
рег. №: ЛСР-000779/08
от 15.02.08
Дата перерегистрации: 20.12.17
Метформин
Таб., покр. пленочной оболочкой, 500 мг: 30 шт.
рег. №: ЛП-004380
от 19.07.17
Метформин

Таб., покр. пленочной оболочкой, 500 мг: 30, 60, 90 или 120 шт.
рег. №: ЛП-004257
от 25.04.17
Метформин
Таб., покр. пленочной оболочкой, 850 мг: 15, 30 или 60 шт.
рег. №: ЛП-002975
от 27.04.15
Метформин
Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт.
рег. №: ЛП-005463
от 11.04.19
Метформин
Таб., покр. пленочной оболочкой, 850 мг: 30 шт.
рег. №: ЛП-004380
от 19.07.17
Метформин

Таб., покр. пленочной оболочкой, 850 мг: 30, 60, 90 или 120 шт.
рег. №: ЛП-004257
от 25.04.17
Метформин Авексима
Таб., покр. пленочной оболочкой, 500 мг: 10, 12, 20, 24, 30, 36, 40, 48, 50, 60, 72 шт.
рег. №: ЛП-005441
от 04.04.19
Метформин Авексима
Таб., покр. пленочной оболочкой, 850 мг: 10, 12, 20, 24, 30, 36, 40, 48, 50, 60, 72 шт.
рег. №: ЛП-005441
от 04.04.19
Метформин Канон
Таб., покр. пленочной оболочкой, 500 мг: 30, 50, 60, 90, 100 или 120 шт.
рег. №: ЛП-001724
от 02.07.12
Дата перерегистрации: 04.04.19
Таб., покр. пленочной оболочкой, 850 мг: 30, 50, 60, 90, 100 или 120 шт.
рег. №: ЛП-001724
от 02.07.12
Дата перерегистрации: 04.04.19
Таб., покр. пленочной оболочкой, 1000 мг: 30, 50, 60, 90, 100 или 120 шт.
рег. №: ЛП-001724
от 02.07.12
Дата перерегистрации: 04.04.19
Метформин Лонг
Таб. пролонгированного действия, покр. пленочной оболочкой, 1000 мг: 10, 20, 30, 60, 100 или 120 шт.
рег. №: ЛП-003855
от 22.09.16
Метформин Лонг
Таб. пролонгированного действия, покр. пленочной оболочкой, 850 мг: 10, 20, 30, 60, 100 или 120 шт.
рег. №: ЛП-003855
от 22.09.16
Метформин Лонг
Таб. с пролонгир. высвобождением 500 мг
рег. №: ЛП-008316
от 27.06.22
Таб. с пролонгир. высвобождением 750 мг
рег. №: ЛП-008316
от 27.06.22
Таб. с пролонгир. высвобождением 1000 мг
рег. №: ЛП-008316
от 27.06.22
Метформин Лонг
Таб. с пролонгированным высвобождением 500 мг: 3, 5, 6, 9, 10, 15, 18, 20, 27, 30, 36, 40, 45, 50, 60, 90, 100 или 120 шт.
рег. №: ЛП-005288
от 14.01.19
Таб. с пролонгированным высвобождением 750 мг: 3, 5, 6, 9, 10, 15, 18, 20, 27, 30, 36, 40, 45, 50, 60, 90, 100 или 120 шт.
рег. №: ЛП-005288
от 14.01.19
Таб. с пролонгированным высвобождением 1000 мг: 3, 5, 6, 9, 10, 15, 18, 20, 27, 30, 36, 40, 45, 50, 60, 90, 100 или 120 шт.
рег. №: ЛП-005288
от 14.01.19
Произведено:
ОЗОН
(Россия)
Метформин Лонг Канон
Таб. с пролонгированным высвобождением 1000 мг: 30 или 60 шт.
рег. №: ЛП-004315
от 01.06.17
Метформин Лонг Канон
Таб. с пролонгированным высвобождением 500 мг: 30 или 60 шт.
рег. №: ЛП-004315
от 01.06.17
Метформин Лонг Канон
Таб. с пролонгированным высвобождением 750 мг: 30 или 60 шт.
рег. №: ЛП-004315
от 01.06.17
Метформин МВ

Таб. с пролонгированным высвобождением 1000 мг: 30, 60, 90 или 120 шт.
рег. №: ЛП-004302
от 18.05.17
Метформин МВ

Таб. с пролонгированным высвобождением 500 мг: 30, 60, 90 или 120 шт.
рег. №: ЛП-004302
от 18.05.17
Метформин МВ

Таб. с пролонгированным высвобождением 750 мг: 30, 60, 90 или 120 шт.
рег. №: ЛП-004302
от 18.05.17
Метформин МВ

Таб. с пролонгированным высвобождением 850 мг: 30, 60, 90 или 120 шт.
рег. №: ЛП-004302
от 18.05.17
Метформин МВ-Тева
Таб. пролонгированного действия 500 мг: 30, 60 или 120 шт.
рег. №: ЛП-001968
от 14.01.13
Дата перерегистрации: 24.09.18
Метформин МС
Таб., покр. пленочной обол., 500 мг: 20, 30, 40, 50, 60 или 100 шт.
рег. №: ЛП-004568
от 06.12.17
Таб., покр. пленочной обол., 850 мг: 20, 30, 40, 50, 60 или 100 шт.
рег. №: ЛП-004568
от 06.12.17
Таб., покр. пленочной обол., 1000 мг: 20, 30, 40, 50, 60 или 100 шт.
рег. №: ЛП-004568
от 06.12.17
Метформин Пролонг-Акрихин
Таб. пролонгированного действия, покр. пленочной оболочкой, 1000 мг: 30 или 60 шт.
рег. №: ЛП-002674
от 23.10.14
Метформин Пролонг-Акрихин
Таб. пролонгированного действия, покр. пленочной оболочкой, 750 мг: 30 или 60 шт.
рег. №: ЛП-003700
от 23.06.16
Метформин Санофи
Таб., покр. пленочной оболочкой, 500 мг: 30, 60 или 90 шт.
рег. №: ЛСР-003625/10
от 30.04.10
Дата перерегистрации: 10.06.21
Таб., покр. пленочной оболочкой, 850 мг: 30, 60 или 90 шт.
рег. №: ЛСР-003625/10
от 30.04.10
Дата перерегистрации: 10.06.21
Таб., покр. пленочной оболочкой, 1000 мг: 10, 30, 60 или 90 шт.
рег. №: ЛСР-003625/10
от 30.04.10
Дата перерегистрации: 10.06.21
Метформин-Акрихин
Таб. 500 мг: 30, 60 или 100 шт.
рег. №: Р N003192/01
от 05.03.09
Дата перерегистрации: 30.11.17
Таб., покр. пленочной оболочкой, 1 г: 30 или 60 шт.
рег. №: ЛСР-005803/08
от 22.07.08
Дата перерегистрации: 09.04.18
Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт.
рег. №: ЛСР-005803/08
от 22.07.08
Дата перерегистрации: 09.04.18
Метформин-Алси
Таб., покр. пленочной оболочкой, 500 мг: 30 или 60 шт.
рег. №: ЛП-006773
от 11.02.21
Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт.
рег. №: ЛП-006773
от 11.02.21
Метформин-ВЕРТЕКС
Таб., покр. пленочной оболочкой, 1000 мг: 30, 60, 100 или 120 шт.
рег. №: ЛП-005387
от 04.03.19
Метформин-Вертекс
Таб., покр. пленочной оболочкой, 500 мг: 30, 60, 100 или 120 шт.
рег. №: ЛП-004690
от 12.02.18
Дата перерегистрации: 11.04.19
Таб., покр. пленочной оболочкой, 850 мг: 30, 60, 100 или 120 шт.
рег. №: ЛП-004690
от 12.02.18
Дата перерегистрации: 11.04.19
Метформин-Рихтер

Таб., покр. пленочной оболочкой, 500 мг: 60 шт.
рег. №: ЛС-001149
от 21.06.10
Дата перерегистрации: 17.03.20
Таб., покр. пленочной оболочкой, 850 мг: 60 шт.
рег. №: ЛС-001149
от 21.06.10
Дата перерегистрации: 17.03.20
Метформин-СЗ
Таб. с пролонгированным высвобождением 500 мг: 20, 30 или 60 шт.
рег. №: ЛП-006994
от 30.04.21
Дата перерегистрации: 01.11.22
Таб. с пролонгированным высвобождением 750 мг: 20, 30 или 60 шт.
рег. №: ЛП-006994
от 30.04.21
Дата перерегистрации: 01.11.22
Таб. с пролонгированным высвобождением 1000 мг: 20, 30 или 60 шт.
рег. №: ЛП-006994
от 30.04.21
Дата перерегистрации: 01.11.22
Метформин-Тева
Таб., покр. пленочной оболочкой, 500 мг: 30 или 60 шт.
рег. №: ЛП-000028
от 09.11.10
Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт.
рег. №: ЛП-000028
от 09.11.10
Таб., покр. пленочной оболочкой, 1000 мг: 30 или 60 шт.
рег. №: ЛП-000028
от 09.11.10
контакты:
ТЕВА
(Израиль)
Оземпик®
Р-р д/п/к введения 1.34 мг/1 мл: картридж в шприц-ручке 1.5 мл (0.25 мг/доза или 0.5 мг/доза) и 3 мл (1 мг/доза)
рег. №: ЛП-005726
от 15.08.19
Онглиза®
Таб., покр. пленочной оболочкой, 2.5 мг: 30 шт.
рег. №: ЛП-(000475)-(РГ-RU )
от 22.12.21
Предыдущий рег. №: ЛСР-008697/10
Таб., покр. пленочной оболочкой, 5 мг: 30 шт.
рег. №: ЛП-(000475)-(РГ-RU )
от 22.12.21
Предыдущий рег. №: ЛСР-008697/10
Фасовка, упаковка и выпускающий контроль качества:
ASTRAZENECA UK
(Великобритания)
Пиоглар
Таб. 15 мг: 10, 30 или 50 шт.
рег. №: ЛС-001671
от 16.07.11
Пиоглар
Таб. 30 мг: 10, 30 или 50 шт.
рег. №: ЛС-001671
от 16.07.11
Пиоглит
Таб. 15 мг: 30 шт.
рег. №: ЛСР-010500/08
от 24.12.08
Таб. 30 мг: 30 шт.
рег. №: ЛСР-010500/08
от 24.12.08
Ребелсас®
Таб. 3 мг: 30 шт.
рег. №: ЛП-006910
от 09.04.21
Таб. 7 мг: 30 шт.
рег. №: ЛП-006910
от 09.04.21
Таб. 14 мг: 30 шт.
рег. №: ЛП-006910
от 09.04.21
Ринформин Лонг
Таб. с пролонгированным высвобождением 500 мг: 30 или 60 шт.
рег. №: ЛП-005420
от 25.03.19
Ринформин Лонг
Таб. с пролонгированным высвобождением 750 мг: 30 или 60 шт.
рег. №: ЛП-005420
от 25.03.19
Ринформин®
Таб., покр. пленочной оболочкой, 500 мг: 30 или 60 шт.
рег. №: ЛП-005951
от 02.12.19
Таб., покр. пленочной оболочкой, 850 мг: 30 или 60 шт.
рег. №: ЛП-005951
от 02.12.19
Таб., покр. пленочной оболочкой, 1000 мг: 30 или 60 шт.
рег. №: ЛП-005951
от 02.12.19
Сатерекс®
Таб., покр. пленочной оболочкой, 20 мг: 28, 30, 56, 60, 70, 84, 90, 98, 112 или 120 шт.
рег. №: ЛП-003598
от 04.05.16
Таб., покр. пленочной оболочкой, 30 мг: 28, 30, 56, 60, 70, 84, 90, 98, 112 или 120 шт.
рег. №: ЛП-003598
от 04.05.16
Сатерекс® Мет
Таб., покр. пленочной оболочкой, 30 мг и 500 мг: 84 шт.
рег. №: ЛП-006578
от 17.11.20
Таб., покр. пленочной оболочкой, 30 мг и 1000 мг: 84 шт.
рег. №: ЛП-006578
от 17.11.20
Сатерекс®Мет
Таб., покр. пленочной оболочкой 30 мг и 500 мг
рег. №: ЛП-(001161)-(РГ-RU )
от 29.08.22
Таб., покр. пленочной оболочкой 30 мг и 1000 мг
рег. №: ЛП-(001161)-(РГ-RU )
от 29.08.22
Сигдуо Лонг®
Таб. с модифицированным высвобождением, покр. пленочной оболочкой, 5 мг+1000 мг: 60 шт.
рег. №: ЛП-005093
от 09.10.18
Таб. с модифицированным высвобождением, покр. пленочной оболочкой, 10 мг+1000 мг: 30 шт.
рег. №: ЛП-005093
от 09.10.18
Владелец товарного знака группа компаний:
ASTRAZENECA
Сиглетик

Таб., покр. пленочной оболочкой, 25 мг: 10, 14, 28 или 56 шт.
рег. №: ЛП-(000626)-(РГ-RU )
от 15.03.22
Таб., покр. пленочной оболочкой, 50 мг: 14, 15, 28 или 56 шт.
рег. №: ЛП-(000626)-(РГ-RU )
от 15.03.22
Таб., покр. пленочной оболочкой, 100 мг: 10, 14, 28 или 56 шт.
рег. №: ЛП-(000626)-(РГ-RU )
от 15.03.22
Синджарди
Таб., покр. пленочной оболочкой, 500 мг+5 мг: 30, 60, 90 или 180 шт.
рег. №: ЛП-004736
от 12.03.18
Дата перерегистрации: 15.08.18
Таб., покр. пленочной оболочкой, 500 мг+12.5 мг: 30, 60, 90 или 180 шт.
рег. №: ЛП-004736
от 12.03.18
Дата перерегистрации: 15.08.18
Таб., покр. пленочной оболочкой, 850 мг+5 мг: 30, 60, 90 или 180 шт.
рег. №: ЛП-004736
от 12.03.18
Дата перерегистрации: 15.08.18
Таб., покр. пленочной оболочкой, 850 мг+12.5 мг: 30, 60, 90 или 180 шт.
рег. №: ЛП-004736
от 12.03.18
Дата перерегистрации: 15.08.18
Таб., покр. пленочной оболочкой, 1000 мг+12.5 мг: 30, 60, 90 или 180 шт.
рег. №: ЛП-004736
от 12.03.18
Дата перерегистрации: 15.08.18
Таб., покр. пленочной оболочкой, 1000 мг+5 мг: 30, 60, 90 или 180 шт.
рег. №: ЛП-004736
от 12.03.18
Дата перерегистрации: 15.08.18
Сиофор® 1000
Таб., покр. оболочкой, 1000 мг: 30, 60 или 120 шт.
рег. №: ЛС-002180
от 13.04.12
Сиофор® 1000
Таб., покр. оболочкой, 1000 мг: 30, 60 или 120 шт.
рег. №: ЛС-002180
от 13.04.12
Сиофор® 500
Таб., покр. оболочкой, 500 мг: 30, 60 или 120 шт.
рег. №: П N013673/01
от 16.04.12
Сиофор® 500
Таб., покр. оболочкой, 500 мг: 30, 60 или 120 шт.
рег. №: П N013673/01
от 16.04.12
Сиофор® 850
Таб., покр. оболочкой, 850 мг: 30, 60 или 120 шт.
рег. №: П N013674/01
от 13.04.12
Сиофор® 850
Таб., покр. оболочкой, 850 мг: 30, 60 или 120 шт.
рег. №: П N013674/01
от 13.04.12
Сиофор® 850
Таб., покр. оболочкой, 850 мг: 30, 60 или 120 шт.
рег. №: П N013674/01
от 13.04.12
Ситадиаб®
Таб., покр. пленочной оболочкой, 100 мг: 28 шт.
рег. №: ЛП-(000724)-(РГ-RU )
от 22.04.22
Статиглин
Таб. 1.75 мг: 14, 20, 25, 30, 42, 50, 56, 60, 75, 80, 84, 90, 100, 112, 120, 150, 180 или 240 шт.
рег. №: ЛП-(000736)-(РГ-RU )
от 25.04.22
Предыдущий рег. №: ЛП-004405
Таб. 3.5 мг: 14, 20, 25, 30, 42, 50, 56, 60, 75, 80, 84, 90, 100, 112, 120, 150, 180 или 240 шт.
рег. №: ЛП-(000736)-(РГ-RU )
от 25.04.22
Предыдущий рег. №: ЛП-004405
Таб. 5 мг: 14, 20, 25, 30, 42, 50, 56, 60, 75, 80, 84, 90, 100, 112, 120, 150, 180 или 240 шт.
рег. №: ЛП-(000736)-(РГ-RU )
от 25.04.22
Предыдущий рег. №: ЛП-004405
Субетта®

Таб. д/рассасывания: 100 шт.
рег. №: ЛП-(000028)-(РГ-RU )
от 18.12.19
Дата перерегистрации: 09.06.22
Тражента®
Таб., покр. пленочной оболочкой, 5 мг: 14, 28, 30 или 56 шт.
рег. №: ЛП-001430
от 12.01.12
Дата перерегистрации: 27.07.22
Трулисити®
Р-р д/п/к введения 0.75 мг/0.5 мл: шприц-ручки 4 шт.
рег. №: ЛП-003682
от 16.06.16
Дата перерегистрации: 28.02.17
Р-р д/п/к введения 1.5 мг/0.5 мл: шприц-ручки 4 шт.
рег. №: ЛП-003682
от 16.06.16
Форметин ® Лонг
Таб. с пролонг. высвобождением 1000 мг: 30, 40, 50, 60 или 70 шт.
рег. №: ЛП-004110
от 30.01.17
Форметин ® Лонг
Таб. с пролонг. высвобождением 500 мг: 30, 40, 50, 60 или 70 шт.
рег. №: ЛП-004110
от 30.01.17
Форметин ® Лонг
Таб. с пролонг. высвобождением 750 мг: 30, 40, 50, 60 или 70 шт.
рег. №: ЛП-004110
от 30.01.17
Форметин ® Лонг
Таб. с пролонг. высвобождением 850 мг: 30, 40, 50, 60 или 70 шт.
рег. №: ЛП-004110
от 30.01.17
Форметин®
Таб. 0.5 г: 60 шт.
рег. №: ЛСР-003304/07
от 22.10.07
Дата перерегистрации: 16.03.15
Форметин®
Таб. 0.85 г: 60 шт.
рег. №: ЛСР-003304/07
от 22.10.07
Дата перерегистрации: 16.03.15
Форметин®
Таб. 0.85 г: 60 шт.
рег. №: ЛСР-003304/07
от 22.10.07
Дата перерегистрации: 16.03.15
Таб. 0.5 г: 60 шт.
рег. №: ЛСР-003304/07
от 22.10.07
Дата перерегистрации: 14.03.22
Форметин®
Таб. 1 г: 60 шт.
рег. №: ЛСР-003304/07
от 22.10.07
Дата перерегистрации: 14.03.22
Форсиглекс
Таб., покр. пленочной оболочкой, 500 мг+50 мг: 56 шт.
рег. №: ЛП-006228
от 01.06.20
Таб., покр. пленочной оболочкой, 850 мг+50 мг: 56 шт.
рег. №: ЛП-006228
от 01.06.20
Таб., покр. пленочной оболочкой, 1000 мг+50 мг: 56 шт.
рег. №: ЛП-006228
от 01.06.20
Эводин®
Таб., покр. пленочной оболочкой, 5 мг: 28 шт.
рег. №: ЛП-(000415)-(РГ-RU )
от 03.11.21
Предыдущий рег. №: ЛП-005584
Юглин
Таб. 30 мг: 30, 60 или 120 шт.
рег. №: ЛП-004519
от 31.10.17
Янувия®
Таб., покр. пленочной оболочкой, 25 мг: 14, 28, 56, 84 или 98 шт.
рег. №: ЛСР-003200/07
от 15.10.07
Дата перерегистрации: 20.11.19
Таб., покр. пленочной оболочкой, 50 мг: 14, 28, 56, 84 или 98 шт.
рег. №: ЛСР-003200/07
от 15.10.07
Дата перерегистрации: 20.11.19
Таб., покр. пленочной оболочкой, 100 мг: 14, 28, 56, 84 или 98 шт.
рег. №: ЛСР-003200/07
от 15.10.07
Дата перерегистрации: 20.11.19
Янумет
Таб., покр. пленочной оболочкой, 500 мг+50 мг: 14, 28, 56, 84 или 98 шт.
рег. №: ЛП-(000149)-(РГ-RU )
от 02.03.21
Предыдущий рег. №: ЛП-000046
Таб., покр. пленочной оболочкой, 850 мг+50 мг: 14, 28, 56, 84 или 98 шт.
рег. №: ЛП-(000149)-(РГ-RU )
от 02.03.21
Предыдущий рег. №: ЛП-000046
Таб., покр. пленочной оболочкой, 1000 мг+50 мг: 14, 28, 56, 84 или 98 шт.
рег. №: ЛП-(000149)-(РГ-RU )
от 02.03.21
Предыдущий рег. №: ЛП-000046
Янумет® Лонг
Таб. с пролонгированным высвобождением, покр. пленочной оболочкой, 500 мг+50 мг: 7, 10, 14, 28, 30, 56, 60, 90, 180 или 1000 шт.
рег. №: ЛП-(000566)-(РГ-RU )
от 11.02.22
Предыдущий рег. №: ЛП-004332
Таб. с пролонгированным высвобождением, покр. пленочной оболочкой, 1000 мг+50 мг: 7, 10, 14, 28, 30, 56, 60, 90, 180 или 1000 шт.
рег. №: ЛП-(000566)-(РГ-RU )
от 11.02.22
Предыдущий рег. №: ЛП-004332
Таб. с пролонгированным высвобождением, покр. пленочной оболочкой, 1000 мг+100 мг: 7, 10, 14, 28, 30, 56, 60, 90, 180 или 1000 шт.
рег. №: ЛП-(000566)-(РГ-RU )
от 11.02.22
Предыдущий рег. №: ЛП-004332
Яситара
Таб., покр. пленочной оболочкой, 25 мг: 14, 28, 56, 84 или 98 шт.
рег. №: ЛП-(000666)-(РГ-RU )
от 05.04.22
Предыдущий рег. №: ЛП-004566
Таб., покр. пленочной оболочкой, 50 мг: 14, 28, 56, 84 или 98 шт.
рег. №: ЛП-(000666)-(РГ-RU )
от 05.04.22
Предыдущий рег. №: ЛП-004566
Таб., покр. пленочной оболочкой, 100 мг: 14, 28, 56, 84 или 98 шт.
рег. №: ЛП-(000666)-(РГ-RU )
от 05.04.22
Предыдущий рег. №: ЛП-004566
- Главная →
- Аналоги на букву Ф
Аналоги таблеток Форсига

Автор публикации
Наш эксперт
Содержание статьи
Список аналогов:
1. НовоНорм (дешевле на 1967 руб., рейтинг 4)
2. Диаглинид (дешевле на 1908 руб., рейтинг 4)
3. Джардинс (дешевле на 1908 руб., рейтинг 4)
4. Инвокана (дороже на 311 руб., рейтинг 4)
Сравнение аналогов, какой лучше
Форсига или Янувия
Форсига или Галвус
Форсига или Диабетон МВ
Форсига или Джардинс
Форсига или Випидия
Форсига (таблетки)
Рейтинг: 563 голосов
111
Производитель: Уточняется
Формы выпуска:
- Таб. п/обол. 10 мг, 30 шт. От 2142 руб.
Цена на Форсига в аптеках: от 2091 руб. до 2850 руб. (952 предложений)
Инструкция по применению
Форсига — таблетированный препарат для лечения сахарного диабета второго типа на основе дапаглифлозина в дозировке 5 мг. Может назначаться дополнительно к диабетической диете и физическим упражнениям. У Форсиги есть противопоказания и возрастные ограничения, перед началом лечения внимательно изучите инструкцию.
Доступные заменители Форсиги в таблетках
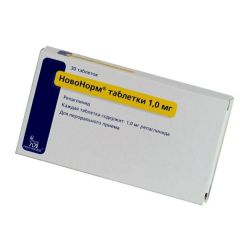
НовоНорм (таблетки)
Рейтинг: 564 голосов
111
Аналог дешевле от 1967 руб.
Производитель: Ново Нордиск (Дания)
Формы выпуска:
- Табл. 1 мг, 30 шт. От 175 руб.
- Табл. 2 мг, 30 шт. От 219 руб.
Цена на НовоНорм в аптеках: от 78 руб. до 245 руб. (1170 предложений)
Инструкция по применению
НовоНорм – доступный заменитель Форсиги. Единственное активное вещество в лекарстве – репаглинид. Препарат в течение 30 минут повышает инсулиновую концентрацию в крови. В связи с отсутствием данных о проведенных исследованиях о безопасности препарата и эффективном приеме таблеток в детской возрастной группе и не рекомендуется применять лекарство детям до 18 лет. В виде побочных реакций очень часто возникает диарея и боли в животе.
ОбсуждениеДобавить комментарий
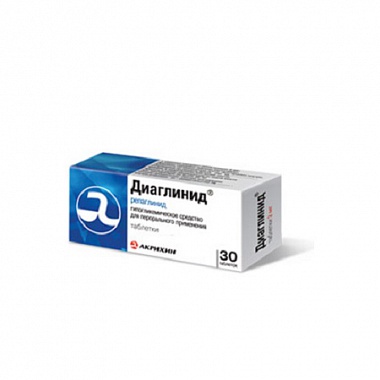
Диаглинид (таблетки)
Рейтинг: 353 голосов
111
Аналог дешевле от 1908 руб.
Производитель: Акрихин (Россия)
Формы выпуска:
- Табл. 1 мг, 30 шт. От 234 руб.
Цена на Диаглинид в аптеках: от 205 руб. до 335 руб. (2 предложений)
Инструкция по применению
Диаглинид – синтетическое гипогликемическое средство, в состав которого входит репаглинид. Если низкоуглеводная диета и физкультура плохо помогают держать уровень сахара в крови, только тогда начинают прием препарата. Автомобилистам и людям с профессией, которая требует повышенного внимания — с большим вниманием нужно принимать диаглинид. Если у больных нарушена работа печени или почек, лекарство принимают очень осторожно.
ОбсуждениеДобавить комментарий
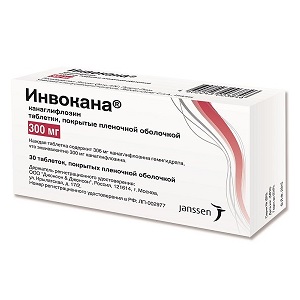
Инвокана (таблетки)
Рейтинг: 344 голосов
111
Аналог дороже от 311 руб.
Производитель: Уточняется
Формы выпуска:
- Таб. п/обол. 100 мг, 30 шт. От 2453 руб.
Цена на Инвокана в аптеках: от 1894 руб. до 5890 руб. (235 предложений)
Инструкция по применению
Инвокана – таблетки, похожие на капсулы в оболочке, имеют гравировку CFZ. Канаглифлозин является активным веществом данного препарата . Инвокана относится к новому виду гипогликемических средств и оказывает благоприятное эффективное лечение больных диабетом. Данный препарат назначают для лечения пациентам с инсулиннезависимым диабетом второго типа.
ОбсуждениеДобавить комментарий
Информация, опубликованная на этой странице не является призывом к лечению и не заменяет консультацию специалиста. Пожалуйста, обратитесь к врачу!
Источники информации:
- Справочник лекарств РЛС©
- Справочник лекарственных препаратов Видаль
- Государственный реестер лекарственных средств (Росминздрав)
- Государственный реестер лекарственных средств (data.gov.ru)
- Министерство здравоохранения Российской Федерации
Что лучше: Форсига или Янувия Наверх
Рейтинг: 4 из 5
Средняя цена: 2091 рублей

Рейтинг: 4 из 5
Средняя цена: 1563 рублей
(дешевле на 528 руб.)
Что лучше: Форсига или Галвус Наверх

Рейтинг: 4 из 5
Средняя цена: 2091 рублей

Рейтинг: 4 из 5
Средняя цена: 784 рублей
(дешевле на 1307 руб.)
Что лучше: Форсига или Диабетон МВ Наверх

Рейтинг: 4 из 5
Средняя цена: 2091 рублей
Рейтинг: 4 из 5
Средняя цена: 301 рублей
(дешевле на 1790 руб.)
Что лучше: Форсига или Джардинс Наверх

Рейтинг: 4 из 5
Средняя цена: 2091 рублей

Рейтинг: 4 из 5
Средняя цена: 972 рублей
(дешевле на 1119 руб.)
Что лучше: Форсига или Випидия Наверх

Рейтинг: 4 из 5
Средняя цена: 2091 рублей
Рейтинг: 4 из 5
Средняя цена: 843 рублей
(дешевле на 1248 руб.)
Цель страницы: показать список аналогов (синонимов), актуальные цены и рейтинги лекарств, выставленные пользователями (суммарно более 10 000 оценок).
Вместе с этим препаратом посетители ищут:
Форсига — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-002596
Торговое наименование:
Форсига
Международное непатентованное наименование:
дапаглифлозин
Лекарственная форма:
таблетки, покрытые плёночной оболочкой
Состав
1 таблетка, покрытая плёночной оболочкой, 5 мг содержит:
Действующее вещество: дапаглифлозина пропандиола моногидрат 6,150 мг, в пересчёте на дапаглифлозин 5 мг
Вспомогательные вещества: целлюлоза микрокристаллическая 85,725 мг, лактоза безводная 25,000 мг, кросповидон 5,000 мг, кремния диоксид 1,875 мг, магния стеарат 1,250 мг; оболочка таблетки: Опадрай® II жёлтый 5,000 мг (поливиниловый спирт частично гидролизованный 2,000 мг, титана диоксид 1,177 мг, макрогол 3350 1,010 мг, тальк 0,740 мг, краситель оксид железа жёлтый 0,073 мг).
1 таблетка, покрытая плёночной оболочкой, 10 мг содержит:
Действующее вещество: дапаглифлозина пропандиола моногидрат 12,30 мг, в пересчёте на дапаглифлозин 10 мг
Вспомогательные вещества: целлюлоза микрокристаллическая 171,45 мг, лактоза безводная 50,00 мг, кросповидон 10,00 мг, кремния диоксид 3,75 мг, магния стеарат 2,50 мг; оболочка таблетки: Опадрай® II жёлтый 10,00 мг (поливиниловый спирт частично гидролизованный 4,00 мг, титана диоксид 2,35 мг, макрогол 3350 2,02 мг, тальк 1,48 мг, краситель оксид железа жёлтый 0,15 мг).
Описание
Таблетки, покрытые плёночной оболочкой, 5 мг:
Круглые двояковыпуклые таблетки, покрытые плёночной оболочкой жёлтого цвета, с гравировкой «5» на одной стороне и «1427» на другой стороне.
Таблетки, покрытые плёночной оболочкой, 10 мг:
Ромбовидные двояковыпуклые таблетки, покрытые плёночной оболочкой жёлтого цвета, с гравировкой «10» на одной стороне и «1428» на другой стороне.
Фармакотерапевтическая группа:
гипогликемическое средство для перорального применения — ингибитор натрийзависимого переносчика глюкозы 2 типа
Код ATX:
А10ВК01
Фармакологические свойства
Механизм действия
Дапаглифлозин — мощный (константа ингибирования (Ki) 0,55 нМ), селективный обратимый ингибитор натрий-глюкозного котранспортера 2-го типа (SGLT2).
Ингибирование SGLT2 дапаглифлозином вызывает снижение реабсорбции глюкозы из клубочкового фильтрата в проксимальных почечных канальцах с сопутствующим снижением реабсорбции натрия, приводя к выведению глюкозы почками и осмотическому диурезу. Таким образом дапаглифлозин увеличивает доставку натрия к дистальным канальцам, что усиливает канальцево-клубочковую обратную связь и снижает внутриклубочковое давление. Это в сочетании с осмотическим диурезом приводит к уменьшению перегрузки объемом, снижению артериального давления и уменьшению преднагрузки и постнагрузки, что может оказывать благоприятное влияние на ремоделирование сердца и сохранять функцию почек. Другие эффекты включают повышение гематокрита и снижение массы тела.
Благоприятное влияние дапаглифлозина на сердечно-сосудистую систему и почки обусловлено не только снижением концентрации глюкозы в крови и наблюдается не только у пациентов с сахарным диабетом. Помимо осмотического диуреза и связанного с ним гемодинамического действия, возникающего при ингибировании SGLT2, потенциальными механизмами, обеспечивающими благоприятное воздействие дапаглифлозина на сердечно-сосудистую систему и почки, могут быть вторичные эффекты в отношении метаболизма миокарда, ионных каналов, фиброза, адипокинов и мочевой кислоты.
Дапаглифлозин снижает концентрацию глюкозы плазмы крови натощак и после приема пищи, а также концентрацию гликированного гемоглобина за счет уменьшения реабсорбции глюкозы в почечных канальцах, способствуя выведению глюкозы почками. Выведение глюкозы (глюкозурический эффект) наблюдается уже после приема первой дозы препарата, сохраняется в течение последующих 24 часов и продолжается на протяжении всей терапии. Количество глюкозы, выводимой почками за счет этого механизма, зависит от концентрации глюкозы в крови и от скорости клубочковой фильтрации (СКФ). Таким образом, у пациентов с нормальной концентрацией глюкозы в крови и/или низкой СКФ на фоне применения дапаглифлозина отмечается низкая склонность к развитию гипогликемии, поскольку количество фильтруемой глюкозы небольшое и может быть реабсорбировано переносчиком SGLT1 и неблокированным переносчиком SGLT2. Дапаглифлозин не нарушает нормальную продукцию эндогенной глюкозы в ответ на гипогликемию. Действие дапаглифлозина не зависит от секреции инсулина и чувствительности к инсулину. В клинических исследованиях дапаглифлозина отмечалось улучшение функции бета-клеток (тест НОМА, homeostasis model assessment).
SGLT2 селективно экспрессируется в почках. Дапаглифлозин не оказывает воздействия на другие переносчики глюкозы, осуществляющие транспорт глюкозы к периферическим тканям, и проявляет более чем в 1400 раз большую селективность к SGLT2, чем к SGLT1, основному транспортеру в кишечнике, отвечающему за всасывание глюкозы.
Фармакодинамика
После приема дапаглифлозина здоровыми добровольцами и пациентами с сахарным диабетом 2 типа (СД2) наблюдалось увеличение количества выводимой почками глюкозы. При приеме дапаглифлозина в дозе 10 мг/сутки в течение 12 недель пациентами с СД2 примерно 70 г глюкозы в сутки выделялось почками (что соответствует 280 ккал/сутки). У пациентов с СД2, принимавших дапаглифлозин в дозе 10 мг/сутки длительно (до 2 лет), выведение глюкозы поддерживалось на протяжении всего курса терапии.
Выведение глюкозы почками при применении дапаглифлозина также приводит к осмотическому диурезу и увеличению объема мочи. Увеличение объема мочи у пациентов с СД2, принимавших дапаглифлозин в дозе 10 мг/сутки, сохранялось в течение 12 недель и составляло примерно 375 мл/сутки. Увеличение объема мочи сопровождалось небольшим и транзиторным повышением выведения натрия почками, что не приводило к изменению концентрации натрия в сыворотке крови.
Клиническая эффективность
СД2
Анализ результатов 13 плацебо-контролируемых исследований продемонстрировал снижение систолического артериального давления (САД) на 3,7 мм рт. ст. и диастолического артериального давления (ДАД) на 1,8 мм рт. ст. на 24 неделе терапии дапаглифлозином в дозе 10 мг/сутки по сравнению со снижением САД и ДАД на 0,5 мм рт. ст. в группе плацебо. Аналогичное снижение артериального давления наблюдалось на протяжении 104 недель лечения.
Комбинированная терапия дапаглифлозином 10 мг и эксенатидом пролонгированного действия приводила к значительно большему снижению САД на 28 неделе терапии (на 4,3 мм рт. ст.) по сравнению со снижением САД при терапии дапаглифлозином (на 1,8 мм рт. ст.) и при терапии эксенатидом пролонгированного действия (на 1,2 мм рт. ст.).
При применении дапаглифлозина в дозе 10 мг/сутки у пациентов с СД2 с неадекватным контролем гликемии и артериальной гипертензией, получающих блокаторы рецепторов ангиотензина II, ингибиторы ангиотензинпревращающего фермента, в том числе, в комбинации с другим гипотензивным препаратом, было отмечено уменьшение показателя гликированного гемоглобина на 3,1% и снижение САД на 4,3 мм рт. ст. через 12 недель терапии по сравнению с плацебо.
Эффект дапаглифлозина по сравнению с плацебо в отношении сердечно-сосудистых и почечных исходов при добавлении к текущей базовой терапии был установлен в клиническом исследовании DECLARE, проведенном у 17160 пациентов с СД2 и двумя и более дополнительными факторами сердечно-сосудистого риска (возраст ≥ 55 лет у мужчин или ≥ 60 лет у женщин и один или более из следующих факторов: дислипидемия, гипертензия или табакокурение) или с диагностированным сердечно-сосудистым заболеванием.
Дапаглифлозин 10 мг продемонстрировал превосходство по сравнению с плацебо в предотвращении первичной комбинированной конечной точки, включающей госпитализацию по поводу сердечной недостаточности или сердечно-сосудистую смерть (отношение рисков (ОР) 0,83 [95% доверительный интервал (ДИ) 0,73, 0,95]; р=0,005). Различие эффекта терапии было достигнуто за счет госпитализации по поводу сердечной недостаточности (ОР 0,73 [95% ДИ 0,61, 0,88]), без различия в отношении сердечно-сосудистой смерти (ОР 0,98 [95% ДИ от 0,82 до 1,17]).
Преимущество терапии дапаглифлозином по сравнению с плацебо наблюдалось у пациентов с диагностированным сердечно-сосудистым заболеванием и без такового, с исходной сердечной недостаточностью или без таковой, и было сопоставимым в ключевых подгруппах, включая возраст, пол, функцию почек (рСКФ) и регион.
Дапаглифлозин снижал частоту явлений комбинированной точки, включающей подтвержденное устойчивое снижение рСКФ, терминальную стадию почечной недостаточности, смерть вследствие осложнений со стороны почек или сердечно-сосудистую смерть. Разница между группами была обусловлена снижением числа явлений компонентов комбинированной точки почечных исходов, включающей устойчивое снижение рСКФ, терминальную стадию почечной недостаточности и смерть вследствие осложнений со стороны почек.
Отношение рисков по времени до возникновения нефропатии (устойчивое снижение рСКФ, терминальная стадия почечной недостаточности или смерть вследствие осложнений со стороны почек) составило 0,53 (95% ДИ 0,43, 0,66) для дапаглифлозина по сравнению с плацебо.
Также дапаглифлозин снижал риск новых случаев возникновения устойчивой альбуминурии (ОР 0,79 [95% ДИ 0,72, 0,87]) и приводил к более выраженной регрессии макроальбуминурии (ОР 1,82 [95% ДИ 1,51, 2,20]) по сравнению с плацебо.
Хроническая сердечная недостаточность
Исследование DAPA-HF с участием 4744 пациентов с хронической сердечной недостаточностью (II-IV функциональный класс по классификации Нью-Йоркской ассоциации кардиологов [NYHA]) со сниженной фракцией выброса (фракция выброса левого желудочка [ФВЛЖ] ≤ 40%) проводили с целью установить, снижает ли дапаглифлозин риск сердечно-сосудистой смерти и госпитализации по поводу сердечной недостаточности.
Дапаглифлозин снижал частоту первичной комбинированной конечной точки, включающей сердечно-сосудистую смерть, госпитализацию по поводу сердечной недостаточности или экстренное обращение за помощью в связи с ухудшением течения сердечной недостаточности (ОР 0,74 [95% ДИ 0,65, 0,85]; р<0,0001). Все три компонента первичной комбинированной конечной точки по отдельности вносили вклад в эффект лечения (сердечно-сосудистая смерть: ОР 0,82 [95% ДИ 0,69, 0,98], госпитализация по поводу сердечной недостаточности: ОР 0,70 [95% ДИ 0,59, 0,83], экстренное обращение за помощью в связи с ухудшением течения сердечной недостаточности: ОР 0,43 [95% ДИ 0,20, 0,90]). Зарегистрировано несколько экстренных обращений за помощью в связи с ухудшением течения сердечной недостаточности. Дапаглифлозин также снижал частоту сердечно-сосудистой смерти или госпитализации по поводу сердечной недостаточности (ОР 0,75 [95% ДИ 0,65, 0,85], р<0,0001).
Дапаглифлозин также снижал общее число случаев госпитализации по поводу сердечной недостаточности (первой и повторной) и сердечно-сосудистой смерти; было зарегистрировано 567 случаев в группе дапаглифлозина в сравнении с 742 случаями в группе плацебо (отношение частот 0,75 [95% ДИ 0,65, 0,88]; р=0,0002).
Частота смерти по любой причине была ниже в группе терапии дапаглифлозином по сравнению с плацебо (ОР 0,83 [95% ДИ 0,71, 0,97]).
Результаты в отношении первичной комбинированной конечной точки были сопоставимы у пациентов с сердечной недостаточностью с СД2 и без него, а также в других ключевых подгруппах, включая степень тяжести сердечной недостаточности, функцию почек (рСКФ), возраст, пол и регион.
Терапия дапаглифлозином приводила к статистически значимому и клинически значимому преимуществу по сравнению с плацебо в отношении симптомов сердечной недостаточности, оцениваемых по изменению через 8 месяцев от исходного уровня общего показателя симптомов по Канзасскому опроснику для больных кардиомиопатией (KCCQ-TSS) (вероятность преимущества 1,18 [95% ДИ 1,11, 1,26]; р<0,0001). Частота симптомов и тяжесть симптомов внесли вклад в результат, полученный по эффективности терапии. Преимущество наблюдалось как в улучшении симптомов сердечной недостаточности, так и в предотвращении ухудшения симптомов сердечной недостаточности.
Хроническая болезнь почек
Влияние дапаглифлозина на почечные исходы и сердечно-сосудистую смертность у пациентов с хронической болезнью почек было установлено в исследовании DAPA-CKD, в котором дапаглифлозин сравнивали с плацебо при добавлении к стандартной базовой терапии у пациентов с хронической болезнью почек с рСКФ ≥ 25 до ≤ 75 мл/мин/1,73 м2 и альбуминурией (соотношение альбумин/креатинин в моче (А/Кр мочи) ≥ 200 и ≤ 5000 мг/г).
Дапаглифлозин превосходил плацебо в снижении частоты развития первичной комбинированной конечной точки, включающей устойчивое снижение рСКФ на ≥ 50%, достижение терминальной стадии почечной недостаточности, сердечно-сосудистую смерть или смерть вследствие осложнений со стороны почек (ОР 0,61 [95% ДИ 0,51, 0,72]; р<0,0001).
Все четыре компонента первичной комбинированной конечной точки по отдельности вносили вклад в эффект лечения. Дапаглифлозин также снижал частоту развития комбинированной конечной точки, включающей устойчивое снижение рСКФ на ≥ 50%, терминальную стадию почечной недостаточности или смерть вследствие осложнений со стороны почек (ОР 0,56 [95% ДИ 0,45, 0,68], р<0,0001), комбинированной конечной точки, включающей сердечно-сосудистую смерть и госпитализацию по поводу сердечной недостаточности (ОР 0,71 [95% ДИ 0,55, 0,92], р=0,0089) и смерти по любой причине (ОР 0,69 [95% ДИ 0,53, 0,88], р=0,0035).
Преимущество терапии дапаглифлозином по сравнению с плацебо в отношении первичной комбинированной конечной точки было сопоставимо у пациентов с хронической болезнью почек с СД2 или без него, а также в других ключевых подгруппах, включая значения рСКФ и А/Кр мочи, возраст, пол и регион.
Фармакокинетика
Абсорбция
После приема внутрь дапаглифлозин быстро и полностью всасывается в желудочно-кишечном тракте и может приниматься как во время приема пищи, так и вне его. Максимальная концентрация дапаглифлозина в плазме крови (Стах) обычно достигается в течение 2 часов после приема натощак. Значения Стах и AUC (площадь под кривой зависимости концентрации от времени) увеличиваются пропорционально дозе дапаглифлозина. Абсолютная биодоступность дапаглифлозина при приеме внутрь в дозе 10 мг составляет 78%. Прием пищи оказывал умеренное влияние на фармакокинетику дапаглифлозина у здоровых добровольцев. Прием пищи с высоким содержанием жиров снижал Стах дапаглифлозина на 50%, удлинял Ттах (время достижения максимальной концентрации в плазме) примерно на 1 час, но не влиял на AUC по сравнению с приемом натощак. Эти изменения не являются клинически значимыми.
Распределение
Дапаглифлозин примерно на 91% связывается с белками. У пациентов с различными заболеваниями, например, с нарушениями функции почек или печени, этот показатель не изменялся.
Метаболизм
Дапаглифлозин — С-связанный глюкозид, агликон которого связан с глюкозой углерод-углеродной связью, что обеспечивает его устойчивость в отношении глюкозидаз. Средний период полувыведения из плазмы крови (Т1/2) у здоровых добровольцев составлял 12,9 часов после однократного приема дапаглифлозина внутрь в дозе 10 мг. Дапаглифлозин метаболизируется с образованием, главным образом, неактивного метаболита дапаглифлозин-З-О-глюкуронида.
После приема внутрь 50 мг 14С-дапаглифлозина 61% принятой дозы метаболизируется в дапаглифлозин-З-О-глюкуронид, на долю которого приходится 42% общей плазменной радиоактивности (по AUC0-12 ч). На долю неизмененного препарата приходится 39% общей плазменной радиоактивности. Доли остальных метаболитов по отдельности не превышают 5% общей плазменной радиоактивности. Дапаглифлозин-З-О-глюкуронид и другие метаболиты не оказывают фармакологического действия. Дапаглифлозин-З-О-глюкуронид формируется под действием фермента уридиндифосфат-глюкуронозилтрансферазы 1А9 (UGT1A9), присутствующего в печени и почках, изоферменты цитохрома CYP вовлечены в метаболизм в меньшей степени.
Выведение
Дапаглифлозин и его метаболиты выводятся, преимущественно, почками, и только менее 2% выводится в неизмененном виде. После приема 50 мг 14С-дапаглифлозина было обнаружено 96% радиоактивности — 75% в моче и 21% — в фекалиях. Примерно 15% радиоактивности, обнаруженной в фекалиях, приходилось на неизмененный дапаглифлозин.
Фармакокинетика у особых групп пациентов
Пациенты с нарушением функции почек
В равновесном состоянии (среднее значение AUC) системная экспозиция дапаглифлозина у пациентов с СД2 и нарушением функции почек легкой, средней или тяжелой степени (определяемой по клиренсу йогексола) была на 32%, 60% и 87% выше, чем у пациентов с СД2 и нормальной функцией почек, соответственно. Количество глюкозы, выводимой почками в течение суток при приеме дапаглифлозина в равновесном состоянии, зависело от состояния функции почек. У пациентов с СД2 и нормальной функцией почек, и с нарушением функции почек легкой, средней или тяжелой степени в сутки выводилось 85, 52, 18 и 11 г глюкозы, соответственно. Не выявлено различий в связывании дапаглифлозина с белками у здоровых добровольцев и у пациентов с нарушением функции почек различной степени тяжести. Неизвестно, оказывает ли гемодиализ влияние на экспозицию дапаглифлозина. Влияние снижения функции почек на системную экспозицию препарата оценивали на популяционной фармакокинетической модели. Спрогнозированная моделью AUC была выше у пациентов с хронической болезнью почек по сравнению с пациентами с нормальной функцией почек и существенно не различалась у пациентов с хронической болезнью почек с СД2 или без него, что согласуется с ранее полученными данными.
Пациенты с нарушением функции печени
У пациентов с печеночной недостаточностью легкой или средней степени тяжести средние значения Стах и AUC дапаглифлозина были, соответственно, на 12% и 36% выше по сравнению со здоровыми добровольцами. Данные различия не являются клинически значимыми, поэтому корректировки дозы дапаглифлозина при печеночной недостаточности легкой и средней степени тяжести не требуется (см. раздел «Способ применения и дозы»). У пациентов с печеночной недостаточностью тяжелой степени (класс С по Чайлд-Пью) средние значения Стах и AUC дапаглифлозина были на 40% и 67% выше, соответственно, по сравнению со здоровыми добровольцами.
Пациенты пожилого возраста (≥ 65 лет)
Не отмечалось клинически значимого увеличения экспозиции у пациентов в возрасте до 70 лет (если не учитывать другие факторы, помимо возраста). Тем не менее, можно ожидать увеличения экспозиции за счет снижения функции почек, связанного с возрастом. Данные об экспозиции у пациентов в возрасте старше 70 лет недостаточны.
Пол
У женщин среднее значение AUC в равновесном состоянии на 22% превышает аналогичный показатель у мужчин.
Расовая принадлежность
Клинически значимых различий системной экспозиции у представителей европеоидной, негроидной и монголоидной рас не выявлено.
Масса тела
Отмечены более низкие значения экспозиции при повышенной массе тела. Поэтому у пациентов с низкой массой тела может отмечаться некоторое повышение экспозиции, а у пациентов с повышенной массой тела — снижение экспозиции дапаглифлозина. Однако данные различия не являются клинически значимыми.
Показания к применению
Сахарный диабет 2 типа
Сахарный диабет 2 типа у взрослых пациентов в дополнение к диете и физическим упражнениям для улучшения гликемического контроля в качестве:
Сахарный диабет 2 типа у взрослых пациентов с установленным диагнозом сердечно-сосудистого заболевания или двумя и более факторами сердечно-сосудистого риска* для снижения риска госпитализации по поводу сердечной недостаточности.
* возраст у мужчин ≥55 лет или ≥ 60 лет у женщин и наличие не менее одного фактора риска: дислипидемия, артериальная гипертензия, курение.
Хроническая сердечная недостаточность
Хроническая сердечная недостаточность (II-IV функциональный класс по классификации NYHA) со сниженной фракцией выброса у взрослых пациентов для снижения риска сердечно-сосудистой смерти и госпитализации по поводу сердечной недостаточности.
Хроническая болезнь почек
Хроническая болезнь почек у взрослых пациентов с риском ее прогрессирования для уменьшения риска устойчивого снижения рСКФ, наступления терминальной стадии хронической почечной недостаточности, смерти от сердечно-сосудистого заболевания и госпитализации по поводу сердечной недостаточности.
Противопоказания
С осторожностью: печеночная недостаточность тяжелой степени, инфекции мочевыделительной системы, повышение показателя гематокрита.
Применение в период беременности и грудного вскармливания
Беременность
В связи с тем, что применение дапаглифлозина в период беременности не изучено, препарат противопоказан в период беременности. В случае диагностирования беременности терапия дапаглифлозином должна быть прекращена.
Период грудного вскармливания
Неизвестно, проникает ли дапаглифлозин и/или его неактивные метаболиты в грудное молоко. Нельзя исключить риск для новорожденных/младенцев. Дапаглифлозин противопоказан в период грудного вскармливания.
Способ применения и дозы
Внутрь, независимо от приёма пищи, не разжевывая.
Перед началом терапии препаратом Форсига следует оценить состояние водно-солевого обмена и, при необходимости, восполнить объем циркулирующей крови (ОЦК).
СД2
Монотерапия: рекомендуемая доза препарата Форсига составляет 10 мг 1 раз в сутки.
Комбинированная терапия: рекомендуемая доза препарата Форсига составляет 10 мг 1 раз в сутки в комбинации с метформином, производными сульфонилмочевины (в том числе, в комбинации с метформином), тиазолидиндионами, ингибиторами ДПП-4 (в том числе, в комбинации с метформином); агонистом рецепторов ГПП-1 — эксенатидом пролонгированного действия, в комбинации с метформином; препаратами инсулина (в том числе, в комбинации с одним или двумя гипогликемическими препаратами для перорального применения).
С целью снижения риска гипогликемии при совместном назначении препарата Форсига с препаратами инсулина или препаратами, повышающими секрецию инсулина (например, с производным сульфонилмочевины), может потребоваться снижение дозы препаратов инсулина или препаратов, повышающих секрецию инсулина.
Стартовая комбинированная терапия с метформином: рекомендуемая доза препарата Форсига составляет 10 мг 1 раз в сутки, доза метформина — 500 мг 1 раз в сутки. В случае неадекватного гликемического контроля дозу метформина следует увеличить.
СД2 у взрослых пациентов с установленным диагнозом сердечно-сосудистого заболевания или двумя и более факторами сердечно-сосудистого риска для снижения риска госпитализации по поводу сердечной недостаточности: рекомендуемая доза препарата Форсига составляет 10 мг 1 раз в сутки.
Хроническая сердечная недостаточность
Рекомендуемая доза препарата Форсига составляет 10 мг 1 раз в сутки.
Хроническая болезнь почек
Рекомендуемая доза препарата Форсига составляет 10 мг 1 раз в сутки.
Применение у особых групп пациентов
Пациенты с нарушением функции печени
При печеночной недостаточности легкой или средней степени тяжести нет необходимости корректировать дозу препарата. Пациентам с печеночной недостаточностью тяжелой степени рекомендуется начальная доза препарата 5 мг. При хорошей переносимости доза может быть увеличена до 10 мг (см. разделы «Фармакокинетика» и «Особые указания»).
Пациенты с нарушением функции почек
Коррекции дозы в зависимости от функции почек не требуется.
Следует оценить функцию почек перед началом терапии препаратом Форсита и далее при наличии клинических показаний.
Не рекомендуется применение препарата Форсита для улучшения гликемического контроля у взрослых пациентов с сахарным диабетом 2 типа с рСКФ менее 45 мл/мин/1,73 м2 ввиду возможной неэффективности препарата в данной популяции вследствие механизма фармакологического действия дапаглифлозина.
Применение препарата Форсига не рекомендуется для лечения хронической болезни почек у пациентов с поликистозом почек или у пациентов, которым требуется или которые недавно получали иммуносупрессивную терапию почечной недостаточности. Ожидается, что дапаглифлозин не будет эффективен у этих групп пациентов.
Рекомендации по дозированию препарата в зависимости от показателей расчетной скорости клубочковой фильтрации (рСКФ)
|
рСКФ (мл/мин/1,73 м2) |
Рекомендуемая доза |
|
рСКФ 45 или выше |
Коррекции дозы не требуется. |
|
рСКФ менее 45 до 25 |
Коррекции дозы не требуется. |
|
рСКФ менее 25 |
Противопоказано для начала терапии, однако пациенты могут продолжать терапию для уменьшения риска снижения рСКФ, наступления терминальной стадии хронической почечной недостаточности, смерти от сердечно-сосудистого заболевания и госпитализации по поводу сердечной недостаточности. |
|
Терминальная стадия хронической почечной недостаточности, требующая проведения диализа |
Противопоказано. |
Дети и подростки до 18 лет
Безопасность и эффективность дапаглифлозина у пациентов младше 18 лет не изучались (см. раздел «Противопоказания»).
Пациенты пожилого возраста
У пациентов пожилого возраста коррекции дозы дапаглифлозина не требуется.
Побочное действие
Профиль безопасности дапаглифлозина оценивали в клинических исследованиях1 безопасности и эффективности дапаглифлозина при применении для терапии СД2, хронической сердечной недостаточности и хронической болезни почек, в период пострегистрационного наблюдения.
Профиль безопасности дапаглифлозина по изучаемым в исследованиях показаниям был сопоставим. Тяжелая гипогликемия и диабетический кетоацидоз наблюдались только у пациентов с сахарным диабетом. Нежелательные реакции не были дозозависимыми.
Возможные на фоне терапии дапаглифлозином нежелательные реакции распределены по системно-органным классам с указанием частоты их возникновения согласно рекомендациям ВОЗ: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000), очень редко (<1/10000) и неуточненной частоты (невозможно оценить на основании имеющихся данных).
Инфекционные и паразитарные заболевания: часто* — вульвовагинит, баланит и связанные с ними генитальные инфекции2,3, инфекция мочевыводящих путей2,4; нечасто** -вульвовагинальный зуд, грибковые инфекционные заболевания; очень редко -некротизирующий фасциит промежности (гангрена Фурнье)
Нарушения со стороны обмена веществ и питания: очень часто — гипогликемия (при применении в комбинации с производным сульфонилмочевины или инсулином)2; нечасто** — снижение ОЦК2,5, жажда; редко — диабетический кетоацидоз (при применении при СД2)2,9
Нарушения со стороны нервной системы: часто* — головокружение
Нарушения со стороны желудочно-кишечного тракта: нечасто** — запор, сухость во рту
Нарушения со стороны кожи и подкожных тканей: часто* — сыпь10; очень редко -ангионевротический отек
Нарушения со стороны костно-мышечной системы и соединительной ткани: часто* -боль в спине
Нарушения со стороны почек и мочевыводящих путей: часто* — дизурия, полиурия6; нечасто** — никтурия
Лабораторные и инструментальные данные: часто* — дислипидемия8, повышение значения гематокрита7, снижение почечного клиренса креатинина на начальном этапе терапии2; нечасто** — повышение концентрации мочевины в крови, повышение концентрации креатинина в крови на начальном этапе терапии2.
1 Представлены данные применения препарата до 24 недель (краткосрочная терапия) независимо от приема дополнительного гипогликемического препарата.
2 См. соответствующий подраздел ниже для получения дополнительной информации.
3 Вульвовагинит, баланит и связанные с ними генитальные инфекции включают, например, следующие заранее определенные предпочтительные термины: вульвовагинальную грибковую инфекцию, вагинальную инфекцию, баланит, грибковую инфекцию половых органов, вульвовагинальный кандидоз, вульвовагинит, кандидозный баланит, генитальный кандидоз, инфекцию половых органов, инфекцию половых органов у мужчин, инфекцию полового члена, вульвит, бактериальный вагинит, абсцесс вульвы.
4 Инфекция мочевыводящих путей включает следующие предпочтительные термины, перечисленные в порядке убывания частоты: инфекция мочевыводящих путей, цистит, инфекция мочевыводящих путей, вызванная бактериями рода Escherichia, инфекция мочеполового тракта, пиелонефрит, тригонит, уретрит, инфекция почек и простатит.
5 Снижение ОЦК включает, например, следующие заранее определенные предпочтительные термины: обезвоживание, гиповолемия, артериальная гипотензия.
6 Полиурия включает предпочтительные термины: поллакиурия, полиурия и усиление диуреза.
7 Средние изменения значения гематокрита от исходных значений составили 2,30% в группе дапаглифлозина 10 мг по сравнению с -0,33% в группе плацебо. Значения гематокрита >55% отмечены у 1,3% пациентов, получавших дапаглифлозин 10 мг, по сравнению с 0,4% пациентов, получавших плацебо.
8 Среднее изменение следующих показателей в процентах от исходных значений в группе дапаглифлозина 10 мг и группе плацебо, соответственно, составило: общий холестерин 2,5% по сравнению с 0,0%; холестерин-ЛПВП 6,0% по сравнению с 2,7%; холестерин-ЛПНП 2,9% по сравнению с -1,0%; триглицериды -2,7% по сравнению с -0,7%.
9 Отмечено в исследовании DECLARE. Частота основана на годовом показателе.
10 Нежелательная реакция отмечена при пострегистрационном наблюдении. Сыпь включает следующие предпочтительные термины, перечисленные в порядке частоты развития в клинических исследованиях: сыпь, генерализованная сыпь, зудящая сыпь, макулёзная сыпь, макулопапулезная сыпь, пустулёзная сыпь, везикулёзная сыпь, эритематозная сыпь. В плацебо-контролируемых и с активным контролем клинических исследованиях (группа, получавшая дапаглифлозин: n=5936, контрольная группа: n=3403) частота развития сыпи была схожей у пациентов, получавших дапаглифлозин (1,4%), и пациентов в контрольной группе (1,4%), что соответствует категории частоты «часто».
* Отмечены у ≥ 2% пациентов, принимавших дапаглифлозин в дозе 10 мг, и на ≥ 1% чаще, чем в группе плацебо.
** Отмечены у ≥ 0,2% пациентов и на ≥ 0,1% чаще и у большего количества пациентов (как минимум на 3) в группе дапаглифлозина 10 мг по сравнению с группой плацебо, вне зависимости от приема дополнительного гипогликемического препарата.
Описание отдельных нежелательных реакций
Вулъвовагинит, баланит и связанные с ними генитальные инфекции
В объединенных данных по безопасности 13 исследований вульвовагинит, баланит и связанные с ними генитальные инфекции отмечены у 5,5% и 0,6% пациентов, принимавших дапаглифлозин 10 мг и плацебо, соответственно. Большинство инфекций были слабо или умеренно выраженными; начальный курс стандартной терапии был эффективен, в связи с чем пациенты редко прекращали прием дапаглифлозина. Эти инфекции чаще развивались у женщин (8,4% и 1,2% при применении дапаглифлозина и плацебо, соответственно), а у пациентов с такими инфекциями в анамнезе они чаще рецидивировали.
В исследовании DECLARE количество пациентов с серьезными нежелательными явлениями в виде генитальных инфекций было небольшим и сбалансированным: по 2 (<0,1 %) пациента в группе дапаглифлозина и группе плацебо.
В исследовании DAPA-HF не было пациентов с серьезными нежелательными явлениями в виде генитальных инфекций в группе дапаглифлозина, в группе плацебо серьезное нежелательное явление зарегистрировано у 1 пациента. В группе дапаглифлозина у 7 (0,3%) пациентов были отмечены нежелательные явления, приводившие к прекращению лечения ввиду генитальных инфекций, и ни у одного пациента в группе плацебо.
В исследовании DAPA-CKD было 3 (0,1%) пациента с серьезными нежелательными явлениями в виде генитальных инфекций в группе дапаглифлозина и ни одного пациента с такими явлениями в группе плацебо. В группе дапаглифлозина у 3 (0,1%) пациентов отмечены нежелательные явления, приводившие к прекращению лечения из-за генитальных инфекций, а в группе плацебо пациентов с такими явлениями не было. О развитии серьезных нежелательных явлений и нежелательных явлений, приводивших к прекращению лечения из-за генитальных инфекций, у пациентов без сахарного диабета не сообщалось.
Некротизирующий фасциит промежности (гангрена Фурнье)
Сообщалось о пострегистрационных случаях развития гангрены Фурнье у пациентов, принимающих ингибиторы SGLT2, включая дапаглифлозин (см. раздел «Особые указания»).
В исследовании DECLARE у 17160 пациентов с СД2 и медианой воздействия 48 месяцев всего было зарегистрировано 6 случаев гангрены Фурнье: один в группе, получавшей дапаглифлозин, и 5 в группе плацебо.
Гипогликемия
Частота развития гипогликемии зависела от типа базовой терапии, используемой в клинических исследованиях СД2.
В исследованиях дапаглифлозина в качестве монотерапии, комбинированной терапии с метформином продолжительностью до 102 недель частота развития эпизодов легкой гипогликемии была схожей (< 5%) в группах лечения, включая плацебо. Во всех исследованиях эпизоды тяжелой гипогликемии отмечены нечасто, и их частота была сопоставима между группой дапаглифлозина и плацебо. В исследованиях дапаглифлозина в качестве добавления к препарату сульфонилмочевины или препарату инсулина отмечена более высокая частота гипогликемии (см. раздел «Взаимодействие с другими лекарственными средствами»). В исследовании дапаглифлозина 10 мг, назначаемого одновременно с эксенатидом пролонгированного действия (на фоне применения метформина), не отмечено эпизодов тяжелой или легкой гипогликемии.
В исследовании DECLARE не отмечено повышенного риска развития тяжелой гипогликемии при терапии дапаглифлозином по сравнению с плацебо. Тяжелая гипогликемия зарегистрирована у 58 (0,7%) пациентов, получавших дапаглифлозин, и у 83 (1,0%) пациентов, получавших плацебо.
В исследовании DAPA-HF тяжелая гипогликемия зарегистрирована у 4 (0,2%) пациентов как в группе дапаглифлозина, так и в группе плацебо и наблюдалась только у пациентов с СД2.
В исследовании DAPA-CKD тяжелая гипогликемия зарегистрирована у 14 (0,7%) пациентов в группе дапаглифлозина и у 28 (1,3%) пациентов в группе плацебо и наблюдалась только у пациентов с СД2.
Снижение ОЦК
В объединенных данных по безопасности 13 исследований нежелательные реакции, указывающие на снижение ОЦК (включая сообщения об обезвоживании, гиповолемии или артериальной гипотензии), отмечены у 1,1% и 0,7% пациентов, принимавших дапаглифлозин 10 мг и плацебо, соответственно; серьезные нежелательные реакции отмечены у < 0,2% пациентов, и они были сопоставимы в группах дапаглифлозина 10 мг и плацебо (см. раздел «Особые указания»).
В исследовании DECLARE количество пациентов с явлениями, указывающими на снижение ОЦК, было сбалансировано между группами лечения: 213 (2,5%) и 207 (2,4%) в группах дапаглифлозина и плацебо, соответственно. Серьезные нежелательные явления были зарегистрированы у 81 (0,9%) и 70 (0,8%) пациентов в группе дапаглифлозина и плацебо, соответственно. Явления в целом были сбалансированы между группами лечения по возрастным категориям, применению диуретиков, артериальному давлению и применению ингибитора ангиотензинпревращающего фермента/блокатора рецепторов ангиотензина. Среди пациентов с исходной рСКФ < 60 мл/мин/1,73 м2 в группе дапаглифлозина отмечено 19 случаев серьезных нежелательных явлений, указывающих на снижение ОЦК, и 13 — в группе плацебо.
В исследовании DAPA-HF количество пациентов с явлениями, указывающими на снижение ОЦК, было сбалансировано между группами лечения: 170 (7,2%) и 153 (6,5%) в группах дапаглифлозина и плацебо, соответственно. В группе дапаглифлозина было меньше пациентов с серьезными явлениями в виде симптомов, указывающих на снижение ОЦК, по сравнению с группой плацебо: 23 (1,0%) и 38 (1,6%) пациентов, соответственно. Схожие результаты наблюдались при анализе в подгруппах по возрасту, наличию сахарного диабета исходно, исходному значению рСКФ и САД.
В исследовании DAPA-CKD количество пациентов с явлениями, указывающими на снижение ОЦК, составило 120 (5,6%) в группе дапаглифлозина и 84 (3,9%) в группе плацебо. В группе дапаглифлозина у 16 (0,7%) пациентов отмечены серьезные явления в виде симптомов, указывающих на снижение ОЦК, и у 15 (0,7%) пациентов в группе плацебо.
Диабетический кетоацидоз при СД2
В исследовании DECLARE с медианой воздействия 48 месяцев явления диабетического кетоацидоза были зарегистрированы у 27 пациентов в группе дапаглифлозина 10 мг и 12 пациентов в группе плацебо. Данные явления возникали равномерно в течение периода исследования. В группе дапаглифлозина из 27 пациентов с диабетическим кетоацидозом 22 получали сопутствующую инсулинотерапию на момент развития явления. Предрасполагающие к развитию диабетического кетоацидоза факторы были ожидаемыми для популяции с СД2 (см. раздел «Особые указания»).
В исследовании DAPA-HF явления диабетического кетоацидоза были зарегистрированы у 3 пациентов с СД2 в группе дапаглифлозина и ни у одного пациента в группе плацебо.
В исследовании DAPA-CKD явления диабетического кетоацидоза не зарегистрированы ни у одного пациента в группе дапаглифлозина, но отмечались у 2 пациентов с СД2 в группе плацебо.
Инфекции мочевыводящих путей
В объединенных данных по безопасности 13 исследований инфекции мочевыводящих путей чаще отмечены при применении дапаглифлозина 10 мг, чем при применении плацебо (4,7% по сравнению с 3,5%, соответственно; см. раздел «Особые указания»). Большинство инфекций были слабо или умеренно выраженными; начальный курс стандартной терапии был эффективен, в связи с чем пациенты редко прекращали применение дапаглифлозина. Эти инфекции чаще развивались у женщин, а у пациентов с такими инфекциями в анамнезе они чаще рецидивировали.
В исследовании DECLARE серьезные случаи инфекций мочевыводящих путей регистрировались менее часто для дапаглифлозина 10 мг по сравнению с плацебо: 79 (0,9%) явлений по сравнению с 109 (1,3%) явлениями, соответственно.
В исследовании DAPA-HF количество пациентов с серьезными нежелательными явлениями в виде инфекций мочевыводящих путей было небольшим и сбалансированным: 14 (0,6%) пациентов в группе дапаглифлозина и 17 (0,7%) пациентов в группе плацебо. В группе дапаглифлозина и плацебо было по 5 (0,2%) пациентов с нежелательными явлениями, приводившими к прекращению лечения ввиду инфекций мочевыводящих путей.
В исследовании DAPA-CKD серьезные нежелательные явления в виде инфекций мочевыводящих путей отмечены у 29 (1,3%) пациентов в группе дапаглифлозина и у 18 (0,8%) пациентов в группе плацебо. В группе дапаглифлозина было 8 (0,4%) пациентов с нежелательными явлениями, приводившими к прекращению лечения из-за инфекций мочевыводящих путей, и 3 (0,1%) пациента в группе плацебо. Количество пациентов, у которых возникли серьезные нежелательные явления или нежелательные явления, приводившие к прекращению лечения из-за инфекций мочевыводящих путей, среди пациентов без диабета было небольшим и схожим между группами лечения (6 [0,9%] по сравнению с 4 [0,6%] для серьезных нежелательных явлений; 1 [0,1%] по сравнению с 0 для нежелательных явлений, приводивших к прекращению лечения).
Повышение концентрации креатинина
Нежелательные реакции, связанные с повышением концентрации креатинина, были сгруппированы (например, снижение почечного клиренса креатинина, нарушение функции почек, повышение концентрации креатинина в крови и снижение СКФ). В объединенных данных по безопасности 13 исследований данная группа реакций была отмечена у 3,2% и 1,8% пациентов, получавших дапаглифлозин 10 мг и плацебо, соответственно. У пациентов с нормальной функцией почек или нарушением функции почек легкой степени (исходно рСКФ ≥ 60 мл/мин/1,73 м2) эта группа реакций была зарегистрирована у 1,3% и 0,8% пациентов, получавших дапаглифлозин 10 мг и плацебо, соответственно. Эти реакции чаще отмечались у пациентов с исходной рСКФ ≥ 30 и < 60 мл/мин/1,73 м2 (18,5% в группе дапаглифлозина 10 мг по сравнению с 9,3% в группе плацебо).
Дополнительная оценка пациентов с нежелательными явлениями, связанными с функцией почек, показала, что у большинства этих пациентов отмечено изменение концентрации креатинина в сыворотке на ≤ 0,5 мг/дл относительно исходного значения. Повышение концентрации креатинина в целом было временным на фоне продолжения терапии или обратимым после прекращения терапии.
В исследовании DECLARE, включавшем пожилых пациентов и пациентов с нарушением функции почек (рСКФ менее 60 мл/мин/1,73 м2), рСКФ снижалась с течением времени в обеих группах лечения. Через 1 год терапии среднее значение рСКФ в группе дапаглифлозина было немного ниже, а через 4 года терапии — немного выше по сравнению с группой плацебо.
В исследовании DAPA-HF отмечено снижение среднего значения рСКФ, которое начально было более выраженным в группе дапаглифлозина по сравнению с группой плацебо. Через 20 месяцев изменение рСКФ относительно исходного значения было схожим между группами лечения.
В исследовании DAPA-CKD рСКФ снижалась с течением времени как в группе дапаглифлозина, так и в группе плацебо. Первоначальное (на 14 день) снижение средней рСКФ составило -4,0 мл/мин/1,73 м2 в группе дапаглифлозина и -0,8 мл/мин/1,73 м2 в группе плацебо. Через 28 месяцев изменение рСКФ относительно исходного значения составило -7,4 мл/мин/1,73 м2 в группе дапаглифлозина и -8,6 мл/мин/1,73 м2 в группе плацебо.
Передозировка
Дапаглифлозин безопасен и хорошо переносится здоровыми добровольцами при однократном приеме в дозах до 500 мг (в 50 раз выше рекомендуемой дозы). Глюкоза определялась в моче после приема препарата (как минимум, в течение 5 дней после приема дозы 500 мг), при этом не выявлены случаи обезвоживания, артериальной гипотензии, электролитного дисбаланса, клинически значимого влияния на интервал QTc. Частота развития гипогликемии была схожей с частотой при приеме плацебо. В клинических исследованиях у здоровых добровольцев и пациентов с СД2, принимавших препарат однократно в дозах до 100 мг (в 10 раз выше максимальной рекомендуемой дозы) в течение 2 недель, частота развития гипогликемии была немного выше, чем при приеме плацебо, и не зависела от дозы. Частота развития нежелательных явлений, включая обезвоживание или артериальную гипотензию, была схожей с частотой в группе плацебо, при этом не выявлено клинически значимых, дозозависимых изменений лабораторных показателей, включая сывороточную концентрацию электролитов и биомаркеров функции почек.
В случае передозировки необходимо проводить поддерживающую терапию, учитывая состояние пациента. Выведение дапаглифлозина с помощью гемодиализа не изучалось.
Взаимодействие с другими лекарственными средствами
Фармакодинамическое взаимодействие
Диуретики
Дапаглифлозин может усиливать диуретический эффект тиазидных и «петлевых» диуретиков и повышать риск развития обезвоживания и артериальной гипотензии (см. раздел «Особые указания»).
Инсулин и препараты, повышающие секрецию инсулина
На фоне применения инсулина и препаратов, повышающих секрецию инсулина, может возникать гипогликемия. Поэтому с целью снижения риска гипогликемии при совместном применении препарата Форсига с препаратом инсулина или препаратом, повышающим секрецию инсулина, может потребоваться снижение дозы препарата инсулина или препарата, повышающего секрецию инсулина (см. разделы «Способ применения и дозы» и «Побочное действие»).
Фармакокинетическое взаимодействие
Метаболизм дапаглифлозина, в основном, осуществляется посредством глюкуронидной конъюгации под действием UGT1A9.
В ходе исследований in vitro дапаглифлозин не ингибировал изоферменты системы цитохрома Р450 CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4, и не индуцировал изоферменты CYP1A2, CYP2B6 или CYP3A4. В связи с этим не ожидается влияния дапаглифлозина на метаболический клиренс сопутствующих препаратов, которые метаболизируются под действием этих изоферментов.
Влияние других лекарственных препаратов на дапаглифлозин
Исследования взаимодействий с участием здоровых добровольцев, в основном, принимавших однократную дозу препарата, показали, что метформин, пиоглитазон, ситаглиптин, глимепирид, воглибоза, гидрохлоротиазид, буметанид, валсартан или симвастатин не оказывают влияния на фармакокинетику дапаглифлозина.
После совместного применения дапаглифлозина и рифампицина, индуктора различных активных транспортеров и ферментов, метаболизирующих лекарственные препараты, отмечено снижение системной экспозиции (AUC) дапаглифлозина на 22%, при отсутствии клинически значимого влияния на суточное выведение глюкозы почками. Не рекомендуется корректировать дозу препарата. Клинически значимого влияния при применении с другими индукторами (например, карбамазепином, фенитоином, фенобарбиталом) не ожидается.
После совместного применения дапаглифлозина и мефенамовой кислоты (ингибитора UGT1A9) отмечено увеличение на 55% системной экспозиции дапаглифлозина, но без клинически значимого влияния на суточное выведение глюкозы почками. Не рекомендуется корректировать дозу препарата.
Влияние дапаглифлозина на другие лекарственные препараты
В исследованиях взаимодействий с участием здоровых добровольцев, в основном, однократно принимавших дозу препарата, дапаглифлозин не влиял на фармакокинетику метформина, пиоглитазона, ситаглиптина, глимепирида, гидрохлоротиазида, буметанида, валсартана, дигоксина (субстрат P-gp) или варфарина (S-варфарин, субстрат изофермента CYP2C9), или на антикоагуляционный эффект, оцениваемый по Международному нормализованному отношению (МНО). Применение однократной дозы дапаглифлозина 20 мг и симвастатина (субстрата изофермента CYP3A4) приводило к повышению на 19% AUC симвастатина и на 31% AUC симвастатиновой кислоты. Повышение экспозиции симвастатина и симвастатиновой кислоты не считается клинически значимым.
Другие взаимодействия
Влияние курения, диеты, приема растительных препаратов и употребления алкоголя на параметры фармакокинетики дапаглифлозина не изучалось.
Особые указания
Применение у пациентов с нарушением функции почек
Следует оценить функцию почек перед началом терапии препаратом Форсига и далее при наличии клинических показаний.
В исследования эффективности и безопасности препарата Форсига не включались пациенты с рСКФ менее 25 мл/мин/1,73 м2. Применение препарата Форсига противопоказано у пациентов, находящихся на гемодиализе.
Не рекомендуется применение препарата Форсига для улучшения гликемического контроля у взрослых пациентов с сахарным диабетом 2 типа с рСКФ менее 45 мл/мин/1,73 м2 ввиду возможной неэффективности препарата в данной популяции вследствие механизма фармакологического действия дапаглифлозина.
Применение препарата Форсига не рекомендуется для лечения хронической болезни почек у пациентов с поликистозом почек или у пациентов, которым требуется или которые недавно получали иммуносупрессивную терапию почечной недостаточности. Ожидается, что дапаглифлозин не будет эффективен у этих групп пациентов.
В одном исследовании у пациентов с СД2 с нарушением функции почек средней степени тяжести (рСКФ < 60 мл/мин/1,73 м2) нежелательные реакции в виде повышения концентрации паратиреоидного гормона и артериальной гипотензии в группе дапаглифлозина отмечались у большей доли пациентов, чем в группе плацебо.
Применение у пациентов с нарушениями функции печени
В клинических исследованиях получены ограниченные данные применения препарата у пациентов с нарушениями функции печени. Экспозиция дапаглифлозина увеличена у пациентов с нарушениями функции печени тяжелой степени (см. разделы «Способ применения и дозы», «С осторожностью» и «Фармакокинетика»).
Снижение ОЦК
Препарат Форсига может вызывать снижение ОЦК, которое иногда может проявляться в виде симптоматической артериальной гипотензии или острых транзиторных изменений концентрации креатинина. При пострегистрационном применении ингибиторов SGLT2, включая препарат Форсига, у пациентов с СД2 были отмечены случаи острого поражения почек, некоторые из которых потребовали госпитализации и проведения диализа. У пациентов с нарушением функции почек (рСКФ менее 60 мл/мин/1,73 м2), пациентов пожилого возраста или пациентов, принимающих «петлевые» диуретики, может отмечаться повышенный риск снижения ОЦК или артериальной гипотензии. Перед началом терапии препаратом Форсига у пациентов с одной или более из данных характеристик необходимо провести оценку ОЦК и функции почек. После начала терапии следует проводить наблюдение за пациентами для выявления возможных признаков и симптомов артериальной гипотензии, а также контролировать функцию почек.
Применение у пациентов с риском развития артериальной гипотензии
В соответствии с механизмом действия дапаглифлозин усиливает диурез, что может приводить к небольшому снижению артериального давления, отмеченному в клинических исследованиях (см. раздел «Фармакодинамика»). Диуретический эффект может быть более выраженным у пациентов с очень высокой концентрацией глюкозы в крови.
Следует соблюдать осторожность у пациентов, для которых вызванное дапаглифлозином снижение артериального давления может представлять риск, например, у пациентов, получающих гипотензивную терапию, с эпизодами гипотензии в анамнезе или у пожилых пациентов.
Кетоацидоз у пациентов с сахарным диабетом
Имеются сообщения о случаях кетоацидоза, в том числе диабетического кетоацидоза, у пациентов с сахарным диабетом 1 и 2 типа, принимающих препарат Форсига и другие ингибиторы SGLT2. Препарат Форсига не показан для лечения пациентов с сахарным диабетом 1 типа.
Принимающие препарат Форсига пациенты с признаками и симптомами, указывающими на кетоацидоз, включая тошноту, рвоту, боль в животе, недомогание и одышку, должны быть обследованы на наличие кетоацидоза, даже при концентрации глюкозы в крови ниже 14 ммоль/л. При подозрении на кетоацидоз следует рассмотреть возможность отмены или временного прекращения применения препарата Форсига, и немедленно провести обследование пациента.
Факторы, предрасполагающие к развитию кетоацидоза, включают низкую функциональную активность бета-клеток, обусловленную нарушением функции поджелудочной железы (например, сахарный диабет 1 типа, панкреатит или операция на поджелудочной железе в анамнезе), снижение дозы инсулина, снижение калорийности потребляемой пищи или повышенную потребность в инсулине вследствие инфекций, заболеваний или хирургического вмешательства, а также злоупотребления алкоголем. Препарат Форсига следует применять с осторожностью у этих пациентов.
Некротизирующий фасциит промежности (гангрена Фурнье)
Сообщалось о пострегистрационных случаях некротизирующего фасциита промежности (гангрены Фурнье) у женщин и мужчин, принимающих ингибиторы SGLT2 (см. раздел «Побочное действие»). Это редкое, потенциально серьезное и угрожающее жизни заболевание, которое требует неотложного хирургического вмешательства и применения антибиотиков. Пациенту рекомендуется обратиться к врачу в том случае, если у него появились симптомы боли, чувствительности при прикосновении, эритема или отек в генитальной области или области промежности, которые сопровождаются лихорадкой и недомоганием. Известно, что либо урогенитальная инфекция, либо абсцесс промежности могут предшествовать некротизирующему фасцииту.
В том случае, если имеется подозрение на гангрену Фурнье, применение препарата Форсига должно быть прекращено и начато незамедлительное лечение (включая антибиотики и хирургическую обработку).
Инфекции мочевыводящих путей
У пациентов, принимающих ингибиторы SGLT2, включая препарат Форсига, были отмечены случаи серьезных инфекций мочевыводящих путей, включая уросепсис и пиелонефрит, которые потребовали госпитализации. Терапия ингибиторами SGLT2 увеличивает риск инфекций мочевыводящих путей. Следует наблюдать за пациентами для выявления возможных признаков и симптомов инфекций мочевыводящих путей и, при наличии показаний, незамедлительно начинать лечение (см. раздел «Побочное действие»). При лечении пиелонефрита или уросепсиса следует рассмотреть возможность временной отмены терапии дапаглифлозином.
Ампутация нижних конечностей
Увеличение случаев ампутации нижних конечностей (в первую очередь пальцев стопы) наблюдалось в продолжающихся в настоящее время длительных клинических исследованиях при СД2 с применением другого ингибитора SGLT2. Неизвестно, является ли это эффектом препаратов класса SGLT2. Пациентам с сахарным диабетом, принимающим ингибиторы SGLT2, важно рекомендовать постоянный профилактический уход за стопами.
Хроническая сердечная недостаточность
Опыт применения дапаглифлозина у пациентов с хронической сердечной недостаточностью IV функционального класса по классификации NYHA ограничен.
Оценки результатов анализа мочи
Вследствие механизма действия препарата результаты анализа мочи на глюкозу у пациентов, принимающих препарат Форсига, будут положительными.
Влияние на определение 1,5-ангидроглюцитола
Оценка гликемического контроля с помощью определения 1,5-ангидроглюцитола не рекомендуется, поскольку измерение 1,5-ангидроглюцитола является ненадежным методом для пациентов, принимающих ингибиторы SGLT2. Для оценки гликемического контроля следует использовать альтернативные методы.
Гипогликемия на фоне сопутствующего применения инсулина и стимуляторов секреции инсулина
Инсулин и стимуляторы секреции инсулина могут вызывать развитие гипогликемии. Препарат Форсига может повышать риск гипогликемии при применении в комбинации с инсулином или стимуляторами секреции инсулина (см. раздел «Побочное действие»). Может потребоваться снижение дозы инсулина или стимулятора секреции инсулина для уменьшения риска гипогликемии при их сопутствующем применении с препаратом Форсига.
Грибковые генитальные инфекции
Препарат Форсига повышает риск развития грибковых генитальных инфекций. Пациенты с грибковыми генитальными инфекциями в анамнезе более склонны к развитию данных инфекций (см. раздел «Побочное действие»). Следует контролировать состояние пациентов и проводить соответствующее лечение в случае таких инфекций.
Влияние на способность управлять транспортными средствами и механизмами
Исследований по изучению влияния дапаглифлозина на способность к управлению транспортными средствами и механизмами не проводилось.
Форма выпуска
Таблетки, покрытые плёночной оболочкой, 5 мг, 10 мг.
Для таблеток 5 мг:
(при производстве на предприятии АстраЗенека Фармасьютикалс ЛП, США):
по 10 таблеток в перфорированном блистере из алюминиевой фольги; по 3 перфорированных блистера с инструкцией по применению в картонной пачке с контролем первого вскрытия.
Для таблеток 10 мг:
(при производстве на предприятии АстраЗенека Фармасьютикалс ЛП, США):
по 10 таблеток в перфорированном блистере из алюминиевой фольги; по 3 перфорированных блистера с инструкцией по применению в картонной пачке с контролем первого вскрытия.
(при производстве на предприятии ООО «АстраЗенека Индастриз», Россия):
по 10 таблеток в блистере из алюминиевой фольги; по 3 блистера или 9 блистеров с инструкцией по применению в картонной пачке с контролем первого вскрытия.
Условия хранения
При температуре не выше 30°C. Хранить в недоступном для детей месте.
Срок годности
3 года. Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Владелец (держатель) регистрационного удостоверения
АстраЗенека ЮК Лимитед, 1 Френсис Крик Авеню, Кембридж Биомедикал Кампус, Кембридж, Великобритания СВ2 0AA
AstraZeneca UK Limited, 1 Francis Crick Avenue, Cambridge Biomedical Campus, Cambridge, United Kingdom CB2 0AA
Производитель
Производство готовой лекарственной формы
1. АстраЗенека Фармасьютикалс ЛП, 4601 Хайуэй 62 Ист, Маунт Вернон, Индиана, 47620, США
AstraZeneca Pharmaceuticals LP, 4601 Highway 62 East, Mount Vernon, Indiana, 47620, USA
2. ООО «АстраЗенека Индастриз»
249006, Россия, Калужская область, Боровский район, деревня Добрино, 1-ый Восточный проезд, владение 8
Фасовщик (первичная упаковка), упаковщик (вторичная (потребительская) упаковка), выпускающий контроль качества
1. АстраЗенека ЮК Лимитед, Силк Роуд Бизнес Парк, Макклсфилд, Чешир SK10 2NA, Великобритания
AstraZeneca UK Limited, Silk Road Business Park, Macclesfield, Cheshire SK10 2NA, United Kingdom
2. ООО «АстраЗенека Индастриз»
249006, Россия, Калужская область, Боровский район, деревня Добрино, 1-ый Восточный проезд, владение 8
Организация, принимающая претензии от потребителей
Представительство АстраЗенека ЮК Лимитед, Великобритания, в г. Москве и ООО АстраЗенека Фармасьютикалз
123100, г. Москва, 1-й Красногвардейский проезд, д. 21, стр. 1, этаж 30, комнаты 13 и 14
Купить Форсига в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Выберите тип аналогов (синонимов), чтобы получить список препаратов.
Аналоги по действующему веществу — препараты, которые содержат одно и то же активное вещество, но выпускаются под разными торговыми наименованиями.
Для того чтобы подобрать полный аналог по действующему веществу, необходимо также выбрать дозировку и лекарственную форму.
Аналоги по фармгруппе — препараты, которые содержат разные действующие вещества, но относятся к одной фармакологической группе и применяются по одинаковым
показаниям.
Аналоги по АТХ — препараты, относящиеся к одному уровню АТХ-классификации.
Лекарственная форма:
таблетки, покрытые плёночной оболочкой
Состав
Одна таблетка, покрытая плёночной оболочкой, 5 мг содержит:
Активное вещество:
дапаглифлозина пропандиола моногидрат 6,150 мг, в пересчёте на дапаглифлозин 5 мг
Вспомогательные вещества: целлюлоза микрокристаллическая 85,725 мг, лактоза безводная 25,000 мг, кросповидон 5,000 мг, кремния диоксид 1,875 мг, магния стеарат 1,250 мг;
Оболочка таблетки: Опадрай® II жёлтый 5,000 мг (поливиниловый спирт частично гидролизованный 2,000 мг, титана диоксид 1,177 мг, макрогол 3350 1,010 мг, тальк 0,740 мг, краситель оксид железа жёлтый 0,073 мг).
Одна таблетка, покрытая плёночной оболочкой, 10 мг содержит:
Активное вещество:
дапаглифлозина пропандиола моногидрат 12,30 мг, в пересчёте на дапаглифлозин 10 мг
Вспомогательные вещества: целлюлоза микрокристаллическая 171,45 мг, лактоза безводная 50,00 мг, кросповидон 10,00 мг, кремния диоксид 3,75 мг, магния стеарат 2,50 мг;
Оболочка таблетки: Опадрай® II жёлтый 10,00 мг (поливиниловый спирт частично гидролизованный 4,00 мг, титана диоксид 2,35 мг, макрогол 3350 2,02 мг, тальк 1,48 мг, краситель оксид железа жёлтый 0,15 мг).
Описание
Таблетки, покрытые плёночной оболочкой, 5 мг:
Круглые двояковыпуклые таблетки, покрытые плёночной оболочкой жёлтого цвета, с гравировкой «5» на одной стороне и «1427» на другой стороне.
Таблетки, покрытые плёночной оболочкой, 10 мг:
Ромбовидные двояковыпуклые таблетки, покрытые плёночной оболочкой жёлтого цвета, с гравировкой «10» на одной стороне и «1428» на другой стороне.
Фармакотерапевтическая группа
Гипогликемическое средство для перорального применения — ингибитор натрийзависимого переносчика глюкозы 2 типа
Код АТХ: А10ВХ09
Фармакологические свойства
Механизм действия
Дапаглифлозин — мощный (константа ингибирования (Ki) 0,55 нМ), селективный обратимый ингибитор натрий-глюкозного котранспортера 2-го типа (SGLT2). SGLT2 селективно экспрессируется в почках и не обнаруживается более чем в 70 других тканях организма (в том числе, в печени, скелетных мышцах, жировой ткани, молочных железах, мочевом пузыре и головном мозге). SGLT2 является основным переносчиком, участвующим в процессе реабсорбции глюкозы в почечных канальцах. Реабсорбция глюкозы в почечных канальцах у пациентов с сахарным диабетом 2 типа (СД2) продолжается, несмотря на гипергликемию. Тормозя почечный перенос глюкозы, дапаглифлозин снижает её реабсорбцию в почечных канальцах, что приводит к выведению глюкозы почками. Результатом действия дапаглифлозина является снижение концентрации глюкозы натощак и после приема пищи, а также снижение концентрации гликозилированного гемоглобина у пациентов с СД2.
Выведение глюкозы (глюкозурический эффект) наблюдается уже после приема первой дозы препарата, сохраняется в течение последующих 24 часов и продолжается на протяжении всей терапии. Количество глюкозы, выводимой почками за счет этого механизма, зависит от концентрации глюкозы в крови и от скорости клубочковой фильтрации (СКФ). Дапаглифлозин не нарушает нормальную продукцию эндогенной глюкозы в ответ на гипогликемию. Действие дапаглифлозина не зависит от секреции инсулина и чувствительности к инсулину. В клинических исследованиях препарата Форсига™ отмечалось улучшение функции бета-клеток (тест НОМА, homeostasis model assessment).
Выведение глюкозы почками, вызванное дапаглифлозином, сопровождается потерей калорий и снижением массы тела. Ингибирование дапаглифлозином натрий-глюкозного котранспорта сопровождается слабым диуретическим и транзиторным натрийуретическим эффектами.
Дапаглифлозин не оказывает воздействия на другие переносчики глюкозы, осуществляющие транспорт глюкозы к периферическим тканям, и проявляет более чем в 1400 раз большую селективность к SGLT2, чем к SGLT1, основному транспортеру в кишечнике, отвечающему за всасывание глюкозы.
Фармакодинамика
После приема дапаглифлозина здоровыми добровольцами и пациентами с СД2 наблюдалось увеличение количества выводимой почками глюкозы. При приеме дапаглифлозина в дозе 10 мг/сутки в течение 12 недель пациентами с СД2 примерно 70 г глюкозы в сутки выделялось почками (что соответствует 280 ккал/сутки). У пациентов с СД2, принимавших дапаглифлозин в дозе 10 мг/сутки длительно (до 2 лет), выведение глюкозы поддерживалось на протяжении всего курса терапии.
Выведение глюкозы почками при применении дапаглифлозина также приводит к осмотическому диурезу и увеличению объема мочи. Увеличение объема мочи у пациентов с СД2, принимавших дапаглифлозин в дозе 10 мг/сутки, сохранялось в течение 12 недель и составляло примерно 375 мл/сутки. Увеличение объема мочи сопровождалось небольшим и транзиторным повышением выведения натрия почками, что не приводило к изменению концентрации натрия в сыворотке крови.
Фармакокинетика
Абсорбция
После приема внутрь дапаглифлозин быстро и полностью всасывается в желудочно-кишечном тракте и может приниматься как во время приема пищи, так и вне его. Максимальная концентрация дапаглифлозина в плазме крови (Стах) обычно достигается в течение 2 часов после приема натощак. Значения Сmах и AUC (площадь под кривой зависимости концентрации от времени) увеличиваются пропорционально дозе дапаглифлозина. Абсолютная биодоступность дапаглифлозина при приеме внутрь в дозе 10 мг составляет 78%. Прием пищи оказывал умеренное влияние на фармакокинетику дапаглифлозина у здоровых добровольцев. Прием пищи с высоким содержанием жиров снижал Стах дапаглифлозина на 50%, удлинял Ттах (время достижения максимальной концентрации в плазме) примерно на 1 час, но не влиял на AUC по сравнению с приемом натощак. Эти изменения не являются клинически значимыми.
Распределение
Дапаглифлозин примерно на 91% связывается с белками. У пациентов с различными заболеваниями, например, с нарушениями функции почек или печени, этот показатель не изменялся.
Метаболизм
Дапаглифлозин — С-связанный глюкозид, агликон которого связан с глюкозой углерод-углеродной связью, что обеспечивает его устойчивость в отношении глюкозидаз. Средний период полувыведения из плазмы крови (T½) у здоровых добровольцев составлял 12,9 часов после однократного приема дапаглифлозина внутрь в дозе 10 мг. Дапаглифлозин метаболизируется с образованием, главным образом, неактивного метаболита дапаглифлозин-3-О-глюкуронида.
После приема внутрь 50 мг 14С-дапаглифлозина 61% принятой дозы метаболизируется в дапаглифлозин-3-О-глюкуронид, на долю которого приходится 42% общей плазменной радиоактивности (по AUC0-12 ч)- На долю неизмененного препарата приходится 39% общей плазменной радиоактивности. Доли остальных метаболитов по отдельности не превышают 5% общей плазменной радиоактивности. Дапаглифлозин-3-О-глюкуронид и другие метаболиты не оказывают фармакологического действия. Дапаглифлозин-3-О-глюкуронид формируется под действием фермента уридиндифосфат-глюкуронозилтрансферазы 1А9 (UGT1A9), присутствующего в печени и почках, изоферменты цитохрома CYP вовлечены в метаболизм в меньшей степени.
Выведение
Дапаглифлозин и его метаболиты выводятся, преимущественно, почками, и только менее 2% выводится в неизмененном виде. После приема 50 мг 14С-дапаглифлозина было обнаружено 96% радиоактивности — 75% в моче и 21% — в фекалиях. Примерно 15% радиоактивности, обнаруженной в фекалиях, приходилось на неизмененный дапаглифлозин.
Фармакокинетика в особых клинических ситуациях
Пациенты с нарушением функции почек
В равновесном состоянии (среднее значение AUC) системная экспозиция дапаглифлозина у пациентов с СД2 и почечной недостаточностью легкой, средней или тяжелой степени (определяемой по клиренсу йогексола) была на 32%, 60% и 87% выше, чем у больных с СД2 и нормальной функцией почек, соответственно. Количество глюкозы, выводимой почками в течение суток при приеме дапаглифлозина в равновесном состоянии, зависело от состояния функции почек. У пациентов с СД2 и нормальной функцией почек, и с почечной недостаточностью легкой, средней или тяжелой степени в сутки выводилось 85, 52, 18 и 11 г глюкозы, соответственно. Не выявлено различий в связывании дапаглифлозина с белками у здоровых добровольцев и у пациентов с почечной недостаточностью различной степени тяжести. Неизвестно, оказывает ли гемодиализ влияние на экспозицию дапаглифлозина.
Пациенты с нарушением функции печени
У пациентов с печеночной недостаточностью легкой или средней степени тяжести средние значения Сmах и AUC дапаглифлозина были, соответственно, на 12% и 36% выше по сравнению со здоровыми добровольцами. Данные различия не являются клинически значимыми, поэтому корректировки дозы дапаглифлозина при печеночной недостаточности легкой и средней степени тяжести не требуется (см. раздел «Способ применения и дозы»), У пациентов с печеночной недостаточностью тяжелой степени (класс С по Чайлд-Пью) средние значения Сmах и AUC дапаглифлозина были на 40% и 67% выше, соответственно, по сравнению со здоровыми добровольцами.
Пациенты пожилого возраста (>65 лет)
Не отмечалось клинически значимого увеличения экспозиции у пациентов в возрасте до 70 лет (если не учитывать другие факторы, помимо возраста). Тем не менее, можно ожидать увеличения экспозиции за счет снижения функции почек, связанного с возрастом. Данные об экспозиции у пациентов в возрасте старше 70 лет недостаточны.
Пол
У женщин среднее значение AUC в равновесном состоянии на 22% превышает аналогичный показатель у мужчин.
Расовая принадлежность
Клинически значимых различий системной экспозиции у представителей европеоидной, негроидной и монголоидной рас не выявлено.
Масса тела
Отмечены более низкие значения экспозиции при повышенной массе тела. Поэтому у пациентов с низкой массой тела может отмечаться некоторое повышение экспозиции, а у пациентов с повышенной массой тела — снижение экспозиции дапаглифлозина. Однако данные различия не являются клинически значимыми.
Показания к применению
Сахарный диабет 2 типа в дополнение к диете и физическим упражнениям для улучшения гликемического контроля в качестве:
монотерапии;
добавления к терапии метформином при отсутствии адекватного гликемического контроля на данной терапии;
стартовой комбинированной терапии с метформином, при целесообразности данной терапии.
Противопоказания
Повышенная индивидуальная чувствительность к любому компоненту препарата.
Сахарный диабет 1 -го типа.
Диабетический кетоацидоз.
Почечная недостаточность средней и тяжелой степени тяжести (СКФ <60 мл/мин/1,73 м2) или терминальная стадия почечной недостаточности.
Наследственная непереносимость лактозы, недостаточность лактазы и глюкозо-галактозная непереносимость.
Беременность и период грудного вскармливания.
Детский возраст до 18 лет (безопасность и эффективность не изучены).
Пациенты, принимающие «петлевые» диуретики (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды лекарственного взаимодействия»), или со сниженным объемом циркулирующей крови, например, вследствие острых заболеваний (таких как желудочно-кишечные заболевания).
Пожилые пациенты в возрасте 75 лет и старше (для начала терапии).
С осторожностью:
печеночная недостаточность тяжелой степени, инфекции мочевыделительной системы, риск снижения объема циркулирующей крови, пожилые пациенты, хроническая сердечная недостаточность, повышенное значение гематокрита.
Применение во время беременности и в период грудного вскармливания
В связи с тем, что применение дапаглифлозина в период беременности не изучено, препарат противопоказан в период беременности. В случае диагностирования беременности терапия дапаглифлозином должна быть прекращена.
Неизвестно, проникает ли дапаглифлозин и/или его неактивные метаболиты в грудное молоко. Нельзя исключить риск для новорожденных/младенцев. Дапаглифлозин противопоказан в период грудного вскармливания.
Способ применения и дозы
Внутрь, независимо от приёма пищи.
Монотерапия: рекомендуемая доза препарата Форсига™ составляет 10 мг один раз в сутки.
Комбинированная терапия: рекомендуемая доза препарата Форсига™ составляет 10 мг один раз в сутки в комбинации с метформином.
Стартовая комбинированная терапия с метформином: рекомендуемая доза препарата Форсига™ составляет 10 мг один раз в сутки, доза метформина — 500 мг один раз в сутки. В случае неадекватного гликемического контроля дозу метформина следует увеличить.
Применение у особых групп пациентов
Пациенты с нарушением функции печени
При нарушениях функции печени легкой или средней степени тяжести нет необходимости корректировать дозу препарата. Пациентам с нарушением функции печени тяжелой степени рекомендуется начальная доза препарата 5 мг. При хорошей переносимости доза может быть увеличена до 10 мг (см. разделы «Фармакокинетика» и «Особые указания»).
Пациенты с нарушением функции почек Эффективность дапаглифлозина зависит от функции почек, у пациентов с нарушениями функции почек средней степени тяжести эффективность лечения снижена, а у пациентов с нарушениями тяжелой степени — вероятнее всего, отсутствует. Препарат Форсига™ противопоказан пациентам с почечной недостаточностью средней и тяжелой степени (клиренс креатинина (КК) <60 мл/мин или СКФ <60 мл/мин/1,73 м2 ) или с терминальной стадией почечной недостаточности (см. разделы «Противопоказания», «Побочное действие» и «Особые указания»).
При нарушениях функции почек легкой степени нет необходимости корректировать дозу препарата.
Дети
Безопасность и эффективность дапаглифлозина у пациентов младше 18 лет не изучалась (см. раздел «Противопоказания»).
Пациенты пожилого возраста
У пациентов пожилого возраста нет необходимости корректировать дозу препарата. Однако при выборе дозы следует учитывать, что у этой категории пациентов более вероятны нарушение функции почек и риск снижения объема циркулирующей крови (ОЦК). Поскольку клинический опыт применения препарата у пациентов 75 лет и старше ограничен, противопоказано начинать терапию дапаглифлозином в данной возрастной группе.
Побочное действие
Краткий обзор профиля безопасности
В заранее запланированный анализ объединенных данных были включены результаты 12 плацебо-контролируемых исследований, в которых 1193 пациента принимали дапаглифлозин в дозе 10 мг и 1393 пациента получали плацебо.
Общая частота развития нежелательных явлений (краткосрочная терапия) у пациентов, принимавших дапаглифлозин в дозе 10 мг, была схожей с таковой в группе плацебо. Количество нежелательных явлений, приведших к отмене терапии, было небольшим и сбалансированным между группами лечения. Наиболее частыми нежелательными явлениями, приводившими к отмене терапии дапаглифлозином в дозе 10 мг, были повышение концентрации креатинина в крови (0,4%), инфекции мочевыводящих путей (0,3%), тошнота (0,2%), головокружение (0,2%) и сыпь (0,2%). У одного пациента, принимавшего дапаглифлозин, отмечено развитие нежелательного явления со стороны печени с диагнозом лекарственный гепатит и/или аутоиммунный гепатит.
Наиболее частой нежелательной реакцией была гипогликемия, развитие которой зависело от типа базовой терапии, используемой в каждом исследовании. Частота развития эпизодов легкой гипогликемии была схожей в группах лечения, включая плацебо.
Описание отдельных нежелательных реакций
Гипогликемия
Частота развития гипогликемии зависела от типа базовой терапии, используемой в каждом исследовании.
В исследованиях дапаглифлозина в качестве монотерапии, комбинированной терапии с метформином продолжительностью до 102 недель частота развития эпизодов легкой гипогликемии была схожей (<5%) в группах лечения, включая плацебо. Во всех исследованиях эпизоды тяжелой гипогликемии отмечены нечасто, и их частота была сопоставима между группой дапаглифлозина и плацебо.
Снижение ОЦК
Нежелательные реакции, связанные со снижением ОЦК (включая сообщения об обезвоживании, гиповолемии или артериальной гипотензии), отмечены у 0,8% и 0,4% пациентов, принимавших дапаглифлозин 10 мг и плацебо, соответственно; серьёзные реакции отмечены у <0,2% пациентов, и они были сопоставимы в группах дапаглифлозина 10 мг и плацебо (см. раздел «Особые указания»).
Вульвовагинит, баланит и подобные инфекции половых органов
Вульвовагинит, баланит и подобные инфекции половых органов отмечены у 4,8% и 0,9% пациентов, принимавших дапаглифлозин 10 мг и плацебо, соответственно. Большинство инфекций были слабо или умеренно выраженными; начальный курс стандартной терапии был эффективен, в связи с чем пациенты редко прекращали прием дапаглифлозина. Эти инфекции чаще развивались у женщин (6,9% и 1,5% при применении дапаглифлозина и плацебо, соответственно), а у пациентов с такими инфекциями в анамнезе они чаще рецидивировали.
Инфекции мочевыводящих путей
Инфекции мочевыводящих путей чаще отмечены при применении дапаглифлозина 10 мг, чем при применении плацебо (4,3% по сравнению с 3,7%, соответственно; см. раздел «Особые указания»). Большинство инфекций были слабо или умеренно выраженными; начальный курс стандартной терапии был эффективен, в связи с чем пациенты редко прекращали применение дапаглифлозина. Эти инфекции чаще развивались у женщин, а у пациентов с такими инфекциями в анамнезе они чаще рецидивировали.
Паратиреоидный гормон (ПТГ)
Отмечено небольшое повышение концентрации ПТГ в сыворотке крови, и в большей степени у пациентов с более высокими исходными концентрациями ПТГ. Исследования минеральной плотности костной ткани у пациентов с нормальной функцией почек или нарушением функции почек легкой степени не выявили потери костной массы в течение одного года терапии.
Злокачественные опухоли
В клинических исследованиях общая доля пациентов со злокачественными или неуточненными опухолями была схожей в группе дапаглифлозина (1,47%) и группе плацебо/препарата сравнения (1,35%). Согласно данным исследований на животных препарат не проявлял канцерогенных или мутагенных свойств. При рассмотрении случаев развития опухолей различных систем органов, относительный риск, ассоциировавшийся с дапаглифлозином, был выше 1 для некоторых опухолей (мочевой пузырь, предстательная железа, молочная железа) и ниже 1 для других (например, кровь и лимфатическая система, яичники, мочевыделительная система), в целом без повышения риска развития опухолей, ассоциируемого с дапаглифлозином. Повышенный/пониженный риск не был статистически значимым ни для одной системы органов. Учитывая отсутствие в доклинических исследованиях сведений о развитии опухолей, а также короткий латентный период между первой экспозицией препарата и диагностикой опухоли, причинно-следственная связь оценивается как маловероятная. Так как численный дисбаланс опухолей молочной железы, мочевого пузыря и предстательной железы требует особого внимания, изучение этого вопроса будет продолжено в рамках пострегистрационных исследований.
Пожилые пациенты (>65 лет)
Нежелательные реакции, связанные с нарушением функции почек или почечной недостаточностью, зарегистрированы у 2,5% пациентов, получавших дапаглифлозин, и у 1,1% больных, получавших плацебо, в группе пациентов >65 лет (см. раздел «Особые указания»). Наиболее частой нежелательной реакцией, связанной с нарушением функции почек, было повышение концентрации креатинина в сыворотке. Большинство этих реакций было транзиторными и обратимыми. Среди пациентов в возрасте >65 лет снижение ОЦК, наиболее часто регистрировавшееся как артериальная гипотензия, отмечено у 1,5% и 0,4% пациентов, принимавших дапаглифлозин и плацебо, соответственно (см. раздел «Особые указания»),
Передозировка
Дапаглифлозин безопасен и хорошо переносится здоровыми добровольцами при однократном приеме в дозах до 500 мг (в 50 раз выше рекомендуемой дозы). Глюкоза определялась в моче после приема препарата (как минимум, в течение 5 дней после приема дозы 500 мг), при этом не выявлены случаи обезвоживания, гипотонии, электролитного дисбаланса, клинически значимого влияния на интервал QTc. Частота развития гипогликемии была схожей с частотой при приеме плацебо. В клинических исследованиях у здоровых добровольцев и пациентов с СД2, принимавших препарат однократно в дозах до 100 мг (в 10 раз выше максимальной рекомендуемой дозы) в течение 2 недель, частота развития гипогликемии была немного выше, чем при приеме плацебо, и не зависела от дозы. Частота развития нежелательных явлений, включая обезвоживание или артериальную гипотензию, была схожей с частотой в группе плацебо, при этом не выявлено клинически значимых, дозозависимых изменений лабораторных показателей, включая сывороточную концентрацию электролитов и биомаркеров функции почек.
В случае передозировки необходимо проводить поддерживающую терапию, учитывая состояние больного. Выведение дапаглифлозина с помощью гемодиализа не изучалось.
Взаимодействие с другими лекарственными препаратами
Диуретики
Дапаглифлозин может усиливать диуретический эффект тиазидных и «петлевых» диуретиков и повышать риск развития обезвоживания и артериальной гипотензии (см. раздел «Особые указания»).
Фармакокинетическое взаимодействие
Метаболизм дапаглифлозина, в основном, осуществляется посредством глюкуронидной конъюгации под действием UGT1A9.
В ходе исследований in vitro дапаглифлозин не ингибировал изоферменты системы цитохрома Р450 CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4, и не индуцировал изоферменты CYP1A2, CYP2B6 или CYP3A4. В связи с этим не ожидается влияния дапаглифлозина на метаболический клиренс сопутствующих препаратов, которые метаболизируются под действием этих изоферментов.
Влияние других лекарственных препаратов на дапаглифлозин
Исследования взаимодействий с участием здоровых добровольцев, в основном, принимавших однократную дозу препарата, показали, что метформин, пиоглитазон, ситаглиптин, глимепирид, воглибоза, гидрохлоротиазид, буметанид, валсартан или симвастатин не оказывают влияния на фармакокинетику дапаглифлозина. После совместного применения дапаглифлозина и рифампицина, индуктора различных активных транспортеров и ферментов, метаболизирующих лекарственные препараты, отмечено снижение системной экспозиции (AUC) дапаглифлозина на 22%, при отсутствии клинически значимого влияния на суточное выведение глюкозы почками. Не рекомендуется корректировать дозу препарата. Клинически значимого влияния при применении с другими индукторами (например, карбамазепином, фенитоином, фенобарбиталом) не ожидается.
После совместного применения дапаглифлозина и мефенамовой кислоты (ингибитора UGT1A9) отмечено увеличение на 55% системной экспозиции дапаглифлозина, но без клинически значимого влияния на суточное выведение глюкозы почками. Не рекомендуется корректировать дозу препарата.
Влияние дапаглифлозина на другие лекарственные препараты
В исследованиях взаимодействий с участием здоровых добровольцев, в основном, однократно принимавших дозу препарата, дапаглифлозин не влиял на фармакокинетику метформина, пиоглитазона, ситаглиптина, глимепирида, гидрохлоротиазида, буметанида, валсартана, дигоксина (субстрат P-gp) или варфарина (S-варфарин, субстрат изофермента CYP2C9), или на антикоагуляционный эффект, оцениваемый по Международному нормализованному отношению (MHO). Применение однократной дозы дапаглифлозина 20 мг и симвастатина (субстрата изофермента CYP3A4) приводило к повышению на 19% AUC симвастатина и на 31% AUC симвастатиновой кислоты. Повышение экспозиции симвастатина и симвастатиновой кислоты не считается клинически значимым.
Другие взаимодействия
Влияние курения, диеты, приема растительных препаратов и употребления алкоголя на параметры фармакокинетики дапаглифлозина не изучалось.
Особые указания
Применение у пациентов с нарушениями функции почек
Эффективность дапаглифлозина зависит от функции почек, и эта эффективность снижена у пациентов с почечной недостаточностью средней степени тяжести и, вероятно, отсутствует у больных с нарушением функции почек тяжелой степени (см. раздел «Способ применения и дозы»). Среди пациентов с почечной недостаточностью средней степени тяжести (КК<60 мл/мин или оцениваемая СКФ<60 мл/мин/1,73 м2), у большей доли больных, получавших дапаглифлозин, отмечено повышение уровня креатинина, фосфора, паратиреоидного гормона и артериальная гипотензия, чем у пациентов, получавших плацебо. Препарат Форсига™ противопоказан пациентам с почечной недостаточностью средней или тяжелой степени (КК<60 мл/мин или оцениваемая СКФ<60 мл/мин/1,73 м2). Препарат Форсига™ не изучали при почечной недостаточности тяжелой степени (КК<30 мл/мин или оцениваемая СКФ<30 мл/мин/1,73 м2) или терминальной стадии почечной недостаточности.
Рекомендуется проводить мониторинг функции почек следующим образом:
до начала терапии дапаглифлозином и не реже раза в год впоследствии (см. разделы «Способ применения и дозы», «Побочное действие», «Фармакодинамика» и « Фармакокинетика»);
до начала приема сопутствующих лекарственных препаратов, которые могут снизить функцию почек, и периодически впоследствии;
при нарушении функции почек, близкому к средней степени тяжести, по крайней мере 2-4 раза в год. При снижении функции почек ниже значения КК<60 мл/мин или оцениваемой СКФ<60 мл/мин/1,73 м2, необходимо прекратить прием дапаглифлозина.
Применение у пациентов с нарушениями функции печени
В клинических исследованиях получены ограниченные данные применения препарата у пациентов с нарушениями функции печени. Экспозиция дапаглифлозина увеличена у пациентов с нарушениями функции печени тяжелой степени (см. разделы «Способ применения и дозы», «С осторожностью» и «Фармакокинетика»),
Применение у пациентов с риском снижения ОЦК, развития артериальной гипотензии и/или нарушения электролитного баланса
В соответствии с механизмом действия дапаглифлозин усиливает диурез, сопровождающийся небольшим снижением артериального давления (см. раздел «Фармакодинамика»), Диуретический эффект может быть более выраженным у пациентов с очень высокой концентрацией глюкозы в крови.
Дапаглифлозин противопоказан пациентам, принимающим «петлевые» диуретики (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды лекарственного взаимодействия»), или пациентам со сниженным О ЦК, например, вследствие острых заболеваний (таких как желудочно-кишечные заболевания). Следует соблюдать осторожность у пациентов, для которых вызванное дапаглифлозином снижение артериального давления может представлять риск, например, у пациентов с сердечно-сосудистыми заболеваниями в анамнезе, у пациентов с артериальной гипотензией в анамнезе, получающих антигипертензивную терапию, или у пожилых пациентов.
При приеме дапаглифлозина рекомендуется тщательный мониторинг состояния ОЦК и концентрации электролитов (например, физикальный осмотр, измерение артериального давления, лабораторные анализы, включая гематокрит) на фоне сопутствующих состояний, которые могут приводить к снижению ОЦК. При снижении ОЦК рекомендуется временное прекращение приема дапаглифлозина до коррекции этого состояния (см. раздел «Побочное действие»).
Инфекции мочевыводящих путей
При анализе объединенных данных применения дапаглифлозина до 24 недель инфекции мочевыводящих путей чаще отмечены при применении дапаглифлозина в дозе 10 мг по сравнению с плацебо (см. раздел «Побочное действие»). Развитие пиелонефрита отмечали нечасто, со схожей частотой в контрольной группе. Выведение глюкозы почками может сопровождаться повышенным риском развития инфекций мочевыводящих путей, поэтому при лечении пиелонефрита или уросепсиса следует рассмотреть возможность временной отмены терапии дапаглифлозином (см. раздел «Побочное действие»).
Пожилые пациенты
У пожилых пациентов более вероятно нарушение функции почек и/или применение антигипертензивных лекарственных средств, которые могут влиять на функцию почек, такие как ингибиторы ангиотензинпревращающего фермента (иАПФ) и антагонисты рецепторов ангиотензина II 1 типа (АРА). Для пожилых пациентов применимы те же рекомендации при нарушении функции почек, как и для всех популяций пациентов (см. разделы «Способ применения и дозы», «Побочное действие»и «Фармакодинамика»), В группе >65 лет у большей доли пациентов, получавших дапаглифлозин, развились нежелательные реакции, связанные с нарушением функции почек или почечной недостаточностью по сравнению с плацебо. Наиболее частой нежелательной реакцией, связанной с нарушением функции почек, было повышение концентрации креатинина в сыворотке крови, большинство случаев было транзиторными и обратимыми (см. раздел «Побочное действие»).
У пожилых пациентов риск снижения ОЦК может быть выше, и более вероятен прием диуретиков. Среди пациентов в возрасте >65 лет у большей доли больных, получавших дапаглифлозин, отмечены нежелательные реакции, связанные со снижением ОЦК (см. раздел «Побочное действие»).
Опыт применения препарата у пациентов в возрасте 75 лет и старше ограничен. Противопоказано начинать терапию дапаглифлозином в этой популяции (см. разделы «Способ применения и дозы» и «Фармакокинетика»).
Хроническая сердечная недостаточность
Опыт применения препарата у пациентов с хронической сердечной недостаточностью I-II функционального класса по классификации NYHA ограничен, и в ходе клинических исследований дапаглифлозин не применялся у пациентов с хронической сердечной недостаточностью III-IV функционального класса по NYHA.
Повышение значения гематокрита
При применении дапаглифлозина наблюдалось повышение гематокрита (см. раздел «Побочное действие»), в связи с чем следует соблюдать осторожность у пациентов с повышенным значением гематокрита.
Оценки результатов анализа мочи
Вследствие механизма действия препарата результаты анализа мочи на глюкозу у пациентов, принимающих препарат Форсига™, будут положительными.
Влияние на способность к управлению транспортными средствами и механизмами
Исследований по изучению влияния дапаглифлозина на способность к управлению транспортными средствами и механизмами не проводилось.
Форма выпуска
Таблетки, покрытые плёночной оболочкой, 5 мг, 10 мг.
По 14 таблеток в блистере из алюминиевой фольги; по 2 или 4 блистера в картонной пачке с инструкцией по применению или по 10 таблеток в перфорированном блистере из алюминиевой фольги; по 3 или 9 перфорированных блистеров в картонной пачке с инструкцией по применению.
Места вскрытия картонной пачки заклеены двумя защитными прозрачными бесцветными стакерами; на среднюю часть каждого стакера, ограниченную линиями отрыва, нанесен рисунок в виде жёлтой сетки.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия хранения
При температуре не выше 30°С, в местах, недоступных для детей.
Хранить в недоступном для детей месте.
Условия отпуска
По рецепту.
Производитель
Бристол-Майерс Сквибб Мэнюфэкчуринг Компани, Пуэрто-Рико
Роад 3, Км. 77,5, а/я 609, Хумакао, PR-00791, Пуэрто-Рико
Bristol-Myers Squibb Manufacturing Company
Road 3, Km 77.5, Post Box 609, Humacao, PR-00791, Puerto Rico
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
Бристол-Майерс Сквибб Компани, США
345, Парк-авеню, г. Нью-Йорк, штат Нью-Йорк, США
Bristol-Myers Squibb Company, USA
345, Park Avenue, New York, New York, USA
Выпускающий контроль качества
Бристол-Майерс Сквибб С.р.Л., Италия
Лок. Фонтана дель Черазо, 03012, Ананьи (ФР), Италия
Bristol-Myers Squibb S.r.L.
Loc. Fontana del Ceraso, 03012, Anagni (FR), Italy