Медиаторный механизм транспорта электрона достаточно широко используется для проведения электрохимических ферментативных реакций. В работе 45] описан электрохимический процесс с участием лактатдегидрогеназы, флавинмононуклео-тида и феназинметасульфата в качестве медиаторов в работе i[12] проанализирована электрохимическая ионизация водорода на угольных электродах, катализируемая гидрогеназой в работе 47] исследованы эффекты ускорения ионизации кислорода в системе пероксидаза — ионы металла — гидрохинон — пи-рографитовый электрод. [c.76]
Синтетический краситель феназинметасульфат представляет собой наиболее активный акцептор водорода для растворимого фермента. Недавно осуществленная очистка фермента в значительной степени удалась потому, что для определения его активности выбрали именно этот краситель. [c.191]
Неоднократно было обнаружено, что феназинметасульфат служит наиболее эффективным акцептором водорода для флавопротеид-ных дегидрогеназ. Сукцинатдегидрогеназа тесно связана с митохондриальными мембранами, но она была переведена в растворимое состояние и получена в чистом виде из митохондрий сердца быка. Очищенные препараты содержали двухвалентное железо и 1 моль флавина на 1 моль белка. По-видимому, флавин связан с белком ковалентными связями. Сравнительно недавно из митохондрий растений были получены препараты растворимой сукцииатдегидро-геназы [14]. [c.191]
Кроме ФМН и витамина Кз, существует ряд других переносчиков водорода, катализирующих циклическое фотосинтетическое фосфорилирование. Наибольшая скорость фосфорилирования наблюдалась при использовании искусственного переносчика водорода — феназинметасульфата (ФМС). Активность ФМС, возможно, обусловлена его фотохимическим превращением в пиоцианин в присутствии кислорода. Высокая скорость циклического фотосинтетического фосфорилирования в присутствии ФМС является, вероятно, след- [c.265]
Для растворенного фермента лишь феназинметасульфат (N-метилфена-зинийметасульфат) и феррицианид калия представляют практический интерес как акцепторы электронов. Реакция (XIV.6) легко обратима и обеспечивает полное восстановление фумарата до сукцината, если используемый краситель обладает достаточно низким окислительно-восстановительным потенциалом (восстановленный ФМН, виологеновые красители и т. п.), даюш им возможность реакциям (XIV.66) и (XIV.6b) протекать справа налево. [c.356]
LDH-коллагеновую мембрану (LDH — лактатдегидрогеназа) получали по методу Карубе [484] из коллагеновой волокнистой суспензии. Эту суспензию обрабатывают пепсином, чтобы разрущить ( разварить ) волокна и получить почти прозрачную жидкость, и после этого добавляют LDH. Анод, покрытый коллагеновой мембраной с LDH, погружают в раствор глутарового альдегида, а затем промывают дистиллированной водой. В качестве электроактивного вещества был выбран флавинмононуклеотид (FMN), который окисляет NADH в NAD (были испытаны и другие электроактивные вещества, например тиогликолевая кислота, метилвиологен, феназинметасульфат, однако FMN оказался наиболее удобным). Восстановленный FMN (FMN/H ) окисляется на аноде, так что ток окисления измерить легко. [c.167]
Наличие двух участков сопряжения у бактерий доказывается тем, что при использовании в качестве разобщителя валиномицина наблюдается снижение интенсивности образования АТФ в два раза. В то же время добавление в этих условиях феназинметасульфата (ФМС) предотвращает снижение интенсивности фотофосфорилирования. В последнем случае число участков сопряжения уменьшается, так как ФМС накоротко замыкает электронтранспортную цепь, но скорость оборота элект ронов по циклу повышается, так как обходятся наиболее медленные участки электронтранспортной [c.188]
При изучении циклического фосфорилирования используют, как правило, различные добавки — доноры и акцепторы электронов (феназинметасульфат, витамин Кз, 2,6-дихлорфенолиндофенол), которые могут включаться в цикл и облегчать движение электрона. Циклическое фосфорилирование не нарушается моноуроном и диуроном — ингибиторами электронного транспорта фотосистемы I. Спектр его действия имеет максимум при 710 нм. Это еще раз указывает на непосредственную связь циклического фосфорилирования с фотосистемой I. [c.84]
С электронными потоками в пределах фотосистемы I связан еще один тип фотофосфорилирования — псевдо-циклический. Псевдоциклическое фотофосфорилирование можно рассматривать как химический зашунтированный нециклический процесс. Он активируется такими катализаторами, как феназинметасульфат, флавинмононукле-отид, витамин Кз- В противоположность циклическому псевдоциклическое фосфорилирование подавляется диуроном и требует присутствия кислорода, который вовлекается, по-видимому, в цепь окислительно-восстановительных превращений. [c.84]
В основе тетразолиевого метода выявления локализации ферментов в гелях лежит образование нерастворимых хромогенных веществ — формазанов. Схематически их образование может быть представлено последовательностью реакций NADH + феназинметасульфат (ФМС) ФМС [c.272]
В пробы (конечный объем 4 мл) вносят 0,3 мл буферного раствора, а затем последовательно по 0,2 мл растворов сукцината натрия, феназинметасульфата, цианида калия и 2,6-дихлорфенолиндофенола. Последний вносят в пробы примерно за 10 мин до определения активности фермента. Не следует заблаговременно смешивать растворы сукцината, феназинметасульфата и 2,6-дихлорфенолиндофенола, так как может произойти. неферментативное восстановление последнего. Содержимое пробирки перемешивают и инкубируют в водяной баНе [c.45]
Быстродействующий рН-электрод. Для определения быстродействия рН-электродов используется фотохимический метод, предложенный С. Фаулером и Б. Коком (1976). В нем применяется индуцируемая светом реакция подкисления, протекающая в инкубационной среде, содержащей 200 мкМ феназинметасульфата (ФМС) и 1 мМ окисленного цитохрома с, [c.182]
Метод I. Ход работы. Один из методов определения сук-цинатдегйдрогеназной активности основан на измерении снижения оптической плотности (при % = 600 нм) 2,6-дих-лорфенолиндофенола (ДХФИФ), восстанавливающегося в присутствии феназинметасульфата (ФМС) при ферментативном окислении сукцината (рис. 91). [c.250]
В пробирки (конечный объем — 4 мл) вносят определенные объемы растворов буфера, ЭДТА, сукцината натрия, цианида калия или азида натрия, ДХФИФ, 0,1—0,2 мг белка в 0,1—0,2 мл и перемещивают. Не следует заблаговременно смешивать растворы сукцината, феназинметасульфата и ДХФИФ, так как может произойти неферментативное восстановление последнего. Инкубационная среда должна содержать такие компоненты 10 мМ фосфатного буфера (рН=7,4) 10 мМ раствор сукцината калия 0,1 мМ раствор ЭДТА 1 мМ азида натрия 0,05 мМ раствор 2,6-дихлорфенолиндофенола 0,1—0,2 мг белка (рекомендуется к раствору белка добавить тритон Х-100 до концентрации 1 % для разрушения митохондрий и доступности субстрата для фермента). [c.250]
Разработка методов иммобилизации клеток этой бактерии в полиакриламидный гель (ПААГ), в мембраны из поливинилового спирта и адсорбция ее на целлюлозе позволила повысить эффективность метода трансформации стероидов. Для иммобилизации в ПААГ культуру выращивали описанным выше способом, отделяли центрифугированием, отмывали фосфатным буфером. Система для полимеризации состояла из 10 %-ного полиакриламидного геля с 0,5 %-ным относительным содержанием сшивающего агента метиленбисакриламида и катализаторов тетраметил-этилендиамина (ТЕМЕД) и персульфата аммония. Акриламид перекристаллизовывали перед употреблением из хлороформа. В сосуд для полимеризации помещали 6 мл клеточной суспензии, содержащей 0,1—0,6 г биомассы, смесь 1,90 г акриламида с 0,10 г метиленбисакриламида в 11 мл воды, 3 капли ТЕМЕД а и 15 мг персульфата в 3 мл воды. Общий объем 20 мл. Полимеризацию мономера проводили при температуре 10—12 °С в атмосфере азота в течение 2—15 мин. Полученный блок геля механически фрагментировали, продавливая через сито 20—30 меш, промывали физиологическим раствором до исчезновения невключившихся клеток (4—5 л). Полученные гранулы помещали в термостатируемую колонку (1X28 см). Реакционная смесь, пропускаемая через колонку, содержала 0,1 г/л гидрокортизона в фосфатном буфере (pH 7,0), скорость потока через колонку 1,3 мл/ч на 1 мл геля (ЗУ), акцептор водорода — феназинметасульфат—добавляли в концентрации 0,1 г/л с момента трансформации, температура 20—22 °С. Выделение стероидов и определение активности проводили по методике, описанной выше. При таких условиях [c.545]
Теоретические основы биотехнологии (2003) — [
c.155
,
c.156
]
Электрофорез в разделении биологических макромолекул (1982) — [
c.283
]
Доставка по Москве
Доставка осуществляется по всей России и странам СНГ. Возможен самовывоз со склада по адресу Московская область, г. Мытищи, 7-й Ленинский переулок, д.13. Доставка по Москве и Московской области осуществляется бесплатно.
Цена товара указана со склада в Москве и не включает расходы на доставку в другие города.
Вы можете выбрать способ доставки в личном кабинете, чтобы он автоматически указывался при оформлении всех последующих заказов. При выборе варианта «Транспортная компания по выбору клиента» укажите в комментариях транспортную компанию, с которой вы предпочитаете работать.
Точная стоимость доставки рассчитывается менеджером при подтверждении заказа в зависимости от весообъемных характеристик и дальности. Товары, требующие особого температурного режима, доставляются с соблюдением требуемых условий. Если в заказе есть прекурсоры, необходимо оформить официальное письмо об отпуске прекурсоров. (образец письма об отпуске прекурсоров)
Оплата
Компания Диаэм работает с юридическими и физическими лицами. После оформления заказа продавец-консультант сформирует счет и направит его вам по электронной почте и на страницу заказа в Личном кабинете на сайте. Вы также можете сами сформировать счет из Корзины, авторизовавшись на сайте. Счет оплачивается через банк. Вы можете оплатить товар в кассе Диаэм или любом отделении банка.
Для получения товара необходимо предоставление доверенности организации, а для получения товара при оплате физическим лицом необходим паспорт.
Состав
При пересчете на массовые доли сухого вещества, 1 таблетка содержит 500 грамм основного биологически активного компонента. Дополнительно в составе присутствуют:
- картофельный крахмал;
- повидон (полное название – низкомолекулярный медицинский поливинилпирролидон);
- безводный диоксид кремния (коллоидная форма);
- стеарат кальция.
Форма выпуска
Препарат выпускается в двух вариациях:
- Порошок (разовая доза содержит 0.2 грамма основного компонента).
- Таблетированный Сульфадиметоксин – по 10 таблеток в контурной ячеечной упаковке (в коробке – 10 ячеистых пластинок).
Фармакологические действие
Сульфадиметоксин, как типичный представитель сульфаниламидных препаратов, оказывает бактериостатический эффект на патологические микроорганизмы. Механизма действия раскрывает органическая химия, основной биологический компонент лекарственного средства является структурным аналогом пара-аминбензойной кислоты, которую он конкурентно ингибирует в процессе образования фолиевой кислоты (ключевой фактор роста и развития большинства микроорганизмов).
Таким образом, подавляется синтез нуклеиновых кислот (как пуриновым, так и пиримидиновым основаниям для существования необходима дигидрофолиевая кислота), что проявляется в торможении роста и размножения инородных, микроскопических организмов. Человеческая клетка лишь потребляет и утилизирует продукт метаболизма витамина В9, потому ее жизнедеятельности препарат не угрожает.
Сульфадиметоксин активен в отношении большого количества грамположительных и грамотрицательных микроорганизмов. Так, препарат отменно борется с пневмококками, разными видами стрепто- и стафилококков, дизентерийной шигеллой, кишечной палочкой и палочкой Фридлендера (клебсиелла). Несколько хуже заметен эффект в отношении трахомы и протея.
Фармакодинамика и фармакокинетика
Период полувыведения препарата составляет 24-48 часов, в зависимости от индивидуальных особенностей организма. Сульфадиметоксин хорошо всасывается слизистой желудочно-кишечного тракта. В системном кровотоке связывается с белками плазмы, после чего равномерно распределяется по всем тканям и органам. Лекарственное средство способно проникать через гематоэнцефалический барьер и плаценту. Излюбленным местом накопления являются серозные полости тела.
Метаболизируется препарат в печени, путем ацетилирования. Растворимость продуктов после химической трансформации значительно ухудшается и зависит от кислотности первичной мочи. Выделяется сульфадиметоксин преимущественно почками, иногда может приводить к образованию кристаллов (кристаллурии).
Показания к применению Сульфадиметоксина
Вот небольшой список, от чего Сульфадиметоксин эффективно помогает в относительно короткий временной промежуток:
- пневмония;
- острые респираторные заболевания верхних дыхательных путей;
- бронхит с подтвержденной микробной этиологией;
- шигеллезная дизентерия;
- синуситы;
- тонзиллиты;
- воспалительные поражения центральной нервной системы (менингококковая инфекция);
- патологии мочевыделительной и мочевыводящей систем с положительным кокковым возбудителем.
Сульфадиметоксин может использоваться в комплексной терапии, когда в схему консервативного лечения включается несколько препаратов разной направленности для более полного спектра лечебного действия. В таком случае показания к применению расширяются посредством следующих заболеваний:
- стойкие формы малярии;
- раневая инфекция;
- пиодермия – гнойное воспаление кожный покровов вследствие кокковой инвазии;
- рожа (или рожистое воспаление) – инфекционное заболевания с характерными эритемами и буллами на верхних и нижних конечностях.
Противопоказания
От приема Сульфадиметоксина следует отказаться, если имеется повышенная чувствительность или непереносимость отдельных компонентов препарата, наследственный или приобретенный дефицит глюкозо-6-дегидрогеназы, азотемии различной этиологии.
Под тщательным наблюдением квалифицированного медицинского персонала следует применять лекарственное средство, если в анамнезе присутствуют заболевания кроветворной системы или декомпенсированные формы сердечной недостаточности.
Побочные действия
Консервативный курс лечения обычно хорошо переносится, если лечение проводится в стационарных условиях. В противном же случае возможны такие нежелательные реакции, как:
- Головная боль и головокружение.
- Диспепсические нарушения пищеварения (сухость в ротовой полости, тошнота, рвота, диарея).
- Лекарственная лихорадка – резкий подъем температурной кривой сразу после приема препарата.
- Кожные, зудящие высыпания.
- Лейкопения – снижения уровня свободных лейкоцитов в системном кровотоке, и как следствие снижение резистентности организма.
- Холестатический гепатит – воспалительное заболевания печени с застоем желчи в выводных протоках.
- Аллергические реакции – крапивница, дерматит, ангионевротический отек или другие.
Отдельно стоит отметить, что Сульфадиметоксин образует специфические кристаллы в моче, от чего таблетки изменяют ее цвет на насыщенно желто-коричневый при определенной кислотности, вследствие образования специфических кристаллов.
Инструкция по применению Сульфадиметоксина (Способ и дозировка)
Прежде всего следует провести пробу на чувствительность патогенных микроорганизмов, вызвавших заболевание, ведь не все штаммы кокковой инфекции отвечают на лечение сульфаниламидными препаратами.
Таблетки следует принимать перорально с интервалом в 24 часа. Курс лечения составляет от 7 до 14 дней, в зависимости от патофизиологии заболевания. Как принимать таблетки в каждом конкретном случае будет прописывать врач, однако общая схема для взрослых – 2 гр в первый день госпитализации и по 1 гр для поддержания стабильного уровня биологически активного компонента в системном кровотоке.
Инструкция на Сульфадиметоксин несколько отличается в педиатрической практике. В первые сутки назначают 25 мг/кг, а далее по 12.5 мг/кг в последующие для детей младшего возраста. Если ребенок старше 12 лет, то первоначальная доза составляет 1 гр, а поддерживающие – 0.5 гр.
Передозировка
Состояние перенасыщения организма препаратом клинически проявляется в интенсивной жажде, сильной сухости во рту, малым количество насыщенно желто-коричневой мочи, болью в правом подреберье (проекция печени) и пояснице (почечная локализация). Биохимический анализ выявит значительно повышение таких ферментов, как АСТ, АЛТ и кислой фосфатазы.
Терапевтические меры при передозировке:
- Рефлексогенная инициация рвоты.
- Промывание желудка или высокая очистительная клизма.
- Вяжущие и адсорбирующие препараты перорально.
- Солевые слабительные.
- Форсированный диурез, если препарат успел полностью всосаться из желудочно-кишечного тракта.
Взаимодействие
Сульфадиметоксин нельзя сочетать с:
- Препаратами угнетающими кроветворение (например, бутадионом или анальгином).
- Пероральными сахар снижающими средствами (производные сульфонил мочевины).
- Производными пара-амин бензойной кислоты (местные анестетики группы новокаина).
Действие фармакологических препаратов будет усиливаться, если помимо основного компонента терапевтического курса применяются:
- нестероидные противовоспалительные средства;
- антитромботические препараты;
- барбитураты;
- антагонисты витамина К.
Эффекты Сульфадиметоксина снижаются на фоне использования фолиевой кислоты, пероральных контрацептивов и бактерицидных беталактамных антибиотиков (пенициллины, карбапенемы, цефалоспорины и так далее).
Токсичность лекарственного средства повышают:
- производные пиразолона;
- салицилаты;
- метотрексат и дифенин.
Условия продажи
Сульфадиметоксин отпускается только по врачебному рецепторному бланку, так как фармацевтический препарат значится в лекарственном списке Б (сильнодействующие вещества).
Условия хранения
Сберегать таблетки следует в сухом, недоступном для детей месте при температуре не превышающей 25 градусов Цельсия. Обязательно следить за наличием оригинальной упаковки таблеток.
Срок годности
Минимальный срок годности препарата – 5 лет.
Аналоги сульфадиметоксина
Совпадения по коду АТХ 4-го уровня:
Сульфамонометоксин, Сульфаметоксипиразин (Сульфален), Сульфадиазин (Сульфазин), Сульфаметоксазол.
Синонимы
Мадрибон (наиболее часто встречаемое, так как это патентованное название Сульфадиметоксина), Мадроксин, Дупосул, Фуксал, Суперсульфа.
Детям
Препарат назначается только с трех лет.
При беременности и лактации
Сульфадиметоксин строго противопоказан при беременности, в периоды созревания молока или кормления грудью.
Отзывы о Сульфадиметоксине
Врачебные отзывы о препарате подтверждают эффективность лекарственного средства в борьбе с кокковой инфекцией внутренних органов и кожных покровов, если полностью соответствовать консервативному курсу лечения. В противном случае у патогенных микроорганизмов развивается резистентность к целой группе препаратов, так как все сульфаниламиды обладают типичным химически строением.
В хирургических стационарах хорошую оценку дают комплексному препарату (диоксометилтетрагидропиримидин + сульфадиметоксин + тримекаин + хлорамфеникол), так как в таком составе эффект основного биологически активного вещества дополняется анальгезирующим, некролитическим и противовоспалительным действием. Лекарственное средство является препаратом выбора в санационной схеме большого количества гнойных нозологических единиц.
Отдельно стоит отметить, что на форумах часто встречается такой вопрос: «Сульфадиметоксин – антибиотик или нет?». Это заблуждение развеял доктор Комаровский на своем официальном сайте: «Препарат деструктивно влияет на патогенные микроорганизмы, соответственно, исходя из фармакологического определения антибиотика – Сульфадиметоксин является таковым».
Цена Сульфадиметоксина
Стоимость препарата в аптечных киосках на территории Украины оставляет 5 гривен. Цена в Российской Федерации несколько отличается и составляет порядка 25 рублей.
Статья на конкурс «био/мол/текст»: Аминокислота — «кирпичик» белковой последовательности — закодирована в геноме тремя нуклеотидами, при этом не всегда единственным образом. Здравый смысл подсказывает, что можно выбрать случайный триплет для данной аминокислоты и что от этого выбора ничего не зависит. Оказывается, здравый смысл в этом случае неправ.
Вместо предисловия
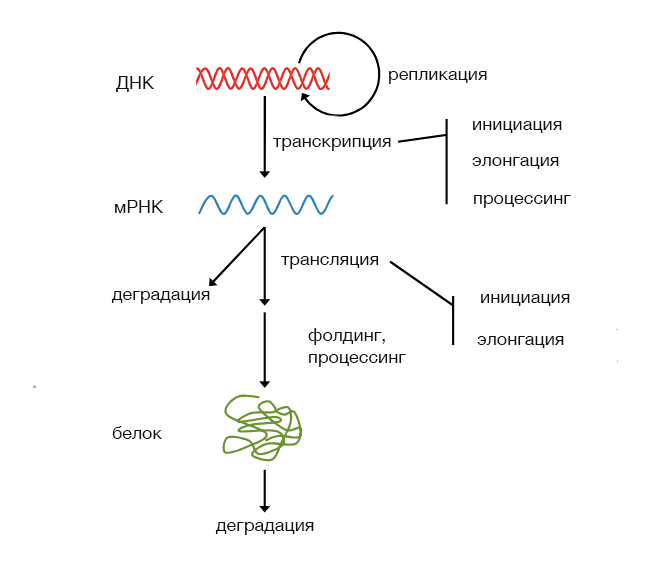
Науке известно некое обобщение, которое называют «центральной догмой молекулярной биологии». Это правило описывает поток информации на молекулярном уровне: от молекулы дезоксирибонуклеиновой кислоты (ДНК) к рибонуклеиновой кислоте (РНК) и затем к белку. Конечно же, можно привести множество уточнений, усложнений, оговорок и замечаний к этой упрощённой модели, но тем не менее, сформулированная Фрэнсисом Криком в далёком 1958 году, она по сей день является ключом к понимаю того, как «знание», закодированное в последовательности ДНК, превращается в функциональный белок.
Для работы с информацией, содержащейся в ДНК, принято отображать её в виде последовательности мономеров (нуклеотидов), составляющих одну из двух цепей ДНК: A (аденин), G (гуанин), C (цитозин) и T (тимин). Такое представление даёт возможность анализировать информацию, заключённую, например, в гене человеке, с помощью знакомых программистам алгоритмов и методов для работы со строковым типом данных.
Аналогичный алфавит был предложен для записи последовательности белковой молекулы, мономерами которой являются аминокислоты. Для обозначения каждой протеиногенной аминокислоты используется или трёхбуквенное обозначение (на основе первых букв названия аминокислоты, например Ser для серина), или однобуквенное обозначение, разработанное Маргарет Оакли Дэйхофф. Последнее видится вполне разумной оптимизацией: это позволяет в три раза сократить размер пространства, необходимого для хранения последовательности белка, и является более удобным с точки зрения работы с последовательностью как со строкой. Имея последовательность «кирпичиков» ДНК, можно попытаться предсказать, какие элементы — аминокислоты — будут составлять молекулу белка.
Синтез молекулы информационной РНК (мРНК) является первым шагом в рассматриваемой цепи передачи информации: в процессе транскрипции информация, закодированная в последовательности дезоксирибонуклетидов, позволяет получить последовательность рибонуклеиновой кислоты с помощью принципа комплементарности. Это означает, что «буквы» РНК будут соответствовать «буквам» в смысловой цепи ДНК (A → U, C → G, и т.д.).
Сама по себе мРНК является сложной молекулой. Её структура (наличие функциональных элементов) может подвергаться модификации и зависит в том числе от организма, о котором идёт речь (значительны различия между мРНК прокариот и эукариот, — например, наличие протяженных нетранслируемых участков в эукариотических мРНК, практически отсутсвующих у прокариотических). Для нашего дальнейшего анализа будем считать, что нам известна та последовательность мРНК, которая транслируется в последовательность белка. Этот этап передачи информации не похож на транскрипцию, где ключевым был принцип комплементарности: здесь кодирование и декодирование данных осуществляется иначе.
Рисунок 1. Экспрессия и некоторые факторы, влияющие на неё
В качестве деталей для конструирования белков природа выбрала 20 аминокислот. (Здесь стоит отметить существование организмов, некоторые белки которых включают селеноцистеин (Sec) и пирролизин (Pyl). Работы о появлении, эволюции и эволюционном значении этих 21-й и 22-й протеиногенных аминокислот могут показаться интересными и, пожалуй, заслуживают отдельного разговора.) Отсюда возникает требование, вполне естественное и очевидное: для записи в геноме информации о последовательностях белков при таком числе аминокислот необходимо, чтобы одна аминокислота была «зашифрована» в виде как минимум трёх нуклеотидов . На самом деле, именно три нуклеотида (триплет, или кодон — от английского code) кодируют одну аминокислоту. Логическим следствием этой идеи является избыточность генетического кода. Однако с «лишними» 44 (43 − 20 = 44) кодонами можно было бы поступить разными способами: к примеру, не использовать их вовсе или дать возможность нескольким разным кодонам кодировать одну аминокислоту. Последний путь и был избран природой .
Стóит уточнить, что пытливые умы ученых уже создали искусственным путем систему, в которой рибосома при помощи набора «ортогональных» тРНК распознает уже не триплет, а квадруплет, т.е. переключается на кодирование аминокислот не по схеме 43=64, а 44=256: «Слово из четырёх букв» [11]. — Ред.
Возникновение генетического кода почти наверняка не было случайным. По одной из современных гипотез, существует определенное сродство между аминокислотами и кодирующими их триплетами. Возможно, такое сродство лежит в основе механизма матричного синтеза, который в своей первоначальной форме не включал таких «адапторов», какими являются транспортные РНК: «У истоков генетического кода: родственные души» [12]. — Ред.
Информация, содержащаяся в цепи мРНК, считывается по три нуклеотида аппаратом белкового синтеза, при этом важным фактом является свойство неперекрываемости: один нуклеотид входит в состав только одного триплета. Не лишним здесь будет замечание о существовании так называемых стоп-кодонов: считывание UAG, или UGA, или UAA с мРНК даёт сигнал к завершению процесса трансляции. Кстати, эти кодоны имеют красочные названия: янтарь, опал и охра (amber, opal и ochre).
Итак, получается, что изменение некоторых букв генома в определённых позициях не повлечёт за собой замены аминокислот соответствующего белка, которая могла бы сказаться на его свойствах или функции. Существуют даже четырёхкратно вырожденные сайты (fourfold degenerate sites): например, кодоны GGU, GGC, GGA и GGG соответствуют глицину.
Рисунок 2. «Стандартный» генетический код. Отмечены четырёхкратно вырожденные сайты. Аминокислоты отсортированы в алфавитном порядке согласно их латинским названиям.
Синонимы и… не синонимы
Замена буквы в кодоне, конечно, возможна не только в текстовом редакторе, но и в настоящей ДНК. Такие мутации в белок-кодирующих областях генома подразделяют на синонимичные и не синонимичные (некоторые предпочитают использовать синонимы этих слов — «синонимические» и «не синонимические»). Если первые не изменяют аминокислоту, соответствующую кодону, где произошла мутация, то не синонимичные мутации приводят к замене аминокислоты. Такую классификацию мутаций можно использовать для характеристики сайтов (позиций) кодона: например, для кодона CUG первая позиция является на 1/3 синонимичной (UUG, как и CUG, кодирует лейцин) и на 2/3 не синонимичной (AUG и GUG кодируют метионин и валин, соответственно).
Идея о равноценности кодонов, кодирующих одну аминокислоту (иногда их именуют синонимичными кодонами), кажется не противоречащей логике. Действительно, если взглянуть на проблему с высоты центральной догмы молекулярной биологии, то вполне разумно будет заявить об отсутствии эффекта синонимичных мутаций на последовательность белка, а значит и на функцию его в клетке и его эволюционную судьбу. Однако такая гипотеза явно не соответствует реальности: если подсчитать доли синонимичных кодонов в каком-нибудь известном геноме, то вычисленные частоты наверняка будут значимо различаться. Таким образом, налицо предпочтение одних синонимичных кодонов другим, что не имеет, на первый взгляд, никакого смысла. Этот феномен назвали смещением частоты кодонов (codon-usage bias, далее СЧК), и суть его заключается именно в статистическом отклонении использования синонимичных кодонов от равномерного.
Зачем клетке редкие и частые кодоны?
Причины СЧК так или иначе затронуты в десятках (и даже сотнях) публикаций, поэтому важно рассмотреть основные идеи, лежащие в основе различных гипотез. Определённые паттерны использования кодонов наблюдаются в геномах организмов, принадлежащих различным систематическим группам: бактерий, архей, червей, млекопитающих и т.д. Для объяснения наблюдаемых паттернов можно привлечь две классические модели. Первая из них предлагает связывать СЧК с мутационным процессом; так, можно искать объяснение СЧК в смещённых частотах нуклеотидов, рождаемых точечными мутациями или системами репарации. Эту модель можно назвать «нейтральной», в отличие от второй, которая привлекает к объяснению понятие естественного отбора и утверждает, что синонимичные мутации могут влиять на приспособленность организма. И нейтральный, и селективный механизм, вероятно, играют роль в создании той картины СЧК, которую можно наблюдать как между различными видами, так и в пределах одного генома между генами.
Рассмотрение СЧК для генов одного генома становится особенно интересным в свете следующего факта: уровень экспрессии генов в ряде видов положительно коррелирует со степенью СЧК. Вероятно, явление СЧК наиболее выражено в последовательностях генов с высокими уровнями экспрессии для повышения эффективности или точности трансляции. Это заявление стоит рассматривать как гипотезу, которая остаётся темой дискуссий и споров. Так, подобное объяснение не согласуется с представлением, что именно инициация (а не элонгация) является основным фактором, ограничивающим скорость синтеза белка в клетке (подробнее см. [1]).
СЧК может частично объясняться и другими факторами, например вторичной структурой мРНК. В качестве примера можно привести гены алкогольдегидрогеназы плодовой мухи: вторичная структура их мРНК более стабильна для генов с более низкими уровнями экспрессии. Предполагается, что отбор в пользу «сильной» вторичной структуры может использоваться для снижения уровня экспрессии гена и наоборот.
Ещё одним примером того, как синонимическая мутация может влиять на стабильность мРНК, являются мутации в гене дофаминового рецептора человека DRD2. В последовательности этого гена обнаружено 6 разных полиморфизмов (SNP, single nucleotide polymorphism, или «снипов», как их называют), но лишь одна мутация, уменьшающая время жизни молекулы мРНК, связана с нарушением экспрессии гена DRD2, которая регулируется дофамином [2]. Эта мутация — C957T, т. е. замена девятьсот пятьдесят седьмой буквы последовательности с C на T, — приводит к заметным изменениям в модели вторичной структуры мРНК. Кстати, интересно, что при сравнении частоты кодонов в последовательностях гена DRD2 и его «соседей» по хромосоме обнаружилось смещение в частоте использования нуклеотидов в третьей позиции кодонов гена DRD2 в пользу G и C.
Как известно, мРНК эукариот, будучи синтезированной, подвергается процессингу, а лишь затем транслируется. Сплайсинг РНК является одним из этапов процессинга и состоит в вырезании «ненужных» участков пре-мРНК — интронов. Оказывается, науке известно большое число заболеваний, связанных с нарушением процесса сплайсинга в результате синонимических мутаций. В их списке можно найти, например, синдром Марфана, фенилкетонурию и множественный склероз. Предполагается, что эти мутации могут создавать новые сайты сплайсинга или влиять на элементы последовательности, важные для контроля процесса сплайсинга (так называемые энхансеры и сайленсеры сплайсинга — exonic splicing enhancers and silencers). Наблюдаемые явления СЧК, таким образом, могут частично объясняться отбором, действующим на последовательности этих модуляторов сплайсинга.
Традиционно сплайсинг считается особенностью именно молекул РНК. Однако оказывается, что у белков тоже бывает сплайсинг, причем в этом случае процесс протекает спонтанно (то есть, автокаталитически): «Белки против РНК — кто первым придумал сплайсинг?» [13]. — Ред.
Любопытно, что даже в пределах одного гена выявлено явление СЧК. Например, возможно использование менее адаптированных (к набору изоакцепторных тРНК) кодонов в тех сайтах, где для правильной ко-трансляционной укладки белка необходима врéменная остановка рибосомы. Обнаружено также явление автокорреляции кодонов в последовательности гена, позволяющее, как предполагают авторы этого наблюдения, повысить эффективность элонгации посредством механизма повторного использования молекул тРНК, «недавно» задействованных в процессе трансляции.
В поисках оптимальных кодонов
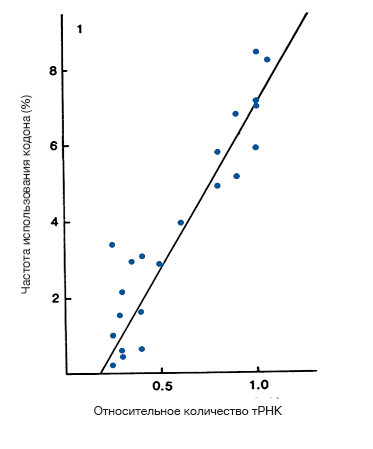
Рисунок 3. Взаимосвязь между частотой использования кодона и количеств тРНК для некоторых генов с сильным смещением использования кодонов от равномерного
Вполне естественной в свете всего вышесказанного выглядит идея организовать набор «хороших» кодонов, а заодно и определиться с критериями для этого. Согласно одной из теорий, преимущество таких кодонов перед их синонимичными собратьями заключается в оптимальной стабильности кодон-антикодонового взаимодействия: молекула тРНК будет оптимально подходить для кодона, если GC-состав (доля нуклеотидов G и C в последовательности) для такого взаимодействия будет промежуточным, т. е. находиться между экстремальными значениями слабых взаимодействий A—U (две водородные связи) и сильных пар G—C (три водородные связи). Однако такая теория не поддержана экспериментальными данными. Смещение частоты кодонов в сторону именно кодон-антикодоновых пар промежуточной стабильности не наблюдается, к тому же для разных организмов свойственны различные наборы «хороших» кодонов.
Но как же тогда природа выбирает оптимальные кодоны? Предполагают, что оптимизация эффективности трансляции возможна для любого выбранного кодона, например, с помощью подбора концентраций тРНК. В таком случае нет причин полагать, что свойства кодон-антикодоновых взаимодействий являются основой для выбора оптимальных кодонов.
Мухи и люди
Примечательно, что использование кодонов в геномах млекопитающих имеет много отличий в сравнении с другими таксонами. Различия использования кодонов между генами млекопитающих объясняются в первую очередь вариацией в GC-составе на уровне генома: оказывается, для генома млекопитающих свойственно наличие изохор — крупных (длиной >300 тысяч оснований) фрагментов хромосом, характеризующихся однородным GC-составом. При этом GC-состав между изохорами различается. Точнее всего предсказать нуклеотидный состав синонимичных сайтов и смещение частоты кодонов для определённого гена удаётся именно по нуклеотидному составу изохоры, которой этот ген принадлежит. Это можно считать подтверждением того, что отбор, действующий на гены или экзоны, не является главной движущей силой для синонимических мутаций.
Действие отбора на использование кодонов млекопитающими подвергается сомнению по теоретическим соображениям: эффективный размер популяции млекопитающих мал, что ограничивает эффективность отбора. В этой связи следует упомянуть теорию «почти нейтральных» мутаций. Если нейтральная теория предполагает скорость эволюции равной частоте нейтральных мутаций, то «почти нейтральная» теория основана на идее отрицательной корреляции между скоростью эволюции и эффективным размером популяции вида. Так, если негативный эффект s, оказываемый мутацией, невелик по сравнению с эффективным размером популяции Ne (s << 1/Ne), то её называют «эффективно нейтральной».Таким образом, мутация, «вредная» для плодовой мухи, может быть эффективно нейтральной для млекопитающих, так как для последних значение Ne много меньше. Поэтому предполагается маловероятным влияние естественного отбора на синонимические мутации для видов, популяции которых характеризуются Ne << 1 000 000, однако для некоторых биологических объектов, таких как бактерии и мухи, это влияние будет прослеживаться.
Уникальный серин
Давайте сделаем небольшое отступление и снова обратим взор на генетический код. Структура его такова, что лишь одна из аминокислот — серин — кодируется двумя наборами триплетов (TCN, где N — любое основание, и AGY, где Y — пиримидиновое основание, то есть C или T), для перехода между которыми недостаточно однонуклеотидной мутации. Так как вероятность одновременного мутирования двух позиций кодона считается малой, то предполагалось, что если остаток серина важен для функции белка, то соответствующий кодон будет «заперт» в одном из кодоновых семейств. Однако случаи «переключения» между этими кодоновыми семействами в кодирующих последовательностях были обнаружены, например, при изучении эволюции генов убиквитина — высококонсервативного белка, играющего ключевую роль в процессах деградации белков клетки [14], [15].
Было подсчитано, что если подобные переключения действительно имели место в эволюции, то происходили они с частотой, много превышающей частоту двух случайных мутаций в соседних сайтах. Так было предложено одно из возможных объяснений — динуклеотидные мутации. Другое объяснение не привлекает такие мутации, а основано на двух последовательных мутациях: «вредной», заменяющей сериновый кодон на треониновый (ACN) или цистеиновый (TGY), и «полезной», возвращающий серин «на место». При этом вторая мутация может привести к кодону другого семейства (AGY → ACY → TCY или TCY → TGY → AGY) или восстановить в последовательности прежний кодон. Эта гипотеза, однако, не отвечает на вопрос о том, как промежуточный (несериновый) кодон сохраняется в популяции.
Как взвесить тРНК?
Оптимальные кодоны для некоторых видов, в том числе для плодовой мухи Drosophila melanogaster и круглого червя Caenorhabditis elegans, соответствуют наиболее представленным тРНК, т.е. такие кодоны более всего адаптированы к набору изоакцепторных тРНК этих видов. Уместно отметить, что оценку количества тРНК можно производить по-разному. Наиболее прямой подход — использовать экспериментальные данные о количестве молекул тРНК в клетках ткани организма. Однако проведение таких экспериментов требует большого количества времени, материальных ресурсов и усилий исследователей. К счастью, есть способ косвенной оценки представленности тРНК: по количеству копий соответствующих генов в геноме интересующего организма. И хотя этот подход требует наличия последовательности всего генома, в наше время, когда количество данных полногеномного секвенирования возрастает экспоненциально, это вряд ли можно назвать проблемой [16–18].
Вычислительный аспект
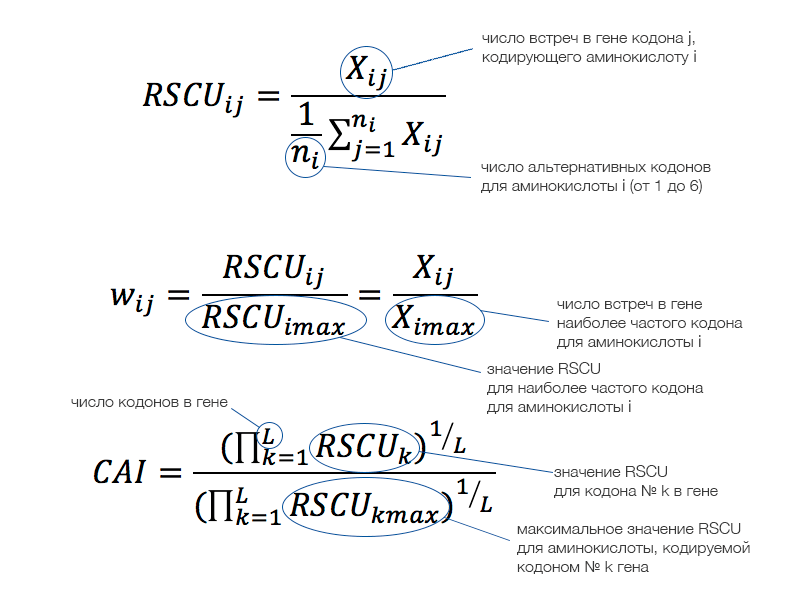
Взгляд на феномен СЧК будет неполным, если не затронуть некоторые аспекты статистического и компьютерного анализа, связанные с тематикой вопроса. Так, необходимостью сравнения использования кодонов в последовательностях (разных генов и/или видов) продиктовано использование показателя RSCU (относительного использования синонимичных кодонов, the relative synonymous codon usage). RSCU может принимать значения от 0 (кодон отсутствует) до 6 (используется один кодон из 6 синонимичных). Если смещения частоты использования в семействе синонимичных кодонов не наблюдается, то значение RSCU равно единице. Формально RSCU определяют как отношение наблюдаемой частоты кодона к его частоте, ожидаемой в предположении равномерного использования синонимичных кодонов.
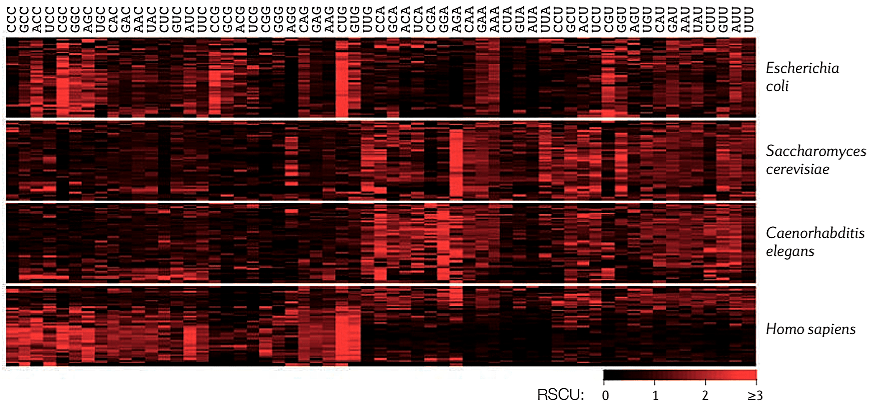
При вычислении RSCU игнорируются стоп-кодоны; для метионина и триптофана (каждую из этих аминокислот кодирует лишь один кодон) значение RSCU постоянно, поэтому RSCU для кодонов AUG и UGG также может быть опущено. Таким образом, для гена можно рассчитать RSCU по всем кодонам (так получится набор из 59 значений: 64 кодона − 3 стоп-кодона − 2 кодона [Met, Trp]). Если выполнить подобные вычисления для набора генов (например, некоторой выборки генов человека), можно изобразить полученные результаты в виде тепловой карты (рис. 4).
Рисунок 4. Относительное использование синонимичных кодонов (RSCU) для 50 случайно выбранных генов нескольких видов. Ясно прослеживается смещение частоты кодонов как в пределах одного генома, так и между геномами
На RSCU основано вычисление других показателей, например, относительной приспособленности кодона (w), которая вычисляется для определённых аминокислоты и кодона как отношение RSCU этого кодона к RSCU оптимального кодона для этой аминокислоты. Значение w позволяет получить индекс адаптации кодонов (the codon adaptation index, CAI), представляющий собой среднее геометрическое значений w для гена. Для Escherichia coli (кишечная палочка) было показано, что значения CAI генов рибосомных белков, как правило, высокие, в то время как для генов с низкими уровнями экспрессии характерны низкие значения CAI. Этот индекс может использоваться для предсказания уровней экспрессии генов определённого вида и гетерологичных генов (генов другого вида), сравнения использования кодонов разными организмами, идентификации рамок считывания, оценки скорости молекулярной эволюции или как мера адаптации использования кодонов в процессе эволюции (последнее представляет интерес, например, для вирусных генов).
Рисунок 5. Величины, используемые для оценки смещения частоты кодонов, и способы их вычисления
Стоит упомянуть также, такие способы оценки СЧК, как FOP (частота оптимальных кодонов, the frequency of optimal codons) и tAI (индекс адаптации к тРНК, the tRNA adaptation index). FOP представляет собой долю оптимальных кодонов среди всех кодонов гена. Как было показано для кишечной палочки, более высокие значения FOP присущи генам с высокими уровнями экспрессии. Создатели tAI, развивая идею CAI, предложили оценку адаптации гена к пулу тРНК организма. Индекс адаптации к тРНК учитывает число изоакцепторных тРНК для каждого кодона, число копий гена каждой тРНК, а также эффективность кодон-антикодоновых взаимодействий. Значение tAI коррелирует с уровнями экспрессии генов: наибольшие значения tAI принимает для высоко экспрессируемых генов.
Прикладное значение
По традиции, в завершение стоит обозначить применимость затронутых теоретических аспектов (что-то вроде «СЧК вокруг нас»). Во-первых, как уже было упомянуто, синонимические мутации и отбор, действующий на них, связаны с различными заболеваниями (их неполный список можно найти, например, в [4]). При этом во многих случаях точный механизм, по которому синонимические мутации приводят к аберрантному сплайсингу, вызывающему заболевания, ещё не известен. Итак, синонимические мутации могут иметь, если говорить более строгим языком, патофизиологическое и фармакогенетическое значение.
Второй областью, где можно встретить рассматриваемое явление, является искусственное СЧК. Основой его является возможность «подгонки» кодонного состава гена под использование кодонов интересующего организма. Например, такая «подгонка» позволила добиться лучших результатов в экспрессии зелёного флуоресцентного белка GFP в клетках человека. «Одомашненный» CЧК даёт надежду на возможность улучшения характеристик трансгенов — чужеродных молекул ДНК, внедряемых в клетку, — без изменения белка, кодируемого ими. В данном случае, как и на протяжении истории человечества, ответ на вопрос «А как это делает природа?» позволяет добиться практического результата «своими руками»: так, знание направления действия отбора на синонимические позиции в модуляторах сплайсинга позволяет увеличить время жизни транскрипта. Оптимизацию последовательности трансгена можно проводить in silico — методами компьютерного моделирования и анализа (например, см. [5]). На данный момент, однако, их применение ограничено видами, для которых хорошо изучены отклонения в концентрациях тРНК, такими как бактерии и дрожжи .
О том, что такое GFP и об их разнообразии см. в статье «Флуоресцентные белки: разнообразнее, чем вы думали!» [19]. — Ред.
Современные исследования показывают, что СЧК позволяет контролировать экспрессию генов не только на уровне трансляции, но также транскрипции. В последнем случае, СЧК позволяет модулировать специфичность взаимодействия ряда транскрипционных факторов с экзонными (кодирующими) участками генов: «Таинственный код нашего генома» [20]. — Ред.
- Joshua B. Plotkin, Grzegorz Kudla. (2011). Synonymous but not the same: the causes and consequences of codon bias. Nat Rev Genet. 12, 32-42;
- J. Duan. (2003). Synonymous mutations in the human dopamine receptor D2 (DRD2) affect mRNA stability and synthesis of the receptor. Human Molecular Genetics. 12, 205-216;
- Andersson S.G. and Kurland C.G. (1990). Codon preferences in free-living microorganisms. Microbiol. Rev. 54, 198–210;
- J. V. Chamary, Joanna L. Parmley, Laurence D. Hurst. (2006). Hearing silence: non-neutral evolution at synonymous sites in mammals. Nat Rev Genet. 7, 98-108;
- Mark Welch, Alan Villalobos, Claes Gustafsson, Jeremy Minshull. (2009). You’re one in a googol: optimizing genes for protein expression. J. R. Soc. Interface.. 6;
- Sharp P.M., Averof M., Lloyd A.T., Matassi G., Peden J.F. (1995). DNA sequence evolution: the sounds of silence. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 349, 241-247;
- Paul M. Sharp, Wen-Hsiung Li. (1987). The codon adaptation index-a measure of directional synonymous codon usage bias, and its potential applications. Nucl Acids Res. 15, 1281-1295;
- Toshimichi Ikemura. (1981). Correlation between the abundance of Escherichia coli transfer RNAs and the occurrence of the respective codons in its protein genes: A proposal for a synonymous codon choice that is optimal for the E. coli translational system. Journal of Molecular Biology. 151, 389-409;
- M. d. Reis. (2004). Solving the riddle of codon usage preferences: a test for translational selection. Nucleic Acids Research. 32, 5036-5044;
- L Duret. (2002). Evolution of synonymous codon usage in metazoans. Current Opinion in Genetics & Development. 12, 640-649;
- Слово из четырёх букв;
- У истоков генетического кода: родственные души;
- Белки против РНК — кто первым придумал сплайсинг?;
- Вездесущий убиквитин;
- «Вездесущий убиквитин» возвращается;
- Код жизни: прочесть не значит понять;
- Перевалило за тысячу: третья фаза геномики человека;
- Технология: $1000 за геном;
- Флуоресцентные белки: разнообразнее, чем вы думали!;
- Таинственный код нашего генома.
Статьи
Опубликовано в журнале:
Профилактика старения »» Выпуск 3 2000 А.А. Подколзин, А.Г. Мегреладзе, В.И. Донцов, С.Д. Арутюнов, О.М. Мрикаева , Е.А. Жукова
Национальный Геронтологический Центр
Научно-исследовательский центр Московского государственного медико-стоматологического университета МЗ РФ
АКТИВНЫЕ ФОРМЫ КИСЛОРОДА В РЕАКЦИЯХ ПОВРЕЖДЕНИЯ БИОМОЛЕКУЛ
Молекулярный кислород сам по себе обычно не вступает в неконтролируемые химические реакции внутри организма, для его активации нужны ферментативные процессы – главные ферменты метаболизма кислорода у млекопитающих: оксидазы и оксигеназы. Но в каталитических центрах этих ферментов кислород испытывает превращения до конечных соединений, не выделяясь в среду и не подвергая опасности органические макромолекулы клетки, повреждающими же агентами являются активные формы кислорода (АФК), образующиеся в ряде физико-химических процессов в организме. Главные активные формы кислорода (Осипов и др., 1990):
- супероксидные радикалы (О2—),
- перекись водорода (Н2О2),
- гидроксильные (свободные) радикалы (* ОН, НО2*),
- синглетные формы кислорода (1О2),
- ионы НО2-.
Основные механизмы появления АФК в организме связаны обычно с нарушениями функционирования электроннотранспортных цепей митохондрий или микросом, а также при изменении свойств дегидрогеназ. Особняком стоит нормальный процесс формирования АФК фагоцитами в ходе стимуляции неспецифической защиты организма.
Синглетный кислород образуется в реакциях фотоокисления в присутствии так называемых фотосенсибилизаторов: флавины, гематопорфирин, хлорофилл и др., а также при дисмутации супероксидных радикалов (Khan,1970). Синглетный кислород агрессивен в отношении биосубстратов, в особенности в отношении молекул с двойной связью; конечным итогом таких реакций обычно является образование гидроперекисей органических молекул – один из важнейших в процессах перекисного окисления ненасыщенных липидов в биомембранах (Осипов,1990, Roschupkin, Pelenitsin, Potapenko etc, 1975).
В присутствии металлов переменной валентности эти продукты запускают цепные реакции окислительной деградации биомолекул (Vladimirov etc., 1980). Главным защитным механизмом такого процесса является бета-каротин, переводящий синглетный кислород в триплетный, однако, обычная вода и токоферол также способны вызывать такой процесс инактивации синглетного кислорода (Duran, 1982, Mercel, Kearns, 1972) . В клинической практике синглетный кислород участвует в кожных проявлениях некоторых генетических заболеваний – порфирий (Frank, 1982), а также в процессах эритемы при ультрафиолетовом облучении кожи при приеме лекарств, обладающих фотосенсибилизирующим действием.
Во всех аэробных клетках в процессе присоединения одного электрона к молекуле кислорода образуются супероксидный анион-радикал — О2— и его протонированная форма – гидроперекисный радикал — НО2*; оба они порождают ряд других активных форм кислорода. Образование этих АФК наиболее существенно вблизи цепей переноса электронов – дыхательная цепь, микросомы и, в растительных клетках, хлоропласты (Каган, Сербинова, Минин и др, 1985, Rosen, Finkelstein, Rauckman, 1982).
Эти АФК играют также важную роль в защитных — неспецифических иммунных механизмах организма: они выделяются в ходе активации при инфекционных и иных воспалительных процессов фагоцитирующих клеток (нейтрофилы, макрофаги, моноциты, эозинофилы) (Маянский, Маянский, 1983, Edwards,. Hallett, L loyd etc, 1983, Klebanoff, Clark, 1978). Супероксидный радикал может прямо инактивировать адреналин, аскорбиновую кислоты (Bhuyan, Bhuyan, 1977), а более активный гидроперексиный радикал – реагирует с линолевой, линоленовой, арахидоновой кислотами, окисляя их до гидроперекисей (Bielsky, Arudi, Sutherland, 1983). Образованию гидроперекисного радикала способствует закисление среды, он также свободно проникает через биомембраны, так как не несет заряда.
Гидроперекиси липидов являеются весьма активными соединениями и обладают высокой биологической агрессивностью. Для протекания цепного окисления липидов в биологических мембранах совершенно необходимы переходные металлы, в частности, ионы железа (Ванин,1967, Владимиров, Арчаков, 1972). Простым и доступным методом определения продуктов перекисного окисления липидов является реакция с тиобарбитуровой кислотой (Marcuse, Johnston, 1973). Главным механизмом защиты организма от данных форм АФК является фермент супероксиддисмутаза (СОД), активность ее обычно достаточна, чтобы инактивировать их в месте образования, не допуская диффузии в среде макромолекул ткани.
Для определения концентрации супероксидных анион-радикалов используют методы электропарамагнитного резонанса (ЭПР-резонанс) и реакции оксиления интенсивно поглощающих соединений: цитохрома С, нитросинего тетразолия, адреналина и др. (Massey, 1959, Beyer, 1987, Misra, Frodowich, 1972).
Для доказательства специфичности этих реакций используют их подавление супероксиддисмутазой.
Дисмутация супероксидных анион-радикалов под действием СОД в биологических тканях ведет к образованию перекиси водорода, способной легко проникать через мембраны клеток. Перекись водорода обнаруживается при фагоцитозе, при работе митохондрий и микросом (Rosen, Finkelstein, Rauckman, 1982, E dwards, Hallett, Lloyd etc, 1983). В присутствии ионов переходных металлов (например Fe2+) перекись водорода может давать высоко активный гидроксильный радикал (* ОН). Этому процессу препятствуют главные высоко активные ферменты антиоксидантной защиты организма: каталаза и глутатион-пероксидаза. Измерение перекиси водорода в биосубстратах проводят обычно методом титрования перманганатом калия (Bonnichsen, 1948), реакцией с молибдатом аммония (Королюк, Иванова, Майорова, Токорева, 1988) или прямой спектрофотометрией при длине волны равной 240 нм (Bergmeyer, 1955, Cohen, Dembiec, Marcus, 1970).
Используют также пероксидазную реакцию, в ходе которой изменяется окраска индикатора, например, индигокармина (Frew, Jones P, Sholes, 1983), и флюориметричсекие методы (Perschke, Broda, 1961, Keston, Brandt, 1965).
Высокой реакционной способностью обладает гидроксильный радикал (* ОН), образующийся из перекиси водорода в присутствии ионов переходных металлов. Высокая реакционная способность определяет преимущественно местное воздействие этой форм АФК. Прямое повреждение ДНК при этом характеризуется разрывом цепи (180); с другими биомолекулами * ОН образует вторичные свободные радикалы, в том числе перексиные соединения липидов (Азизова и др, 1985, O`Connel, Garner, 1983, Rowley, Halliwell, 1982).
Главные типы повреждений биомолекул * ОН: отрыв атома водорода (таким образом повреждается лецитин – главный компонент биологических мембран, а также сахара в составе нуклеозидов ДНК); присоединение к молекулам по двойным связям (взаимодействие с пуринами и пиримидинами ДНК и РНК, в том числе с образованием вторичных радикалов); перенос электронов также является патогенным механизмом действия * ОН (Anbar, Neta 1967). В образовании гидроксильного радикала важное значение имеют ионы металлов с переменной валентностью, в первую очередь ионы железа (Flitter, Rawley, Haliwell, 1983, Floyd, 1983, Jacobs, 1977).
Ионы железа входят в большом количестве в состав организма (гемоглобин, миоглобин и пр.); в крови они находятся в связанной форме с трансферрином.
Снижение количества железо-переносщих белков и повышение свободного железа крови может вести к стимулированию формирования свободных радикалов; своевременная диагностика и профилактика такого состояния является важным моментом программ диагностики и профилактики старения, в частности, американской ассоциации Life Extension Foundation.
Отмечено, однако, формирование гидроксильного радикала и под действием связанного железа – лактоферрина (Ambruso, Johnston, 1981, Bannister, Bannister, Hill, Thornalley, 1982), а также при действии гемоглобина на перекись водорода (Banatti, Morelli, Guida, de Flora, 1983). Использование хелатосвязывающих агентов дает лечебный эффект при состояниях, при которых предполагается участие гидроксильного радикала в патогенезе заболевания: связывающий ионы железа десферриоксиамин эффективен при воспалительных процессах в легких (Ward, Till, Kunkel etc.,1983) и при аутоиммунных процессах (Bowern, Ramshow, Clark etc., 1984, Clark, Hunt, 1983).
АФК могут образовываться также и при многих иных процессах в организме. Так, например, формирование АФК обычно сопровождает процесс инактивирования в организме ксенобиотиков (Mustafa, 1990, Sinha, Mimnough, 1990), потенцируя их повреждающий эффект.
Главные методы определения * ОН: ЭПР, хроматография биомолекул для определения результатов их изменения под действием * ОН и прямые химические методы определения таких агентов, важным является также метод хемолюминесценции биомолекул, обычно с использованием активаторов хемилюминесценции, наиболее известными из которых являются люминол, люциноген (Allen, 1982).
ЗАЩИТА ОРГАНИЗМА ОТ АФК
СУПЕРОКСИДДИСМУТАЗА (СОД). Супероксиддисмутаза является важнейшим элементом антиоксидантной защиты организма. Это фермент из двух субъединиц с общей молекулярной массой 32 кДа, содержащий по одному атому меди и цинка (существует также марганец-содержащая СОД, обнаруженная в печени крысы и человека; в бактериальных клетках обнаружена железо-содержащая СОД). Фермент ускоряет распад О2— на 4 порядка. Активность СОД обычно определяют по ингибированию содержащих СОД биологическими экстрактами и жидкостями образования под действием О2— окрашенных продуктов из субстратов, например, тетразолия нитросинего (Чевари., Чаба., Секей 1981).
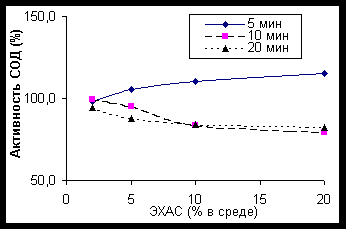
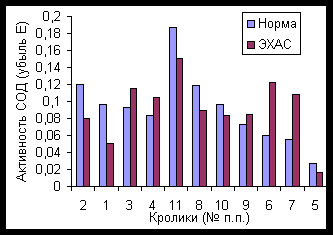
Источником О2— обычно является система феназинметасульфат + НАД*Н или ксантин + ксантиноксидаза. За единицу активности СОД принято ее количество, тормозящее в 2 раза восстановление цитохрома с при реакции ксантиноксидазы (0,003 ед/мл), ксантина (2 мкмоль/мл) и цитохрома с — 0,6 мкмоль/мл (McCord, Fridovich, 1969).
Вторым эшелоном защиты организма от АФК являются пероксидаза и каталаза.
КАТАЛАЗА. Каталаза расщепляет перекись водорода, до которой дисмутирует супероксидный радикал, до молекул воды и молекулярного кислорода. В клетках каталаза в основном сосредоточена в пероксисомах, в которых содержатся и ферменты, продуцирующие перекись водорода, необходимую в ходе ряда процессов жизнедеятельности организма, в частности, в процессах неспецифической иммунной защиты.
ПЕРОКСИДАЗА. Пероксидаза, в особенности глутатион-пероксидаза, широко распространена в клетках животных и растений. Глутатион-пероксидаза состоит из 4 субъединиц в каждой из которых содержится по молекуле селена. В клектах этот фермент располагается в цитозоле и матриксе митохондрий.
Активность глутатион-пероксидазы зависит от содержания глутатиона клетки, что, в свою очередь, определяется активностью глутатионредуктазы и концентрацией НАДФ*Н, который образуется в пентозофосфатном метаболическом цикле. Лимитирующими органами по активности каталазы, являются легкие, мышцы, глаза.
ДРУГИЕ ФОРМЫ ЗАЩИТЫ ОТ АФК
В защите от АФК в организме участвуют и многие другие молекулы и ферментные системы (Осипов, Азизова, Владимиров, 1990).
Классические в настоящее время антиоксиданты – витамин Е, витамин А и каротиноиды, активны почти ко всем АФК, но их вклад в общую антиоксидантную активность организма не слишком велик.
Из других жирорастворимых агентов антиоксидантной активностью обладают стероидные гормоны, билирубин; из водорастворимых – церрулоплазмин (влияя на свободное железо крови), трансферрин, альбумин, SH-группы белков.
Аскорбиновая кислота инактивирует свободные радикалы, образуя неактивный радикал (семидегидроаскорбат), она же является кофактором пероксидазы, (фермент аскорбат-пероксидаза).
Глутатион, присутствуя в клетках в высоких концентрациях, также является акцептором гидроксильного иона и синглетного кислорода, кроме того, он же является кофактором глутатион-пероксидазы и глутатион-редуктазы. Мочевая кислота присутствует в крови в достаточных количествах, чтобы эффективно акцептировать синглетный кислород и гидрок-сильный радикал. Аналогичными эффектами обладают этанол, маннит, глюкоза и некоторые другие органические молекулы.
АФК В НЕСПЕЦИФИЧЕСКОМ ИММУНИТЕТЕ И ВОСПАЛЕНИИ
Формирование АФК – важный защитный механизм, лежащий в основе неспецифического иммунитета: фагоцитоз приводит к многократному увеличению содержания АФК в фагоцитирующих клетках с одновременным повышением потребления кислорода в 20 и более раз («дыхательный взрыв» (Маянский, Маянский, 1983, Klebanoff, Clark, 1978).
Участие АФК в процессах фагоцитоза достаточно сложное.
Фагоцитирующая клетка активируется бактериальными клетками (или механическими частицами, лектинами и пр.), что сопровождается активацией фермента плазматической мембраны – НАДФ*Н-оксидазы с формированием из свободного молекулярного кислорода О2— (Babior, 1978, Badway, Karnovsky, 1980). В процессе генерации АФК участвуют ФАД-содержащий флавопротеин и цитохром b .
В конечном счете с участием ионов железа происходит дисмутация АФК до перекиси водорода.
Кроме того, миелопероксидаза нейтрофилов приводит к образованию гипохлорита, хотя последний не является главным в антибактериальной защите организма.
Высвобождние АФК в ходе «дыхательного взрыва» происходит как в фагосомы, так и в среду, что инактивирует как бактериальные клетки, так и может повреждать сами фагоциты, а также нормальные ткани.
Для защиты от АФК нейтрофилы содержат каталазу и глутатион-пероксидазу (Klebanoff, Clark, 1978).
Активация нейтрофилов сопровождается также при любых явлениях некроза ткани, в том числе микроинфарктах (Клебанов и др., 1984, 1987 ).
Участие гидроксильных радикалов подтверждено в патогенезе ревматоидного артрита, при этом фагоциты активируются иммунными комплексами в синовиальной жидкости (Bennett, Eddie-Quartey, Holt, 1973, Bennett, Skosey, 1977), при этом введение СОД в полость сустава оказывается терапевтически высоко эффективным.
Окисленные липиды обладают антигенными свойствами, запуская аутоиммунные процессы повреждения тканей (Деев и др.,1987, Hejnecke, 1987).
Бронхоконстриктивные заболевания легких, обычно сопровождающиеся хроническими воспалительными процессами, являются второй важнейшей патологией, в которой участие АФК достаточно важно, как это представляется на настоящий момент.
АФК сами способны вызывать бронхоконстрикцию, кроме того, гистамин в ходе развития хронических обструктивных заболеваний легких способен вызывать продукцию АФК вследствие извращения реакции на него нейтрофилов – при бронхиальной астме растормаживается ингибирующее действие гистамина на нейтрофилы; сходным образом действует и ацетилхолин (Коган, 1999). Увеличивается также генерация АФК в ходе приступа бронхиальной астмы, причем обнаруживается параллелизм в тяжести астматических приступов и генерации АФК нейтрофилами и повышением содержания в крови ПОЛ. Имеет место также лечебный эффект антиоксидантной терапии при этом заболевании.
Известен механизм усиления продукции лейкоцитами АФК при обострении бронхиальной астмы (Коган, 1999): он заключается в снижении АФК-ингибирующей функции тромбоцитов в отношении лейкоцитов и стимуляции лейкоцитов под действием ацетилхолина, а также в извращении тормозащего действия гистамина на лейкоциты.
Важное значение имеет утрата лейкоцитами особого недавно открытого отечественными исследователями эффекта – супероксидингибирующего действия углекислого газа (Коган, 1999).
Так, было показано, что влияние углекислоты на многие типы тканей ведет к снижению в 2-4 раза продукции ими генерации супероксидных радикалов.
Этот эффект может лежать в основе тренирующего и лечебного действия гиперкапнических методов терапии и профилактики бронхиальной астмы. В то же время, в ряде случаев такой лечебный эффект отсутствует. Было показано, что в большинстве таких случаев отсутствует и эффект углекислого газа на подавление продукции супероксидных радикалов лейкоцитами таких больных.
Выше обсуждались также эффекты участия АФК в хроническом воспалении, всегда присутствующем при бронхоконстриктивных заболеваниях легких.
Таким образом, воспалительные и констриктивные легочные заболевания – еще один важный патологический процесс, в котором явно принимают участие АФК.
АФК В СЕРДЕЧНО-СОСУДИСТОЙ ПАТОЛОГИИ
Участие АФК в сердечно-сосудистой патологии в настоящее время не оставляет сомнений. Показано усиление процессов перикисного окисления липидов (ПОЛ) в ишемизированном миокарде (Коган, Кудрин, Лосев, 1987, Kogan, Kudrin, 1980). Между продукцией в тканях миокарда перекиси водорода, повреждающем действием перекиси и повышением чувствительности к ней ишемизированных тканей устанавливается порочный круг; повреждению способствует также эмиграция лейкоцитов в зону воспаления и снижение в ней активности ферментов антиоксидантной защиты тканей (Коган, 1999).
Ишемия, парадоксально, не отражается на продукции АФК, в то же время, выраженно повреждая аэробные ткани вследствие недостатка обычного кислорода. Так, показано, что снижение кислорода в 100 раз по отношению к атмосферному, снижает продукцию АФК макрофагами не более чем на 25% (34ж). В то же время, активность СОД, глутатионпероксидазы в ишемизированной области снижается уже в первые минуты ишемии и сохраняется в течение всего периода эксперимента по ишемии миокарда (Лапкин и др., 1982).
Активация селеном активности глутатионпероксидазы обладает протективным эффектом на экспериментальный инфаркт (Коган, 1992), снижая зону морфологически видимого инфаркта и изменения ЭКГ.
В противоположность, активация продукции АФК форболмиристат ацетатом вызывает резкую дисфункцию сердца: уменьшение в 6 раз сердечного индекса, ЭКГ-регистрируемую ишемию миокарда и гибель животных (Rao, Mueller, 1983).
Все эти эффекты могут быть ревертированы внутривенным введением СОД и каталазы или же снижением количества нейтрофилов (антинейтрофильными антителами) как основного источника в норме АФК в организме. Введение СОД снижало также размеры инфаркта миокарда после коронароакклюзии у крыс (Коновалова, Лапкин, Бескровнова, 1989).
СОД защищает, видимо, как от первичных повреждений ишемизированной ткани в ходе начавшейся коронароакклюзии, так и от усугубления повреждения после восстановления кро-вотока — когда повышение кислорода в ткани при восстановлении кровотока ведет к активации продукции АФК и усилению повреждения.
Имеются данные об активации СОД – повышении активности СОД в оттекающей от зоны инфаркта крови, при этом повышается и содержание перекиси (Rao, Mueller, 1983).
Косвенным показателем участия продуцируемых лейкоцитами АФК в патогенезе инфаркта служит и известный факт ухудшения прогноза при повышении степени лейкоцитоза при инфаркте; генерация АФК нейтрофилами и тяжесть стенокардии также параллельны.
Включение коэнзима Q (антиоксиданта, работающего на митохондриальном уровне), улучшает лечебные эффекты при стенокардии.
Интересные данные о влиянии коэнзима Q на эффекты гипербарической оксигенации: без антиоксидантов гипербарическая оксигенация приводит к временному ухудшению и стимулированию приступов стенокардии, с одновременным увеличением продукции АФК нейтрофилами; антиоксидантная терапия снимает эти эффекты, сохраняя лечебное действие гипербарической оксигенации (Аль-Хадиди, 1987).
Антиоксидантная терапия эффективна также в профилактике стенокардитических приступов и достоверно повышает толерантность к физической нагрузке (велоэргометрии).
Все выше перечисленные данные позволяют говорить о кислородном свободнорадикальном механизме аутоагрессии при ишемической болезни сердца и о целесообразности включения в лечение этих заболеваний средств, регулирующих продукцию и инактивацию АФК.
АФК В ПРОЦЕССАХ КАНЦЕРОГЕНЕЗА
Вопрос участия АФК в процессах возникновения опухолей постоянно привлекал к себе внимание исследователей, однако, до настоящего времени он фактически не однозначно не решен. Конкретный механизм индукции опухолей свободными радикалами мало понятен. Предполагают, что АФК повреждают хроматин, ДНК, мебраны, изменяют регуляцию внутриклеточного кальция и пр. (Кольтовер, 1998, Пескин, 1997, Dogru-Abbasoglu, Tanger-Toptani, Ugernal etc, 1997, Papa, Skulachev, 1997, Yan, Levine, Sohal, 1 997). Важным также является разнонаправленность изменений антиоксидант-ного статуса в различных органах (Кольтовер, 1998, Dogru-Abbasoglu etc., 1997, Papa, Skulachev, 1997), что соответствует и различной чувствительности к химическим канцерогенам и ионизирующему облучению.
С возрастом изменяется скорость накопления соматических мутация в разных тканях, причем она выше в печени, чем в мозгу (Dolle etc., 1997). Все это позволяет ряду авторов говорить о возможности использования антиоксидантов в качестве геропротекторов и средств коррекции возрастной патологии, в том числе опухолей, так как риск их возникновения выраженно растет с возрастом (Anisimov, Mylnikov, Khavinson, 1998, Cutler, 1991, Harman, 1994, Shigenaga, Hogen, Ames, 1994).
В настоящее время изучается и другой аспект участия АФК в процессах канцерогенеза, а именно – контроль АФК естественных цитотоксических реакций (Чекнеев, 1999).
Известно, что АФК участвуют в деструкции клеток-мишеней в процессах их взаимодействия с ЕК — естественными киллерами (Cameron, 1986, Saito etc., 1987). Антиоксиданты – диметилсульфоксид, диметилмочевина, этиловый спирт, этиленгликоль, снижают активность ЕК (Suthanthiran etc., 1984), как и обработка мононуклеаров миелопероксидазой (El-Hag, Clark, 1984) а ингибирование активности СОД хелатирующими комплексами усиливает цитотоксическую реакцию (Van Kessel etc., 1987).
В то же время, перекись водорода регуляторно повышает активность ЕК и выработку интерферона (Munakata etc., 1985).
В целом, видимо, имеет место сложная динамическая регуляция иммунной системы с участием АФК, в которой принимают участие, кроме выше описанных, также Р-белки сыворотки крови, обладающие СОД-активностью (Кульберг и др., 1986, Петяев, Кульберг, 1988) и комплексированные с ними сывороточные гамма-глобулины (Кульберг, Петяев, Замотаева, 1988), снижающие антенсивность свободнорадикальных процессов. В экологическом плане рассматривают также участие глобальной экспансии цианобактерий, оказывающих негативное влияние на активность ЕК-иммунитета (Кульберг, 1994, Чекнев, Кульберг, 1995).
УЧАСТИЕ АФК В ПРОЦЕССАХ СТАРЕНИЯ ОРГАНИЗМА
Старение организма – сложный и многогранный процесс, он не может быть в принципе сведен к одному конкретному механизму (наши ссылки), но среди групп влияний, играющих важную роль в старении, безусловно важное значение имеет механизм повреждения биомолекул самыми разнообразными внешними влияниями.
Среди таких влияний многие авторы давно пытались выделить наиболее значимые. Среди таких попыток один из наиболее значимых факторов оказался окислительный метаболизм – оказалось, что его интенсивность обратно пропорциональна продолжительности жизни для многих далеко отстоящих друг от друга видов, хотя некоторые исследователи отмечают, что это соблюдается достаточно хорошо только для относительного (на единицу массы) значения его, причем в расчете на единицу активности супероксиддисмутазы – ключевого фермента антиоксидантной защиты организма (Гродзинский и др., 1987, Дупленко, 1985, Azbel, 1994). Эти факты послужили основой для выдвижения свободнорадикальной теории старения.
Основное положение свободнорадикальной теории старения сформулировано было в 1954 году D.Harman, предположившим, что универсальной причиной старения служит свободнорадикальное окисление липидов, жиров и белков всех организмов кислородом воздуха (Harman, 1991). В дальнейшем было выполнено значительное число самых разнообразных работ в этой области, но каких-либо однозначно интерпретируемых результатов получено не было.
Так, митохондрии (основной потребитель кислорода клеток) старых животных не отличались значимо от таковых молодых (Кольтовер, 1996, 1998) по генерации супероксидного радикала, хотя отмечена структурная и функциональная неоднородность митохондрий старых животных, приводящая к значительным разбросам в результатах исследований и тенденция к повышению генерации АФК митохондриями старых животных все же имеет место (Кольтовер, 1996,Hagen etc.,1997).
Аналогично, микросомы – другой значимый источник супероксидных радикалов, в старости генерируют в 2 раза меньшие количества АФК, снижение же активности СОД цитоплазмы происходит всего на 40%, что явно компенсирует эти изменения (Гуськова, Виленчик, Кольтовер, 1998). В отдельных случаях активность СОД тканей может даже повышаться с возрастом (Dehaan etc., 1995). Активность ферментов антиоксидантной защиты, в принципе, зависит от нейро-эндокринной регуляции и может, таким образом, подтверждать не теорию повреждений, а регуляторную теорию старения (Bolzan etc., 1995).
Активность СОД мозга долгоживущих мышей оказывается выше, чем для короткоживущих линий (Kellog, Fridowich, 1976). Генетически измененные дрозофилы с повышенной активностью СОД живут дольше нормальных мух (Orr, Sohal, 1994). Ингибиторы свободнорадикальных механизмов (дибунол и пр.) увеличивают на 20-30% длительность жизни мышей (Обухова, Эммануэль, 1983, Harman, 1991). Для людей, однако, можно видеть противоположное – синдром Дауна с укорочением продолжительности жизни вдвое сопровождается ростом активности СОД тканей (Dehaan etc., 1995). Фармакокоррекция системы антиоксидантной защиты организма также мало достоверна – активность обычных ферментов (СОД, каталаза, перкосидаза) очень высока и специфична, поэтому способы фармакологического «тушения» антиоксидантов, видимо, мало эффективны в принципе. Более эффективны непрямые методы, например, нормализации функции митохондрий, где эффективны окись азота, кортикостероиды, тиреоидные гормоны (Koltover, 1995).
В то же время, с возрастом безусловно повышается содержание в тканях человека и животных продуктов окислительного повреждения макромолекул, в том числе ДНК (Гродзинский и др.,1987, Фролькис, Мурадян, 1988, Ozawa , 1997).
С нашей точки зрения, впрочем, это указывает лишь на снижение скорости метаболизма для организма в целом. Повреждения ДНК, однако, могут играть важную роль в мутагенезе в старости (Lee, Weindruch., Aiken, 1997, Ozawa, 1997).
Возможно, АФК стимулируют и апоптоз – программируемую гибель клеток, путем раскрытия каналов мембраны для белка, находящегося в межмембранном пространстве и запускающего этот процесс (Kroemer, 1997). АФК, несомненно, главный мутаген аэробных клеток.
АФК могут снижать скорость клеточного деления, возможно, влияя на так называемый «пределе клеточных делений Хейфлика» – культуральный феномен остановки клеточного роста после ряда пассажей культур на свежую среду.
Возможно влияние АФК на ускоренное укорочение концевых (теломерных) участков ДНК – процесс, которому придают важную роль как в клеточном делении, так и в его ограничении (Orr, Sohal , 1994).
Интересны данные получены при параллельном изучении продукции АФК тканями молодых и старых животных (Анисимов и др., 1999). Показано, что в головном мозгу старых животных почти в 2 раза снижается активность СОД; это, однако, не приводило ни к повышению концентрации диеновых конъюгатов ни к повышению показателей перекисного окисления белков или общей антиокислительной активности (содержание аскорбиновой кислоты, токоферола, мочевой килсоты, тиоловых соединений – глутатиона и др.), концентрация же шиффовых основания даже снижалась.
В то же время, в печени старых животных существенно повышалась концентрация шиффовых оснований и продуктов перекисного окисления белков, также при снижении активности СОД в 2 более раза; но не изменялись уровень общей антиокислительной активности и содержание диеновых конъюгатов.
В сыворотке старых крыс существенно повышалось содержание продуктов перекисного окисления липидов и белков при снижении активности СОД и общей антиокислительной активности сыворотки крови.
В литературе отмечены данные о существенном снижении в сыворотке крови пожилых и старых лиц (60-97 лет) уровня глутатиона и повышение продуктов перекисного окисления липидов (Nuttal, Martin, Hutchin etc, 1998). Возможно, накопление продуктов перекисного окисления липидов в мозгу играет роль и в патогенезе возрастной патологии мозга, включая болезнь Альцгеймера (Romero etc., 1998). Интересно, что эти изменения идут на фоне существенного снижения с возрастом генерации АФК в тканях старых животных и человека. В связи с этим снижение активности ферментов антиоксидазной защиты может в этих условиях быть результатом чисто регуляторных изменений – приспособления к пониженной продукции АФК.
Накопление же конечных продуктов повреждения тканей может быть результатом иных процессов – прежде всего, результатом снижения метаболизма и физиологической регенерации большинства самообновляющихся тканей в старости – в этих условиях снижается обновление всех макромолекул и биологических структур, что создает возможности для персистенции измененных форм макромолекул вследствие общего увеличения длительности их жизни.
Сейчас все больше склоняются к мнению, что наиболее значимым при старении оказывается усиленное перекисное окисление белков, а не липидов, чему способствует снижение активности СОД как результата снижения общей продукции АФК (Анисимов и др., 1999).
Общий анализ данных об участии АФК в процессах старения и сопровождающих старение заболеваний позволяет ряду авторов утверждать, что повреждение под действием АФК макромолекул приводит к мутациям, нестабильности генома в целом и развитию ряда возрастных патологий: рак, сердечно-сосудистые заболевания, возрастная иммунодепрессия, дисфункция мозга, катаракта и др. (Голубев, 1996, Кольтовер, 1998, Cutler, 1991, Dogru-Abbasoglu etc.,1997, Shigenag aetc., 1994).
Конкретный механизм индукции старения свободными радикалами мало понятен. Предполагают, что АФК повреждают хроматин, ДНК, мембраны, коллаген, изменяют регуляцию внутриклеточного кальция и пр. (Кольто-вер, 1998, Пескин , 1997, Dogru-Abbasoglu etc., 1997, Papa, Skulachev, 1997, Yan, Levine,etc., 1997). Важным также является разнонаправлен-ность изменений антиоксидантного статуса в различных органах (Кольтовер, 1998, Dogru-Abbasoglu etc., 1997, Papa., Skulachev, 1997), что соответствует и различной чувствительности к химическим канцерогенам и ионизирующему облучению. Скорость накопления соматических мутация в разных тканях может существенно различаться с возрастом, причем она выше в печени, чем в мозгу (Doll etc., 1997).
Все это позволяет говорить о возможности использования антиоксидантов в качестве геропротекторов и средств коррекции возрастной патологии (Anisimov etc., 1998, Cutler, 1991.
Данные, полученные на трансгенных дрозофилах с дополнительными копиями гена СОД и каталазы показали увеличение средней и максимальной продолжительности жизни (Orr, Sohal, 1994); трансгенные мыши с избыточной экспрессией СОД, каталазы и глутатион-пероксидазы обладали повышенной резистентностью к оксидативному стрессу, при снижении же активности этих генов мыши имели признаки преждевременного старения (Ho etc., 1998).
НЕКОТОРЫЕ ДРУГИЕ ЭФФЕКТЫ АФК
В последние годы все большее внимание привлекают физиологические эффекты АФК, которые оказались на удивление разнообразными.
Так, кислороду и АФК придают важное значение в процессах эволюции и видообразования (Скулачев, 1998), у целого ряда клеток АФК вызывают повышение клеточного деления (Nashio, Watanabe, 1992, Dypbukt etc., 1994, Bhunia etc., 1998, Lee S-L., Wang, Fanburg, 1998, Lee S-L., Wang W-W-, Fanburg, 1998), причем показано, что это регуляторный эффект, реализуемый через специфические белки (NF-kB, c-Jun, p21, p44MAPK, c-fos).
Достаточно изучен процесс регуляции АФК сосудистого тонуса (Rubanyi, 1998). Общеизвестен и хорошо изучен механизм «дыхательного взрыва» фагоцитов, являющийся главным компонентом неспецифической иммунной защиты организма.
Продуктам перекисного окисления липидов (ПОЛ) придают важное значение в процессах нормального обновления клеток и клеточных мембран – в поддержании структурного гомеостаза (Зенков, 1993).
Действие внешних прооксидантов, повышенное потребление кислорода, ионизирующее и ультрафиолетовое облучение, загрязнение воздуха, воды и продуктов, недостаток естественных антиоксидантов (витамины Е, К, А, селен и пр.), врожденная недостаточность ферментов антиокосидантной защиты, другие состояния могут приводить к напряжению системы антиоксидантной защиты организма и вызывать так называемый «оксидативный стресс», проявляющийся на молекулярном, клеточном и организменном уровне (Sies, 1991).
Подобный стресс, видимо, является патогенетическим моментом в развитии воспалительных, бронхо-легочных и сердечно-сосудистых заболеваний (Меньшикова, Зенков, 1991).
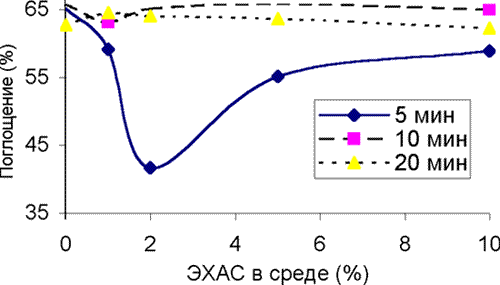
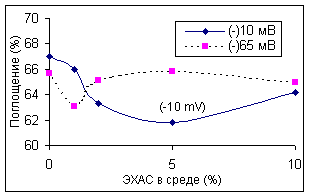
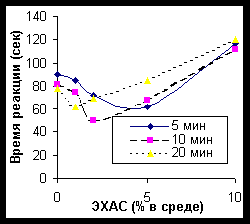
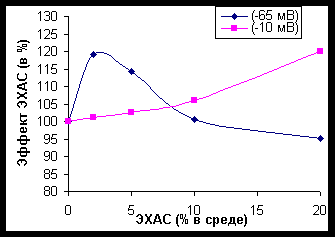
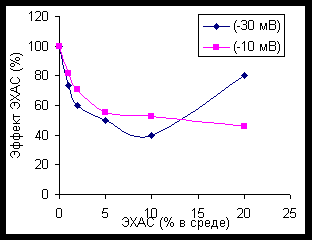
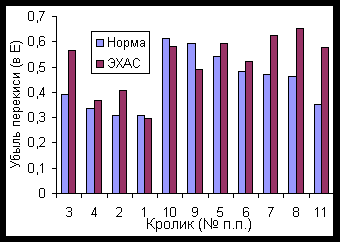
ЭХАС – НОВЫЙ МЕТОД ВОЗДЕЙСТВИЯ НА АНТИОКСИДАНТНУЮ СИСТЕМУ ПОЛУЧЕНИЕ И СВОЙСТВА ЭХАС
Существует путь фармакологической стимуляции антиоксидантных механизмов защиты организма. Такие фармакологические агенты оказались высоко эффективны в эксперименте и клинике как геропротекторы, проявляющие параллельно по данному же механизму свойства антиканцерогенов, радиопротекторов и вообще биостимулирующих веществ. Сейчас становится достаточно ясно, что важнейшим механизмом действия таких средств является влияние на окислительно восстановительный потенциал воды и макромолекул. До последнего времени было затруднительно использовать практически данный путь коррекции ОВП, так как расчетные требуемые количества препарата, который должен поступать длительно в организм, оказываются достаточно велики.
Однако, в настоящее время ситуация принципиальным образом меняется в связи с разработкой новых способов получения веществ с требуемыми показателями ОВП, совершенно безвредных для организма на основе обычной воды — электрохимически активированные системы – ЭХАС (Бабенко, Гойницкий, 1976, Бах, Зубкова, 1997, Бенина, Чегунова, 1974, Бобоходжаев, 1973, Гончарик , 1973, Громашевская и др., 1973).
Есть способ, позволяющий быстро, надежно и в широких масштабах изменять ОВП и рН внутренних сред организма: использование ЭЛЕКТРОХИМИЧЕСКИ АКТИВИРОВАННЫХ СИСТЕМ (ЭХАС) в виде водных растворов или даже просто воды, которая применяется в количестве 1-1,5 кг в сутки.
Метод ЭХАС позволяет вводить в организм стандартизированную по показателям ОВП и рН воду, обогащенную за счет электро-химической обработки по ОН- или Н+ группам и с регулируемым ОВП.
Одновременно в ходе обработки вода приобретает ряд ценных свойств — обеззараживается, дегазируется от хлора, детоксицируется за счет окисления-восстановления токсических соединений и удаляются путем перевода в нерастворимый осадок соли тяжелых металлов.
Известны три основных действующих фактора для ЭХАС:
— образование устойчивых химических соединений (кислот в анолите и щелочей в католите), изменяющих рН жидкости, чему в начале и уделяли главное внимание многие исследователи;
— формирование неустойчивых (метастабильных) суперактивных соединений (высоко окисленные формы ионов и молекул, свободные радикалы), что оказывает физико-химическое и тренирующее действие на системы защиты организма и изменяет ОВП;
— возникновение метастабильных структурных аномалий воды под действием электро-статического поля высокой напряженности у электродов (до 8 млн. вольт на см.), что не влияет на рН и ОВП, но выраженно изменяет биофизические свойства растворенных молекул и условия активации веществ в ходе ферментных реакций, изменяет реакции на границе пленок и клеточных мембран и пр.
В настоящее время имеется единственный патент на использование ЭХАС в клинической практике (Подколзин и соавт., 1993) для лечения гнойных ран, ожогов, воспалительных процессов слизистых оболочек и ряда иных патологических процессов кожи и слизистых.
Отмечены быстрая санация ран, раннее развитие грануляционной ткани, ускорение в 1,4 — 2 раза сроков заживления, улучшение приживления пересаживаемой кожи при ожогах, улучшение результатов лечения стоматологических и ЛОР-заболеваний и другие несомненные показатели благоприятного эффекта ЭХАС.
Отдельные клинические наблюдения, проведенные в других клинических группах, подтвердили эти наблюдения.
Так, показаны выраженные антибактериальные свойства анолита, превосходящие эффект многих современных антибиотиков, эффективность подавления роста таких устойчивых микроорганизмов, как синегнойная палочка, грибки кандида, другая устойчивая к антибиотикам микрофлора.
Католит способствовал ускорению регенерации, заживления и восстановления функций, снимал тканевой ацидоз и нормализовал многие параметры организма, нарушаемые в ходе патологического процесса.
Выраженные иммуностимулирующие свойства католита были показаны в прямых экспериментах с иммунизацией мышей эритроцитами барана. Количество антитело-образующих клеток (АТОК) в тесте Ерне на 4-й день после иммунизации животных повышалось в 4-6 раз. Введение католита позволяло восстановить иммунитет у мышей при моделировании иммунодефицита на примере фенилгидразиновой анемии, а также в случае экспериментального токсического гепатита, вызванного введением четырех-хлористого углерода, что позволяет использовать ЭХАС в случае вторичных иммунодефицитов.
Был исследован механизм иммуностимуляции в тестах кооперации Т-В лимфоцитов в системе Миллера и показано, что католит интенсифицирует процессы кооперации Т-В типа и одновременно угнетает функциональную активность антигенспецифических Т-супрессоров как на стадии формирования, так и отменяет их функциональный эффект для уже имеющихся клеток.
Важнейшим эффектом ЭХАС является способность метода очищать воду, используемую для самых различных целей.
Сравнение различных методов очистки воды показало высокие преимущества данного метода в сравнении со всеми известными способами очистки: микрофильтрации, ультрафильтрации, обратного осмоса, дистилляции, сорбции, ионного обмена, серебрения, иодирования, озонирования, хлорирования, ультрафиолетового облучения, кипячения, электродиализа, коагуляции, электролиза без диафрагмы и др.
Так, при 4-бальной системе оценки анолит обеспечивает 4-бальное очищение практически по всем параметрам: бактериального и вирусного загрязненяи, содержания микробных токсинов, фенолов, хлорорганических соединений, других органических загрязнителей, ионов тяжелых металлов и обеспечивается удовлетворительное удаление избытка минеральных солей.
Испытания показали, что анолит можно хранить и транспортировать в открытой и закрытой посуде без потери качества продукта в течение недель и месяцев; католит в нормальных условиях сохраняет свои качества в течение 1-2-х часов; в доверху плотно закупоренных бутылях — в течение 1-3-х дней.
Обращает на себя внимание, что ЭХАС — экологически чистые и совершенно не загрязняющие внешнюю среду жидкости — через несколько часов в окружающей среде они распадаются естественным образом, превращаясь в обычную воду, к тому же санируя среду обитания.
Установки типа «ИЗУМРУД» и «КРИСТАЛЛ» разрешены в настоящее время к производству для очистки питьевой воды, основные узлы запатентованы в СНГ и за рубежом и не имеют аналогов в мире.
Уже в настоящее время ЭХАС могут быть широко применены в медицине. Разрешено использование ЭХАС как экологически чистых моющих и дезинфицирующих растворов исходя из их уникальных бактериостатических свойств.
Выпускаются промышленно аппараты для очистки воды, в том числе для получения питьевой воды.
Имеется патентованный метод для наружного применения ЭХАС в медицине.
Наиболее перспективным представляется применение ЭХАС в медицине по следующим направлениям:
— использование АНОЛИТА как бактериостатического средства при инфицированных ранах, нагноительных внутренних процессах, воспалительных заболеваниях инфекционной природы самого различного происхождения и локализации (раны, ожоги, ЛОР- и стоматологические заболевания, кожные болезни, нефрология и пр.),
— использование КАТОЛИТА как средства, коррегирующего тканевой ацидоз, стимулирующего процессы регенерации тканей (раны, ожоги в фазе заживления, внутренние болезни),
— использование ЭХАС для коррекции острых (реанимационные состояния, острая фаза различных заболеваний) и хронических (болезни обмена, кожные болезни, болезни почек и печени и пр.) нарушения ОВП,
— использование ЭХАС как радиопротекторов при поражении ионизирующим облучением, лечебном воздействии ИО и цитостатиков,
— использование слабо минерализованных ЭХАС (водопроводная вода) получаемых на установках типа «Изумруд» или «Кристалл» как средства широкого общекоррегирующего и адаптогенного действия в ходе наружного (ванны, души) и внутреннего (для питья) применения,
Особый интерес представляет использование ЭХАС в геронтологической практике в связи с множественным благоприятным действием этих соединений на саму основу метаболических изменений при естественном и патологическом старении. Исходя из теории свободно-радикальных механизмов повреждения, представлений об энергетической недостаточности организма в пожилом возрасте и тканевом ацидозе и других, центральных для процесса старения механизмов, можно рекомендовать самое широкое применение ЭХАС для влияния на ключевые факторы старения и на вторичные его проявления, равно как и для повышения общего энергостатуса организма.
Использование ЭХАС для коррекции ОВП организма позволяет постоянно поддерживать энергостатус его на высоком уровне и противостоять самым различным внешним повреждающим воздействиям.
ВЛИЯНИЕ ЭХАС НА АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
Мы исследовали влияние ЭХАС на активность всех трех основных ферментов антиоксидантной защиты организма по выше описанным методам: активность каталазы определяли в реакции перекиси с молибдатом аммония, активность пероксидазы – по реакции с индигокармином, активность СОД – по реакции ингибирования восстановления НСТ супероксидными ионами, генерируемыми в реакции НАД*Н с ФМС. В качестве стандартов мы использовали отмытые и лизированные эритроциты кролика, хранящиеся в замороженном состоянии до момента исследования.
ЭХАС получали пропуска раствор хлористого натрия (1 г на 1 Л) через установку «Изумруд», имеющую 2 реакционных блока и обеспечивающую в наших условиях получение ЭХАС с окислительно-восстановительным потенциалом от +200 мВ до – 70 мВ. Определение и постоянный контроль за ОВП в течение опыта проводился на рН-метре с платиновыми электродами в стандартном режиме определения ОВП проб.
ВЛИЯНИЕ ЭХАС НА АКТИВНОСТЬ КАТАЛАЗЫ ЭРИТРОЦИТОВ КРОЛИКА
Мы использовали 0,1 мл лизированных 1:1000 эритроцитов кролика, обеспечивающих снижение поглощения света при 410 нм (эквивалентно снижению содержания субстрата, доступного для молибдата аммония) на 50%.
Рисунок 1. Влияние ЭХАС на каталазу эритроцитов кролика (время- и дозо-зависимые эффекты)
По оси ординат – поглощение субстрата (перекиси водорода + молибдат аммония)
Снижение показателей равноценной активированию каталазы
Преинкубация пробы эритроцитов с различными концентрациями ЭХАС в течение 5, 10 и 20 минут показала (рисунок 1), что во всех случаях наблюдается двуфазный эффект ЭХАС: быстрое активирование фермента и последующее возвращение с прежнему уровню активности или слабое ингибирование.
В зависимости от ОВП ЭХАС эффект также достигал максимума, а затем снижался в зависимости от концентрации ЭХАС в среде (рисунок 2), 10 минут преинкубации с ЭХАС). Анализ данных позволяет в целом заключить, что с повышением ОВП и концентрации ЭХАС в среде снижается и необходимое для активации фермента время инкубации.
Рисунок 2. Влияние ЭХАС на каталазу эритроцитов кролика (Влияние ОВП и концентрации ЭХАС в среде инкубации)
Обозначения как на рисунке 1
ВЛИЯНИЕ ЭХАС НА АКТИВНОСТЬ ПЕРОКСИДАЗЫ ЭРИТРОЦИТОВ КРОЛИКА
Изучение влияния ЭХАС на активность пероксидазы эритроцитов кролика показало, в целом, те же закономерности, что и влияние ЭХАС на активность каталазы. Для исследования влияния ЭХАС мы определили оптимальное время реакции, составившее в наших условиях 90-120 минут, достаточное для регистрации эффектов ЭХАС.
Титры перекиси и индигокармина также были оттитрованы в основной реакции, так как концентрации реактивов значимо влияли на точность определения реакции, регистрируемой по времени достижения стандартной окраски (в нашем случае – до полного обесцвечивания раствора, когда розовая окраска еще не начала развиваться), это обеспечило точность реакции в пределах 5-7 сек.
Чем больше концентрация ЭХАС использовалась для преинкубации с эритроцитами, тем меньшее время были необходимо для достижения максимума активации фермента (рисунок 3).
Рисунок 3. Влияние ЭХАС на активность пероксидазы эритроцитов кролика (время- и дозо- зависимость). Величина ОВП ЭХАС = — 50 мВ
По оси ординат – время реакции. Снижение времени реакции указывает на активирование пероксидазы.
В отличие от каталазы, ясно наблюдались отсроченные влияния второй фазы – подавление активности пероксидазы при высоких концентрациях ЭХАС в среде и длительном времени влияния ЭХАС на лизированные эритроциты. Сходные данные отмечены и при исследовании эффекта ЭХАС с различным ОВП (рисунок 4).
Рисунок 4. Влияние ЭХАС на активность пероксидазы эритроцитов кролика (влияние ОВП)
Время преинкубации – 10 минут
По оси ординат – эффект ЭХАС по отношению к контролю, принятому за 100%
ВЛИЯНИЕ ЭХАС НА АКТИВНОСТЬ СУПЕРОКСИДДИСМУТАЗЫ
Изучение влияния ЭХАС на активность рекомбинантной СОД человека показало принципиально те же влияния, что и на активность каталазы и пероксидазы: в малых концентрациях, при небольших временах инкубации и при небольших значениях ОВП имеет место стимулирование фермента, тогда как повышение концентрации ЭХАС в среде, увеличение отрицательных значений ОВП и продление времени преинкубации ЭХАС с ферментом ведет к подавлению активности СОД (рисунки 5-6).
Аналогичное действие ЭХАС оказывали и на СОД эритроцитов кролика: преинкубация ЭХАС в течение 5 минут с лизатом эритроцитов стимулировала эффект СОД в широком диапазоне доз (но повышение дозы снижало эффект!), преикубация в течение 10 минут имела бифазный вид влияния, а в течение 20 минут – только ингибировала активность СОД.
Причина действия ЭХАС заключается, видимо, в том, что ЭХАС сами были способны генерировать продукцию супероксидных радикалов, оказывая, таким образом, умеренное тренирующее действие на активность ферментов антиокосидантной защиты организма. Наличие отрицательного ОВП для ЭХАС указывает на избыток электронов, возникающий при электрохимической активации, что, в принципе, как раз и является условием генерации в биологических системах ионов супероксида.
Рисунок 5. Эффект ЭХАС на активность рекомбинантной СОД (дозо-временная — зависимость)
По оси ординат – эффект ЭХАС в %
(контрольная активность СОД принята за 100%) ОВП = — 65 мВ
Рисунок 6. Эффект ЭХАС на активность рекомбинантной СОД (ОВП — зависимость)
По оси ординат – эффект ЭХАС в %
(контрольная активность СОД принята за 100%)
Кроме того, большие отрицательные значения ОВП (-170 мВ в нашем случае) были способны инактивировать (видимо, окисляя) ингредиенты основной реакции: уже 5 минут инкубации с таким ЭХАС вызывало 22-25% снижение реакции ФМС+НАД*Н и НТС.
Таким образом, во всех случаях влияния ЭХАС на ферменты антиоксидантной защиты организма отмечены ясные дозо-зависимые влияния, зависимые от величины ОВП, концентрации ЭХАС в среде и времени преинкубации с эритроцитами. В целом, по любому параметру влияния ЭХАС достигали некоторого максимума и затем снижались, переходя в подавление активности фермента.
Влияние ЭХАС, видимо, связано с генерацией ЭХАС свободных радикалов, что в умеренных количествах способствует активации ферментов антиоксидантной защиты, то есть, ЭХАС оказывают тренирующее действие на активность ферментов антиоксидантной защиты. В больших количествах) дозах и длительном времени инкубации) ЭХАС подавляет активность этих ферментов, но в обычных условиях в организме практически не возможно достичь ингибирующих концентраций ЭХАС.
Таким образом, в зависимости от величины ОВП дозы и длительности действия, ЭХАС способны стимулировать антиоксидантные ферменты, генерировать продукцию свободных радикалов и инактивировать химические, и видимо биологические, молекулы (последний эффект лежит, очевидно, в основе известного антисептического действия ЭХАС при местном применении в значительных дозах, но фактические не достижим при применении вовнутрь).
Применение ЭХАС в клинической практике вполне оправдано для влияния на активность ферментов антиоксидантной системы организма и может объяснять многие влияния, отмеченные клиницистами при изучении влияния ЭХАС на различные физиологические и патологические процессы в организме как в клинической практике, так и в эксперименте на животных.
Так как антиоксидантные ферменты могут выражено влиять на явления старения клеток и тканей, а использование установок «Изумруд» одобрено для бытовой очистки воды, применение ЭХАС в широкой практике для практически здоровых лиц может быть эффективно тренирующим влиянием на ферменты антиоксидантной защиты организма, что дополняет экологическое влияние очистки воды и известные эффект активации типа «талой» воды – «гомогенизацию» воды (разрушение вторичной структуры воды) в ходе прохождения воды в таких установках через поля высокой электростатической активности.
ВЛИЯНИЕ ЭХАС НА АКТИВНОСТЬ ФЕРМЕНТОВ АНТИКОСИДАЗНОЙ ЗАЩИТЫ ОРГАНИЗМА in vivo
Для изучения влияния ЭХАС на активность ферментов антиоксидзной защиты в целостном организме исследовали влияние введения ЭХАС кроликам in vivo. Кролики получали с питьем в течение 2-х суток по 300 мл ЭХАС с начальной активностью ОВП= -70 мВ (содержание NaCl = 200 мг на 1 л). Затем исследовали уровень активности трех основных ферментов (пероксидазы, каталазы и СОД) в крови, а также реакцию этих ферментов на 10-минутную инкубацию со стандартным раствором ЭХАС (10% ЭХАС с 1 г на 1 л NaCl и с ОВП=-65 мВ) in vitro. Всего в контроле было 4 кролика и в опыте 10 кроликов.
ПЕРОКСИДАЗА.
Активность пероксидазы в контрольной группе составила в среднем 69,8 сек со стандартным отклонением 4,65 сек (разброс данных составил от 65 сек до 76 сек). В опытной группе время реакции снижалось, что указывает на активацию пероксидазы, до 52,9 сек (стандартное отклонение 17,99 сек), при более значительном разбросе активности фермента: от 30 сек до 75 сек. Видимо, такой разброс указывает на индивидуальные различия в активации фермента ЭХАС.
При воздействии ЭХАС на лизат эритроцитов оказалось, что в среднем имеет место тенденция к активации фермента в обеих группах, однако, большие разбросы данных делают заключение по средним значениям не достоверным (активация на 5,9 и 6,2 сек для контрольной и опытной групп соответственно при стандартном отклонении 11,5 и 8,9 сек).
Рассмотрение влияния ЭХАС по каждому из животных отдельно также не позволяет выявить ясных отличий – как при высоких, так и при низких значениях активности фермента влияние ЭХАС in vitro проявлялось как в активировании, так и в подавлении реакции.
КАТАЛАЗА
Активность каталазы в контрольной группе составила в среднем 0,335 условных единиц (выражено в единицах убыли экстинкции, что пропорцоионально количеству ферментированного субстрата – перекиси водорода), со стандартным отклонением 0,041 у.е. (разброс данных составил от 0,305 до 0,393 у.е.).
В опытной группе потребление субстрата за время реакции возрастало (наблюдалось активирование каталазы) до 0,503 у.е. (стандартное отклонение 0,089 у.е.), при более значительном разбросе активности фермента: от 0,353 до 0,613 у.е. Видимо, такой разброс указывает на индивидуальные различия в активации фермента под действием ЭХАС.
При воздействии ЭХАС на лизат эритроцитов оказалось, что в среднем имеет место тенденция к активации фермента в обеих группах (на 21,1 и 19,1 %% для контрольной и опытной групп соответственно), однако, большие разбросы данных делают заключение по средним значениям не достоверным (стандартные отклонения составили соответственно по группам 21,6 и 28,1 %%).
Рассмотрение влияния ЭХАС по каждому из животных отдельно показывает, что поение животных ЭХАС вызывает у всех (кроме кролика № 11) активацию фермента.
Сохраняется при средних и небольших значениях активации также стимулирующее влияние ЭХАС на лизат эритроцитов in vitro, которое хорошо видно для котнтрольных кроликов.
В то же время, сверхактивность (кролики 10 и 9) фермента in vivo сопровождается реверсией действия ЭХАС на лизат: в этом случае активность каталазы снижается (Рисунок 7).
СУПЕРОКСИДДИСМУТАЗА
Активность СОД в контрольной группе составила в среднем 0,098 условных единиц (выражено в единицах убыли экстинкции, что пропорционально количеству НСТ, защищенного от перексида, генерированного в реакции НАД*Н с ФМС), со стандартным отклонением 0,016 у.е. (разброс данных составил от 0,265 до 0,302 у.е.).
Рисунок 7. Влияние ЭХАС на активацию каталазы кролика при введении in vivo
Активность каталазы выражена в убыли экстинкции (Е), что соответствует ферментированному субстрату. Повышению Е соответствует повышение активности фермента
В опытной группе имело место некоторое подавление активности СОД — до 0,088 у.е. (стандартное отклонение 0,053 у.е.), при более значительном разбросе активности фермента: от 0,198 до 0,358 у.е. Видимо, такой разброс указывает на индивидуальные различия в активации фермента под действием ЭХАС.
При воздействии ЭХАС на лизат эритроцитов оказалось, что в среднем имеет место тенденция к снижению активности СОД для контрольной группы (7,6%) при значительном стандартном отклонении (38,2 %), делающем заключение по средним не корректным, тогда как для опытной группы имело место активирование СОД (17,2%), но также при значительном стандартном отклонении (58,8%)
Рассмотрение влияния ЭХАС по каждому из животных отдельно показывает, что поение животных ЭХАС вызывает как повышение, так и снижение активности СОД (Рисунок 8), причем как для контроля, так и для опыта повышенные значения активности СОД сопровождаются реверсией реакции на ЭХАС в тесте in vitro, тогда как сниженные значения СОД – активацией на воздействие ЭХАС на выделенные эритроциты кролика. Исключение составил кролик № 5 с очень низкими значениями СОД, который реагировал на ЭХАС дальнейшим снижением активности СОД.
Рисунок 8. Влияние ЭХАС на активацию СОД кролика при введении in vivo
Активность СОД выражена в убыли экстинкции (Е), в присутствии СОД, что соответствует количеству защищенного от супероксида субстрата (НСТ). Повышению Е соответствует повышение активности фермента.
Таким образом, в целом, влияние ЭХАС на активность ферментов антиоксидантной защиты у животных in vivo имеет, в принципе, те же характерные черты, что и влияние в тестах in vitro, однако, примешивается влияние индивидуальной реактивности к ЭХАС, что, скорее всего, отражается на временнном типе реакции на введение ЭХАС – одни животные могут в тестированные сроки иметь фазу активации, тогда как другие – фазу компенсаторного снижения активности фермента после введения ЭХАС. На это указывают значительные индивидуальные разбросы активности фермента в опытной группе при достаточно однородных значениях в контроле и различия в чувствительности к ЭХАС в тесте in vit ro для животных с высокой и низкой активностью фермента.
Влияния ЭХАС на каталазу были более длительными, чем на ферменты защиты от пероксидных радикалов, что соответствует, в принципе, стратегии действия этих ферментов: СОД и пероксидаза инактивируют реакционные агенты с очень короткими сроками жизни, тогда как каталаза – со значительно более длительными сроками.
Особое значение имеет безусловное выраженное индивидуальное различие во влиянии ЭХАС на изучаемые ферменты.
В целом, можно описать действие ЭХАС на активность ферментов антиоксидазной защиты организма, как время- и дозо- зависимое быстрое активирование, сменяющееся фазой понижения активности, при выраженном индивиудальном различии в реактивности. Эффект ЭХАС скорее всего связан с прямым генерированием АФК (видимо, в результате избытка электронов при отрицательном ОВП), что оказывает тренирующее действие на систему ферментов и может быть зарегистировано прямо в эксперименте; кроме того, при сверхнизких (ниже — 200 мв) отрицательных значениях ОВП имеет место прямое химическое (окислительное) инактивирование химических и, видимо, биологических макромолекул.
Исходя из сказанного, можно считать показаниями к действию ЭХАС:
- состояния, требущие антисептического действия (при ОВП= –200 мВ и ниже) ЭХАС,
- состояния, требующие повышения активности ферментов антиоксидантной защиты (ЭХАС используются в малых и умеренных дозах и при умеренных значениях ОВП= -10 –70 мВ), при ЭТОМ ЭХАС действуют как тренирующие агенты на систему ферментов и требуют учета как фона активности ферментов, так и индивидуальной реактивности организма – требуют подобра доз и контроля эффекта
ЛИТЕРАТУРА
1. Азизова О.А.,Осипов А.Н., Савов В.М. и др. // Биофизика. 1985. Т. 30. С.36-39.
2.Асатиани В.С. Ферментные методы анализа. М.:Наука. 1969. с.612
3. Аль-Хадиди М. Влияние ГБО, антиоксидантной терапии и их комбинации на свободнорадикальные процессы и клиническое течение стенокардии напряжения. Автореф. дис. канд. мед. наук. М.1987.
4. Анисимов В.Н.,Арутюнян А.В.,Опарина Т.И. и др. // Росс. физиол. журн. 1999. Вып.85. №4. С.502-507.
5. Бабенко А.Г., Гойницкий М.Н. // Лаб. дело. 1976. №3. С.157-158.
6. Бах А.Н., Зубкова С.А. // В: Сборник избранных трудов. П/ред. Бах А.Н. Л., 1997. С.412-415.
7. Бенина Н.Ф., Чегунова М.И. //Клин. Мед. 1974. №3. С.26-28.
8. Бобоходжаев М.Х. //Здравоох. Таджикистана. 1973. №6. С.11-15.
9. Ванин А.Ф. //Биохимия.1967.Т.32.С.277-282.
10. Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биомембранах. М.: Наука. 1972.
11. Второе республиканское совещание по электроактивированным средам. Казань. 1987
12. Гончарик И.И. //Актуальные проблемы теорет. и клинич. медицины. Минск. 1973. С.227-228.
13. Голубев А.Г.//Биохимия. 1996.Вып.61. С.2018-2039.
14. Громашевская Л.Л., Стремицкий Г.Ф., Гебеш В.В., Макаровская А.И. // Актуальные проблемы теорет. и клинич. медицины. Минск.1973. С.38-39.
15. Гродзинский Д.М., Войтенко В.П.,Кут- лахмедов Ю.А.,Кольтовер В.К. // Надежность и старение биологических систем. Киев: Наукова Думка, 1987.
16. Гуськова Р.А., Виленчик М.М., Кольтовер В.К. //Биофизика. 1998. Т.25. С.102-105.
17. Деев А.И., Осис Ю.Г., Формазюк В.Е. и др. //Биофизика. 1987. Т. 32. С. 629-636.
18. Донцов В.И., Крутько В.Н., Подколзин А.А. Старение: механизмы и пути преодоления. М.: Биоинформсервис. 1997.
19. ДубинаЕ.Е. и др.//Лаб.дело. 1988. N8. С.16-19.
20. Дупленко Ю.К. Старение: очерки развития проблемы. Л.: Наука. 1985.
21. Зенков Н.К., Меньшикова Е.Б.//Успехи современной биологии. 1993.Т.113.Вып.3. С.286-296.
22. Каган В.Е., Азизова О.А., Архипенко Ю.В. и др. //Биофизика. 1977. Т. 22. С. 625-630.
23. Каган В.Е., Сербинова А.Е.,Минин А.А. и др. //Биохимия. 1985. Т. 50. С. 986-991.
24. Клебанов Г.И., Туркменова Э.М., Крейнина М.В. и др.//Биол.мембраны.1987.Т.4. С. 1084-1092.
25. Красновский А.А. Синглетный кислород в фотобиотических процессах.:Дис.д-ра биол.наук.. М., 1983. 356 с.
26. Кольтовер В.К.// Успехи геронтологии. 1998. Вып.2. С.37-42.
27. Коган А.Х.//Вестник РАМН. 1999.№ 2.С.7-10.
28. Кольтовер В.К.//Успехи геронтологии. 1998. Вып.2. С.37-42.
29. Кольтовер В.К. // Хим.физика. 1996. Т.15. С.101-106.
30. Королюк М.А., Иванова Л.И.,Майорова И.Г., Токорева В.Е.//Лаб.дело. 1988. N1.С. 16-19.
31. Коган А.Х.//Вестник РАМН.1999.№ 2. С.7-10.
32. Коган А.Х., Кудрин А.Н., Лосев Н.И. Антиоксидантная защита сердца при экспериментальном инфаркте миокарда. М.:1987.
33. Коган А.Х., Кудрин А.Н.,Кактурский Л.В. и др.//Пат. физиол. 1992. №.2. С. 5-15.
34. Коновалова Г.Г., Лапкин В.З., Бескровнова Н.Н. //Арх.патол 1989. Т.51. №6. С.19-24.
35. Кульберг А.Я.,Елистратова И.А.,Тарханова И.А. и др. //Иммунология. 1986, №2. С.14-18.
36. Кульберг А.Я.,Петяев И.М.,Замотаева Н.Г.//Иммунология. 1988. №3. С.37-40.
37. Кульберг А.Я. Экологический кризис: стратегия выживания. М.:1994.
38. Лапкин В.З.,Коган А.Х.,Ковалевская А.Л. и др.// Бюл. эксперим. биол. мед. 1982. Т.93. №5. С.58-60.
39. Маянский А.Н., Маянский Д.Н. Очерки о нейтрофиле и макрофаге. Новосибирск. Наука. 1983. 264 с.
40. Меерсон Ф.З., Адыкалиев Н.А., Голубева Л.И. //Бюл. эксперим. биол. мед. 1981. Т. 91. С. 1167-1169.
41. Меньшикова Е.Б., Зенков Н.К.// Тер.архив. 1991. №11. С.85.
42. Осипов А.Н., Азизова О.А.,Владимиров Ю.В. Активные формы кислорода и их роль в организме.//Успехи.биол.химии. 1990. Т. 31. С. 180-208
43. Обухова Л.К., Эммануэль Н.М. // Успехи химии. 1983. Т.52. С.353-372.
44.Петяев И.М.,Кульберг А.Я.// Иммунология. 1988. №5. С.12-14.
45. Подколзин А.А., Донцов В.И. Факторы малой интенсивности в биоактивации и иммунокоррекции. М.:1995.
46. Подколзин А.А., Хасанов Р.Ш. Заявка на изобретение N 365284.13 (121800) от 9.08.1983.
47. Раппопорт Г.Л., Кекало Л.А., Бабенко Н.А. и др. //Пульмонология. Киев. 1977. Вып. 3. С.79-82.
48. Рябинский В.С. //Лаб.дело. 1970. № 3. С. 177-179.
49. Скулачев В.П//Биохимия. 1998. Т.63. Вып.11. С.1570-1579.
50. Тез. Всерос. конф.»Методы и средства стерилизации и дезинфекции в медицине».М., 1992.
51. Тез. Второй Всерос. конф. Применение электроактивированных методов в медицине». Конаково. 1989.
52. Фролькис В.В., Мурадян Х.К. Экспери-ментальные пути продления жизни. //Л.:Наука. 1988.
53. Шукурова Р.А. //Здравоохр. Таджикистана. 1974. № 6. С. 31-33.
54. Чевари С., Чаба И., Секей Й. //Лаб.дело. 1981. N 11 С. 678-680.
55. Ченеев С.Б. //Вестник РАМН.1999.№2. С.10-15.
56. Ченеев С.Б., Кульберг А.Я.// Иммунология. 1995. №2. С.9-12.
57. Albich J.M., McCarthy C.A.,Hurst J.K. //Proc.Nat.Acad.Sci. USA 1981. Vol. 78. P. 210-216.
58. Allen R.C.//Chemical and biological generation of exited states.N.Y.:Acad.press. 1982. P.310—344.
59. Ambruso D.R., Johnston R.B.// J.Clin. Invest. 1981. Vol.67.P.350-360.
60. Anbar M.,Neta P.// Intern.J. Appl. Rediat. Isot. 1967. Vol.18,P.495-523.
61. Anisimov V.N.,Mylnikov S.V.,Khavinson V.Kh.//Mech.Ageing.Devel.1998.Vol.103.P.123-132.
62. Azbel M.Ya. // Proc.Natl.Acad.Sci.USA. 1994. Vol. 91. P.12453-12457.
63. Babior B.M. / /N.Eng.J.Med. 1978. Vol.298. P.659-668.
64. Babior B.M. // N.Eng.J.Med. 1978. Vol.298. P.721-725.
65. Bachur N.R., Gordon S.L., Ggee M.V.// Mol.Pharmacol. 1977. Vol.13, P.901 — 910.
66. Badway J.A.,Karnovsky M.L.//Annu.Rev. Biochem. 1980. Vol.49. P.695-716.
67. Bannister J.V.,Bannister W.H., Hill H.A., Thornalley P.J.//Biochem.et biophys. acta. 1982. Vol.715. P.116-120.
68. Banatti U., Morelli A.,Guida L.,de Flora A.//Biochem. and Biophys. Res. Commun. 1983. Vol. 111. P.980-987.
69. Bennett R.M., Eddie-Quartey A.C., Holt P.L.//Arthritis and Rheum. 1973. Vol.16. P.186-190.
70. Bennett R.M.,Skosey J.L.//Arthritis and Rheum.1977.Vol.20.P.84-90.
71. Bergmeyer H.U. / /Biochem.Ztschr. 1955. Vol.327. P.255-259.
72. Beyer W.F., Fridovich I.//Anal.Biochem. 1987. Vol.161. P.566-599.
73. Bhuyan K.C., Bhuyan D.K.//Biochim. et biophys.ata. 1977. vol.497. P.641-651.
74. Bielsky B.H., Arudi R.L.,Sutherland M.W.// J.Biol.Chem. 1983. Vol.258. P.4759-4761.
75. Bhunia A.K., Han H., Snowden A. etc.// J.Biol.Chem. 1998. Vol.272. P.15642-15649.
76. Bonnichsen R.K.//Acta chem.scand. 1948. Vol.2. P.781-787.
77. Bowern N., Ramshow I.A.,Clark I.A. etc.// J.Exp.Med. 1984. Vol.160.P.1532-1543.
78. Bolzan A.D., Brown O.A., Goya R.G., Bianchi M.S. //Exp.Gerontol.1995. Vol.30. P.169-175.
79. Bodnar A.G., Ouellette M., Frolkis M. etc.//Science. 1998. Vol. 279. P. 439-452.
80. Caruntu F.//Rom.Med.Rev. 1970.Vol.14.P.74-77.
81. Cameron D.J.//Jap.J.Med. 1986. Vol.56. N4. P.135-140.
82. Clark I., Hunt N.H.//Infect. and Immun. 1983. Vol.39. P.1-6.
83. Cohen G., DembiecD., Marcus J. // Anal. Biochem. 1970.Vol.34.P.30-38.
84. Cagnon M., Charbonneau R., Therrien J., Baril M.//Rev.canad.Biol.1976. Vol. 35. P.177-180.
85. Cutler R//Annu.N.Y.Acad.Sci. 1991. Vol.621. P.1-28.
86. Demopoulos H.B.,Flamm E.S.,Pietronigro D.D. etc.//Acta physiol. scand. 1982. Suppl.492. P.91-120.
87. Duran N. // Chemical and biological generation of exited states. N.Y.: Acad. press. 1982. P.345-359.
88. Dehaan J.B.,Cristiano F., Ianello R.C., Kola I. //Biochem.and Mol.Biol.Inter. 1995. Vol.35. P.1281-1297.
89. Dolle M.E.,Giese H.,Hopkins C.L. etc.// Nature Genetics. 1997.Vol.17.P.431-434.
90. Dogru-Abbasoglu S., Tanger-Toptani S., Ugernal B. etc. // Mech.Ageing.Devel. 1997. Vol.98. P.177-180.
91. Dypbukt J.M., Ankarkrona M., Burkitt M. etc.//J.Biol.Chem. 1994. Vol. 269. P. 30553-30560.
92. Edwards S.W., Hallett M.B., Lloyd D. etc.//FEBS Lett. 1983. Vol.161.P.60-64.
93. Flitter W.,Rawley D.A.,Haliwell B.//FEBS Lett. 1983. Vol.158. P.310-312.
94. Floyd R.A.//Arch. Biochem. and Biophys. 1983. Vol.225.P.263-270.
95. Frank B.//Angew.Chem.Intern. Ed. 1982. Vol.21. P.343-353.
95. Frew J.E., Jones P., Sholes G.// Anal. chim. acta. 1983. Vol.155. P.139-146.
97. Goth L.,Meszaros I., Nemeth H.//Clin. Chem. 1982. Vol. 28. P.1999-2000.
98. Goth L.//Hung.scient.instrum.1982.N 58.P.43-45.
99. Goth L., Nemeth H., Meszaros I.//Clin.Chem. 1983. Vol. 29. P. 741-743.
100. Gross J.,Hartwig A.,Golding A.//Z.med. Labortech. 1975. Bd. 16, S.336-339.
101. Gabing T.G.,Babior B.M.//Blood. 1979. Vol.53. N6. P.1133-1139.
102. Harman D. // Annu. N.Y. Acad.Sci. 1994. Vol.717. P.1-15.
103. Hejnecke J.W.//Free Rad.Biol.Med. 1987. Vol.3. P.65-76.
104. Hagen T.M., Yowe D.L., Bartholemew J.C. et al.//Proc.Natl.Acad.Sci.USA. 1997. Vol. 94. P.3064-3069.
105. Harman D. // Proc. Natl. Acad. Sci. USA. 1991. Vol. 88. P.5360-5363.
106. Ho Y.-S.,Magnenat J.-L.,Gargano M. etc.// Environ.Health Perspect.1998. Vol.106. P.1219-1228.
107. Ioshikawa Y., Yokoo T., Kitamura M. // Biochem. Biophys. Res. Commun. 1997. Vol. 240. P. 496-501.
108. Jacobs A. // Semin.Hematol. 1977. Vol. 14. P.89-113.
109. Keston A.S., Brandt R. // Anal. Biochem. 1965. Vol.11. P.1-9.
110. Khan A.U.//Science.1970. Vol.168. P.476-482.
111. Klebanoff S.J.,Clark R.A. The niutrophil: function and clinical disorders. Amsterdam: North-Holland. 1978. 313 p.
112. Kellog E.W., Fridowich I. // J.Gerontol. 1976. Vol.31. P.405-408.
113. Koltover V.K. //Age.1995.Vol.18. N.3. P.85-89.
114. Kroemer G. // Cell Death and Differentiation. 1997. Vol.4. P.443-456.
115. Kogan A.Kh.,Kudrin A.N.//J. Molec. Cell. Cardiol. 1980. Vol. 12. Suppl.1. P.75.
116. Kogan A.Kh., Grachyov S.,Sumarokov A.// Oxidativ Stress and Redox Regulation: Abstracts. Paris. 1996. P.300.
117. Lee C.M., Weindruch R., Aiken J.M. // Free Radical Biol. Med. 1997. Vol.22. P.1259-1269.
118. Luis D.R., Ortega M.G.,Lopez A.L., Gorge J.L.//Analyt.Biochem. 1977. Vol.80. P.409-415.
119. Lee S-L., Wang W.W., Fanburg B.L.//Free Rad.Biol.Med. 1998. Vol. 24. P. 855-858.
120. Marcuse R.,Johnston L.//J.Amer.Oil Chem. soc. 1973. Vol.50. P.387-391.
121. Massey V.//Biochim. et biophys.acta. 1959. Vol.34. P.255-262.
122. Matsuo M., Gomi F., Kuramoto K., Sagai M. //J.Gerontol. 1993. Vol.48. B.133-138.
123. McCord J.M.//Agents and Actions. 1980. Vol.10. P.522-527.
124. McCord J.M.,Fridovich I.//Agents and Actions. 1969. Vol.244. P.6049-6055.
125. Meerhof L.J., Roos D.//J.Reticuloendothel. Soc. 1980. Vol. 28. P.419-425.
126. Mello Filho A.C., Hoffman M.E., Meneghini R. //Biochem. J. 1984. Vol.218. P.273-275.
127. Mercel P.B.,Kearns D.R.//J/Amer.Chem. Soc. 1972. Vol.94. P.7244-7248.
128. Misra H.P., Frodowich I. //J.Biol.Chem. 1972. Vol.247. P.3170-3175.
129. Mustafa M.G. // Free Radicals Biol. and Med. 1990. Vol. 9. P.245.
130. Munakata T.,Semba U.,Shibuya Y.etc.// J.Immunol. 1985. Vol.134. N4. P.2449-2455.
131. Myers C.E.,McGuire W.P., Liss R.H. etc.// Science. 1977. Vol.197. P.165-167.
132. Nashio E., Watanabe Y.//Biochem. Biophys. Res. Commun. 1992. Vol. 232. P. 1-4
133. Nohl H.//Free radicals, aging and degenerative disease. N.Y.: Liss, 1986. P.77-97.
134. Nuttal S.L.,Martin U.,Hutchin T.etc.// Age&Ageing. 1998. Vol.27. P.34.
135. O`Connel M.J., Garner A.//Intern.J. Radiat. Biol. 1983. Vol.44. P.615-625.
136. Orr W.C., Sohal R.S. //Science. 1994. Vol.18. P. 127-137.
137. Ozawa T. //Physiol. Rev. 1997. Vol.77. N.2. P.425-464.
138. Papa S.,Skulachev V.P.//Molec.Cell. Biochem. 1997. Vol.174.P.305-319.
139. Perschke H., Broda E.//Nature. 1961. Vol.190. P.257-261.
140. Rao P.S.,Mueller H.S.//Advanc.Exp.Med. Biol. 1983. Vol.161. P.347-364.
141. Romero F.J.,Bosch-Morell F.,Romero M.J. etc.//Environ. Health Perspect. 1998. Vol.106. P.1229-1234.
142. Romson J., Hook B., Kunkel S. etc.// Circulation. 1983. Vol.67. P.1016-1023.
143. Rosen G.M., Finkelstein E., Rauckman E.J.//Arch.Biochem. and Biophys. 1982. Vol.215. P.367-379.
144. Roschupkin D.I., Pelenitsin A.B., Potapenko A. Ya. etc. // Photochem.and Photobiol. 1975. Vol.21. P.63-69.
145. Rowley D.A., Halliwell B. // FEBS Lett. 1982. Vol.142. P.39-41.
146. Rubanyi C.M. //Free Radicals Biol. and Med. 1988. Vol. 4. P.107.
147. Saito H.,Hayakawa T.,Yui Y. etc.// Int.Arch.Allergy. 1987. Vol. 76. N1. P.92-96.
148. Segal A.W.,Jones O.T.G.//Nature.1978. Vol.276. P.515-518.
149. Sies H.//Amer. J. Med. 1991. Vol. 91. P. 31.
150. Sinha G.K., Mimnough E.G.// //Free Radicals Biol. and Med. 1990. Vol.8. P.567.
151. Shigenaga M.K., Hogen T.M., Ames B.N.// Proc..Nat.Acad.Sci.USA 1994. Vol.91. P.10771.
152. Suthanthiran M., Solomon S.D., Williams P.S. etc.//Nature. 1984.Vol.307. P.276-278.
153. Thomspson J.A., Hess M.L.//Progr. Cardiovasc. Dis. 1986. Vol.28. P.449-462.
154. Van Kessel K.P., Visser M.R., VanStrijp J.A. etc.//Immunology. 1987. Vol.62. N4. P.675.
155. Vladimirov Yu.A.//Free radicals, aging and degenerative diseases. N.Y.: liss, 1986. P.141-195.
156. Vladimirov Yu.A.//Sov.Med.Rev.B. Phy-sicochem Asp.Med. Harwood Acad.Publ. 1987. Vol.1. P.51-127.
157. Vladimirov Yu.A., Olenev V.I., Suslova N.B.,Cheremissina Z.P.//Adv.Lipid.Res. 1980. Vol.17. P.173-249.
158. Von Zglinicki T., Sarezki G., Doccke W. etc.//Exp.Cell.Res.1995.Vol. 220. P.186-193.
159. Ward P.A., Till G.O., Kunkel R. etc.// J.Clin.Invest. 1983. Vol.72. P.789-801.
160. Werns S.W., Shea M.J., Driscoll E.M. etc.// Circulat.Res. 1985. Vol.56. P.895-899.
161. White B.C., Aust S.D., Arfors K.E. atc.// Ann.Emerg.Med. 1984. Vol.13. pt 2. P.127-132.
162. Woodward B., Zabaria M. // J.Mol.and Cell.Cardiol. 1985. Vol.17. P.485-493.
163. Yan L.-J., Levine R.L., Sohal R.S.// Proc..Nat.Acad.Sci.USA. 1997. Vol.94. P.11168.
164. Yunis J.J.//Science. 1983. Vol.221. P.227.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)