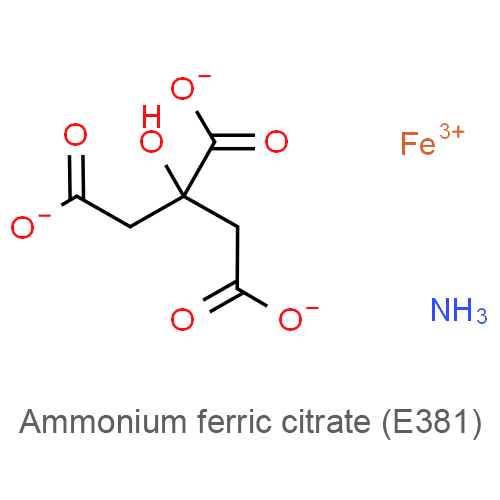
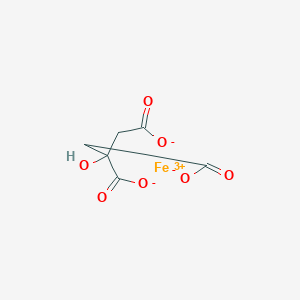
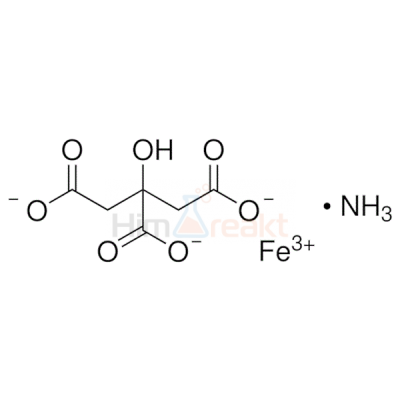
Цитраты аммония-железа
Описание
Пищевая добавка E381 (цитраты аммония-железа) — относится к регуляторам кислотности, антиокислителям и антиоксидантам искусственного происхождения, используется в технологических целях в процессе производства пищевых продуктов.
Польза
Научные данные о пользе применения пищевой добавки Е381 для здоровья человека в настоящий момент отсутствуют.
Вред
При чрезмерном и регулярном потреблении может провоцировать рвоту, понос (признаки отравления), изменение цвета стула — чёрный, мочи — розовый. При прямом контакте негативно влияет на дыхательную систему, при контакте с кожей вызывает ожог.
Запрещён к применению в детском питании.
Применение
Пищевая добавка E381 может применяться при производстве хлебобулочных и мучных кондитерских изделий, слабоалкогольных напитков; использоваться как заменитель поваренной соли.
Железо-аммонийный цитрат может применяться в качестве химического разрыхлителя теста (химический аналог дрожжей). Препятствует комкованию и слёживанию.
Другие сферы применения: очистка воды; в качестве восстановителя солей металлов низкой активности, таких как золото и серебро.
Правовой статус
С 2010 года добавка Е381 исключена из списка разрешённых в пищевой промышленности в Российской Федерации.
Характеристика
- E381
-
Название вещества:
Цитраты аммония-железа -
Английское название:
Ammonium ferric citrate - Категория:
- Происхождение:
-
Опасность:
-
Синонимы:
цитрат железа (III)-аммония, лимонно-кислое железоаммонийное, железоаммонийный цитрат, Е381, NS number 381, Е-381, E number 381, E381 food additive -
Состояние:
порошок с кристаллами разного размера (могут присутствовать пластинки, гранулы, чешуйки и другие формы частичек) -
Запах:
слабый аммиачный -
Максимально допустимая суточная доза на 1 кг массы тела:
0,8 мг/кг -
Формула:
Fe(NH4)3(C6H5O7)2
Схема
Подробнее по теме
Ознакомьтесь с дополнительной информацией о пищевой добавке E381:
- Отзывы
- Вопросы
Цитрат железа (III)
Цена по запросу
-
Описание
Описание
Цитрат железа (III) — красно-коричневое кристаллическое твердое вещество, которое играет важную роль в метаболизме железа живыми организмами. Он снижает всасывание фосфата в кишечнике путем осаждения по механизму, аналогичному используемым в настоящее время солям алюминия, кальция и лантана. Цитрат железа (III) получают реакцией лимонной кислоты с гидроксидом железа. Он медленно растворяется в воде и практически не растворим в спирте. Не совместим с сильными окислителями. Цитрат железа (III) используется в медицине для регулирования уровня железа в крови у пациентов с хроническим заболеванием почек, находящихся на диализе.
CAS: 3522-50-7
Синонимы: Цитрат железа, цитрат железа, цитрат железа (3+), цитрат железа (III), цитрат железа (III), цитрат железа (VAN), лимонная кислота, соль железа, цитрат железа, FeC6H5O7, лимонная кислота, железо (3+) ) соль, CCRIS 6843, тетрагидрат цитрата железа (III), железо (водородный цитрато (3 -)) -, EINECS 219-045-4, EINECS 222-536-6, EINECS 249-117-0, лимонная кислота, железо (3+) соль (1: 1), NSC 112227, железо 2-гидрокси-1,2,3-пропантрикарбоксилат, лимонная кислота, соль железа (3+) (1: 1) (8 Cl), 1,2,3 -Пропанетрикарбоновая кислота, 2-гидрокси-, соль железа
| Molecular Formula: | C6H5FeO7 | Molecular Weight: | 244.944700 [g/mol] |
-
Описание
Описание
Цитрат железа (III) — красно-коричневое кристаллическое твердое вещество, которое играет важную роль в метаболизме железа живыми организмами. Он снижает всасывание фосфата в кишечнике путем осаждения по механизму, аналогичному используемым в настоящее время солям алюминия, кальция и лантана. Цитрат железа (III) получают реакцией лимонной кислоты с гидроксидом железа. Он медленно растворяется в воде и практически не растворим в спирте. Не совместим с сильными окислителями. Цитрат железа (III) используется в медицине для регулирования уровня железа в крови у пациентов с хроническим заболеванием почек, находящихся на диализе.
CAS: 3522-50-7
Синонимы: Цитрат железа, цитрат железа, цитрат железа (3+), цитрат железа (III), цитрат железа (III), цитрат железа (VAN), лимонная кислота, соль железа, цитрат железа, FeC6H5O7, лимонная кислота, железо (3+) ) соль, CCRIS 6843, тетрагидрат цитрата железа (III), железо (водородный цитрато (3 -)) -, EINECS 219-045-4, EINECS 222-536-6, EINECS 249-117-0, лимонная кислота, железо (3+) соль (1: 1), NSC 112227, железо 2-гидрокси-1,2,3-пропантрикарбоксилат, лимонная кислота, соль железа (3+) (1: 1) (8 Cl), 1,2,3 -Пропанетрикарбоновая кислота, 2-гидрокси-, соль железа
| Molecular Formula: | C6H5FeO7 | Molecular Weight: | 244.944700 [g/mol] |
Цитрат железа
Имя: лимонная кислота, соль железа (2+)
CAS: 23383-11-1
Синонимы: цитрат железа(II)
Цитрат моноферрокрасой кислоты: лимонная кислота, соль железа (2+)
Отправить запросТеперь говорите
Подробная информация о продукции
|
Имя |
Лимонная кислота, соль железа (2+) |
|
КАС |
23383-11-1 |
|
Синонимы |
Цитрат железа(II) |
|
Цитрат моноферрокрасой кислоты |
Лимонная кислота, соль железа (2+) |
|
Цитрат железа моногидрат |
2-гидрокси-1,2,3-пропантрикарбоновая кислота/железо,(1:x) соль |
|
EINECS(EC#) |
245-625-1 |
|
Молекулярная формула |
C12H10Фе3O14 |
|
Молекулярная масса |
545.734 |
|
Точка плавления |
Разлагается при H2 при 350°C [CRC10] |
|
Растворимость в воде |
Нерастворимый H2O, спирт, ацетон [MER06] |
горячая этикетка : цитрат железа, Китай, производители, поставщики, завод, в наличии
сопутствующие товары
-
Милтефозин 58066-85-6
-
Гексафторциркониевая кислота
-
Колесевелам 182815-44-7
-
Дифтороатетическая кислота
-
Аргирелин
-
N-ацетилкапролактам 1888-91-1
Запрос
Copyright © Hangzhou Keying Chem Co., Ltd. Все права защищены.
CAS номер: 1185-57-5
Синонимы: Аммоний железо (III) цитрат; Ammonium iron(3+) 2-hydroxy-1,2,3-propanetricarboxylate; Iron (III) ammonium citrate; 1,2,3-Propanetricarboxylic acid 2-hydroxy ammonium iron(3+) salt; Цитрат железа (III) аммония; Лимоннокислое железо-аммоний; Аммоний-железо (III) лимоннокислый; Железо лимонноамиачное зеленое;
Производитель: Китай
Физико-химические свойства:
Химическая формула: 2FeC₆H₅O₇•(NH₄)₂C₆H₆O₇; С₆Н₁₁FеNО₇; Молярная масса: 265,00 г/моль
Плотность: 1,8 г/см³
Температура кипения: 197°C
Описание и внешний вид:
Аммоний железо(III) цитрат неорганическое соединение, кислая соль железа, аммония и лимонной кислоты. Представляет собой твердое порошкообразное вещество, со слабым запахом аммиака, с солоноватым, железистым вкусом, в зависимости от содержания железа может быть желтовато-коричневого, зеленого или красного цвета.
Хорошо растворяется в воде, не растворяется в этиловом спирте. Разлагается под действием света. Цитрат железа аммония можно получить добавлением гидроксида железа к водному раствору лимонной кислоты и аммиака.
Область применения:
Применяется для очистки воды.
При изготовлении чертежей.
В фотоделе для фотографического процесса цианотипии.
Используется в медицине в качестве контрастного вещества для магнитно-резонансной томографии. Для профилактики и лечения анемии.
В качестве восстановителя солей металлов низкой активности, таких как золото и серебро. Применяется в качестве кормовой добавки. Участвует в производстве пищевых добавок, ароматизаторов.
Меры безопасности:
Не является лекарственным (фармацевтическим) препаратом, не предназначен для проведения любых медицинских исследований или процедур.
Воздействие вещества в виде пыли или раствора способствует возникновению раздражения слизистых оболочек глаз, кожи и дыхательных путей.
Вещество опасно при проглатывании и попадании внутрь организма, не предназначено для употребления или наружного применения.
Относится к горючим материалам.
При горении выделяет токсичный, едкий дым, ядовитые, раздражающие пары и газы оксидов азота, окиси углерода, диоксида углерода.
Стабилен при нормальных условиях использования и хранения.
Хранить рекомендуется в плотно закрытой таре, в прохладном, сухом, хорошо проветриваемом помещении, избегая контакта другими несовместимыми веществами, вдали от источников тепла, искр или пламени. При работе рекомендуется использовать респиратор, спецодежду, защитные перчатки, сапоги и очки.
Необходимо соблюдать правила личной гигиены, запрещается принимать пищу, пить и курить во время работы с реактивом.
Помещение для работы должно быть оборудовано общей приточно-вытяжной вентиляцией.
Содержание
- Получение
- Физические свойства
- Применение
Цитрат железа(III) — неорганическое соединение, соль железа и лимонной кислоты с формулой FeC6H5O7, красно-коричневые кристаллы, растворяется в воде, образует кристаллогидрат.
| Цитрат железа(III) | |
|---|---|
| Общие | |
| Систематическое наименование |
Цитрат железа(III) |
| Традиционные названия | Лимоннокислое железо |
| Хим. формула | FeC6H5O7 |
| Физические свойства | |
| Состояние | красно-коричневые кристаллы |
| Молярная масса | 244,94 г/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | растворяется |
| • в этаноле | не растворяется |
| Классификация | |
| Рег. номер CAS | 3522-50-7, 7705-15-9 |
| PubChem | 61300 |
| Рег. номер EINECS | 222-536-6 |
| InChI |
NPFOYSMITVOQOS-UHFFFAOYSA-K |
| ChEBI | 144421 |
| ChemSpider | 55239 |
Получение
- Действием раствора лимонной кислоты на гидроксид железа (III):
Физические свойства
Цитрат железа(III) образует красно-коричневые кристаллы.
Растворяется в воде, не растворяется в этаноле.
Образует кристаллогидраты состава FeC6H5O7•n H2O, где n = 3 и 5.
Разлагается под действием света.
Применение
- Лекарственное средство при гипохромной (железодефицитной) анемии.
- Компонент растворов для диазотипии.
From Wikipedia, the free encyclopedia

One of several ferric citrate complexes[1] |
|
| Names | |
|---|---|
| IUPAC name
iron(3+) 2-hydroxypropane-1,2,3-tricarboxylate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.020.488 |
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C6H5FeO7 |
| Molar mass | 244.944 g·mol−1 |
| Appearance | dark orange-red brown solid[2] |
|
Solubility in water |
~5 g/L in water |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Ferric citrate or iron(III) citrate describes any of several complexes formed upon binding any of the several conjugate bases derived from citric acid with ferric ions. Most of these complexes are orange or red-brown. They contain two or more Fe(III) centers.[3]
Ferric citrates contribute to the metabolism of iron by some organisms. Citrates, which are released by plant roots and by some microorganisms, can solubilize iron compounds in the soil. For example ferric hydroxide reacts with citrates to give form soluble complexes. This solubilization provides a pathway for the absorption of the ferric ions by various organisms.[4]
Ferric citrate is used in medicine to regulate the blood levels of iron in patients with chronic kidney disease on dialysis. It acts by forming an insoluble compound with phosphate present in the diet and thus minimizing its uptake by the digestive system.[5]
Structure[edit]
Citrate forms a variety of coordination complexes with ferric ions.[6][1] Some might be oligomers, and polymers. Thus, ferric citrate is not a single well-defined compound, but a family of compounds, many with the similar formulas. These various forms can coexist in equilibrium.[7] At physiological pH, ferric citrate forms an insoluble red polymer. In other conditions, it forms anionic complexes like [FeC
6H
4O
7]2(H
2O)2]2−. In the present of excess citrate anions, the iron forms negatively charged complexes like [Fe(C
6H
4O
7)2]5− and [Fe
9O(C
6H
4O
7)8(H
2O)3]7−.[3][4]
Chemical properties[edit]
Photoreduction[edit]
The Fe3+
ion in ferric citrate (as in many iron(III) carboxylates) is reduced by exposure to light,[8] especially blue and ultraviolet, to Fe2+
(ferrous) ion with concomitant oxidation of the carboxyl group adjacent to the hydroxyl, yielding carbon dioxide and acetonedicarboxylate:
- 2Fe3+
+ R2-C(OH)-CO−
2 → 2Fe2+
+ R2-C=O + H+
+ CO
2
where -R represents the group —CH
2CO−
2.
This reaction plays an important role in plant metabolism: iron is carried up from the roots as ferric citrate dissolved in the sap,[9]
and photoreduced in the leaves to iron(II) that can be transported into the cells.
Additional reading[edit]
Abrahamson, Harmon B.; Rezvani, Ahmad B.; Brushmiller, J.George (1994). «Photochemical and Spectroscopic Studies of Complexes, of Iron(III) with Citric Acid and Other Carboxylic Acids». Inorganica Chimica Acta. 226 (1–2): 117–127. doi:10.1016/0020-1693(94)04077-X.
See also[edit]
- Ammonium ferric citrate
- Iron(II) citrate
References[edit]
- ^ a b Shweky, Itzhak; Bino, Avi; Goldberg, David P.; Lippard, Stephen J. (1994). «Syntheses, Structures, and Magnetic Properties of Two Dinuclear Iron(III) Citrate Complexes». Inorganic Chemistry. 33 (23): 5161–5162. doi:10.1021/ic00101a001.
- ^ Sigma-Aldrich: Product Specification — Iron(III) citrate, technical grade. Accessed on 2017-03-09.
- ^ a b Bino, Avi; Shweky, Itzhak; Cohen, Shmuel; Bauminger, Erika R.; Lippard, Stephen J. (1998). «A Novel Nonairon(III) Citrate Complex: A «Ferric Triple-Decker»«. Inorganic Chemistry. 37 (20): 5168–5172. doi:10.1021/ic9715658.
- ^ a b Pierre, J. L.; Gautier-Luneau, I. (2000). «Iron and Citric Acid: A Fuzzy Chemistry of Ubiquitous Biological Relevance». Biometals. 13 (1): 91–96. doi:10.1023/A:1009225701332. PMID 10831230. S2CID 2301450.
- ^ Lewis, Julia B.; Sika, Mohammed; Koury, Mark J.; Chuang, Peale; Schulman, Gerald; Smith, Mark T.; Whittier, Frederick C.; Linfert, Douglas R.; Galphin, Claude M.; Athreya, Balaji P.; Nossuli, A. Kaldun Kaldun; Chang, Ingrid J.; Blumenthal, Samuel S.; Manley, John; Zeig, Steven; Kant, Kotagal S.; Olivero, Juan Jose; Greene, Tom; Dwyer, Jamie P.; Collaborative Study Group (2015). «Ferric Citrate Controls Phosphorus and Delivers Iron in Patients on Dialysis». Journal of the American Society of Nephrology. 26 (2): 493–503. doi:10.1681/ASN.2014020212. PMC 4310662. PMID 25060056.
- ^ Xiang Hao, Yongge Wei, Shiwei Zhang (2001): «Synthesis, crystal structure and magnetic property of a binuclear iron(III) citrate complex». Transition Metal Chemistry, volume 26, issue 4, pages 384–387. doi:10.1023/A:1011055306645
- ^ Silva, Andre M. N.; Kong, Xiaole; Parkin, Mark C.; Cammack, Richard; Hider, Robert C. (2009). «Iron(III) citrate speciation in aqueous solution». Dalton Transactions (40): 8616–25. doi:10.1039/B910970F. PMID 19809738.
- ^ Wu Feng and Deng Nansheng (2000): «Photochemistry of hydrolytic iron (III) species and photoinduced degradation of organic compounds: A minireview». Chemosphere, volume 41, issue 8, pages 1137–1147. doi:10.1016/S0045-6535(00)00024-2
- ^ Rellán-Álvarez, Rubén; Giner-Martínez-Sierra, Justo; Orduna, Jesús; Orera, Irene; Rodríguez-Castrillón, José Ángel; García-Alonso, José Ignacio; Abadía, Javier; Álvarez-Fernández, Ana (2010). «Identification of a Tri-Iron(III), Tri-Citrate Complex in the Xylem Sap of Iron-Deficient Tomato Resupplied with Iron: New Insights into Plant Iron Long-Distance Transport». Plant and Cell Physiology. 51 (1): 91–102. doi:10.1093/pcp/pcp170. PMID 19942594.
Артикул: 1185-57-5
Производитель: Не указано
Основное описание
Идентификация
- Название
- Аммоний железо(III) цитрат
- Синонимы
- железо лимонноаммиачное коричневое(iii); аммоний-железо дигидроцитрат-цитрат (1:1:1:2), водный; аммоний-железо лимоннокислое(iii); аммоний-железо дигидроцитрат(iii) , водный;
- Регистрационный номер CAS
- 1185-57-5
- Молекулярная формула
- C6H8O7.xFe.xH3N
- Молекулярный вес
- 279.99
- InChI
- InChI=1S/C6H8O7.Fe.H3N/c7-3(8)1-6(13,5(11)12)2-4(9)10—/h13H,1-2H2,(H,7,8)(H,9,10)(H,11,12)—1H3/q-+3-/p-3
- EINECS
- 214-686-6
- HS Code
- 29181500
Химические и физические свойства
- Плотность
- 1.8 г/см3 (20°C)
- Точка кипения
- 197
- Температура хранения
- Хранить при комнатной температуре.
- Растворимость
- 1200 г/л (20°C).
- Стабильность
- Стабилен при нормальных температурах и давлениях.
- Внешний вид
- Твердое вещество от белого до коричневого цвета.
Риски, безопасность и условия использования
- Указания по безопасности
- S26; S36
- Указания по риску
- R36/37/38
- Класс опасности
- 9
- Символы опасности
Классификация химических реактивов
- Чистый («ч.»)
- Аммоний железо(III) цитрат Ч. Содержание основного компонента 98% и выше (без примесей). Цвет полосы на упаковке — зелёный.
- Чистый для анализа («ч.д.а.», «чда»)
- Аммоний железо(III) цитрат ЧДА. Содержание основного компонента выше или значительно выше 98%. Примеси не превышают допустимого предела для точных аналитических исследований. Цвет полосы на упаковке — синий.
- Химически чистый («х.ч.», «хч»)
- Аммоний железо(III) цитрат ХЧ. Содержание основного компонента более 99%. Цвет полосы на упаковке — красный.
- Особо чистый («осч»)
- Аммоний железо(III) цитрат ОСЧ. Cодержание примесей в таком незначительном количестве, что они не влияют на основные свойства. Цвет полосы на упаковке — жёлтый.
Форма запроса