Цитокиновый шторм (Гиперцитокинемия, Цитокиновая буря)
Цитокиновый шторм – это особая тяжелая форма системной воспалительной реакции, характеризующаяся избыточной активацией иммунокомпетентных клеток, выработкой большого количества воспалительных цитокинов. Может развиться при сепсисе, вирусных инфекциях (грипп, коронавирусная инфекция, лихорадка Эбола), отторжении пересаженного органа и пр. Основные клинические проявления включают лихорадку, боли в голове, поясничной области, затрудненное дыхание. Диагноз устанавливается при обнаружении высокой концентрации в сыворотке цитокинов – ФНО-α, ИЛ-6, ИФН-γ. В качестве лечения применяются моноклональные антитела, блокаторы интерлейкинов, иммуноглобулин.
Общие сведения
Термин «цитокиновый шторм» (син. цитокиновая буря, гиперцитокинемия) был впервые применен американским гематологом-онкологом Джеймсом Феррара в 1993 году при изучении реакции отторжения трансплантата. В большинстве случаев гиперцитокинемия несет в себе гораздо более серьезную опасность для жизни человека, чем болезнь, на фоне которой она развилась. Гиперцитокинемия ассоциируется с тяжелыми формами заболеваний и сама по себе считается предиктором неблагоприятного прогноза. Цитокиновый шторм – явление достаточно редкое, точные эпидемиологические данные о его распространенности отсутствуют.
Цитокиновый шторм
Причины
На сегодняшний день, несмотря на многочисленные исследования, точный этиологический фактор, запускающий каскад патологических реакций цитокинового шторма, не установлен. Предполагается, что непосредственная причина выброса цитокинов заключается в активации Toll-подобных рецепторов (TLR) мононуклеарных клеток.
Не исключается роль генетической предрасположенности (например, избыточная экспрессия рецепторов на поверхности иммунных клеток). Ниже приведены заболевания и состояния, при которых может возникнуть потенциально фатальная гиперцитокинемия:
- Вирусные инфекции. Довольно часто цитокиновый шторм встречается при затяжных осложненных формах птичьего гриппа (H5N1), свиного гриппа (H1N1). Наиболее актуальныой проблемой в настоящее время является гиперцитокинемия при тяжелой форме коронавирусной инфекции COVID-19, протекающей с пневмонией и дыхательной недостаточностью. Именно с развитием цитокинового шторма связаны летальные случаи этого заболевания.
- Сепсис и септический шок. Возрастание уровня цитокинов считается одним из основных звеньев патогенеза при генерализации бактериальных, грибковых инфекций – стафилококковых, стрептококковых, кандидозных.
- Онкологические заболевания. Цитокиновый шторм может наблюдаться на терминальных стадиях онкогематологических болезней – лейкозов, лимфом.
- Трансплантация органов. Гиперцитокинемия лежит в основе отторжения трансплантированного органа, реакции «трансплантат против хозяина» при пересадке гемопоэтических стволовых клеток костного мозга.
- Экстракорпоральное оплодотворение. Активация Т-лимфоцитов, NK-клеток с чрезмерной продукцией цитокинов может наблюдаться после искусственного оплодотворения (имплантации эмбрионов в стенку матки) и вызывать выкидыши или преждевременные роды.
- Другие причины: острый панкреатит с панкреонекрозом, печеночная энцефалопатия, тяжелые формы бронхиальной астмы, резистентной к терапии глюкокортикоидами и бронходилалаторами. При данных заболеваниях цитокиновая буря встречается крайне редко.
Патогенез
Цитокины представляют собой белки, которые синтезируются иммунными клетками (лимфоцитами, макрофагами, NK-клетками). Они выполняют регуляторную функцию, контролируют процессы воспаления, иммунного ответа на чужеродные антигены, также принимают участие в гемостазе, в поддержании микроциркуляции. Однако их избыточное количество оказывает крайне токсический эффект практически на все органы и ткани.
В развитии цитокинового шторма принимает участие большое число цитокинов, провоспалительных медиаторов, но ведущую роль в патогенезе играют фактор некроза опухолей альфа ФНО-α, гамма-интерферон ИФН-γ, интерлейкин-6 (ИЛ-6). Нет единого мнения о каскаде патологических реакций при цитокиновом шторме, среди специалистов и исследователей до сих пор ведутся активные дискуссии.
При контакте с чужеродным антигеном, макрофаги и эндотелиальные клетки начинают продуцировать интерлейкин-6, который вызывает активацию Т-лимфоцитов и других иммунных клеток, их миграцию в очаг воспаления. Активированные лимфоциты, в свою очередь, синтезируют ФНО и интерферон. Также под влиянием интерлейкина запускается образование коллагеназ, металлопротеиназ, нейтральных протеаз.
В результате нарастания уровня цитокинов происходит увеличение сосудистой проницаемости, повреждение сосудистой стенки, клеточных мембран, системное нарушение микроциркуляции и внутрисосудистое тромбообразование. В клетках подавляется выработка аденозинтрифосфата, из-за чего наступает гипоэнергетическое состояние.
«Порочный круг» заключается в механизме положительной обратной связи, т.е. образование цитокинов и активация иммунокомпетентных клеток приводит к активации других клеток иммунной системы, синтезу других цитокинов. Процесс принимает генерализованный характер, что часто вызывает полиорганную недостаточность. Другие исследователи развитие цитокинового шторма связывают с пониженным содержанием в сыворотке больных противовоспалительных цитокинов (ИЛ-1Ra, ИЛ-10) и активацией рецепторов лимфоцитов пероксисомами (PPAR).
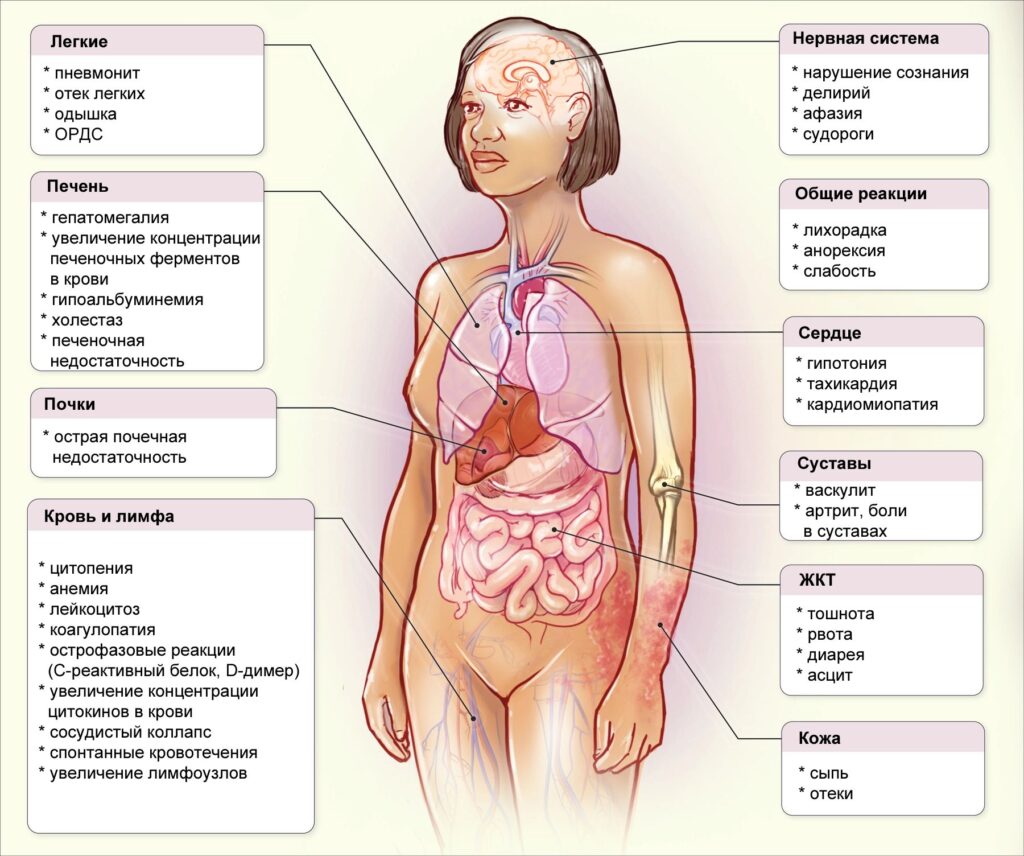
Симптомы цитокинового шторма
Клиническая картина достаточно яркая и разнообразная. Симптомы возникают довольно быстро. Сначала появляются неспецифические признаки – высокая лихорадка, головная боль, миалгии. Затем присоединяются тошнота, рвота, диарея. Пациенты становятся беспокойными. Учащается сердцебиение, снижается артериальное давление. У больных с вирусной инфекцией дыхательных путей сухой кашель усугубляется и приобретает изнуряющий характер. Значительно затрудняется дыхание.
Характерный симптом – увеличение размеров шеи за счет отека подкожной жировой клетчатки, который связан с резким повышением сосудистой проницаемости. Некоторые больные жалуются на ноющие или тупые боли в пояснице, уменьшение объема мочеиспускания. Возможны кожные высыпания. У части пациентов развивается спутанность сознания, галлюцинации, эпилептиформные припадки.
Осложнения
Диагностика
Ввиду тяжелого соматического статуса больные с цитокиновым штормом курируются врачами-реаниматологами. Также по основному заболеванию эти пациенты наблюдаются инфекционистами, терапевтами. Заподозрить данное состояние помогает сочетание клинической картины, анамнестических сведений. Лабораторными предикторами наступления цитокинового шторма являются запредельно высокие сывороточные маркеры воспаления – скорость оседания эритроцитов, С-реактивный белок, ферритин.
Пациентам с нарушением дыхания, особенно при симптомах COVID-19, обязательно проводится аускультация и перкуссия легких, измеряется уровень насыщения крови кислородом (сатурация) с помощью пульсоксиметра. Также назначается дополнительное обследование, включающее:
- Анализы крови. В общем анализе крови отмечается снижение общего уровня лейкоцитов, абсолютная лимфопения, возможны анемия, тромбоцитопения. В биохимическом анализе часто обнаруживается увеличение содержания печеночных трансаминаз (АЛТ, АСТ), общего билирубина, мочевины, креатинина. При сепсисе измеряются показатели прокальцитонина, пресепсина.
- Определение цитокинов. Методом электрохемилюминесцентного анализа обнаруживаются высокие концентрации ИЛ-6, ФНО-α, ИФН-γ.
- Идентификация возбудителя. При подозрении на вирусное инфекционное заболевание проводится забор мазка из зева и полости носа для дальнейшего ПЦР-анализа и определения РНК SARS-CoV-2, РНК вируса гриппа. Для подтверждения сепсиса выполняется 3-кратный бактериологический посев крови.
- Коагулограмма. Могут выявляться изменения как в сторону гиперкоагуляции, так и гипокоагуляции (в зависимости от стадии ДВС-синдрома). Исследуются такие показатели как Д-димер, протромбиновое время, активированное частичное тромбопластиновое время.
- Газовый анализ крови. У многих пациентов отмечается снижение парциального давления кислорода (PaO2) в артериальной крови (гипоксемия), смещение pH крови в кислую сторону (ацидоз).
- Лучевая диагностика. При рентгенографии или компьютерной томографии органов грудной клетки обнаруживаются инфильтраты в легких, области затемнения, картина «матового стекла».
Цитокиновый шторм имеет схожий патогенез и клиническое течение с некоторыми состояниями, от которых его нужно отличать. К ним относятся гемофагоцитарный лимфогистиоцитоз (синдром активации макрофагов), который развивается у ревматологических больных, особенно при ювенильном ревматоидном артрите, и синдром высвобождения цитокинов – ятрогенное состояние, возникающее как ответная реакция на введение генно-инженерных биологических лекарственных препаратов.
Лечение цитокинового шторма
Все больные должны быть госпитализированы в палату интенсивной терапии либо реанимационное отделение. При низком уровне сатурации проводится подключение пациента к искусственной вентиляции легких. Для снижения частоты летальных исходов, независимо от причины, используются следующие лекарственные средства, позволяющие уменьшить степень выраженности цитокинового шторма:
- Таргетная терапия. Наиболее эффективными в подавлении мультиорганного поражения, вызванного гиперцитокинемией, считаются моноклональные антитела к ИЛ-6 – тоцилизумаб, сарилумаб. Также действенными оказались ингибиторы янус-киназ (JAK-киназ) – барицитиниб, тофацитиниб. При их неэффективности применяются антагонисты ИЛ-6 и ИЛ-1 – олокизумаб, RPH-104.
- Глюкокортикостероиды. С целью снижения чрезмерной активации иммунной системы в схему лечения добавляются глюкокортикоиды (дексаметазон, метилпреднизолон)
- Внутривенный иммуноглобулин. Обладающий иммуносупрессивным действием человеческий иммуноглобулин для внутривенного введения способен подавить биологические эффекты цитокинов.
Следует помнить, что данные препараты оказывают ингибирующее действие на несколько звеньев иммунной системы, поэтому их применение ассоциировано с повышением риска присоединения вторичной инфекции, чаще всего бактериальной. Помимо «антицитокинового лечения» проводится следующая терапия:
- Противовирусная. При гриппе назначаются ингибиторы нейраминидазы – осельтамивир. Для лечения COVID-19 используются ЛС для лечения ВИЧ-инфекции и вирусных гепатитов – рекомбинантный интерферон, лопинавир, ритонавир.
- Антибактериальная. При сепсисе рекомендуется комбинация 2 или 3 антибиотиков из разных групп – амоксициллин, гентамицин, левофлоксацин.
- Коррекция ДВС-синдрома. В случае гиперкоагуляции для предотвращения тромбообразования необходимы антикоагулянты – гепарин, ривароксабан. При гипокоагуляции назначаются гемостатики (аминокапроновая кислота, этамзилат) и переливание свежезамороженной плазмы.
- Борьба с гипотензией и шоком. При выраженном снижении давления пациенту вводятся вазопрессоры (норадреналин, допамин) и кардиотоники (добутамин).
Прогноз и профилактика
Цитокиновый шторм является крайне тяжелым состоянием, характеризующимся высокой летальностью. При COVID-19 больше 70% смертельных исходов наступает вследствие данного расстройства. Основными причинами смерти становятся острая дыхательная или полиорганная недостаточность, тромботические осложнения в рамках ДВС-синдрома.
Ввиду того, что этиологический фактор, провоцирующий возникновение цитокиновой бури не установлен, эффективных методов профилактики не существует. Основные меры по предотвращению гиперцитокинемии сводятся к своевременной диагностике и грамотному лечению тех заболеваний, при которых данное состояние развивается. Чтобы снизить фатальность, необходимо применять таргетную терапию как можно раньше.
Литература
1. Молекулярные механизмы “цитокинового шторма” при острых инфекционных заболеваниях/ Шипилов М.В.// Лечебное дело. — 2013.
2. Уровень цитокинов в секрете ротой полости у детей бронхиальной астмой/ Абаджиди М.А., Лукушкина Е.Ф., Мадинская И.В.//Цитокин и воспаление. — 2002. — №3.
3. Hypercytokinemia in severe COVID-19/ John B.Moore., Carl H.June// Science.-2020., Vol.368, Issue 6490.
4. Tne trinity of COVID-19: immunity, inflammation and intervention/ Matthew Z.T., Chek Meng Poh., Laurent Renia., Paul A.MacAry., Lisa F.P.Ng// Nature Reviews Immunology. — 2020.
Цитокиновый шторм — лечение в Москве
From Wikipedia, the free encyclopedia
| Cytokine storm | |
|---|---|
| Other names | hypercytokinemia |
| Specialty | Immunology |
A cytokine storm, also called hypercytokinemia, is a physiological reaction in humans and other animals in which the innate immune system causes an uncontrolled and excessive release of pro-inflammatory signaling molecules called cytokines. Normally, cytokines are part of the body’s immune response to infection, but their sudden release in large quantities can cause multisystem organ failure and death.[1]
Cytokine storms can be caused by a number of infectious and non-infectious etiologies, especially viral respiratory infections such as H1N1 influenza, H5N1 influenza, SARS-CoV-1,[2][3] and SARS-CoV-2, Influenza B, Parainfluenza virus. Other causative agents include the Epstein-Barr virus, cytomegalovirus, group A streptococcus, and non-infectious conditions such as graft-versus-host disease.[4] The viruses can invade lung epithelial cells and alveolar macrophages to produce viral nucleic acid, which stimulates the infected cells to release cytokines and chemokines, activating macrophages, dendritic cells, and others.[5]
Cytokine storm syndrome is a diverse set of conditions that can result in a cytokine storm. Cytokine storm syndromes include familial hemophagocytic lymphohistiocytosis, Epstein-Barr virus–associated hemophagocytic lymphohistiocytosis, systemic or non-systemic juvenile idiopathic arthritis–associated macrophage activation syndrome, NLRC4 macrophage activation syndrome, cytokine release syndrome and sepsis.[6]
Cytokine storms versus cytokine release syndrome[edit]
The term «cytokine storm» is often loosely used interchangeably with cytokine release syndrome (CRS) but is more precisely a differentiable syndrome that may represent a severe episode of cytokine release syndrome or a component of another disease entity, such as macrophage activation syndrome. When occurring as a result of a therapy, CRS symptoms may be delayed until days or weeks after treatment. Immediate-onset (fulminant) CRS appears to be a cytokine storm.[7]
Research[edit]
Nicotinamide (a form of vitamin B3) is a potent inhibitor of proinflammatory cytokines.[8][9] Low blood plasma levels of trigonelline (one of the metabolites of vitamin B3) have been suggested for the prognosis of SARS-CoV-2 death (which is thought to be due to the inflammatory phase and cytokine storm).[10][11]
Magnesium decreases inflammatory cytokine production by modulation of the immune system.[12][13]
History[edit]
The first reference to the term cytokine storm in the published medical literature appears to be by James Ferrara in 1993 during a discussion of graft vs. host disease, a condition in which the role of excessive and self-perpetuating cytokine release had already been under discussion for many years.[14][15][16] The term next appeared in a discussion of pancreatitis in 2002, and in 2003 it was first used in reference to a reaction to an infection.[14]
It is believed that cytokine storms were responsible for the disproportionate number of healthy young adult deaths during the 1918 influenza pandemic, which killed an estimated 50 million people worldwide. In this case, a healthy immune system may have been a liability rather than an asset.[17] Preliminary research results from Taiwan also indicated this as the probable reason for many deaths during the SARS epidemic in 2003.[18] Human deaths from the bird flu H5N1 usually involve cytokine storms as well.[19] Cytokine storm has also been implicated in hantavirus pulmonary syndrome.[20]
In 2006, a study at Northwick Park Hospital in England resulted in all 6 of the volunteers given the drug theralizumab becoming critically ill, with multiple organ failure, high fever, and a systemic inflammatory response.[21] Parexel, a company conducting trials for pharmaceutical companies claimed that theralizumab could cause a cytokine storm—the dangerous reaction the men experienced.[22]
Relationship to COVID-19[edit]
During the COVID-19 pandemic, some doctors have attributed many deaths to cytokine storms.[24][25] A cytokine storm can cause the severe symptoms of acute respiratory distress syndrome (ARDS), which has a high mortality rate in COVID-19 patients.[26] SARS-CoV-2 activates the immune system resulting in a release of a large number of cytokines, including IL-6, which can increase vascular permeability and cause a migration of fluid and blood cells into the alveoli leading to such consequent symptoms as dyspnea and respiratory failure.[27] In an autopsy study from Karolinska Hospital, 29 pleural effusions of deceased COVID-19 patients, were analyzed using Olink® Inflammation and Organ Damage panels. Out of 184 protein markers, 20 markers were raised significantly in COVID-19 deceased patients. A group of markers showed over-stimulation of the immune system, including ADA, BTC, CA12, CAPG, CD40, CDCP1, CXCL9, ENTPD2, Flt3L, IL-6, IL-8, LRP1, OSM, PD-L1, PTN, STX8, and VEGFA; furthermore, DPP6 and EDIL3 indicated damage to arterial and cardiovascular organs.[23] The higher mortality has been linked to the effects of ARDS aggravation and the tissue damage that can result in organ-failure and/or death.[28]
ARDS was shown to be the cause of mortality in 70% of COVID-19 deaths.[29] A cytokine plasma level analysis showed that in cases of severe SARS-CoV-2 infection, the levels of many interleukins and cytokines are highly elevated, indicating evidence of a cytokine storm.[28] Additionally, postmortem examination of patients with COVID-19 has shown a large accumulation of inflammatory cells in lung tissues including macrophages and T-helper cells.[30]
Early recognition of a cytokine storm in COVID-19 patients is crucial to ensure the best outcome for recovery, allowing treatment with a variety of biological agents that target the cytokines to reduce their levels. Meta-analysis suggests clear patterns distinguishing patients with or without severe disease. Possible predictors of severe and fatal cases may include «lymphopenia, thrombocytopenia and high levels of ferritin, D-dimer, aspartate aminotransferase, lactate dehydrogenase, C-reactive protein, neutrophils, procalcitonin and creatinine» as well as interleukin-6 (IL-6). Ferritin and IL-6 are considered to be possible immunological biomarkers for severe and fatal cases of COVID-19. Ferritin and C-reactive protein may be possible screening tools for early diagnosis of systemic inflammatory response syndrome in cases of COVID-19.[31]
Due to the increased levels of cytokines and interferons in patients with severe COVID-19, both have been investigated as potential targets for SARS-CoV-2 therapy. An animal study found that mice producing an early strong interferon response to SARS-CoV-2 were likely to live, but in other cases the disease progressed to a highly morbid overactive immune system.[32][33] The high mortality rate of COVID-19 in older populations has been attributed to the impact of age on interferon responses.
Short-term use of dexamethasone, a synthetic corticosteroid, has been demonstrated to reduce the severity of inflammation and lung damage induced by a cytokine storm by inhibiting the severe cytokine storm or the hyperinflammatory phase in patients with COVID-19.[34]
Clinical trials continue to identify causes of cytokine storms in COVID-19 cases.[35][36] One such cause is the delayed Type I interferon response that leads to accumulation of pathogenic monocytes. High viremia is also associated with exacerbated Type I interferons response and worse prognosis.[37] Diabetes, hypertension, and cardiovascular disease are all risk factors of cytokine storms in COVID-19 patients.[38]
References[edit]
- ^ Farsalinos, Konstantinos; Barbouni, Anastasia; Niaura, Raymond (2020). «Systematic review of the prevalence of current smoking among hospitalized COVID-19 patients in China: Could nicotine be a therapeutic option?». Internal and Emergency Medicine. 15 (5): 845–852. doi:10.1007/s11739-020-02355-7. PMC 7210099. PMID 32385628.
- ^ Wong, Jonathan P.; Viswanathan, Satya; Wang, Ming; Sun, Lun-Quan; Clark, Graeme C.; D’Elia, Riccardo V. (February 2017). «Current and future developments in the treatment of virus-induced hypercytokinemia». Future Medicinal Chemistry. 9 (2): 169–178. doi:10.4155/fmc-2016-0181. ISSN 1756-8927. PMC 7079716. PMID 28128003.
- ^ Liu, Qiang; Zhou, Yuan-hong; Yang, Zhan-qiu (January 2016). «The cytokine storm of severe influenza and development of immunomodulatory therapy». Cellular & Molecular Immunology. 13 (1): 3–10. doi:10.1038/cmi.2015.74. PMC 4711683. PMID 26189369.
- ^ Tisoncik, Jennifer R.; Korth, Marcus J.; Simmons, Cameron P.; Farrar, Jeremy; Martin, Thomas R.; Katze, Michael G. (2012). «Into the Eye of the Cytokine Storm». Microbiology and Molecular Biology Reviews. 76 (1): 16–32. doi:10.1128/MMBR.05015-11. ISSN 1092-2172. PMC 3294426. PMID 22390970.
- ^ Song, Peipei; Li, Wei; Xie, Jianqin; Hou, Yanlong; You, Chongge (October 2020). «Cytokine storm induced by SARS-CoV-2». Clinica Chimica Acta; International Journal of Clinical Chemistry. 509: 280–287. doi:10.1016/j.cca.2020.06.017. ISSN 0009-8981. PMC 7283076. PMID 32531256.
- ^ Behrens, Edward M.; Koretzky, Gary A. (2017). «Review: Cytokine Storm Syndrome: Looking Toward the Precision Medicine Era». Arthritis & Rheumatology. 69 (6): 1135–1143. doi:10.1002/art.40071. ISSN 2326-5205. PMID 28217930.
- ^ Porter D, Frey N, Wood PA, Weng Y, Grupp SA (March 2018). «Grading of cytokine release syndrome associated with the CAR T cell therapy tisagenlecleucel». Journal of Hematology & Oncology. 11 (1): 35. doi:10.1186/s13045-018-0571-y. PMC 5833070. PMID 29499750.
- ^ Ungerstedt JS, Blömback M, Söderström T (2003). «Nicotinamide is a potent inhibitor of proinflammatory cytokines». Clin Exp Immunol. 131 (1): 48–52. doi:10.1046/j.1365-2249.2003.02031.x. PMC 1808598. PMID 12519385.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Yanez M, Jhanji M, Murphy K, Gower RM, Sajish M, Jabbarzadeh E (2019). «Nicotinamide Augments the Anti-Inflammatory Properties of Resveratrol through PARP1 Activation». Sci Rep. 9 (1): 10219. Bibcode:2019NatSR…910219Y. doi:10.1038/s41598-019-46678-8. PMC 6629694. PMID 31308445.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Caterino, Marianna, Michele Costanzo, Roberta Fedele, Armando Cevenini, Monica Gelzo, Alessandro Di Minno, Immacolata Andolfo et al. «The serum metabolome of moderate and severe COVID-19 patients reflects possible liver alterations involving carbon and nitrogen metabolism.» International journal of molecular sciences 22, no. 17 (2021): 9548.
- ^ Besharati, Mohammad Reza; Izadi, Mohammad; Alireza Talebpour (2021). «Blood Plasma Trigonelline Concentration and the Early Prognosis of Death in SARS-Cov-2 Patients». doi:10.5281/zenodo.5856445.
- ^ Sugimoto J, Romani AM, Valentin-Torres AM, Luciano AA, Ramirez Kitchen CM, Funderburg N; et al. (2012). «Magnesium decreases inflammatory cytokine production: a novel innate immunomodulatory mechanism». J Immunol. 188 (12): 6338–46. doi:10.4049/jimmunol.1101765. PMC 3884513. PMID 22611240.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Nielsen FH (2018). «Magnesium deficiency and increased inflammation: current perspectives». J Inflamm Res. 11: 25–34. doi:10.2147/JIR.S136742. PMC 5783146. PMID 29403302.
- ^ a b Clark, Ian A (June 2007). «The advent of the cytokine storm». Immunology & Cell Biology. 85 (4): 271–273. doi:10.1038/sj.icb.7100062. PMID 17551531. S2CID 40463322.
- ^ Ferrara JL, Abhyankar S, Gilliland DG (February 1993). «Cytokine storm of graft-versus-host disease: a critical effector role for interleukin-1». Transplantation Proceedings. 25 (1 Pt 2): 1216–7. PMID 8442093.
- ^ Abhyankar, Sunil; Gilliland, D. Gary; Ferrara, James L.M. (1993). «Interleukin-1 is a critical effector molecule during cytokine dysregulation in graft versus host disease to minor histocompatibility antigens1». Transplantation. 56 (6): 1518–1522. doi:10.1097/00007890-199312000-00045. ISSN 0041-1337. PMID 8279027.
- ^ Osterholm MT (May 2005). «Preparing for the next pandemic». The New England Journal of Medicine. 352 (18): 1839–42. CiteSeerX 10.1.1.608.6200. doi:10.1056/NEJMp058068. PMID 15872196. S2CID 45893174.
- ^ Huang KJ, Su IJ, Theron M, Wu YC, Lai SK, Liu CC, Lei HY (February 2005). «An interferon-gamma-related cytokine storm in SARS patients». Journal of Medical Virology. 75 (2): 185–94. doi:10.1002/jmv.20255. PMC 7166886. PMID 15602737.
- ^ Haque A, Hober D, Kasper LH (October 2007). «Confronting potential influenza A (H5N1) pandemic with better vaccines». Emerging Infectious Diseases. 13 (10): 1512–8. doi:10.3201/eid1310.061262. PMC 2851514. PMID 18258000.
- ^ Mori M, Rothman AL, Kurane I, Montoya JM, Nolte KB, Norman JE, et al. (February 1999). «High levels of cytokine-producing cells in the lung tissues of patients with fatal hantavirus pulmonary syndrome». The Journal of Infectious Diseases. 179 (2): 295–302. doi:10.1086/314597. PMID 9878011.
- ^ The Lancet Oncology (February 2007). «High stakes, high risks». The Lancet. Oncology. 8 (2): 85. doi:10.1016/S1470-2045(07)70004-9. PMID 17267317.
- ^ Coghlan A (2006-08-14). «Mystery over drug trial debacle deepens». Health. New Scientist. Retrieved 2009-04-29.
- ^ a b Razaghi, Ali; Szakos, Attila; Alouda, Marwa; Bozóky, Béla; Björnstedt, Mikael; Szekely, Laszlo (2022-11-14). «Proteomic Analysis of Pleural Effusions from COVID-19 Deceased Patients: Enhanced Inflammatory Markers». Diagnostics. 12 (11): 2789. doi:10.3390/diagnostics12112789. ISSN 2075-4418. PMID 36428847.
- ^ Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ (March 2020). «COVID-19: consider cytokine storm syndromes and immunosuppression». Lancet. 395 (10229): 1033–1034. doi:10.1016/S0140-6736(20)30628-0. PMC 7270045. PMID 32192578.
- ^ Ruan Q, Yang K, Wang W, Jiang L, Song J (March 2020). «Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China». Intensive Care Medicine. 46 (5): 846–848. doi:10.1007/s00134-020-05991-x. PMC 7080116. PMID 32125452.
- ^ Hojyo S, Uchida M, Tanaka K, Hasebe R, Tanaka Y, Murakami M, Hirano T (October 2020). «How covid-19 induces cytokine storm with high mortality». Inflammation and Regeneration. 40 (37): 37. doi:10.1186/s41232-020-00146-3. PMC 7527296. PMID 33014208.
- ^ Farsalinos, Konstantinos; Barbouni, Anastasia; Niaura, Raymond (2020-05-09). «Systematic review of the prevalence of current smoking among hospitalized COVID-19 patients in China: could nicotine be a therapeutic option?». Internal and Emergency Medicine. 15 (5): 845–852. doi:10.1007/s11739-020-02355-7. ISSN 1828-0447. PMC 7210099. PMID 32385628.
- ^ a b Ragad, Dina (16 June 2020). «The COVID-19 Cytokine Storm; What we know so far». Front. Immunol. 11: 1446. doi:10.3389/fimmu.2020.01446. PMC 7308649. PMID 32612617.
- ^ Hojyo, Shintaro; Uchida, Mona; Tanaka, Kumiko; Hasebe, Rie; Tanaka, Yuki; Murakami, Masaaki; Hirano, Toshio (2020-10-01). «How COVID-19 induces cytokine storm with high mortality». Inflammation and Regeneration. 40: 37. doi:10.1186/s41232-020-00146-3. ISSN 1880-9693. PMC 7527296. PMID 33014208.
- ^ Tang, Yujun; Liu, Jiajia; Zhang, Dingyi; Xu, Zhenghao; Ji, Jinjun; Wen, Chengping (2020-07-10). «Cytokine Storm in COVID-19: The Current Evidence and Treatment Strategies». Frontiers in Immunology. 11: 1708. doi:10.3389/fimmu.2020.01708. ISSN 1664-3224. PMC 7365923. PMID 32754163.
- ^ Melo, Ana Karla G.; Milby, Keilla M.; Caparroz, Ana Luiza M. A.; Pinto, Ana Carolina P. N.; Santos, Rodolfo R. P.; Rocha, Aline P.; Ferreira, Gilda A.; Souza, Viviane A.; Valadares, Lilian D. A.; Vieira, Rejane M. R. A.; Pileggi, Gecilmara S.; Trevisani, Virgínia F. M. (29 June 2021). «Biomarkers of cytokine storm as red flags for severe and fatal COVID-19 cases: A living systematic review and meta-analysis». PLOS ONE. 16 (6): e0253894. Bibcode:2021PLoSO..1653894M. doi:10.1371/journal.pone.0253894. PMC 8241122. PMID 34185801.
- ^ Channappanavar, Rudragouda; Perlman, Stanley (2017). «Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology». Seminars in Immunopathology. 39 (5): 529–539. doi:10.1007/s00281-017-0629-x. ISSN 1863-2297. PMC 7079893. PMID 28466096.
- ^ Velasquez-Manoff, Moises (2020-08-11). «How Covid Sends Some Bodies to War With Themselves». The New York Times. ISSN 0362-4331. Retrieved 2020-12-28.
- ^ Sharun, Khan; Tiwari, Ruchi; Dhama, Jaideep; Dhama, Kuldeep (October 2020). «Dexamethasone to combat cytokine storm in COVID-19: Clinical trials and preliminary evidence». International Journal of Surgery. 82: 179–181. doi:10.1016/j.ijsu.2020.08.038. PMC 7472975. PMID 32896649.
- ^ Hermine, Olivier; Mariette, Xavier; Tharaux, Pierre-Louis; Resche-Rigon, Matthieu; Porcher, Raphaël; Ravaud, Philippe; CORIMUNO-19 Collaborative Group (20 October 2020). «Effect of Tocilizumab vs Usual Care in Adults Hospitalized With COVID-19 and Moderate or Severe Pneumonia: A Randomized Clinical Trial». JAMA Internal Medicine. 181 (1): 32–40. doi:10.1001/jamainternmed.2020.6820. ISSN 2168-6106. PMC 7577198. PMID 33080017.
- ^ Gupta, Shruti; Wang, Wei; Hayek, Salim S.; Chan, Lili; Mathews, Kusum S.; Melamed, Michal L.; Brenner, Samantha K.; Leonberg-Yoo, Amanda; Schenck, Edward J.; Radbel, Jared; Reiser, Jochen; Bansal, Anip; Srivastava, Anand; Zhou, Yan; Finkel, Diana; Green, Adam; Mallappallil, Mary; Faugno, Anthony J.; Zhang, Jingjing; Velez, Juan Carlos Q.; Shaefi, Shahzad; Parikh, Chirag R.; Charytan, David M.; Athavale, Ambarish M.; Friedman, Allon N.; Redfern, Roberta E.; Short, Samuel A. P.; Correa, Simon; Pokharel, Kapil K.; Admon, Andrew J.; Donnelly, John P.; Gershengorn, Hayley B.; Douin, David J.; Semler, Matthew W.; Hernán, Miguel A.; Leaf, David E.; STOP-COVID Investigators (20 October 2020). «Association Between Early Treatment With Tocilizumab and Mortality Among Critically Ill Patients With COVID-19». JAMA Internal Medicine. 181 (1): 41–51. doi:10.1001/jamainternmed.2020.6252. PMC 757720. PMID 33080002.
- ^ Sa Ribero, Margarida; Jouvenet, Nolwenn; Dreux, Marlène; Nisole, Sébastien (2020-07-29). «Interplay between SARS-CoV-2 and the type I interferon response». PLOS Pathogens. 16 (7): e1008737. doi:10.1371/journal.ppat.1008737. ISSN 1553-7366. PMC 7390284. PMID 32726355.
- ^ Mangalmurti, Nilam; Hunter, Christopher A. (14 July 2020). «Cytokine Storms: Understanding COVID-19». Immunity. 53 (1): 19–25. doi:10.1016/j.immuni.2020.06.017. PMC 7321048. PMID 32610079.
О цитокиновом шторме активно заговорили с началом пандемии Covid-19, ведь именно он повышает риск развития тяжелых осложнений и летальных исходов у многих пациентов с коронавирусной инфекцией. Однако само по себе это явление не новое и достаточно неоднозначное: оно показывает, как иммунная система вместо того, чтобы бороться со злом, примыкает к нему и помогает возбудителям болезни уничтожать макроорганизм, вверенный ей для охраны и обороны. Naked Science попробовал разобраться, что представляет собой цитокиновый шторм и какие способы его терапии существуют.
Основа основ
Прежде чем говорить о слишком мощной и явно патологической воспалительной реакции, нужно понять, как вообще работает воспаление. Это сложная биологическая реакция на любое повреждение наших клеток или вторжение инфекционных агентов. Она неспецифическая, то есть воспалительный ответ будет и на солнечный ожог, и на ушиб, и на занозу, и на вирус.
Но как тогда организм узнает, что пора реагировать? За ответ на этот вопрос шведские биохимики Суне Бергстрём и Бенгт Самуэльсон, а также британский фармаколог Джон Вейн в 1982 году получили Нобелевскую премию по физиологии или медицине.
Арахидоновая кислота. С нее все начинается. Она присутствует в клеточной мембране и высвобождается, если клетка гибнет. Причина не важна: это может быть и следствие механического воздействия, и разрыв при выходе размножившихся в клетке вирусных частиц.
Свободная арахидоновая кислота начинает окисляться, запускается знаменитый каскад, который сегодня знают все студенты-медики. При содействии ферментов-циклооксигеназ синтезируются тромбоксаны, лейкотриены и простагландины.
Эффекты именно этих медиаторов воспаления проявляются в виде классической пятерки признаков: повышение температуры (причем не только локально, в месте повреждения, но и глобально, во всем организме), боль, покраснение, отек и нарушение функции клеток. Затем к воспалению подключаются клетки иммунной системы, между собой они «переговариваются» при помощи специальных сигнальных молекул — интерлейкинов. В итоге в водоворот событий оказываются вовлечены десятки молекул и клеток.
Цель воспаления — не только устранить спровоцировавший его фактор, но и восстановить целостность клеток. Мало того, это процесс саморегулирующийся, в каскаде арахидоновой кислоты образуются как провоспалительные, так и противовоспалительные агенты.
Все прекращается, когда устанавливается динамическое равновесие: поврежденные клетки зачищены, на их месте образовались новые, патогенов в организме нет, жизнь продолжается.
Иногда воспаление может затягиваться и превращаться из блага в проблему. Что интересно, и недостаточно выраженное воспаление, и гиперреакция одинаково опасны для организма. В первом случае возбудитель будет чувствовать себя слишком вольготно, массово размножится и навредит человеку. Во втором — навредит уже иммунная система, «решившая» применить внутри собственного организма оружие массового поражения. Цитокиновый шторм — яркий пример второго сценария.
Цитокиновый шторм (cytokine storm, cytokine release syndrome) представляет собой форму системной воспалительной реакции организма, характеризующейся массовым высвобождением цитокинов.
Цитокины — низкомолекулярные белки, вырабатывающиеся преимущественно эффекторными клетками крови и осуществляющие регуляцию межклеточных и межсистемных взаимодействий.
На сегодня известно несколько десятков цитокинов. По своему действию они делятся на провоспалительные, противовоспалительные, регуляторы клеточного и гуморального иммунитета.
Развитие цитокинового шторма обусловлено неконтролируемой активацией иммунной системы и дисрегуляцией синтеза про- и противовоспалительных цитокинов и хемокинов.
В результате такого чрезмерного высвобождения цитокинов и хемокинов развивается гипервоспалительный ответ. От его выраженности зависит как тяжесть течения, так и сам исход, и долгосрочные последствия перенесенного заболевания.
Через годы, через века
Повышенный уровень цитокинов наблюдается при различных заболеваниях. Но в ряде случаев превышение их концентрации происходит в сотни и даже тысячи раз, что, в свою очередь, приводит к развитию тяжелых и жизнеугрожающих состояний.
К примеру, «цитокиновый шторм» может встречаться при таких заболеваниях и состояниях, как сепсис, рассеянный склероз, острый панкреатит, острый респираторный синдром, грипп, состояние после тяжелых травм, лихорадка Эбола и другие.
Не исключено, что именно патологический иммунный ответ стал причиной невероятно высокой смертности во время испанки — пандемии гриппа 1918-1919 годов. Реконструированный вирус H1N1, выделенный во время пандемии 1918-го, по сравнению с обычными эталонными штаммами вируса гриппа А, вызывал крайне выраженное воспаление легких у мышей.
Если заглянуть в историю, то можно обнаружить, что термин «цитокиновый шторм» встречался в медицинской литературе уже в 1993 году: Джеймс Феррара и соавторы употребили это словосочетание для описания реакции «трансплантат против хозяина» (РТПХ).
Трудности стандартизации
До сих пор нет четкого согласования ни для определения, ни для классификации цитокинового шторма. Связано это с тем, что, по данным российских и зарубежных авторов, при разных патологиях повышаются разные группы цитокинов.
Например, определение Национального института рака США, основанное на Общих терминологических критериях нежелательных явлений (CTCAE), слишком широкое, поскольку критерии воспалительного синдрома вполне применимы и для некоторых физиологических состояний. В то время как определение Американского общества трансплантологии и клеточной терапии основывается на критериях, которые сосредотачиваются исключительно на ятрогенных (вызванных медицинским вмешательством) причинах цитокинового шторма, и, по сути, игнорирует инфекционные причины.
К тому же грань между нормальным и патологическим ответами организма весьма условна. Одни и те же цитокины могут приносить как пользу для макроорганизма, так и вред. Плюс многие из них взаимосвязаны. Так что крайне сложно сказать, где заканчивается неравная битва с возбудителем и начинается смертоносная борьба.
Симптомы и проявления
Как и в случае с определением и пониманием причин, четкой и характерной клинической картины у цитокинового шторма нет, особенно на начальных стадиях.
Симптомы могут быть вызваны как прямым повреждением клеток цитокинами, так и опосредованным — через иммунные клетки.
Следствием цитокинового шторма может стать развитие ряда серьезных патологических состояний. В их числе — острый респираторный дистресс-синдром, развитие нарушений свертывания крови, полиорганная недостаточность и прочее.
Так, например, SARS-CoV-2-индуцированный цитокиновый шторм активирует коагуляцию за счет стимуляции провоспалительными цитокинами (IL-6, IL-8), экспрессии тканевого тромбопластина и активации системы свертывания. Кроме того, происходят активация тромбоцитов и дисфункция клеток эндотелия.
Результатом таких изменений могут стать массивное тромбообразование и закупорка мелких и крупных сосудов различных органов, что вызывает нарушение циркуляции в этих органах и последующее нарушение их нормального функционирования.
Все это может привести к самому печальному исходу. Да и в случае разрешения болезни последствия могут быть крайне неблагоприятными.
Подходы к лечению
Общая стратегия заключается в борьбе с основным заболеванием, в поддержании функций организма и подавлении избыточной иммунной реакции. Конкретика зависит от причины возникновения цитокинового шторма и степени его тяжести. При этом важный нюанс — фокусное воздействие на цитокины, на которых замыкаются критически важные звенья патогенеза.
На сегодня накоплено немало исследований по медикаментозному лечению цитокинового шторма. Из лекарственных препаратов неплохо зарекомендовал себя тоцилизумаб — моноклональное антитело, антагонист рецептора интерлейкина-6 (IL-6R). При тяжелом течении возможна его комбинация с кортикостероидами — гормональными препаратами, мощно подавляющими системные воспалительные реакции.
В клинической практике успешно используют ингаляционный кортикостероид будесонид («Будостер», «Пульмикорт», «Респинид»), который угнетает высвобождение многих цитокинов непосредственно в дыхательных путях.
Существенный минус в том, что и у моноклональных антител, и глюкокортикостероидов есть ряд побочных эффектов. К ним относятся инфекции верхних дыхательных путей, нарушение функции печени, стероидный диабет, артериальная гипертензия и другие. К тому же, если говорить о некоторых моноклональных антителах, то только блокада растворимых и мембранных форм IL-6R не может выступать эффективным методом подавления цитокинового шторма, так как взаимодействие IL-6 на поверхности Т-клеток может происходить напрямую, без участия рецептора.
Заболевания, медицинские процедуры и методики лечения, которые могут осложниться цитокиновым штормом:
• CAR-T — иммунотерапия опухолей крови, когда собственные Т-клетки человека оснащают искусственным, химерным рецептором, способным распознавать антигены на поверхности атипичных клеток. Среднетяжелый или тяжелый цитокиновый шторм регистрируется от четверти до половины случаев применения CAR-T, а легкий – практически у всех. Реже «штормит» пациентов, проходящих иммунотерапию по поводу неходжкинской лимфомы, хронического лимфоцитарного лейкоза и множественной миеломы.
• Терапия биспецифическими антителами (например, блинатумомабом) — есть риск возникновения шторма при первом введении препарата. В исследовании 189 пациентов с рецидивирующим/рефрактерным острым лимфобластным лейкозом, которых лечили блинатумомабом, тяжелый шторм зарегистрировали лишь у 2% пациентов.
• Гаплоидентичная аллогенная трансплантация гематопоэтических клеток. В группе из 75 пациентов, перенесших терапию с трансплантатами периферической крови, насыщенными Т-клетками, тяжелый шторм зарегистрировали у 12%, легкий — у 75%.
• Другие виды иммунотерапии. О редких цитокиновых штормах сообщалось после применения антитимоцитарного глобулина, а также моноклональными антителами, включая ритуксимаб, обинутузумаб, брентуксимаб и некоторые другие.
• Тяжелые инфекции. В наше время цитокиновый шторм описан для гриппа и для Covid-19.Не стоит также забывать, что чем больше препаратов в составе терапии, тем выше риски развития как нежелательных явлений, так и межлекарственных взаимодействий. Поэтому предпочтение стараются отдавать монотерапии.
Но наука не стоит на месте: постоянно появляются инновационные разработки для упреждения развития гипервоспаления. Например, препарат «Атериксен», который снижает выработку провоспалительных цитокинов IL-6, IL-8 и хемокинов MIG (CXCL9) и IP-10 (CXCL10) — основных медиаторов острой фазы воспаления, лихорадки и цитокинового шторма.
Немаловажно, что этот препарат также снижает воспаление в легочной ткани и обеспечивает защитный иммунный ответ при заражении респираторными вирусами, что особенно актуально в свете Covid-индуцированного цитокинового шторма, с которым мы, к сожалению, так близко познакомились в последние несколько лет.
Учитывая, что при цитокиновом шторме организм страдает не только от основного заболевания, но и от ударов собственного иммунитета, немаловажное значение приобретают токсичность применяемых препаратов и их побочные эффекты. «Атериксен» обладает благоприятным профилем безопасности и переносимости, а иммунотоксических, мутагенных, канцерогенных или аллергизирующих свойств у него не обнаружено.
Продвижение исследований и лечения цитокинового шторма требует междисциплинарного подхода с привлечением всех достижений современной науки. Профилирование биомаркеров и конкретизация задействованных в каждом конкретном случае цитокинов позволят индивидуализировать лечение и увеличить шансы не только на выживание, но и на предупреждение тяжелых осложнений и последствий цитокинового шторма.
И это прекрасное далёко как раз не за горами: лаборатории готовы выдать в клиническую практику новые методики и препараты уже в ближайшее десятилетие.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl + Enter.
А цитокиновый шторм, также называется гиперцитокинемия, является физиологической реакцией у человека и других животных, у которой врожденная иммунная система вызывает неконтролируемое и чрезмерное высвобождение провоспалительный сигнальные молекулы, называемые цитокины. Обычно цитокины являются частью иммунного ответа организма на инфекцию, но их внезапное высвобождение в больших количествах может вызвать мультисистемная органная недостаточность и смерть.[1] Цитокиновые бури могут быть вызваны рядом инфекционных и неинфекционных этиологий, особенно вирусными респираторными инфекциями, такими как Грипп H5N1, SARS-CoV-1,[2][3] и SARS-CoV-2 (COVID-19 агент). Другие возбудители включают: Вирус Эпштейна-Барра, цитомегаловирус, и стрептококк группы А, и неинфекционные состояния, такие как болезнь трансплантат против хозяина.[4] Вирусы могут вторгаться в эпителиальные клетки легких и альвеолярные макрофаги с образованием вирусной нуклеиновой кислоты, которая стимулирует инфицированные клетки высвобождать цитокины и хемокины, активируя макрофаги, дендритные клетки и другие.[5]
Синдром цитокинового шторма разнообразный набор условий, которые могут привести к цитокиновому шторму. Синдромы цитокинового шторма включают знакомые гемофагоцитарный лимфогистиоцитоз, Гемофагоцитарный лимфогистиоцитоз, ассоциированный с вирусом Эпштейна-Барра, системный или несистемный ювенильный идиопатический артрит –Ассоциированный синдром активации макрофагов, Синдром активации макрофагов NLRC4, синдром высвобождения цитокинов и сепсис.[6]
Цитокиновые штормы против синдрома высвобождения цитокинов
Термин «цитокиновый шторм» часто свободно используется как синоним синдром высвобождения цитокинов (CRS), а точнее дифференцируемая синдром которые могут представлять собой тяжелый эпизод синдрома высвобождения цитокинов или компонент другого заболевания, например синдром активации макрофагов. При появлении в результате терапии симптомы СВК могут проявляться через несколько дней или недель после лечения. Немедленное начало (молниеносный ) CRS, кажется, цитокиновый шторм.[7]
Исследование
Никотинамид (форма витамин B3 ) является мощным ингибитором провоспалительных цитокинов.[8][9]
Магний снижает выработку воспалительных цитокинов за счет модуляции иммунной системы.[10][11]
История
Первое упоминание термина цитокиновый шторм в опубликованном медицинская литература похоже, Феррара и др. в 1993 г. при обсуждении болезнь трансплантат против хозяина; состояние, при котором роль избыточного и самовоспроизводящегося выброса цитокинов обсуждалась уже много лет.[12][13] Этот термин затем появился в обсуждении панкреатит в 2002 г., а в 2003 г. он впервые использовался в отношении реакции на инфекцию.[12]
Считается, что цитокиновые штормы были ответственны за непропорционально большое количество смертей здоровых молодых людей во время Пандемия гриппа 1918 г., в результате которого погибли от 17 до 50 миллионов человек. В этом случае здоровая иммунная система могла быть скорее недостатком, чем активом.[14] Предварительные результаты исследований Тайвань также указали на это как на вероятную причину многих смертей во время ОРВИ эпидемия в 2003 году.[15] Смерть людей от птичьего гриппа H5N1 обычно также включают цитокиновые бури.[16] Цитокиновый шторм также был замешан в хантавирусный легочный синдром.[17]
В 2006 году исследование в Больница Нортвик-Парк в Англии, все 6 добровольцев получили препарат терализумаб тяжелое заболевание с полиорганной недостаточностью, высокой температурой и системным воспалительная реакция.[18][19]Парексель, компания, проводящая испытания для фармацевтических компаний, в одном из своих документов написала об испытании и сказала, что терализумаб может вызвать цитокиновый шторм — опасную реакцию, которую испытали мужчины.[20]
Отношение к COVID-19
В течение COVID-19 пандемия, некоторые врачи связывают множество смертей с цитокиновыми штормами.[21][22]Более высокая смертность связана с обострением ОРДС и повреждением тканей, которое может привести к органной недостаточности и / или смерти.[23] При анализе уровня цитокинов в плазме пациентов с тяжелым Sars-CoV-2 уровни многих интерлейкинов и цитокинов чрезвычайно повышены, что свидетельствует о наличии цитокинового шторма у наиболее сильно пораженных.[23] Раннее распознавание этого цитокинового шторма у пациентов с COVID-19 имеет решающее значение для обеспечения наилучшего результата, позволяя проводить лечение различными биологическими агентами, которые нацелены на цитокины, чтобы снизить их уровень. Из-за повышенных уровней цитокинов и интерферонов у людей с тяжелым Sars-CoV-2 оба исследуются в качестве потенциальной терапии COVID-19.A. изучение Стэнли Перлмана, профессора Университета Айовы, цитируемого в Газета «Нью-Йорк Таймс проведенное на мышах, обнаружило, что те, которые могут вызывать сильные реакции интерферона на SARS-CoV, которые также происходят от летучих мышей, рано будет больше шансов выжить; в противном случае они увидели бы сверхактивную иммунную систему, которая обернулась бы гибелью. По мере того как люди стареют, нам становится все труднее создавать своевременный адекватный ответ интерферона, что может объяснить, почему показатели смертности выше среди пожилых людей.
Испытания продолжают определять причины цитокиновых бурь.[24][25]
Цитокиновые бури могли возникать по разным причинам, но Мангалмурти и Хантер упоминают в своих статья что «диабет, гипертония и сердечно-сосудистые заболевания» могут способствовать возникновению цитокиновых штормов в организме, который уже борется с новым коронавирусом (Mangalmurti and Hunter, 2020, 24).[26]
использованная литература
- ^ Фарсалинос, Константинос; Барбуни, Анастасия; Ниаура, Раймонд (2020). «Систематический обзор распространенности курения среди госпитализированных пациентов с COVID-19 в Китае: может ли никотин быть вариантом лечения?». Внутренняя и неотложная медицина. 15 (5): 845–852. Дои:10.1007 / s11739-020-02355-7. ЧВК 7210099. PMID 32385628.
- ^ Вонг, Джонатан П .; Вишванатан, Сатья; Ван, Мин; Сунь, Лунь-цюань; Кларк, Грэм С .; Д’Элия, Риккардо В. (февраль 2017 г.). «Текущие и будущие разработки в лечении вирус-индуцированной гиперцитокинемии». Медицинская химия будущего. 9 (2): 169–178. Дои:10.4155 / fmc-2016-0181. ISSN 1756-8927. ЧВК 7079716. PMID 28128003.
- ^ Лю, Цян; Чжоу Юань-хун; Ян, Чжань-цю (январь 2016). «Цитокиновая буря тяжелого гриппа и разработка иммуномодулирующей терапии». Клеточная и молекулярная иммунология. 13 (1): 3–10. Дои:10,1038 / cmi.2015.74. ЧВК 4711683. PMID 26189369.
- ^ Tisoncik, Jennifer R .; Korth, Marcus J .; Simmons, Cameron P .; Фаррар, Джереми; Martin, Thomas R .; Катце, Майкл Г. (2012). «В Глаз цитокиновой бури». Обзоры микробиологии и молекулярной биологии. 76 (1): 16–32. Дои:10.1128 / MMBR.05015-11. ISSN 1092-2172. ЧВК 3294426. PMID 22390970.
- ^ Песня, Пейпей; Ли, Вэй; Се, Цзяньцинь; Хоу, Яньлун; You, Chongge (октябрь 2020 г.). «Цитокиновый шторм, вызванный SARS-CoV-2». Clinica Chimica Acta; Международный журнал клинической химии. 509: 280–287. Дои:10.1016 / j.cca.2020.06.017. ISSN 0009-8981. ЧВК 7283076. PMID 32531256.
- ^ Беренс, Эдвард М .; Корецкий, Гэри А. (2017). «Обзор: Синдром цитокинового шторма: взгляд в эру точной медицины». Артрит и ревматология. 69 (6): 1135–1143. Дои:10.1002 / арт.40071. ISSN 2326-5205. PMID 28217930.
- ^ Портер Д., Фрей Н., Вуд П.А., Вен Й., Групп С.А. (март 2018 г.). «Оценка синдрома высвобождения цитокинов, связанного с терапией Т-клетками CAR tisagenlecleucel». Журнал гематологии и онкологии. 11 (1): 35. Дои:10.1186 / s13045-018-0571-y. ЧВК 5833070. PMID 29499750.
- ^ Ungerstedt JS, Blömback M, Söderström T (2003). «Никотинамид — мощный ингибитор провоспалительных цитокинов». Клин Эксп Иммунол. 131 (1): 48–52. Дои:10.1046 / j.1365-2249.2003.02031.x. ЧВК 1808598. PMID 12519385.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Янез М., Джанжи М., Мерфи К., Гауэр Р.М., Саджиш М., Джаббарзаде Э. (2019). «Никотинамид усиливает противовоспалительные свойства ресвератрола за счет активации PARP1». Научный представитель. 9 (1): 10219. Bibcode:2019НатСР … 910219Y. Дои:10.1038 / s41598-019-46678-8. ЧВК 6629694. PMID 31308445.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Сугимото Дж., Романи А.М., Валентин-Торрес А.М., Лучано А.А., Рамирес Китчен К.М., Фундербург N; и другие. (2012). «Магний снижает выработку воспалительных цитокинов: новый врожденный иммуномодулирующий механизм». J Immunol. 188 (12): 6338–46. Дои:10.4049 / jimmunol.1101765. ЧВК 3884513. PMID 22611240.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Нильсен FH (2018). «Дефицит магния и усиление воспаления: современные перспективы». J Inflamm Res. 11: 25–34. Дои:10.2147 / JIR.S136742. ЧВК 5783146. PMID 29403302.
- ^ а б Кларк, Ян А. (июнь 2007 г.). «Наступление цитокиновой бури». Иммунология и клеточная биология. 85 (4): 271–273. Дои:10.1038 / sj.icb.7100062. PMID 17551531. S2CID 40463322.
- ^ Феррара Дж. Л., Абхьянкар С., Гиллиланд Д. Г. (февраль 1993 г.). «Цитокиновый шторм болезни трансплантат против хозяина: критическая эффекторная роль интерлейкина-1». Трансплантация. 25 (1 Пет 2): 1216–7. PMID 8442093.
- ^ Остерхольм MT (Май 2005 г.). «Подготовка к следующей пандемии». Медицинский журнал Новой Англии. 352 (18): 1839–42. CiteSeerX 10.1.1.608.6200. Дои:10.1056 / NEJMp058068. PMID 15872196.
- ^ Хуан К.Дж., Су И.Дж., Терон М., Ву Ю.К., Лай С.К., Лю С.К., Лей Х.Й. (февраль 2005 г.). «Цитокиновый шторм, связанный с интерфероном-гамма, у пациентов с ОРВИ». Журнал медицинской вирусологии. 75 (2): 185–94. Дои:10.1002 / jmv.20255. ЧВК 7166886. PMID 15602737.
- ^ Хак А., Хобер Д., Каспер Л. Х. (октябрь 2007 г.). «Противодействие потенциальной пандемии гриппа A (H5N1) с помощью более эффективных вакцин». Возникающие инфекционные заболевания. 13 (10): 1512–8. Дои:10.3201 / eid1310.061262. ЧВК 2851514. PMID 18258000.
- ^ Мори М., Ротман А.Л., Курейн И., Монтойя Дж. М., Нолте К. Б., Норман Дж. Э. и др. (Февраль 1999 г.). «Высокий уровень цитокин-продуцирующих клеток в тканях легких у пациентов с фатальным хантавирусным легочным синдромом». Журнал инфекционных болезней. 179 (2): 295–302. Дои:10.1086/314597. PMID 9878011.
- ^ Ланцет онкологии (февраль 2007 г.). «Высокие ставки, высокие риски». Ланцет. Онкология. 8 (2): 85. Дои:10.1016 / S1470-2045 (07) 70004-9. PMID 17267317.
- ^ Ю, Хао Хун; Грэм, Андреа Л .; Стенгель, Роберт Ф. (1 октября 2012 г.). «Динамика цитокиновой бури». PLOS ONE. 7 (10): e45027. Bibcode:2012PLoSO … 745027Y. Дои:10.1371 / journal.pone.0045027. ЧВК 3462188. PMID 23049677.
- ^ Коглан А (14 августа 2006 г.). «Тайна разгрома испытаний лекарственных препаратов становится все глубже». Здоровье. Новый ученый. Получено 2009-04-29.
- ^ Мехта П., Маколи Д.Ф., Браун М., Санчес Э., Таттерсолл Р.С., Мэнсон Дж.Дж. (март 2020 г.). «COVID-19: рассмотрите синдромы цитокинового шторма и иммуносупрессию». Ланцет. 395 (10229): 1033–1034. Дои:10.1016 / S0140-6736 (20) 30628-0. ЧВК 7270045. PMID 32192578.
- ^ Жуань Ц., Ян К., Ван В., Цзян Л., Сон Дж. (Март 2020 г.). «Клинические предикторы смертности от COVID-19 на основе анализа данных 150 пациентов из Ухани, Китай». Интенсивная терапия. 46 (5): 846–848. Дои:10.1007 / s00134-020-05991-х. ЧВК 7080116. PMID 32125452.
- ^ а б Рагад, Дина (16 июня 2020 г.). «Цитокиновая буря COVID-19; что мы знаем на данный момент». Фронт. Иммунол.
- ^ Эрмин, Оливье; Мариетт, Ксавье; Тараукс, Пьер-Луи; Реш-Ригон, Матье; Порчер, Рафаэль; Раво, Филипп; Совместная группа CORIMUNO-19 (20 октября 2020 г.). «Эффект тоцилизумаба по сравнению с обычным уходом у взрослых, госпитализированных с COVID-19 и умеренной или тяжелой пневмонией: рандомизированное клиническое испытание». JAMA Internal Medicine. Дои:10.1001 / jamainternmed.2020.6820. ЧВК 7577198. PMID 33080017.
- ^ Гупта, Шрути; Ван, Вэй; Хайек, Салим С .; Чан, Лили; Mathews, Kusum S .; Меламед, Михал Л .; Бреннер, Саманта К .; Леонберг-Ю, Аманда; Schenck, Эдвард Дж .; Радбел, Джаред; Райзер, Йохен; Бансал, Анип; Шривастава, Ананд; Чжоу, Ян; Финкель, Диана; Грин, Адам; Маллаппаллил, Мэри; Faugno, Энтони Дж .; Чжан, Цзинцзин; Велес, Хуан Карлос К .; Шаефи, Шахзад; Парих, Чираг Р .; Charytan, David M .; Athavale, Ambarish M .; Фридман, Аллон Н .; Редферн, Роберта Э .; Коротко, Samuel A. P .; Корреа, Саймон; Покхарел, Капил К .; Адмон, Эндрю Дж .; Доннелли, Джон П .; Гершенгорн, Хейли Б .; Дуэн, Дэвид Дж .; Семлер, Мэтью В .; Эрнан, Мигель А .; Лист, Дэвид Э .; STOP-COVID Investigators (20 октября 2020 г.). «Связь между ранним лечением тоцилизумабом и смертностью среди тяжелобольных пациентов с COVID-19». JAMA Internal Medicine. Дои:10.1001 / jamainternmed.2020.6252. ЧВК 757720. PMID 33080002.
- ^ Мангалмурти, Нилам; Хантер, Кристофер А. (14 июля 2020 г.). «Цитокиновые бури: понимание COVID-19». Иммунитет. 53 (1): 19–25 — через ScienceDirect.
Русский[править]
Тип и синтаксические свойства сочетания[править]
ци—то—ки́—но—вый шторм
Устойчивое сочетание (термин). Используется в качестве именной группы.
Произношение[править]
- МФА: [t͡sɨtɐˈkʲinəvɨɪ̯ ʂtorm]
Семантические свойства[править]
Значение[править]
- мед. воспалительная реакция в организме, при которой уровень цитокинов в крови резко возрастает, что приводит к атаке иммунитета на клетки и ткани собственного организма ◆ Врачи обратили внимание: тяжелое течение COVID-19 и возникновение цитокинового шторма связано с повышением у больных интерлейкина-6, а левилимаб нейтрализует рецепторы к интерлейкину-6. А. А. Абдусалямов, «Инфекционная безопасность. COVID-19 : учебное пособие для среднего профессионального образования», 2021 г. [Google Книги]
Синонимы[править]
- гиперцитокинемия
Антонимы[править]
- —
Гиперонимы[править]
- реакция
Гипонимы[править]
Этимология[править]
Перевод[править]
| Список переводов | |
Библиография[править]
Цитокиновый шторм – фраза, которая активно используется в лексиконе при обсуждении новой коронавирусной инфекции. Данное состояние впервые было подробно описано всего около 10 лет назад. Попытаемся же вместе с экспертом разобраться, что это за реакция и когда она возникает.
Что такое цитокиновый шторм простыми словами
Цитокиновый шторм – это системная воспалительная реакция, являющаяся опасной для жизни. При ней в крови повышается уровень цитокинов – белков, которые отвечают за связь клеток организма друг с другом.
В обычной ситуации цитокины контролируют инфекцию и не позволяют патогенным микроорганизмам размножаться. При сбое же их вырабатывается слишком много и наш иммунитет перенаправляет свои силы уже не на патогены, а на собственные клетки, атакуя внутренние органы.
Интересные факты о цитокиновом шторме
| Другие названия | Гиперцитокинемия, синдром цитокинового шторма, синдром высвобождения цитокинов |
| Симптомы | Лихорадка, головная боль, боли в мышцах и суставах, потеря аппетита, утомляемость, сыпь |
| Группы риска | Возраст старше 60 лет, серьезные сопутствующие заболевания (инфаркт, инсульт, ИБС, сахарный диабет, аутоиммунные заболевания, хронические болезни почек), ХОБЛ, бронхиальная астма |
| Изменения в лабораторных показателях | Повышение ферритина, СРБ, D-димеров итропонинов, ЛДГ |
| Осложнения | Поражение легких, нарушение процессов свертывания крови, почечная, печеночная недостаточность, сердечная недостаточность |
Цитокиновый шторм могут спровоцировать:
- вирусные инфекции (птичий грипп, свиной грипп, новая коронавирусная инфекция);
- трансплантация органов;
- сепсис;
- онкология (чаще при терминальных стадиях);
- ЭКО (экстракорпоральное оплодотворение);
- панкреонекроз, тяжелые формы бронхиальной астмы.
Причины цитокинового шторма при коронавирусе
На настоящий момент нет точного понимания причин цитокинового шторма.
Возможные причины этой реакции:
- неадекватное восприятие организмом инфекции;
- чрезмерная активность патогенов;
- неконтролируемая инфекция.
Причина всех этих состояний – сбой обратной связи в организме. Это и приводит к избыточному выделению цитокинов.
Симптомы цитокинового шторма при коронавирусе
Основные симптомы цитокинового шторма при коронавирусе это:
- повышение температуры тела (чаще 38,5 градусов);
- снижение аппетита;
- головная боль;
- повышенная утомляемость;
- боли в мышцах и суставах;
- диарея;
- сыпь.
Данное состояние достаточно нестабильное и может привести к развитию полиорганной недостаточности:
- массивное свертывание крови или массивное кровотечение;
- одышка;
- снижение уровня кислорода в крови;
- понижение артериального давления.
При дальнейшем прогрессировании симптомов цитокинового шторма наблюдается развитие почечной и печеночной недостаточности.
При большом количестве циркулирующих цитокинов появляются и неврологические нарушения, которые можно заметить спустя несколько дней с начала шторма: галлюцинации, спутанность сознания, эпилептические припадки.
Лечение цитокинового шторма при коронавирусе
Лечение цитокинового шторма при COVID-19 очень важно. Неправильно подобранная терапия может привести к непоправимым осложнениям. Вся терапия делится на специфическую, которая проводится только в условиях стационара, и неспецифическую, которая является общеукрепляющей и может проводиться дома самостоятельно.
Диагностика
Не существует определенных методов диагностики, которые точно помогут определить цитокиновый шторм. Необходим комплексный подход, который включает в себя:
- общий анализ крови — помогает оценить ответ организма на воспалительный процесс (при цитокиновом шторме наблюдается снижение лейкоцитов и тромбоцитов);
- коагулограмма – нарушение процессов свертывания крови (предрасположенность к кровотечению или тромбообразованию);
- СРБ (С-реактивный белок) – неспецифический маркер воспаления;
- Ферритин – внутриклеточное депо железа в организме и маркер воспаления (при коронавирусе повышается из-за сгущения крови и недостатка кислорода);
- АСАТ, АЛАТ, билирубин, ЛДГ – оценивают повреждение органов;
- определение цитокинов: ИЛ-6, ФНО.
- газовый анализ крови – наблюдается снижение концентрации кислорода в крови и смещение рН в кислую сторону;
- пульсоксиметрия – метод определения степени насыщения кислородом крови;
- лучевая диагностика – для оценки прогрессирования воспалительных процессов (при коронавирусе использование КТ).
Современные методы лечения
Основные методы лечения цитокинового шторма подразделяются на:
- медикаментозные (гормональные препараты, моноклональные антитела, ингибиторы янус-киназ).
- экстакорпоральные – изменение состава и свойств крови вне организма человека с помощью специальных приборов (плазмаферез, плазмофильтрация, гемосорбция).
Кроме специфической терапии также проводится профилактика и лечение сопутствующих состояний:
- противовирусная терапия;
- антибактериальные препараты;
- профилактика кровотечения и тромбообразования (антикоагулянты, гемостатики);
- метаболические средства (нормализуют обменные процессы в организме, активируют тканевый обмен, коррекция ацидоза, гипоксии).
Обзор рынка препаратов для реабилитации после цитокинового шторма по версии КП
Специфическое лечение цитокинового шторма при ковиде проводится только в условиях стационара. Перечислим некоторые препараты, которые, как правило, продаются в аптеках и могут быть показаны в период реабилитации после перенесенного заболевания только по назначению врача.
«Корилип»
Препарат является метаболическим средством, выпускается в виде ректальных свечей. В его состав входят кокарбоксилаза, витамин В2 и альфа-липоевая кислота.
Если применять препарат при первых признаках заболевания, он помогает предотвращать развитие цитокинового шторма. Также препарат помогает преодолевать последствия такого шторма и лечения постковидных осложнений.
Альфа-липоевая кислота — природный антиоксидант, который позволяет организму предотвращать потерю энергии клетками, которая характерна для новой коронавирусной инфекции.
Противопоказания: гиперчувствительность к компонентам препарата, ректальные кровотечения.
«Милдронат»
Препарат относится к метаболическим средствам. Активное действующее вещество – мельдоний. Его основная задача — приводить в норму процессы доставки кислорода и потребления их клетками.
Кроме того, средство может повышать работоспособность, активировать тканевый и гуморальный иммунитет и оказывать тонизирующее действие на ЦНС.
Противопоказания: аллергическая реакция на компоненты препарата, беременность и период лактации, серьезные заболевания печени и/или почек.
«Цитофлавин»
Метаболический препарат, основные вещества которого — витамины. Янтарная кислота в его составе – это антиоксидант, который помогает улучшать тканевое дыхание, снижать токсическое воздействие некоторых лекарственных препаратов.
Витамин В2 отвечает за восстановление нервной и сердечно-сосудистой системы. Никотинамид способствует улучшению кровообращения, обладает противовоспалительными свойствами.
Противопоказания: аллергия на компоненты препарата, беременность и период лактации, серьезные заболевания органов ЖКТ, подагра.
«Триметазидин МВ»
Метаболический препарат группы антиоксидантов. Основная функция – нормализация клеточных процессов в состоянии гипоксии.
Активное вещество – триметазадин. Его основные свойства: снижение выраженности ацидоза и защита клеток от ишемии.
Противопоказания: повышенная чувствительность к компонентам препарата, серьезные заболевания ЦНС (болезнь Паркинсона, тремор), почечная недостаточность, беременность и период лактации, возраст до 18 лет.
«Актовегин»
Актовегин относится к группе ангиопротекторов, антиоксидантов, корректоров микроциркуляции, регенерантов.
Препарат отвечает за энергетический обмен в клетках, помогает снижать концентрацию мочевой кислоты, оказывает влияние на кровоток.
Противопоказан препарат при чувствительности к компонентам, сердечной недостаточности, отеке легких, задержке жидкости в организме, в возрасте до 18 лет.
Профилактика цитокинового шторма при коронавирусе в домашних условиях
Не существует специфической профилактики цитокинового шторма. Так как основной механизм развития данного состояния – гиперреактивность иммунной системы, следует снизить риск заражение COVID-19. А значит вся профилактика – это предотвращение заболеванием новой коронавирусной инфекцией:
- проведение вакцинации и ревакцинации соответственно графику;
- лечение сопутствующих заболеваний (особенно тех, кто усугубляет течение ковида: сахарный диабет, ХОБЛ, аутоиммунные заболевания);
- прием дополнительных препаратов для активации обменных процессов в организме (витамины, метаболические препараты);
- соблюдение правил личной гигиены;
- ношение масок и перчаток;
- ограничение посещения мест с большим скоплением людей (магазины, кинотеатры, выставки).
При появлении первых симптомов заболевания следует обратиться за помощью к врачу. Это позволит начать лечение на ранних этапах и избежать осложнений.
Популярные вопросы и ответы
Мы обсудили важные вопросы, связанные с цитокиновым штормом при коронавирусе, с врачом-терапевтом Татьяной Померанцевой.
На какой день развивается цитокиновый шторм при коронавирусе?
Наиболее опасным считает период с 8 по 14 день течения заболевания. Это связано с тем, что к этому времени вырабатывается достаточное количество цитокинов, которые могут принести серьезный вред организму. Также ковид имеет двухволновое течение, что и объясняет развитие повторных симптомов через неделю.
Может ли цитокиновый шторм возникнуть после прививки?
Каждое введение вакцины может вызвать развитие цитокинового шторма. Это связано с тем, что у каждого человека уникальная иммунная система, которая может непредсказуемо отреагировать на любое воздействие.
В настоящее время все вакцины проходят клинические испытания и риск развития неблагоприятных побочных эффектов практически равен 0.
Каковы последствия цитокинового шторма при коронавирусе?
Основные осложнения, которые возможны при прогрессировании цитокинового шторма:
• поражение легких, которое проявляется острым респираторным дистресс-синдромом;
• ДВС-синдром (массивное нарушение процессов свертывания крови);
• почечная и/или печеночная недостаточность;
• сердечная недостаточность и кардиогенный шок.
Источники:
- Временные клинические рекомендации «Коронавирусная инфекция», версия 14, от 27.12.2021;
- 2000-2022. РЕГИСТР ЛЕКАРСТВЕННЫХ СРЕДСТВ РОССИИ® РЛС
- «Цитокиновый шторм: причины и последствия» Потапнев М.П., 2021
- Молекулярные механизмы “цитокинового шторма” при острых инфекционных заболеваниях/ Шипилов М.В.// Лечебное дело. — 2013.
- Уровень цитокинов в секрете ротой полости у детей бронхиальной астмой/ Абаджиди М.А., Лукушкина Е.Ф., Мадинская И.В.//Цитокин и воспаление. — 2002. — №3.
- Hypercytokinemia in severe COVID-19/ John B.Moore., Carl H.June// Science.-2020., Vol.368, Issue 6490.
Иммунные проявления становятся все более узнаваемыми состояниями у пациентов с COVID-19, во всем мире зарегистрировано около 3000 случаев, включающих более 70 различных системных и органоспецифических заболеваний. Хотя воспаление, вызванное инфекцией SARS-CoV-2, в основном сосредоточено в респираторной системе, у некоторых пациентов может развиться патологическая воспалительная реакция, затрагивающая внелегочные ткани. Признаки и симптомы, связанные с этим чрезмерным иммунным ответом, очень разнообразны и могут напоминать некоторые аутоиммунные или воспалительные заболевания с клиническим фенотипом, на который, по-видимому, влияют эпидемиологические факторы, такие как возраст, пол или этническая принадлежность. Выраженность проявлений также очень разнообразна, от доброкачественных и самоограничивающихся признаков до опасных для жизни системных синдромов. Мало что известно о патогенезе этих проявлений, и некоторые из них, как правило, возникают в течение первых 2 недель инфекции SARS-CoV-2, тогда как другие, как правило, появляются на поздней постинфекционной стадии или даже у бессимптомных пациентов. У некоторых пациентов может развиться гипервоспалительный ответ, вызванный чрезмерной реакцией на вирус, характеризующийся сильно нарушенным ответом на интерферон I типа, связанным с постоянной вирусной нагрузкой в крови, при этом воспаление частично вызывается фактором транскрипции NF-κB с повышенным TNF и IL. -6 производство.
Системный фенотип, связанный с воспалительной реакцией, вызванной инфекцией SARS-CoV-2, очень широк и может напоминать фенотип некоторых аутоиммунных или воспалительных заболеваний. У детей системное поражение в значительной степени совпадает с болезнью Кавасаки, тогда как у взрослых оно, по-видимому, ближе к гемофагоцитарному лимфогистиоцитозу (HLH), антифосфолипидному синдрому (APS) или системному васкулиту
Цитокиновый шторм
У некоторых пациентов с COVID-19 может развиться тяжелое острое вирусное поражение легких под эгидой острого респираторного дистресс-синдрома ( ARDS) — клинического синдрома, характеризующегося острым воспалением легких и отеком легких с повышенной проницаемостью из-за повреждения альвеолярного капилляра. Термин «цитокиновый шторм» стал синонимом патогенеза ковида , хотя некоторые авторы предположили, что использование этого термина вводит в заблуждение в контексте тяжелой формы COVID-19. Даже термин «цитокиновый шторм» часто заменяли термином «синдром высвобождения цитокинов» (CRS) 10 , который описывает связанное с иммунитетом нарушение регуляции, связанное с высвобождением большого количества цитокинов, которое вызывает системное воспаление с полиорганной недостаточностью и высокой смертностью. CRS является одним из наиболее частых серьезных побочных эффектов терапии химерными антигенными рецепторами T (CAR-T) клетками и характеризуется лихорадкой, тахикардией, тахипноэ и гипотонией, ключевыми симптомами, определяющими синдром системной воспалительной реакции.
IL-6
IL -6 — провоспалительный цитокин, является важным медиатором острого воспалительного ответа при ARDS и CRS , а также, по-видимому, влияет на тяжелую форму COVID-19, способствуя повышению концентрации С-реактивного белка, гиперкоагуляции и гиперферритинемии. Однако концентрации IL-6 в сыворотке, зарегистрированные у пациентов с COVID-19, значительно ниже, чем у пациентов с CRS, ARDS или сепсисом или даже гриппом.
Синдром системного воспалительного ответа у детей
В апреле 2020 года в Великобритании было зарегистрировано несколько тяжелобольных детей с признаками синдрома системного воспалительного ответа, напоминающими болезнь Кавасаки, некоторые из которых дали положительный результат на инфекцию SARS-CoV-2, состояние, которое было названо «педиатрическим воспалительным мультисистемным синдромом», временно связанным. с инфекцией SARS-CoV-2 (PIMS-TS), также называемой «мультисистемным воспалительным синдромом у детей» (MIS-C). Сообщения о более чем 700 случаях MIS-C, включая серию крупных случаев в США 17, указывают на то, что этот синдром в основном поражает детей в возрасте> 5 лет и преимущественно небелого этнического происхождения, с мультисистемным проявлением, включая желудочно-кишечные (92%), сердечно-сосудистые (80%), кожно-слизистые (74%) и респираторные (70%) симптомы. Клиническая картина тяжелая; около половины зарегистрированных случаев соответствовали критериям установленной или неполной болезни Кавасаки, а 73% нуждались в интенсивной терапии с общим уровнем смертности 1,7%.
Гемофагоцитарные синдромы
Первичный и вторичный HLH представляют собой гиперферритинемические гипервоспалительные синдромы, которые имеют общий терминальный путь, но разные патогенетические корни, включая вирусы как один из основных внешних триггерных факторов. Особенности COVID-19 и диагностические критерии HLH (высокая температура, спленомегалия, цитопения, гипертриглицеридемия, гиперферритинемия, гипофибриногенемия, высокие концентрации растворимого рецептора IL-2 (также известного как sCD25) в сыворотке крови, низкая активность естественных клеток-киллеров и гемофагоцитоз ) существенно перекрываются. Из 20 зарегистрированных случаев, которые были классифицированы как вероятные HLH, только 20% соответствовали пяти обязательным диагностическим критериям HLH. Кроме того, в тех исследованиях, которые использовали H-score (система оценок, не утвержденная в проспективных исследованиях для диагностики HLH), только 0–10% пациентов достигли диагностического порога определения HLH.
Антифосфолипидный синдром
COVID-19 был связан с коагулопатией и тромбозом, особенно у тяжелых пациентов, поступивших в отделение интенсивной терапии. Однако SARS-CoV-2, по-видимому, не обладает внутренними прокоагулянтными эффектами, и аномальные результаты тестов на коагуляцию, часто обнаруживаемые у пациентов с COVID-19, по-видимому, в основном связаны с воспалительной системной реакцией. Тем не менее, дополнительная аутоиммунная гипотеза возникла , когда в одном исследования сообщалось положительность для волчаночного антикоагулянта в более чем 90% COVID-19 больных. С тех пор количество исследований, сообщающих о тестировании на антифосфолипидные (aPL) антитела у пациентов с COVID-19, быстро увеличилось.
Системный васкулит
Новые данные, по-видимому, подтверждают потенциальную связь между SARS-Cov-2 и системным васкулитом, включая фенотип болезни Кавасаки, о котором сообщается у значительного процента детей с MIS-C, растущее число зарегистрированных случаев васкулита у взрослых и патологоанатомические исследования. Описание васкулита с поражением различных органов.
Миозит
Некоторые клинические данные и лабораторные отклонения показывают, что у значительного процента пациентов с COVID-19 может быть мышечное воспаление. О миалгии сообщалось примерно у 24% пациентов, включенных в несколько крупных серий случаев COVID-19 (хотя и с широким диапазоном частот, от 1% до 74%), тогда как частота повышения уровня креатинкиназы (КК) составляет ~ 11. %. Миалгии могут оставаться активными хроническими симптомами примерно в 10–20% случаев острого COVID-19. Только два исследования оценили частоту миозита у госпитализированных пациентов с COVID-19, обнаружив миозит у 3–11% пациентов. Отдельные сообщения о пациентах с COVID-19 с миозитом и / или рабдомиолизом указывают на то, что большинство случаев произошло у взрослых мужчин с миалгией (в некоторых случаях тяжелой), появляющейся в основном в течение первой недели COVID-19, с уровнями КФК выше 10000. Ед / л в большинстве случаев.
Гематологические расстройства
Лимфопения является характерной чертой COVID-19 не только из-за ее высокой частоты (около половины случаев COVID-19), но и из-за ее значимости для прогноза (ее связывают с развитием острого респираторного дисстресс синдрома , что требует интенсивной терапии, тогда как тромбоцитопения и анемия были зарегистрированы в 24% и 59% случаев COVID-19 соответственно.
Эндокринные расстройства при ковиде
Исследования сообщили об аномальной функции щитовидной железы, потенциально связанной с инфекцией SARS-CoV-2. Ретроспективное исследование пациентов, госпитализированных с COVID-19, выявило тиреотоксикоз у 20% и гипотиреоз у 5% 149 , тогда как другое исследование обнаружило низкие концентрации тиреотропного гормона у 56% пациентов. На сегодняшний день все зарегистрированные случаи дисфункции щитовидной железы, связанной с COVID-19, в подавляющем большинстве соответствуют явному гипертиреозу (определяемому как низкий уровень тиреотропного гормона плюс высокий уровень свободного Т4), часто проявляющийся клиническими симптомами тиреотоксикоза и увеличенной болезнью щитовидной железы.
Вопросы
Поскольку знания о патогенезе COVID-19 остаются ограниченными, остается гораздо больше сомнений, чем определенности, например, знание того, почему иммунные проявления затрагивают только определенных людей с COVID-19, почему фенотип у детей так отличается от фенотипа у взрослых, почему некоторые проявления возникают, особенно в фазе острой инфекции, а другие возникают, когда инфекция преодолевается, почему некоторые проявления сильно различаются в зависимости от географии и / или этнической принадлежности пораженных пациентов, почему у значительной части пациентов симптомы остаются в течение нескольких месяцев после контакта с вирусом , или почему количество зарегистрированных случаев каждого иммунного проявления COVID-19 явно несбалансировано,учитывая, что только два проявления (MIS-C и- это именно те проявления, котопые влияют на детей) составляют две трети от общего числа зарегистрированных случаев.
Категория сообщения в блог:
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Цитокиновый шторм – это особая тяжелая форма системной воспалительной реакции, характеризующаяся избыточной активацией иммунокомпетентных клеток, выработкой большого количества воспалительных цитокинов. Может развиться при сепсисе, вирусных инфекциях (грипп, коронавирусная инфекция, лихорадка Эбола), отторжении пересаженного органа и пр. Основные клинические проявления включают лихорадку, боли в голове, поясничной области, затрудненное дыхание. Диагноз устанавливается при обнаружении высокой концентрации в сыворотке цитокинов – ФНО-α, ИЛ-6, ИФН-γ. В качестве лечения применяются моноклональные антитела, блокаторы интерлейкинов, иммуноглобулин.
- Причины
- Патогенез
- Симптомы цитокинового шторма
- Осложнения
- Диагностика
- Лечение цитокинового шторма
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Термин «цитокиновый шторм» (син. цитокиновая буря, гиперцитокинемия) был впервые применен американским гематологом-онкологом Джеймсом Феррара в 1993 году при изучении реакции отторжения трансплантата. В большинстве случаев гиперцитокинемия несет в себе гораздо более серьезную опасность для жизни человека, чем болезнь, на фоне которой она развилась. Гиперцитокинемия ассоциируется с тяжелыми формами заболеваний и сама по себе считается предиктором неблагоприятного прогноза. Цитокиновый шторм – явление достаточно редкое, точные эпидемиологические данные о его распространенности отсутствуют.
Цитокиновый шторм
Причины
На сегодняшний день, несмотря на многочисленные исследования, точный этиологический фактор, запускающий каскад патологических реакций цитокинового шторма, не установлен. Предполагается, что непосредственная причина выброса цитокинов заключается в активации Toll-подобных рецепторов (TLR) мононуклеарных клеток.
Не исключается роль генетической предрасположенности (например, избыточная экспрессия рецепторов на поверхности иммунных клеток). Ниже приведены заболевания и состояния, при которых может возникнуть потенциально фатальная гиперцитокинемия:
- Вирусные инфекции. Довольно часто цитокиновый шторм встречается при затяжных осложненных формах птичьего гриппа (H5N1), свиного гриппа (H1N1). Наиболее актуальныой проблемой в настоящее время является гиперцитокинемия при тяжелой форме коронавирусной инфекции COVID-19, протекающей с пневмонией и дыхательной недостаточностью. Именно с развитием цитокинового шторма связаны летальные случаи этого заболевания.
- Сепсис и септический шок. Возрастание уровня цитокинов считается одним из основных звеньев патогенеза при генерализации бактериальных, грибковых инфекций – стафилококковых, стрептококковых, кандидозных.
- Онкологические заболевания. Цитокиновый шторм может наблюдаться на терминальных стадиях онкогематологических болезней – лейкозов, лимфом.
- Трансплантация органов. Гиперцитокинемия лежит в основе отторжения трансплантированного органа, реакции «трансплантат против хозяина» при пересадке гемопоэтических стволовых клеток костного мозга.
- Экстракорпоральное оплодотворение. Активация Т-лимфоцитов, NK-клеток с чрезмерной продукцией цитокинов может наблюдаться после искусственного оплодотворения (имплантации эмбрионов в стенку матки) и вызывать выкидыши или преждевременные роды.
- Другие причины: острый панкреатит с панкреонекрозом, печеночная энцефалопатия, тяжелые формы бронхиальной астмы, резистентной к терапии глюкокортикоидами и бронходилалаторами. При данных заболеваниях цитокиновая буря встречается крайне редко.
Патогенез
Цитокины представляют собой белки, которые синтезируются иммунными клетками (лимфоцитами, макрофагами, NK-клетками). Они выполняют регуляторную функцию, контролируют процессы воспаления, иммунного ответа на чужеродные антигены, также принимают участие в гемостазе, в поддержании микроциркуляции. Однако их избыточное количество оказывает крайне токсический эффект практически на все органы и ткани.
В развитии цитокинового шторма принимает участие большое число цитокинов, провоспалительных медиаторов, но ведущую роль в патогенезе играют фактор некроза опухолей альфа ФНО-α, гамма-интерферон ИФН-γ, интерлейкин-6 (ИЛ-6). Нет единого мнения о каскаде патологических реакций при цитокиновом шторме, среди специалистов и исследователей до сих пор ведутся активные дискуссии.
При контакте с чужеродным антигеном, макрофаги и эндотелиальные клетки начинают продуцировать интерлейкин-6, который вызывает активацию Т-лимфоцитов и других иммунных клеток, их миграцию в очаг воспаления. Активированные лимфоциты, в свою очередь, синтезируют ФНО и интерферон. Также под влиянием интерлейкина запускается образование коллагеназ, металлопротеиназ, нейтральных протеаз.
В результате нарастания уровня цитокинов происходит увеличение сосудистой проницаемости, повреждение сосудистой стенки, клеточных мембран, системное нарушение микроциркуляции и внутрисосудистое тромбообразование. В клетках подавляется выработка аденозинтрифосфата, из-за чего наступает гипоэнергетическое состояние.
«Порочный круг» заключается в механизме положительной обратной связи, т.е. образование цитокинов и активация иммунокомпетентных клеток приводит к активации других клеток иммунной системы, синтезу других цитокинов. Процесс принимает генерализованный характер, что часто вызывает полиорганную недостаточность. Другие исследователи развитие цитокинового шторма связывают с пониженным содержанием в сыворотке больных противовоспалительных цитокинов (ИЛ-1Ra, ИЛ-10) и активацией рецепторов лимфоцитов пероксисомами (PPAR).
Симптомы цитокинового шторма
Клиническая картина достаточно яркая и разнообразная. Симптомы возникают довольно быстро. Сначала появляются неспецифические признаки – высокая лихорадка, головная боль, миалгии. Затем присоединяются тошнота, рвота, диарея. Пациенты становятся беспокойными. Учащается сердцебиение, снижается артериальное давление. У больных с вирусной инфекцией дыхательных путей сухой кашель усугубляется и приобретает изнуряющий характер. Значительно затрудняется дыхание.
Характерный симптом – увеличение размеров шеи за счет отека подкожной жировой клетчатки, который связан с резким повышением сосудистой проницаемости. Некоторые больные жалуются на ноющие или тупые боли в пояснице, уменьшение объема мочеиспускания. Возможны кожные высыпания. У части пациентов развивается спутанность сознания, галлюцинации, эпилептиформные припадки.
Осложнения
Цитокиновая буря имеет широкий спектр неблагоприятных последствий. Наиболее часто страдает дыхательная система – у подавляющего числа больных при тяжелых формах COVID-19 и гриппа возникает острый респираторный дистресс-синдром с дыхательной недостаточностью, требующей немедленного подключения к аппарату ИВЛ. За счет выраженного повреждения почек, печени развивается почечная недостаточность, печеночная недостаточность с энцефалопатией.
Возможен инфаркт миокарда и острая сердечная недостаточность и кардиогенным шоком. У некоторых пациентов наблюдается одновременное поражение нескольких органов – полиорганная недостаточность. Нередким осложнением выступает синдром диссеминированного внутрисосудистого свертывания, который характеризуется сочетанием тромбообразования и массивных кровотечений.
Диагностика
Ввиду тяжелого соматического статуса больные с цитокиновым штормом курируются врачами-реаниматологами. Также по основному заболеванию эти пациенты наблюдаются инфекционистами, терапевтами. Заподозрить данное состояние помогает сочетание клинической картины, анамнестических сведений. Лабораторными предикторами наступления цитокинового шторма являются запредельно высокие сывороточные маркеры воспаления – скорость оседания эритроцитов, С-реактивный белок, ферритин.
Пациентам с нарушением дыхания, особенно при симптомах COVID-19, обязательно проводится аускультация и перкуссия легких, измеряется уровень насыщения крови кислородом (сатурация) с помощью пульсоксиметра. Также назначается дополнительное обследование, включающее:
- Анализы крови. В общем анализе крови отмечается снижение общего уровня лейкоцитов, абсолютная лимфопения, возможны анемия, тромбоцитопения. В биохимическом анализе часто обнаруживается увеличение содержания печеночных трансаминаз (АЛТ, АСТ), общего билирубина, мочевины, креатинина. При сепсисе измеряются показатели прокальцитонина, пресепсина.
- Определение цитокинов. Методом электрохемилюминесцентного анализа обнаруживаются высокие концентрации ИЛ-6, ФНО-α, ИФН-γ.
- Идентификация возбудителя. При подозрении на вирусное инфекционное заболевание проводится забор мазка из зева и полости носа для дальнейшего ПЦР-анализа и определения РНК SARS-CoV-2, РНК вируса гриппа. Для подтверждения сепсиса выполняется 3-кратный бактериологический посев крови.
- Коагулограмма. Могут выявляться изменения как в сторону гиперкоагуляции, так и гипокоагуляции (в зависимости от стадии ДВС-синдрома). Исследуются такие показатели как Д-димер, протромбиновое время, активированное частичное тромбопластиновое время.
- Газовый анализ крови. У многих пациентов отмечается снижение парциального давления кислорода (PaO2) в артериальной крови (гипоксемия), смещение pH крови в кислую сторону (ацидоз).
- Лучевая диагностика. При рентгенографии или компьютерной томографии органов грудной клетки обнаруживаются инфильтраты в легких, области затемнения, картина «матового стекла».
Цитокиновый шторм имеет схожий патогенез и клиническое течение с некоторыми состояниями, от которых его нужно отличать. К ним относятся гемофагоцитарный лимфогистиоцитоз (синдром активации макрофагов), который развивается у ревматологических больных, особенно при ювенильном ревматоидном артрите, и синдром высвобождения цитокинов – ятрогенное состояние, возникающее как ответная реакция на введение генно-инженерных биологических лекарственных препаратов.
Лечение цитокинового шторма
Все больные должны быть госпитализированы в палату интенсивной терапии либо реанимационное отделение. При низком уровне сатурации проводится подключение пациента к искусственной вентиляции легких. Для снижения частоты летальных исходов, независимо от причины, используются следующие лекарственные средства, позволяющие уменьшить степень выраженности цитокинового шторма:
- Таргетная терапия. Наиболее эффективными в подавлении мультиорганного поражения, вызванного гиперцитокинемией, считаются моноклональные антитела к ИЛ-6 – тоцилизумаб, сарилумаб. Также действенными оказались ингибиторы янус-киназ (JAK-киназ) – барицитиниб, тофацитиниб. При их неэффективности применяются антагонисты ИЛ-6 и ИЛ-1 – олокизумаб, RPH-104.
- Глюкокортикостероиды. С целью снижения чрезмерной активации иммунной системы в схему лечения добавляются глюкокортикоиды (дексаметазон, метилпреднизолон)
- Внутривенный иммуноглобулин. Обладающий иммуносупрессивным действием человеческий иммуноглобулин для внутривенного введения способен подавить биологические эффекты цитокинов.
Следует помнить, что данные препараты оказывают ингибирующее действие на несколько звеньев иммунной системы, поэтому их применение ассоциировано с повышением риска присоединения вторичной инфекции, чаще всего бактериальной. Помимо «антицитокинового лечения» проводится следующая терапия:
- Противовирусная. При гриппе назначаются ингибиторы нейраминидазы – осельтамивир. Для лечения COVID-19 используются ЛС для лечения ВИЧ-инфекции и вирусных гепатитов – рекомбинантный интерферон, лопинавир, ритонавир.
- Антибактериальная. При сепсисе рекомендуется комбинация 2 или 3 антибиотиков из разных групп – амоксициллин, гентамицин, левофлоксацин.
- Коррекция ДВС-синдрома. В случае гиперкоагуляции для предотвращения тромбообразования необходимы антикоагулянты – гепарин, ривароксабан. При гипокоагуляции назначаются гемостатики (аминокапроновая кислота, этамзилат) и переливание свежезамороженной плазмы.
- Борьба с гипотензией и шоком. При выраженном снижении давления пациенту вводятся вазопрессоры (норадреналин, допамин) и кардиотоники (добутамин).
Прогноз и профилактика
Цитокиновый шторм является крайне тяжелым состоянием, характеризующимся высокой летальностью. При COVID-19 больше 70% смертельных исходов наступает вследствие данного расстройства. Основными причинами смерти становятся острая дыхательная или полиорганная недостаточность, тромботические осложнения в рамках ДВС-синдрома.
Ввиду того, что этиологический фактор, провоцирующий возникновение цитокиновой бури не установлен, эффективных методов профилактики не существует. Основные меры по предотвращению гиперцитокинемии сводятся к своевременной диагностике и грамотному лечению тех заболеваний, при которых данное состояние развивается. Чтобы снизить фатальность, необходимо применять таргетную терапию как можно раньше.
Источники
- Молекулярные механизмы “цитокинового шторма” при острых инфекционных заболеваниях/ Шипилов М.В.// Лечебное дело. — 2013.
- Уровень цитокинов в секрете ротой полости у детей бронхиальной астмой/ Абаджиди М.А., Лукушкина Е.Ф., Мадинская И.В.//Цитокин и воспаление. — 2002. — №3.
- Hypercytokinemia in severe COVID-19/ John B.Moore., Carl H.June// Science.-2020., Vol.368, Issue 6490.
- Tne trinity of COVID-19: immunity, inflammation and intervention/ Matthew Z.T., Chek Meng Poh., Laurent Renia., Paul A.MacAry., Lisa F.P.Ng// Nature Reviews Immunology. — 2020.
- Настоящая статья подготовлена по материалам сайта: https://www.krasotaimedicina.ru/
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.